La prótesis valvular aórtica perfecta e ideal no existe por el momento en nuestra realidad quirúrgica y, conscientes de ello, los cirujanos trabajamos en mejorar nuestras técnicas. En este artículo exponemos las principales técnicas actuales de reparación aórtica.
The perfect and ideal aortic valve prosthesis does not exist yet in our surgical actually, and aware of it surgeons work on improving our techniques. In this paper we present the main current techniques of aortic repair.
Las técnicas para la reparación valvular aórtica se iniciaron hace 50 años1, pero es en las 2 últimas décadas cuando su práctica quirúrgica es mayor, aun con las limitaciones de los resultados a medio plazo. En nuestro país, según los datos del Registro Nacional del 2012, de los 4.300 procedimientos aislados por valvulopatía aórtica en sus diversas formas etiológicas y fisiopatológicas, se realizaron 56 casos de reparación aislada de velos y 100 casos de reparación con sustitución de la raíz (técnicas David/Yacoub), es decir, un global del 3,6% de reparación2. En el registro de los años 2009 al 2011 el Grupo de Trabajo de Valvulopatía de la Sociedad Española de Cirugía Torácica-Cardiovascular describe un ligero pero progresivo incremento en las reparaciones aórticas, del 2,4, el 2,6% y el 3%, respectivamente3.
La reparación de la válvula aórtica y sus resultados están ligados a las diferentes etiologías de la insuficiencia aórtica y a las diversas formas anátomo-patológicas. Otros factores que se deben considerar en la reparación aórtica son la edad, la comorbilidad del paciente, la experiencia del cirujano y los resultados de las actuales prótesis valvulares aórticas (biológicas y mecánicas).
Un factor clave en la reparación aórtica es el concepto de la reconstrucción tridimensional, ya que incluso en sus formas más simples la unidad funcional de la raíz aórtica debe de ser preservada y/o reconstruida. Y es esta idea un aspecto primordial que el cirujano actual debe de integrar en su formación si pretende alcanzar resultados óptimos a medio-largo plazo, tal como han descrito los grupos quirúrgicos de mayor experiencia4-8.
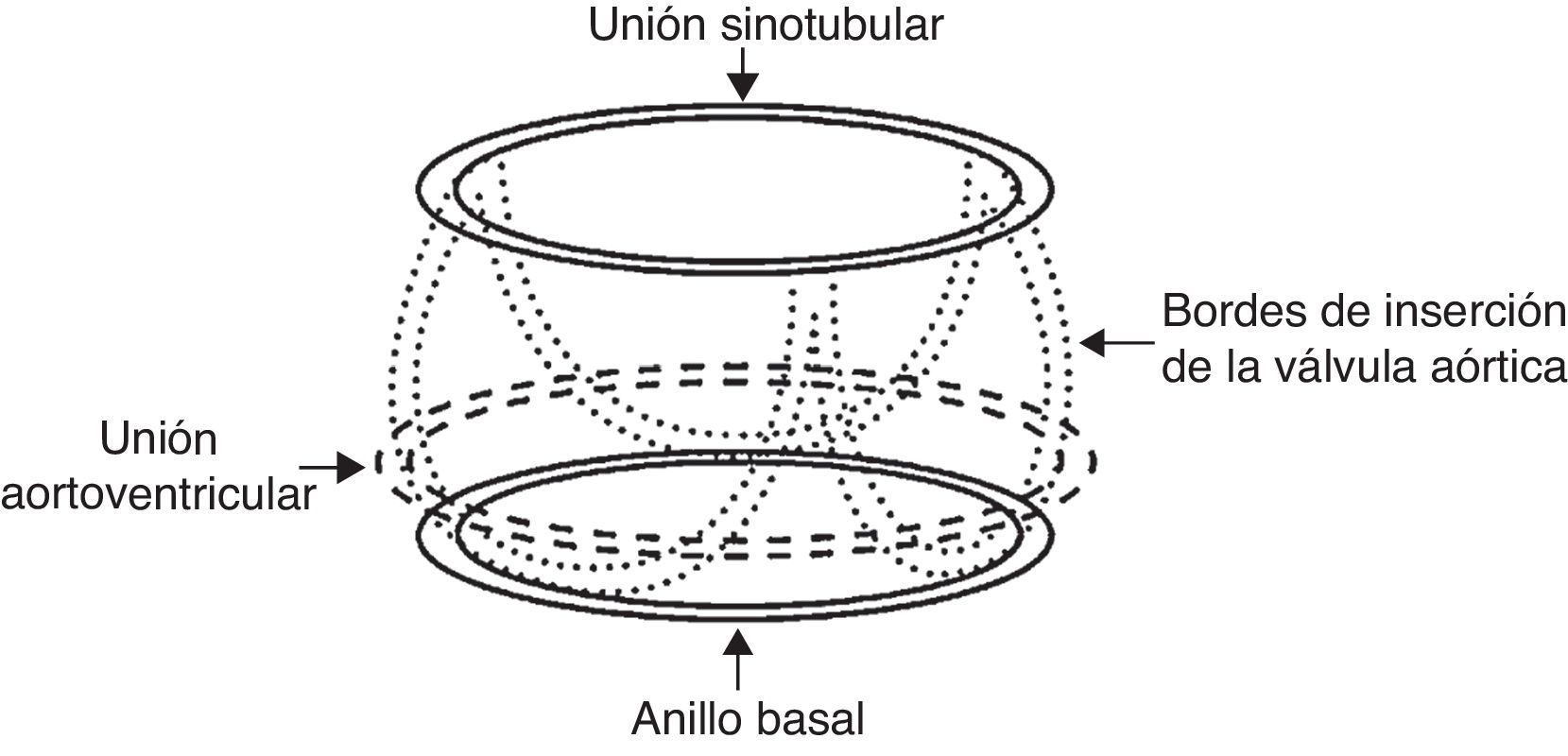
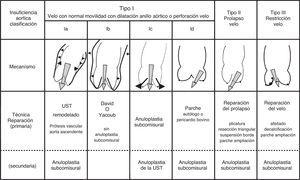
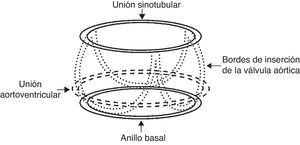
La unidad funcional de la raíz aórtica, o bulbo aórtico, ha sido ampliamente descrita y estudiada con técnicas de imagen durante los últimos años. Su conocimiento nos ha permitido entender su funcionalidad fisio-patológica y los mecanismos implicados en la insuficiencia valvular (fig. 1). Como describen la mayoría de los autores, anatómicamente la raíz aórtica está compuesta de forma práctica en el anillo aórtico basal, el anillo suprasinusal o la unión sinotubular, y la porción de los senos de Valsalva o sinusal con los ostium coronarios y los velos aórticos (fig. 2); y además podemos identificar estructuras como las comisuras y las áreas intercomisurales. La deformación de cualquiera de estas partes genera insuficiencia valvular variable según el grado de distorsión.
Representación esquemática de la raíz aórtica. Imagen tomada de Aicher et al.23.
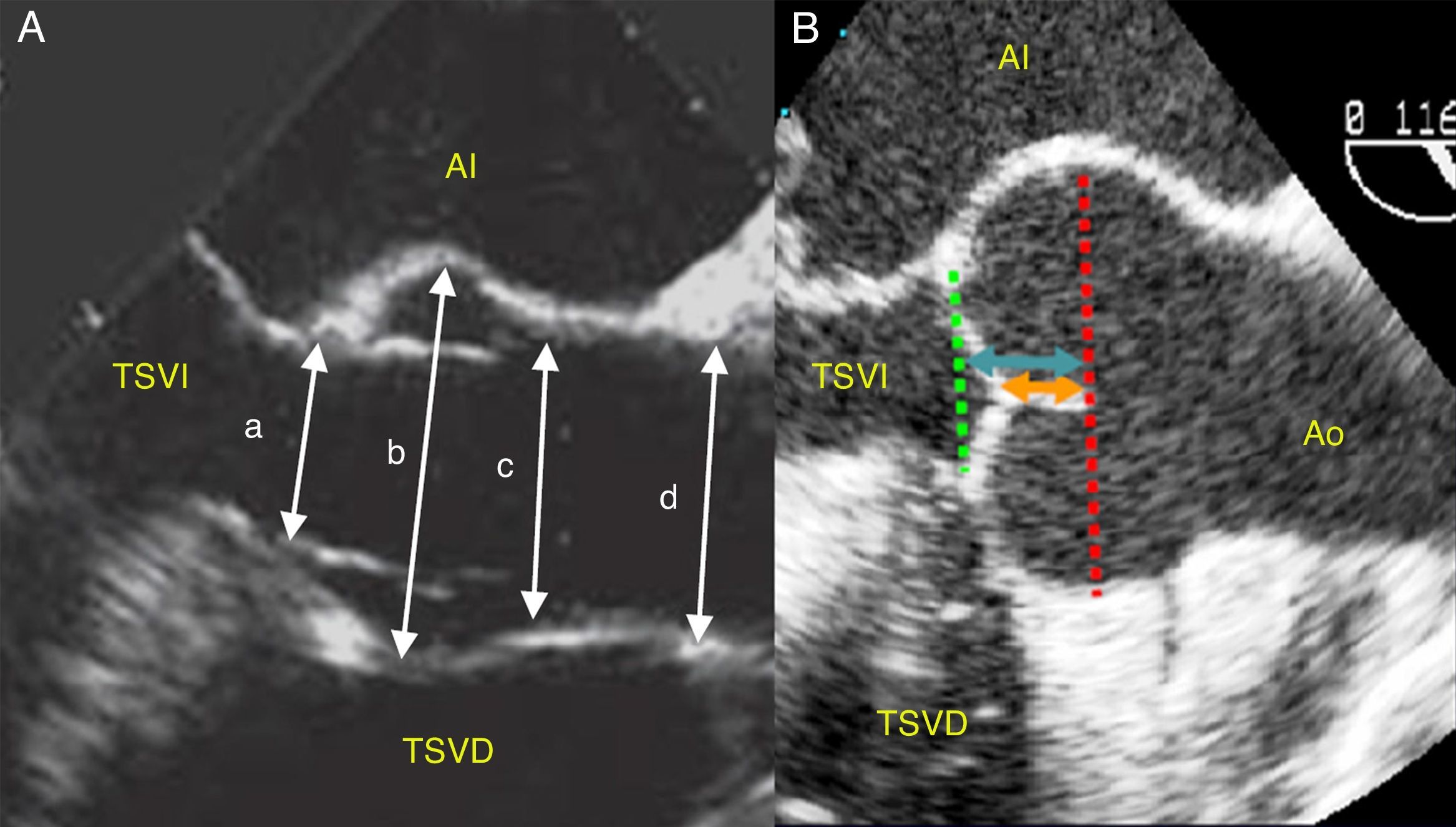
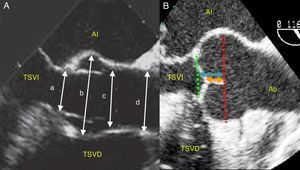
La reparación aórtica exige una exploración valvular preoperatoria e intraoperatoria, con ecocardiografía-Doppler de cada una de sus partes identificando los mecanismos implicados a tratar (fig. 3)9. Y es muy frecuente que la insuficiencia valvular esté generada por varios mecanismos simultáneos.
Imagen ecocardiográfica de la raíz aórtica. Dimensiones de los componentes de la raíz aórtica en eje largo de aorta medioesofágico en ecocardiografía transesofágica (A) e índices de reserva funcional (B): longitud de coaptación (anaranjado); altura efectiva del velo (azul).
a: anillo; b: senos de Valsalva o raíz aórtica; c: unión sinotubular o UST; d: aorta ascendente.
Imagen tomada de Gallego et al.9.
Las dimensiones fisiológicas de la raíz aórtica varían según la edad, el sexo y la superficie corporal del paciente, siendo por ello difícil establecer qué tamaños deben de ser considerados patológicos para tratar. Y no debemos de confundirnos entre lo que son en las guías de la valvulopatía aórtica dimensiones de dilatación con recomendación para la cirugía con las propiamente quirúrgicas, que han mostrado ser parámetros predictores del resultado en la reparación y que van a condicionar nuestras decisiones en el campo quirúrgico (fig. 3). La progresiva experiencia quirúrgica de los grupos pioneros está delimitando cada vez mejor qué dilataciones hay que reparar.
Las alternativas técnicas en la reparación de la válvula aórtica son numerosas. De forma esquemática, en este artículo son agrupadas atendiendo a los componentes estructurales alterados:
- –
técnica para la dilatación aislada de la unión sino-tubular (UST);
- –
técnicas para la dilatación del anillo aórtico (unión ventrículo-arterial);
- –
técnicas de la raíz o cirugía de la raíz aórtica, en la que se realiza el recambio de todo el bulbo con la conservación de los velos y la reimplantación de los ostium coronarios;
- –
y, técnicas para la cirugía de los velos aórticos.
La patología aneurismática de la aorta ascendente que dilata la UST y respeta la porción sinusal de la raíz puede generar insuficiencia valvular (tipo ia, clasificación Carpentier). El mecanismo de la insuficiencia responde a la tracción excéntrica de las comisuras aórticas con la correspondiente tensión de los velos aórticos (tipo ia, con restricción en la movilidad y seudoacortamiento relativo en la longitud del borde del velo) que no llegan a coaptar en su parte central.
Consideraciones técnicas:
- –
En estos casos, la dilatación de la UST suele ser mayor de 35mm, aunque es variable en función de la talla y la superficie corporal del paciente.
- –
La corrección quirúrgica que precisa es la sustitución de la porción aneurismática de la aorta ascendente con prótesis vascular (porción proximal suturada a nivel de la UST).
- –
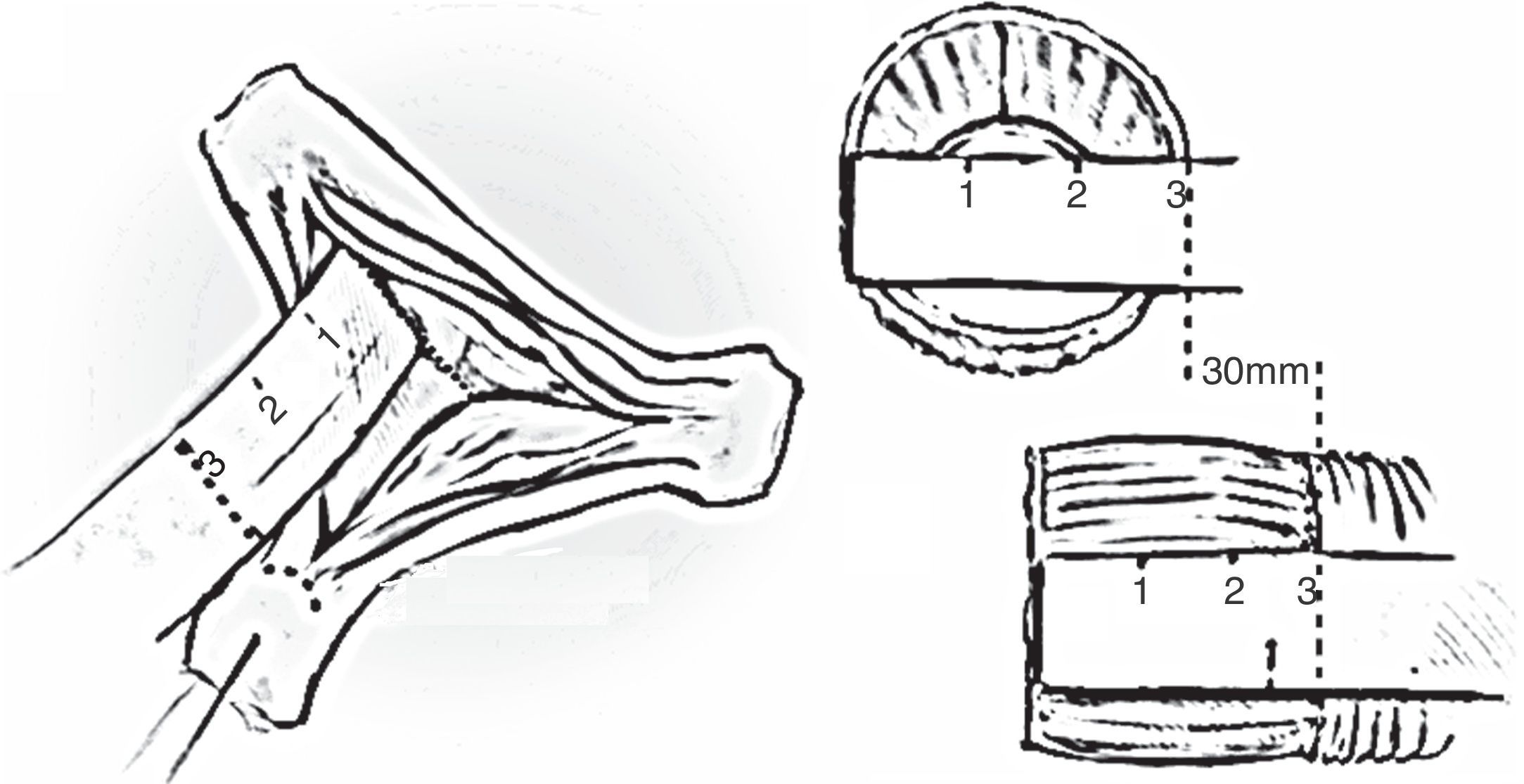
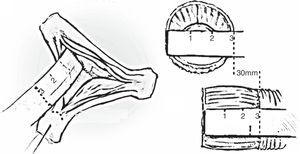
La elección del diámetro de la prótesis se obtiene de la medición del anillo aórtico respetando el coeficiente 0,8:1 entre la UST y el anillo aórtico, respectivamente. Algunos cirujanos preferimos asumir un coeficiente aproximado de 1:1. Otra forma es la descrita en la figura 410.
Figura 4.Medida del tamaño de la prótesis basada en el método de la medición de la altura de la comisura del velo izquierdo-no coronario. Método propuesto por El Khoury10. La distancia desde el anillo mitral hasta el vértice de la comisural corresponde al diámetro del injerto vascular.
(0.15MB). - –
Una prótesis vascular sobredimensionada no corregirá por completo la insuficiencia valvular, persistiendo el mecanismo, y la prótesis pequeña (infradimensionada) provocará insuficiencia por generar prolapso de los velos.
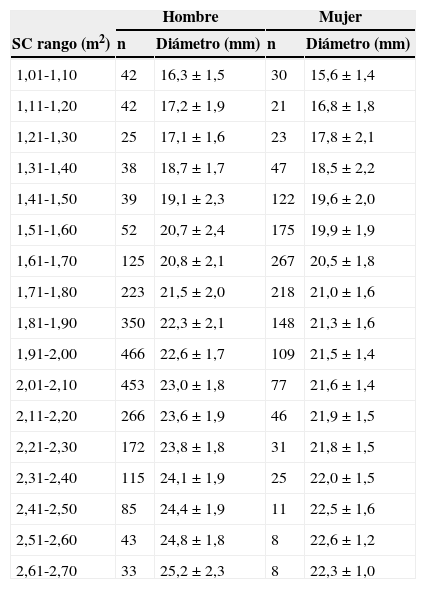
La dilatación del anillo aórtico genera insuficiencia valvular (tipo ic, clasificación Carpentier). Las dimensiones del anillo aórtico suelen ser en el sujeto adulto menor de 25mm, variable según el sexo y la superficie corporal de sujeto (tabla 1) (podemos encontrar casos con diámetros mayores que no se asocian a insuficiencia valvular). En la reparación aórtica, un diámetro ecocardiográfico > 25mm es un factor predictor de recurrencia a medio plazo. Es habitual que la dilatación del anillo aórtico esté asociada a dilatación de otras partes de la raíz, en especial de la porción de los senos (sinusal), entidad que denominamos anuloectasia aórtica.
Dimensiones del anillo aórtico según sexo y superficie corporal
| Hombre | Mujer | |||
|---|---|---|---|---|
| SC rango (m2) | n | Diámetro (mm) | n | Diámetro (mm) |
| 1,01-1,10 | 42 | 16,3±1,5 | 30 | 15,6±1,4 |
| 1,11-1,20 | 42 | 17,2±1,9 | 21 | 16,8±1,8 |
| 1,21-1,30 | 25 | 17,1±1,6 | 23 | 17,8±2,1 |
| 1,31-1,40 | 38 | 18,7±1,7 | 47 | 18,5±2,2 |
| 1,41-1,50 | 39 | 19,1±2,3 | 122 | 19,6±2,0 |
| 1,51-1,60 | 52 | 20,7±2,4 | 175 | 19,9±1,9 |
| 1,61-1,70 | 125 | 20,8±2,1 | 267 | 20,5±1,8 |
| 1,71-1,80 | 223 | 21,5±2,0 | 218 | 21,0±1,6 |
| 1,81-1,90 | 350 | 22,3±2,1 | 148 | 21,3±1,6 |
| 1,91-2,00 | 466 | 22,6±1,7 | 109 | 21,5±1,4 |
| 2,01-2,10 | 453 | 23,0±1,8 | 77 | 21,6±1,4 |
| 2,11-2,20 | 266 | 23,6±1,9 | 46 | 21,9±1,5 |
| 2,21-2,30 | 172 | 23,8±1,8 | 31 | 21,8±1,5 |
| 2,31-2,40 | 115 | 24,1±1,9 | 25 | 22,0±1,5 |
| 2,41-2,50 | 85 | 24,4±1,9 | 11 | 22,5±1,6 |
| 2,51-2,60 | 43 | 24,8±1,8 | 8 | 22,6±1,2 |
| 2,61-2,70 | 33 | 25,2±2,3 | 8 | 22,3±1,0 |
SC: superficie corporal.
Consideraciones técnicas: existen 2 formas de reducir y estabilizar el anillo aórtico. Ayudándonos del tallo de Hegar para ajustar la corrección, de 25mm para pacientes con superficie corporal ≥ 2 m2 y de 23mm para más pequeños < 2 m2.
- –
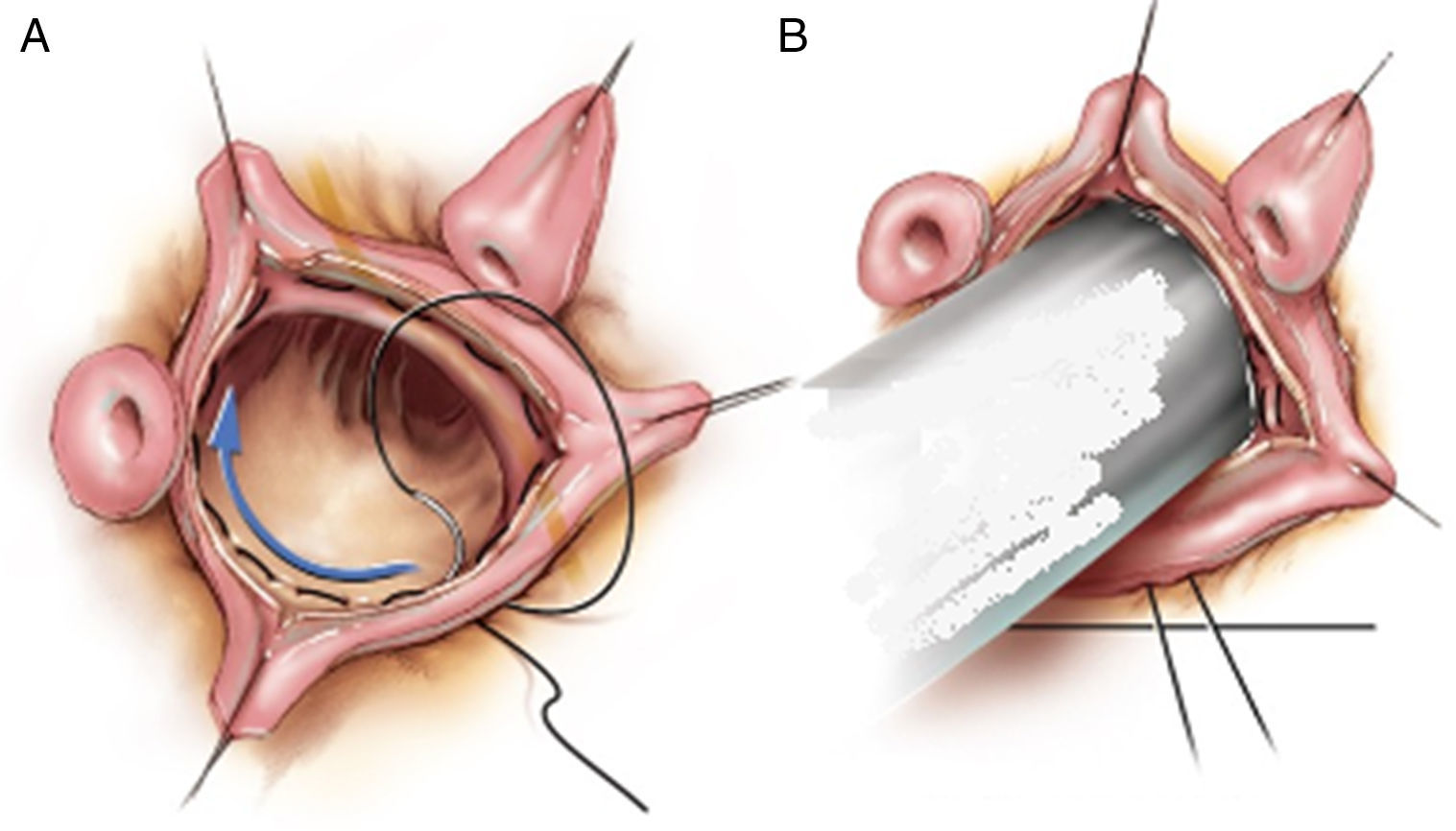
Estabilización interna, abordaje intracavitario del anillo, para realizar una sutura circular (sutura de Elkins [fig. 5] o en algunos casos con refuerzo sintético [tira-banda de teflón o dacrón]; especial precaución en el área intercomisural que aloja el sistema de conducción [porción membranosa del septo]).
- –
Estabilización externa, abordaje epicárdico, que exige la disección profunda y cuidadosa de la raíz aórtica hasta alcanzar planos externos infraanulares, respetando las salidas de las arterias coronarias y la porción membranosa del septo (entre la comisura del velo derecho y no coronariano). De nuevo podemos emplear una sutura circular (sutura de Shäfers con PTFE CV-0) o material sintético fijo (tira-banda de teflón o dacrón) o expandible a la sístole (banda elástica Extra-aortic CORONEO® Inc., Montreal, QC, Canadá).
Estas diversas técnicas no han sido comparadas entre ellas y, por lo tanto, no tenemos datos de cuál es mejor a largo plazo. En la actualidad, su elección depende del criterio de cada cirujano.
No existes datos sobre la estabilización preventiva en los casos de anillos ≤ 25mm, en especial entre patologías predisponentes a esta alteración, como por ejemplo conectivopatías (síndrome de Marfan, Ehlers-Danlos). No obstante, los excelentes resultados de la técnica de David, en especial entre estos grupos de riesgo, traducen la percepción de que deberíamos realizar una fijación preventiva aun con diámetros < 25-27mm para evitarla a largo plazo.
Técnicas de preservación de la raíz aórticaEn numerosos casos, la insuficiencia aórtica está generada por la alteración morfológica de la geometría de la porción de los senos, lo que se asocia con frecuencia a la dilatación de sus orificios de entrada y salida, es decir, del anillo aórtico y la UST, respectivamente. En los casos de insuficiencia severa (tipo ib, clasificación Carpentier) con senos de Valsalva > 45mm en válvula tricúspide o > 42mm en válvula bicúspide, es recomendable la sustitución de la raíz para garantizar a largo plazo una reparación estable.
Los objetivos de la cirugía de la raíz con preservación de la válvula aórtica han de ser:
- –
Corregir la dilatación de la porción sinusal-senos de Valsalva (> 45mm trivalva, > 42 bi/unicúspide).
- –
Crear neosenos (evitar prótesis recta) que protejan los velos del posible mecanismo de colisión contra la prótesis.
- –
Anclar las comisuras simétricamente y en altura evitando el prolapso de los velos.
- –
Restablecer la UST y evitar la apertura excéntrica de comisuras y velos, descrita con anterioridad, y así reducir el estrés de los velos a nivel comisural.
- –
Corregir la dilatación del anillo aórtico (> 25mm) que genera prolapso y restricción de velos. Estudios han mostrado que cuanto mayor es el anillo aórtico, menor es la superficie de coaptación de los velos y mayor su estrés comisural11,12.
- –
Prevenir la dilatación del anillo aórtico mediante la fijación quirúrgica. Aumentar y mantener la superficie de coaptación de velos (ecocardiográficamente ≥ 4mm). Cuanto mayor es la superficie de coaptación, menor es el estrés comisural de los velos11,12. Los velos soportan la columna de presión sanguínea mayoritariamente mediante un mecanismo de apoyo entre ellos, es decir, necesitan tener enfrente una amplia superficie de apoyo que sustente su suspensión y que, a su vez, le permita disminuir la tensión en las comisuras.
Existen, básicamente, 2 técnicas de preservación de la válvula aórtica con la sustitución de los senos de Valsalva, ambas con la necesidad técnica de la reimplantación de los botones coronarios:
- –
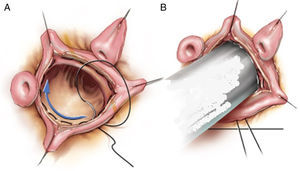
Técnica de remodelado de la raíz, descrita por el Dr. Magdi Yacoub en 197913. Consiste en la sustitución de la porción de los senos de Valsalva suturando la prótesis al remanente de aorta de 3-5mm, siguiendo la línea de las comisuras, lo que confiere a la prótesis la morfología fisiológica de los senos de Valsalva. Esta técnica puede apreciarse en la figura 5 y es descrita con mayor precisión en el artículo del Dr. Yacoub13. Desde su inicio, su mayor crítica fue dirigida al aspecto técnico de no estabilizar el plano del anillo aórtico. Posteriores modificaciones han incluido la estabilización del anillo, con diversas técnicas, como antes hemos descrito. Hoy en día, seguimos hablando de la técnica de Yacoub, aunque ya hay que considerar conceptualmente que incluye el refuerzo del anillo al resto de la técnica originaria. No obstante, algunos autores han renombrado esta modificación final como la técnica David-III (Yacoub con refuerzo del anillo).
- –
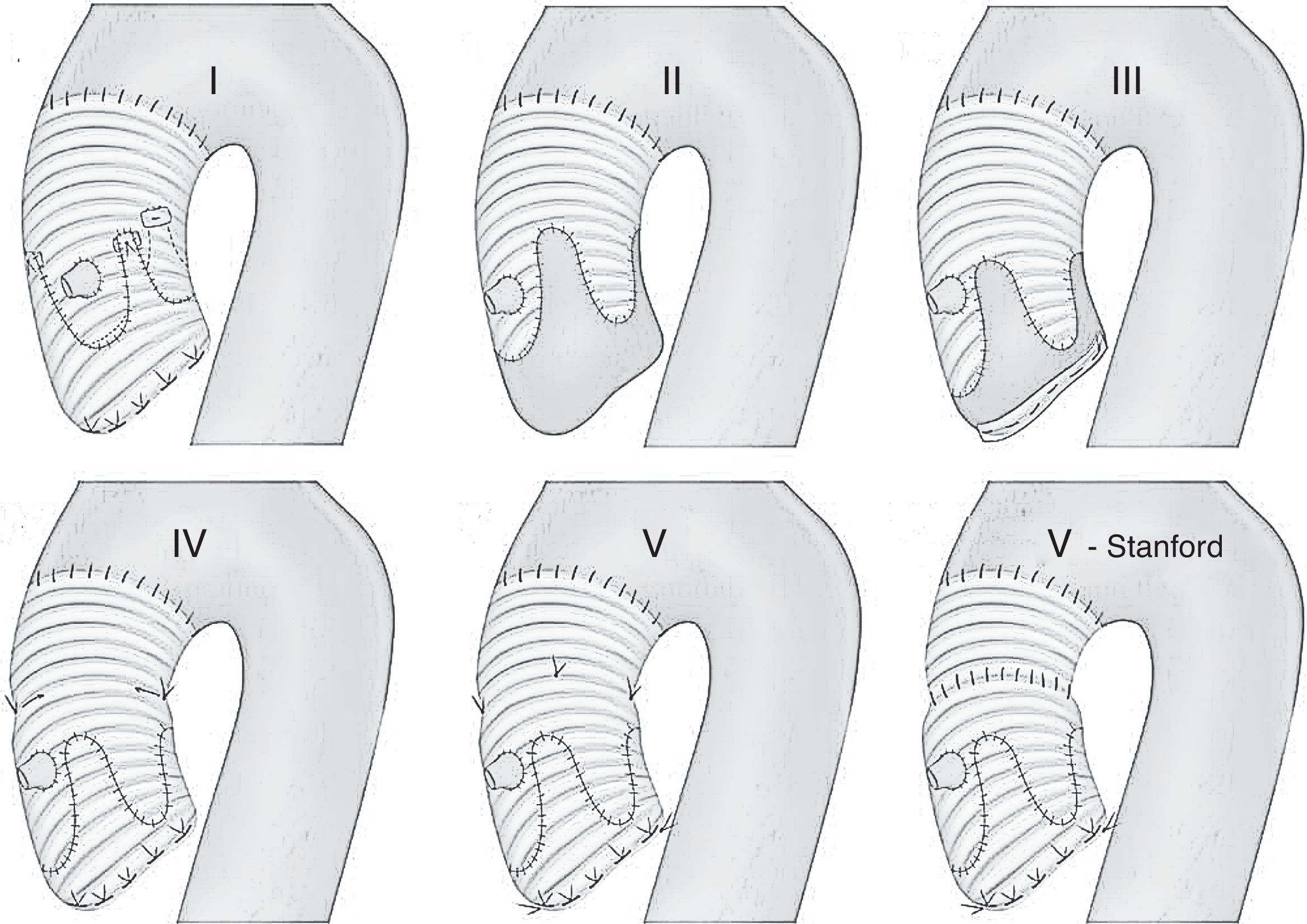
Técnica de reimplantación de la raíz, descrita por el Dr. Tirone David en 198814. Consiste en la sutura proximal de la prótesis sobre la parte externa del anillo aórtico con el empleo de 6 a 12 puntos de dacrón 2/0 en U desde la parte interna del anillo (tracto de salida ventricular), reimplantando el remanente de la válvula dentro de la prótesis mediante una sutura interna. Esta técnica puede apreciarse en la figura 6 y es descrita con mayor precisión en el artículo del Dr. David14. Desde su inicio, esta técnica ha destacado por la fijación externa del anillo aórtico, evitando recurrencias de la insuficiencia aórtica por la redilatación del mismo. Y en un intento de recrear la morfología sinusal de los senos de Valsalva, anulada con las prótesis rectas, han aparecido posteriores modificaciones técnicas hasta la última, denominada David-V, y modificaciones tecnológicas en la morfología de las prótesis (De Paulis Gelweave ValsalvaTM Graft, Vascutek, Terumo, Reino Unido).
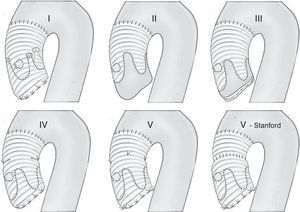
Figura 6.Modificaciones técnicas de la técnica original David (reimplantación). A) Técnica original de David (David I). B) Técnica original de Yacoub (remodelado), también denominada David II. C) Modificación actual de la técnica de Yacoub con fijación del anillo aórtico, también denominada David III. D) Modificación David IV. E) Modificación David V. F) Modificación de la técnica David V según Stanford.
(0.34MB).
Ambos procedimientos de raíz aórtica (técnica Yacoub/David) pueden ser desglosados en 3 partes técnicas, a seguir durante la cirugía:
- 1.
Reparación de senos de Valsalva. Sutura del injerto al anillo aórtico+sutura botones coronario.
- 2.
Reparación del anillo aórtico. Fijación del anillo aórtico (25mm), anuloplastia.
- 3.
Reparación de los velos. Remodelado/reparación de los velos aórticos.
Consideraciones técnicas:
- –
En la cirugía de la raíz aórtica, para evitar recurrencias en la insuficiencia, hay que estabilizar el anillo aórtico si es mayor de 25mm empleando alguna de las diversas técnicas ya descritas. La técnica de reimplante siempre estabiliza externamente el anillo, con independencia de su tamaño, y quizás sea una de las razones por las que tiene muy baja recurrencia en insuficiencia valvular, incluso en los casos de conectivopatías.
- –
En la actual técnica de remodelado es habitual y recomendable fijar el anillo aórtico, que si se realiza desde el interior de la aorta evitaremos la disección profunda de la raíz. Esta disección es inevitable en la técnica del reimplante.
- –
La elección del tamaño de la prótesis depende de las dimensiones quirúrgicas de la raíz. Un método simple, de uso cada vez mayor, es con la medición de la altura de la comisura del velo izquierdo no coronario (fig. 4)10. Otro método habitual es según la medición del anillo aórtico. Habitualmente, en varones es empleada la prótesis de 32mm y en mujeres de 28mm, que garantizan anillos aórticos entre 27 a 25mm4,5,13,14.
- –
Con ambas técnicas hay que reimplantar los botones coronarios. El empleo de prótesis preformadas con senos (De Paulis Gelweave ValsalvaTM Graft, Vascutek, Terumo, Reino Unido) permite una menor tracción de los botones coronarios y quizás por ello un menor riesgo de complicaciones, como por ejemplo de sangrado.
- –
En insuficiencias aórticas severas con dilataciones no muy extremas de los senos, alrededor de los 45mm, es difícil elegir la técnica quirúrgica. En estos casos, hay que valorar el tamaño de la UST y del anillo, considerándolos en la decisión. Los grupos quirúrgicos de mayor experiencia prefieren, aun con estas dimensiones, la sustitución completa de la raíz para estabilizar simultáneamente la UST y el anillo4–8, aunque este criterio no es compartido en toda la comunidad científica.
- –
Durante la realización de ambas técnicas, remodelado y reimplantación, con la reducción del diámetro del anillo aórtico y/o de la UST se suele generar prolapso de los velos. Por ello, ambas técnicas llevan implícita una parte técnica de corrección-reajuste-reparación de los velos a realizar antes de finalizar el procedimiento.
Hasta ahora, los criterios de selección para cada técnica siguen sin estar bien establecidos, pues no existen ensayos prospectivos controlados aleatorizados o metaanálisis. Basados en la experiencia personal, los cirujanos han desarrollado sus propias preferencias a través del tiempo. Algunos cirujanos han pasado de la técnica de Yacoub a la técnica de David15,16 o han optado por la técnica de David17 con el tiempo, creyendo en la durabilidad de este procedimiento. Por ejemplo, Patel et al.16 prefirieron la técnica de Yacoub para los pacientes con el síndrome de Marfan hasta el año 2002, después de la cual pasaron a la técnica de David debido a la tasa de reoperaciones por insuficiencia aórtica recurrente. El mismo Tirone David18 prefiere su técnica cuando el anillo aórtico es > 27mm en hombres y > 25mm en las mujeres, mientras que mantiene la opinión de que la técnica de Yacoub es adecuada en pacientes de edad avanzada con un anillo aórtico normal. Hanke et al.19 sugieren, sin embargo, un anillo de 28 a 30mm como punto de corte para la selección técnica, abogando por la técnica de Yacoub para anillos de diámetros más pequeños y la técnica de David para los diámetros más amplios. Estas opiniones no son compartidas por otros grupos, como Shäfers et al., que siguen decantándose por la modificación actual de la técnica de Yacoub (con fijación del anillo)20; probablemente, la técnica de Yacoub con estabilización del anillo aórtico no debería de tener mayor recurrencia en insuficiencia aórtica que la técnica David.
Basada en la experiencia descrita en la literatura, y con las limitaciones propias de las comparaciones de series con poblaciones diversas, una reciente revisión, que incluyó a un total de 1.338 pacientes de 13 centros, con técnica operatoria de Yacoub para 606 pacientes y David para 732 pacientes, demuestra resultados comparables en mortalidad hospitalaria y a largo plazo para ambas técnicas21. Sin embargo, hay una mayor tendencia a largo plazo de insuficiencia aórtica significativa recurrente en el grupo del Yacoub, que no se traduce necesariamente en una mayor tasa de reintervenciones en comparación con el grupo del David. La tendencia actual, que no por ello evidencia constatada, está a favor de la técnica de David sobre la técnica de Yacoub en patologías que puede poner en peligro la integridad de la raíz aórtica, como el síndrome de Marfan, la disección aórtica aguda tipo A y en los casos con excesiva dilatación anular21. La selección cuidadosa de los pacientes para cada técnica y la restauración exitosa de la geometría normal de los velos siguen siendo las claves del éxito en la cirugía de la raíz aórtica.
Técnicas de preservación de los velos aórticosLa reparación de los velos aórticos es un procedimiento que requiere de una gran reproducibilidad en la técnica. Las variadas etiologías y los diversos mecanismos implicados en su alteración estructural exigen tener conocimiento de las alternativas quirúrgicas.
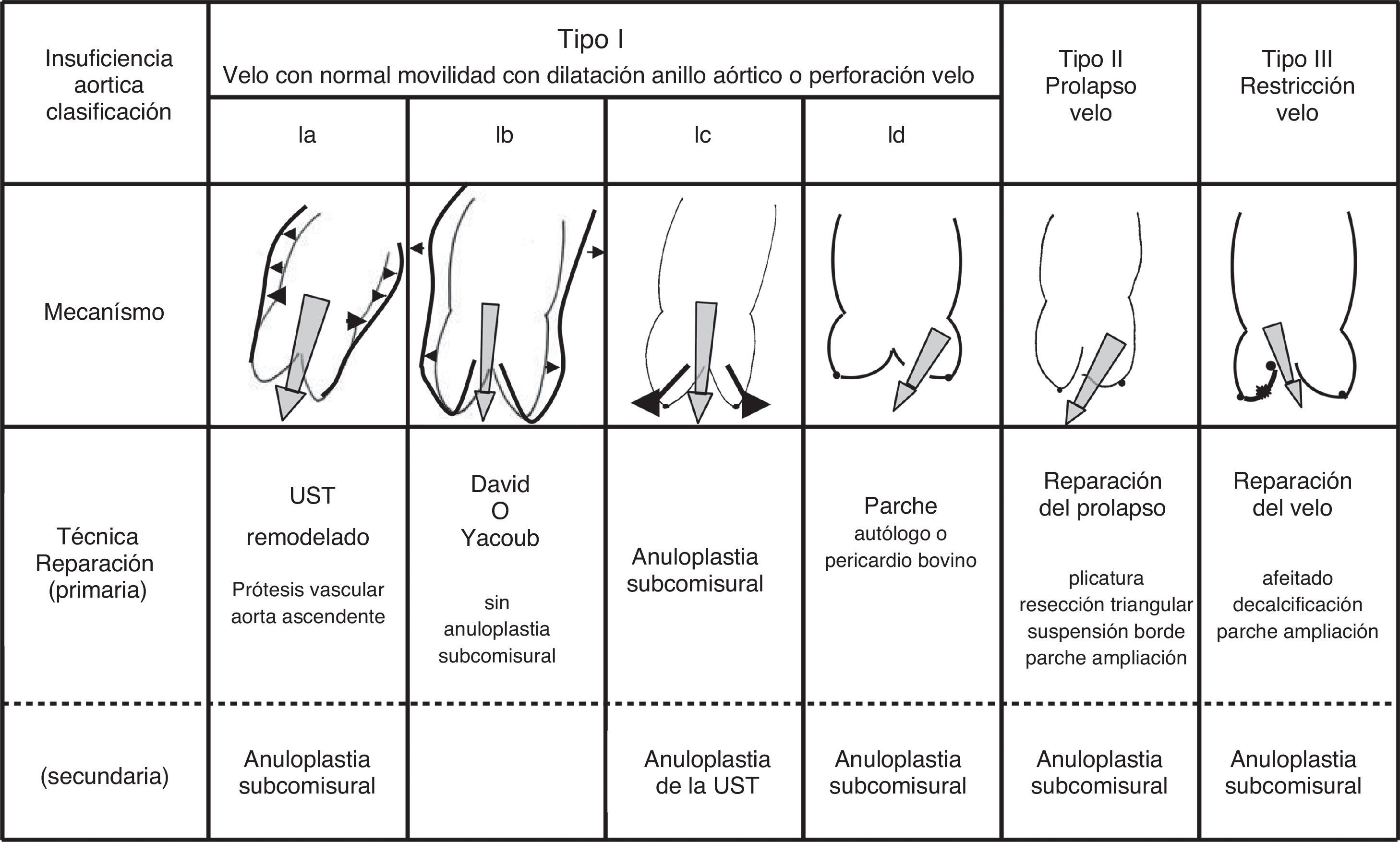
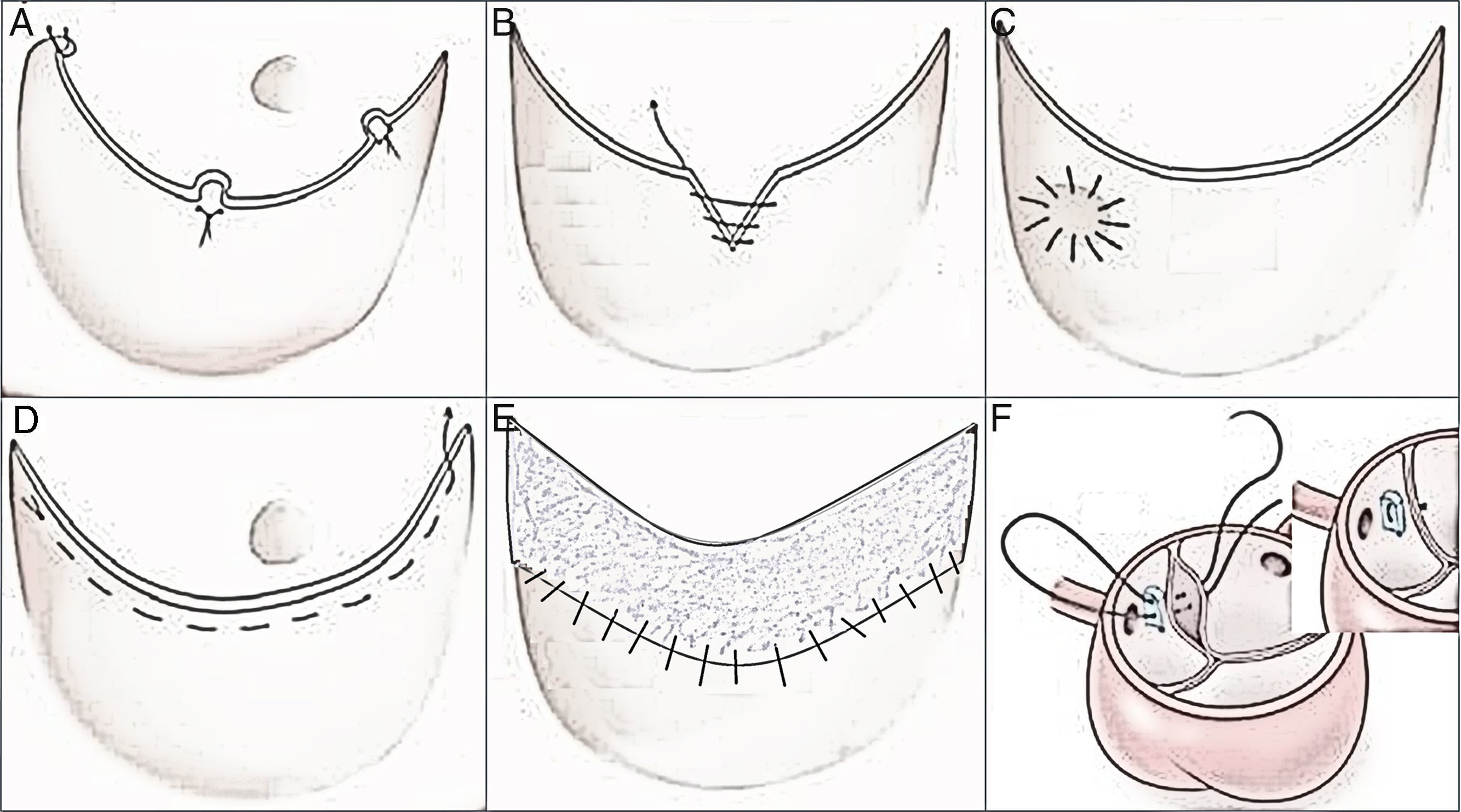
De forma simple, podemos clasificar la patología de los velos aórtico en: primaria o intrínseca (aislada de velos) o tipo id, ii y iii de la clasificación de Carpentier, y secundaria a la generada por la patología cirugía de la raíz aórtica o tipo ia, ib y ic de la clasificación de Carpentier. Es habitual encontrarnos con la asociación de ambas formas, aunque en ocasiones la insuficiencia aórtica es aislada (intrínseca) a la patología del velo, como por ejemplo en las endocarditis. A estas formas patológicas podríamos añadir las insuficiencias inducidas durante la cirugía de la raíz, tal como he comentado anteriormente, y que requieren de su reparación. El Khoury ha descrito una clasificación22 aplicable tanto a las formas patológicas primarias de velos como a las secundarias, atendiendo a la movilidad ecocardiográfica de los velos, denominando tipo i cuando el velo tiene movilidad normal y la insuficiencia es por la dilatación de alguna de las partes de la raíz aórtica (anillo, senos, UST) o por perforación en el velo; tipo ii cuando hay exceso de movilidad del velo, como en las roturas de comisuras o en los prolapsos primarios y quirúrgicos, y tipo iii a los velos con movimiento restrictivo por fibrosis o calcificación (fig. 7).
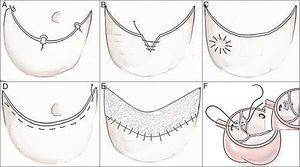
Técnicas de reparación de velos aórticos. A) Acortamiento de velos mediante plicatura del borde (punto de Trussler). B) Acortamiento de velos mediante resección triangular del borde. C) Parche de pericardio en perforaciones de velos. D) Resuspensión del borde libre del velo, mediante fruncido con sutura PTFE CV-6. E) Ampliación completa de la superficie del velo con parche de pericardio. F) Punto-sutura subcomisural de Cabrol reduciendo-plicando la unión aortoventricular; el punto es apoyado en teflón.
Los objetivos de las técnicas van encaminados a restablecer la anatomía de los velos, destacando los siguientes aspectos:
- –
Altura anatómica de los velos (longitud en la porción central del nadir) mayor de 19-20mm. Cuando existe una discrepancia entre velos > 2mm, probablemente existe un prolapso.
- –
Altura efectiva de los velos, medición ecocardiográfica, ≥ 9- 0mm (fig. 3).
- –
Superficie de coaptación entre velos ≥ 9-10mm (medición intraoperatoria con pie de rey) o ≥ 4mm (medición ecocardiográfica) (fig. 3).
- –
Diámetro del anillo aórtico < 25mm.
- –
Altura simétrica de las comisuras.
- –
Simetría en el tamaño de los nadires de los velos.
- –
Coaptación de los velos por encima del plano del anillo aórtico.
- –
Preservar la movilidad de los velos. Un velo poco móvil o inmóvil evoluciona a su deterioro con estenosis o regurgitación.
Las técnicas más descritas son:
- 1.
En el prolapso de los velos (fig. 7):
- –
Acortamiento de velos mediante resección triangular.
- –
Acortamiento de velos mediante plicatura con punto (punto de Trussler).
- –
Resuspensión del borde libre del velo, mediante fruncido con sutura PTFE CV-6. El Khoury et al. recomiendan el refuerzo del borde libre de los velos en los pacientes con conectivopatías.
- –
Extensión-ampliación, parcial o completa, de la superficie del velo con parche de pericardio bovino o autólogo, incrementando la superficie (área) de contacto entre velos.
- –
Parche pericardio (bovino o autólogo) en las perforaciones de velo.
- –
- 2.
En velos con restricción:
- –
Limpieza del velo, mediante la decalcificación o afeitado de las zonas fibróticas.
- –
Extensión-ampliación, parcial o completa, de la superficie del velo con parche de pericardio (bovino o autólogo).
- –
Plicatura de la pared aortica a nivel de la UST para reducir la distancia entre comisuras y promover cierto prolapso del velo.
- –
Otras técnicas más específicas para ciertas patologías son:
- –
En las perforaciones de velos por endocarditis: sutura de parche de pericardio (fig. 7).
- –
En las fenestraciones de los velos: sutura directa con polipropileno 6-7/0. Shäfers et al.23 recomiendan tratar y cerrar solo las fenestraciones presentes en velos patológicos; en velos sanos, recomiendan no tratar.
- –
En válvula aórtica bicúspide-unicúspide: liberación y descolgamiento del anclaje mural del rafe displásico23.
- –
En válvula aórtica unicúspide: formación parcial o completa de un neovelo con parche de pericardio bovino o autólogo23.
- –
En la insuficiencia valvular con áreas intercomisurales dilatadas: empleo del punto-sutura subcomisural o de Cabrol (fig. 7)24. Sirve para aproximar los velos a nivel comisural, reduce el anillo aórtico, disminuye el estrés de los velos en esta área comisural y aumenta el área de coaptación entre ellos.
Los resultados de la reparación de los velos son muy dependientes de la anatomía y los cambios patológicos de la válvula. La durabilidad de cada una de estas técnicas es difícil de ponderar y tan solo la experiencia de los principales grupos está dando cuenta de su utilidad a medio-largo plazo. Entre los factores adversos que predisponen a la recurrencia significativa (insuficiencia aórtica > 2, es decir, grado 3-4) postoperatoria tardía destaca el empleo de pericardio (30% recurrencias a 5 años), el tipo iii de la clasificación de El Khoury (35% recurrencias a 3 años), la orientación comisural < 150o en las válvulas bicúspides (35% a 5 años), anillo aórtico > 29mm (25% a 5 años), no estabilización del anillo aórtico (25% a 5 años) y una superficie de coaptación ecocardiográfica < 4mm4–6,14–22,25,26.
Aplicar técnicas de raíz aórtica (remodelado/reimplantación) en la insuficiencia primaria de velos, aun con senos de tamaño normal, está mostrando que mejora la durabilidad de la reparación a largo plazo4,22,25. No obstante, esta opción aún es controvertida y no compartida por muchos cirujanos, a la espera de estudios comparativos prospectivos.
Resultados de las técnicas de reparación valvular aórticaLas principales series de la literatura describen experiencias personales mezclando formas etiopatogénicas de insuficiencia aórtica, sin entrar a diferenciar claramente los resultados de las técnicas aplicadas para los diversos mecanismos, a excepción de series de conectivopatías y de válvula aórtica bicúspide.
Shäfers et al. publican para el 1.er, 3.er y 5.° año un porcentaje de recurrencia ecocardiográfica significativa (insuficiencia aórtica 3-4/4) del 2, el 4 y el 4% en válvula bicúspide y del 7, el 11 y el 17% en válvula tricúspide, respectivamente; y con necesidad de reintervención en bicúspide del 12% a 5 años y del 19% a 10 años, y en tricúspide del 3% a 5 años y del 7% a 10 años25,26.
El Khoury et al. publican recurrencia ecocardiográfica significativa a 5 años del 12% y del 21% a los 8 años de seguimiento. Este grupo destaca los pobres resultados obtenidos en la reparación de la insuficiencia tipo iii27.
Badiu et al. publican reintervención por recurrencia de la insuficiencia aórtica del 14% a los 3 años de seguimiento, destacando que no encontraron diferencias en cuanto a las formas bicúspide o tricúspide; sin embargo, todas las recurrencias sucedieron en el grupo de pacientes sin cirugía de la raíz (reimplantación) 14% vs. 0% con reimplantación15.
Miller et al. publican, con la técnica de reimplantación, reintervención por recurrencia de la insuficiencia aórtica del 8% a los 10 años de seguimiento, sin diferencias en cuanto a tipo de válvula (bicúspide o tricúspide) o a la presencia de conectivopatía28,29. Para Ashikhmina et al., la necesidad de reintervención en válvula bicúspide fue del 51% a los 10 años30.
ConclusionesLa reparación de la válvula aórtica ha avanzado técnicamente en los últimos años, alcanzándose resultados alentadores, aunque tiene que ser considerada con cautela por su baja reproducibilidad, dependiente de la experiencia propia de cada cirujano. Es bien conocido que la dilatación de la raíz es un problema independiente de la patología de los velos, y la cirugía valvular aórtica aislada no ha mostrado ser suficiente para estabilizar el comportamiento hacia la redilatación de la raíz. Por todo ello, hay que clarificar bien los mecanismos implicados, mediante estudios ecocardiográficos de expertos exploradores, y así tratarlos de forma simultánea durante la reparación. La reparación no es tan solo el resultado inmediato ecocardiográfico, sino la restitución de la morfología y la fisiología de las estructuras de la raíz aórtica, y para ello el cirujano ha de tener una formación y una experiencia quirúrgica adecuadas. En palabras del Dr. Craig Miller, profesor de la Universidad de Stanford, «estos procedimientos son implacables en términos de pequeños errores técnicos y, en este momento, realmente están basados más en un pensamiento geométrico tridimensional y en una cuestión de arte de lo que es en ciencia»31.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
XIX Reunión Anual de Médicos Residentes Cirugía Cardiovascular. Valencia, 29 de marzo del 2014.