La cirugía de la disección aórtica tipo A es una situación clínica que asocia invariablemente una elevada mortalidad. El principal desafío al que se enfrenta el cirujano consiste en mantener con vida al paciente una vez superado el episodio agudo, independientemente de la evolución de la afección residual aórtica y de la necesidad o no de reintervención posterior. Los objetivos quirúrgicos se dirigen a reinstaurar el flujo a través de la luz verdadera, eliminar el desgarro (rotura) principal, y restablecer la anatomía de la raíz y la competencia de la válvula aórtica para limitar los efectos de la malperfusión visceral y coronaria, el riesgo de rotura y taponamiento cardiaco, así como el estado de shock. El contexto clínico de cada paciente, así como la infraestructura disponible y la experiencia del cirujano determinan en último lugar la técnica más adecuada a aplicar.
Type A aortic dissection surgery is invariably associated with a high mortality rate. The first challenge that the surgeon faces is to keep the patient alive, regardless of the residual disease in the remaining aorta and the need for re-intervention in the future. Surgical goals are aimed at restoring flow on the true lumen, excluding a main aortic tear and restoring the anatomy and competence for the aortic root and the aortic valve, in order to limit the consequences of visceral and coronary malperfusion, the risk of rupture and tamponade, as well as shock. The clinical context, the available infrastructure and the experience of the surgeon are ultimate determinants for which the most suitable technique should be performed.
El pronóstico fatal de la disección aórtica tipo A sin tratamiento quirúrgico ha sido bien documentado desde hace más de 2 décadas1. En la actualidad, centros de excelencia consiguen tasas de supervivencia hospitalaria y al año por encima del 80%2,3, por lo que, en ausencia de edades extremas, daño neurológico masivo evolucionado, isquemia (necrosis) intestinal avanzada u otro tipo de gran comorbilidad, cualquier paciente diagnosticado de disección aórtica tipo A debería recibir tratamiento quirúrgico inmediato4. En relación con la edad, resulta lógico que los resultados quirúrgicos sean peores en ancianos, aunque pacientes seleccionados pueden presentar una supervivencia razonable incluso a partir de la octava década5,6. Por otra parte, existe evidencia en aumento en relación con la reversibilidad de determinados cuadros neurológicos (como consecuencia directa de una malperfusión craneal) tras una intervención quirúrgica temprana adecuada7.
Los objetivos principales en la cirugía de la disección aórtica tipo A son 3:
- 1)
Reinstaurar el flujo a través de la luz verdadera.
- 2)
Eliminar el desgarro (rotura) principal.
- 3)
Restablecer la anatomía de la raíz y la competencia de la válvula aórtica.
Todo ello con la finalidad de evitar o tratar la rotura y el taponamiento cardiaco, las consecuencias de la malperfusión de órganos (infarto de miocardio, ictus, etc.) y, eventualmente, el fallecimiento del paciente. La presencia de malperfusión visceral a cualquier nivel (hasta en el 20-30% de los pacientes), así como el taponamiento cardiaco y el estado de shock han sido identificados en múltiples estudios como los principales predictores de mortalidad precoz8, mientras que la insuficiencia valvular o la imposibilidad de exclusión del desgarro principal que origina la disección lo son para la necesidad de reintervención posterior, por lo que es fundamental que los procedimientos quirúrgicos se dirijan a tratar cada una de estas situaciones.
En general, las actuaciones más conservadoras consistentes en la sustitución de aorta ascendente suprasinusal por un conducto protésico o biológico (extendido distalmente a hemiarco si se precisa) con preservación de la válvula aórtica son reproducibles y útiles para tratar a una gran mayoría de pacientes, con una mortalidad aceptable9. De hecho, tras una intervención exitosa de este tipo, la tasa de reintervención por progresión de la enfermedad a los 10 años (en los casos no complicados) se sitúa en torno al 5% de acuerdo con las series de Cleveland10 y Yale11, con un crecimiento promedio del diámetro aórtico de 0,26cm/año, es decir, comportándose de una manera relativamente benigna tras la primera intervención. En consecuencia, procedimientos quirúrgicos más extensos deben ser cuidadosamente planificados e individualizados, teniendo en cuenta el riesgo quirúrgico adicional y el hipotético beneficio para el paciente en cada caso. Sin embargo, la persistencia de una falsa luz residual en el cayado y la aorta torácica descendente está presente en el 60-90% de los pacientes intervenidos, lo que ha generado controversias acerca de la idoneidad de tratar estos segmentos de aorta durante el mismo acto, a posteriori o exclusivamente bajo tratamiento médico. Estudios recientes han identificado variables que predisponen a un mal resultado a largo plazo y la necesidad de reintervención posterior (pudiendo llegar hasta el 50% a 10 años), tales como12:
- 1)
Tamaño de la aorta torácica descendente superior a 35mm.
- 2)
Persistencia de permeabilidad en la falsa luz.
- 3)
Diámetro de la falsa luz superior a 22mm.
- 4)
Desgarro principal superior a 10mm.
La ruta de acceso para proporcionar flujo arterial de entrada a través de la luz verdadera (subclavia, femoral, etc.) continúa siendo motivo de debate en la actualidad13,14. Con independencia del acceso elegido, es imprescindible asegurar la canulación de la luz verdadera, ya que lo contrario podría derivar en una presurización excesiva de la falsa luz, agravando la situación de malperfusión e incrementando el riesgo de progresión de la disección o incluso de rotura de la aorta. La monitorización hemodinámica, la presencia de diuresis adecuada, así como la evolución de la oximetría cerebral y los parámetros bioquímicos intraoperatorios (lactato, etc.), junto con una técnica quirúrgica precisa, son medidas intraoperatorias que contribuyen a asegurar una perfusión adecuada de la luz verdadera durante todo el procedimiento.
Entre las diferentes opciones de canulación, en los últimos años está ganando en popularidad la vía subclavia o axilar derecha por constituir una perfusión anterógrada más fisiológica y presentar un menor número de inconvenientes derivados de la malperfusión, sobre todo en disecciones tipo A que se extienden a lo largo de toda la aorta (tipo i de DeBakey) ante la posibilidad de múltiples entradas entre ambas luces a lo largo de la misma15. Diferentes estudios han puesto énfasis en las ventajas del abordaje axilar respecto al femoral, con una reducción de la mortalidad promediada desde el 23% en las series con canulación femoral hasta el 6,5% en el caso de la subclavia16. La perfusión por vía subclavia puede realizarse mediante canulación arterial directa (habitualmente 16-18F) o mediante la interposición de un injerto protésico de Dacron, tras disecar y controlar proximal y distalmente la arteria bajo el borde clavicular o en el surco deltopectoral.
En el caso de la canulación directa, las técnicas tipo Seldinger no son recomendables debido a la posibilidad de incidir sobre la falsa luz. La canulación suele realizarse con una arteriotomía transversal convencional diferenciando las diferentes capas de la arteria para asegurar una canulación correcta. La cánula debe introducirse unos 4-5cm sin resistencia para no sobrepasar la bifurcación carotidosubclavia, y fijarse adecuadamente para evitar la expulsión retrógrada debido a la presión de la línea. Posteriormente, y tras la decanulación, la arteria suele necesitar ser reconstruida, lo que habitualmente se realiza con suturas interrumpidas de polipropileno 5/0 asegurando la entrada a través de todas las capas de la arteria.
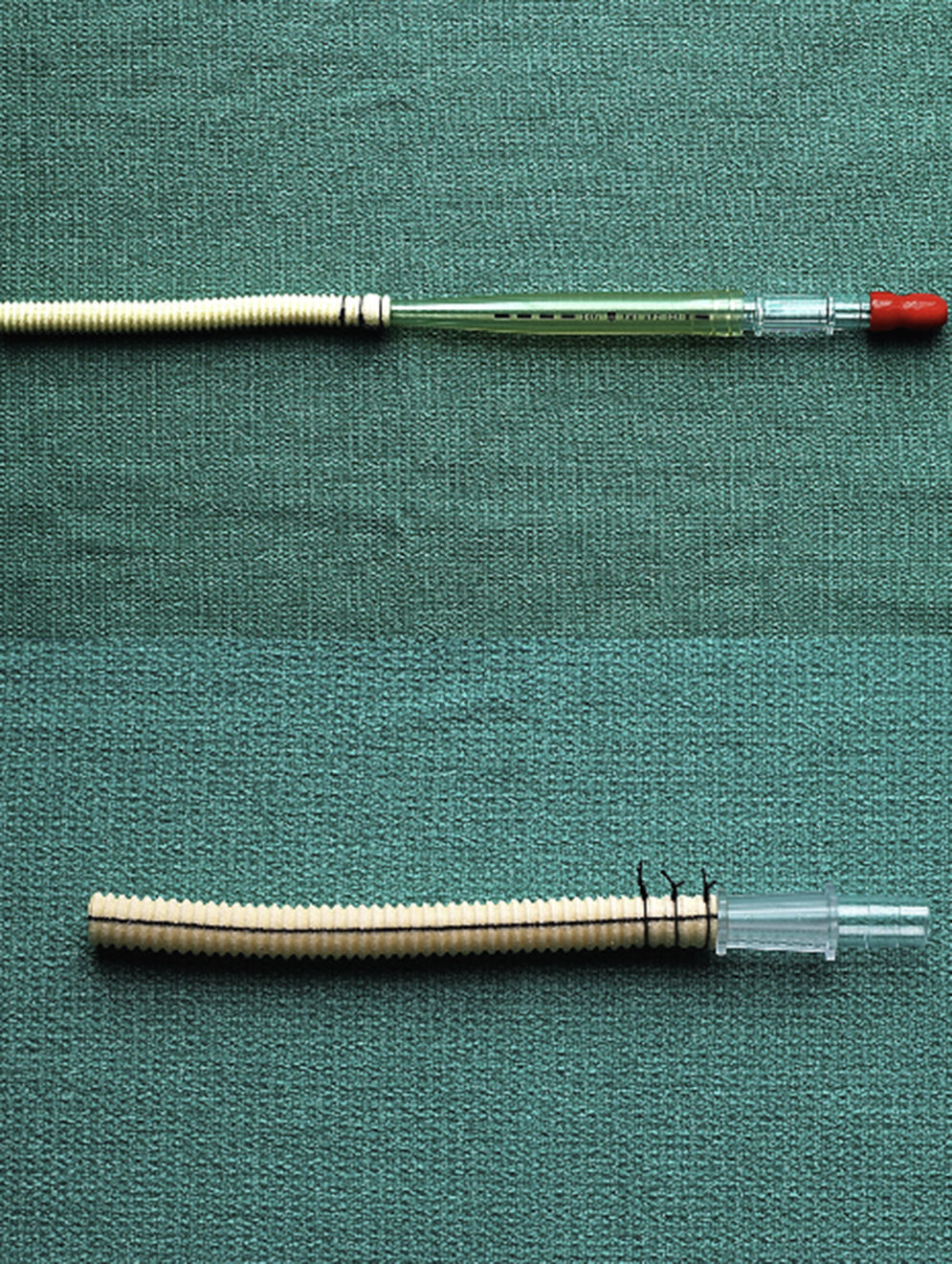
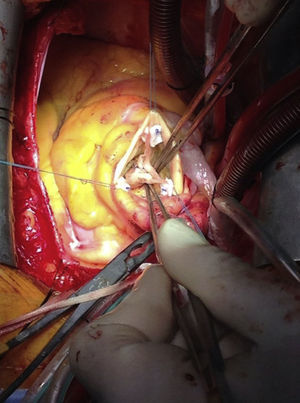
En relación con la interposición de conducto, suele utilizarse una prótesis de Dacron de 8-10mm mediante una anastomosis terminolateral con sutura continua de polipropileno 5/0 a través de una arteriotomía longitudinal. Proximalmente el conducto puede conectarse al circuito arterial con una conexión 3/8 de pulgada o mediante una cánula similar a la de la situación anterior (fig. 1). Esta técnica permite un flujo mayor en arterias pequeñas, así como perfundir el miembro superior derecho y monitorizar la presión arterial por vía radial derecha. Además, presenta un menor riesgo de yatrogenia en relación con lesiones de la arteria radial y del plexo braquial17.
Segundo objetivo: excluir el desgarro principalHoy en día, las técnicas de reparación óptima de la pared aórtica tanto a nivel proximal como distal en las zonas de anastomosis continúan en evolución, e incluyen la reconstrucción neomedial con interposición de teflón o pegamentos biológicos, la inversión adventicial o el refuerzo interno y/o externo con teflón o pericardio autógeno. El entusiasmo inicial por los pegamentos biológicos ha disminuido tras describirse casos de necrosis de pared, fallo de sutura y formación de seudoaneurismas18. En cualquier caso, resulta fundamental (sobre todo en las disecciones aórticas extensas donde puede haber múltiples reentradas entre ambas luces) asegurar una buena anastomosis distal que incluya suficiente cantidad de material de todas las capas de la aorta con la finalidad de evitar el posible sangrado por flujo retrógrado («back flow»), por presurización de la falsa luz a través de alguna de las reentradas, aunque todavía para ciertos autores este es un concepto más teórico que real19.
La preparación ideal para realizar una correcta anastomosis distal requiere unas condiciones de parada circulatoria y cierto grado de hipotermia para disminuir el metabolismo y el daño celular de los órganos durante el tiempo que no están perfundidos. De esta manera se facilita la construcción de una anastomosis «abierta», que permite explorar adecuadamente el interior del arco aórtico y evitar lesiones derivadas del pinzamiento aórtico, que debe ser evitado. David et col.20 mostraron que la evitación del pinzamiento aórtico durante la fase de enfriamiento y la construcción de una anastomosis distal abierta en condiciones de parada circulatoria mejoraba sus resultados a corto y largo plazo, demostrando que el pinzamiento aórtico no solo podría inducir la presurización de la falsa luz, sino también originar nuevas lesiones en la aorta per se.
La anastomosis distal abierta posibilita la extensión de la anastomosis distal más allá del inicio del tronco braquiocefálico, extendiendo los bordes de resección y anastomosis inferiores en la convexidad del arco aórtico (sustitución de aorta ascendente ampliada a hemiarco). Pese a que la sustitución de aorta ascendente, bien aislada, bien ampliada como hemiarco, suele ser suficiente en una gran mayoría de los enfermos, existe disparidad de opiniones en lo relativo a la necesidad de sustituir el arco aórtico completo de manera sistemática en esta afección. En general, las roturas que se localizan incluyendo o más allá de alguno de los troncos supraaórticos, o bien aquellos casos que presentan una dilatación aneurismática marcada del cayado (>50mm), deberían considerarse para una sustitución total del arco aórtico.
La decisión acerca de la idoneidad de una sustitución de cayado aórtico simultánea en el mismo procedimiento es motivo de debate en la actualidad debido al considerable incremento en morbimortalidad del procedimiento respecto a la sustitución de aorta ascendente aislada, así como a la mayor dificultad técnica del mismo (constituyendo en ocasiones un verdadero desafío quirúrgico). Existen signos de mal pronóstico que orientarían hacia un manejo más intensivo de la afección aórtica aconsejando una sustitución completa de cayado, entre los que se encontrarían12:
- 1)
Aneurisma de cayado aórtico preexistente>50mm.
- 2)
Desgarro intimal principal localizado en el cayado aórtico distal (no abordable mediante una exclusión tipo «hemiarco» convencional).
- 3)
Desgarro intimal secundario con una longitud>10mm.
- 4)
Signos clínicos evidentes de malperfusión visceral.
- 5)
Signos radiológicos de malperfusión visceral potencial.
- 6)
Diámetro de la falsa luz>22mm.
- 7)
Diámetro de la aorta torácica descendente>35mm.
Por último, durante el tiempo de parada circulatoria es posible realizar algún tipo de perfusión cerebral selectiva en función de la técnica de canulación, lo que permite ampliar el margen de tiempo de parada circulatoria y disminuir el grado de hipotermia. Mediante canulación axilar derecha y control del tronco braquiocefálico se posibilita la perfusión cerebral anterógrada unilateral por la carótida derecha. Múltiples variantes de perfusión cerebral selectiva han sido descritas en la literatura médica15, aunque en el momento actual existe una tendencia cada vez más generalizada a pasar de situaciones de parada circulatoria con hipotermia profunda (18°C) a hipotermia moderada (24-25°C), que permite márgenes de seguridad similares con tiempos de circulación extracorpórea más cortos, al necesitar un período de recalentamiento menor21,22, aunque estos aspectos quedan fuera del propósito del presente artículo.
Tercer objetivo: restablecer la anatomía de la raíz y la competencia de la válvula aórticaNo es infrecuente encontrar una progresión proximal de la disección hacia la raíz aórtica originando diferentes grados de incompetencia valvular. Los principales mecanismos que generan regurgitación aórtica son la regurgitación central por dilatación de la raíz, el prolapso de alguno de los velos o la inversión de un «flap» intimal que se interpone en el plano de coaptación valvular, siendo la válvula aórtica estructuralmente normal hasta en un 70%23. Salvo la última situación (que se soluciona per se con la sustitución de la aorta ascendente), puede ser necesario algún tipo de actuación sobre la válvula aórtica o la raíz.
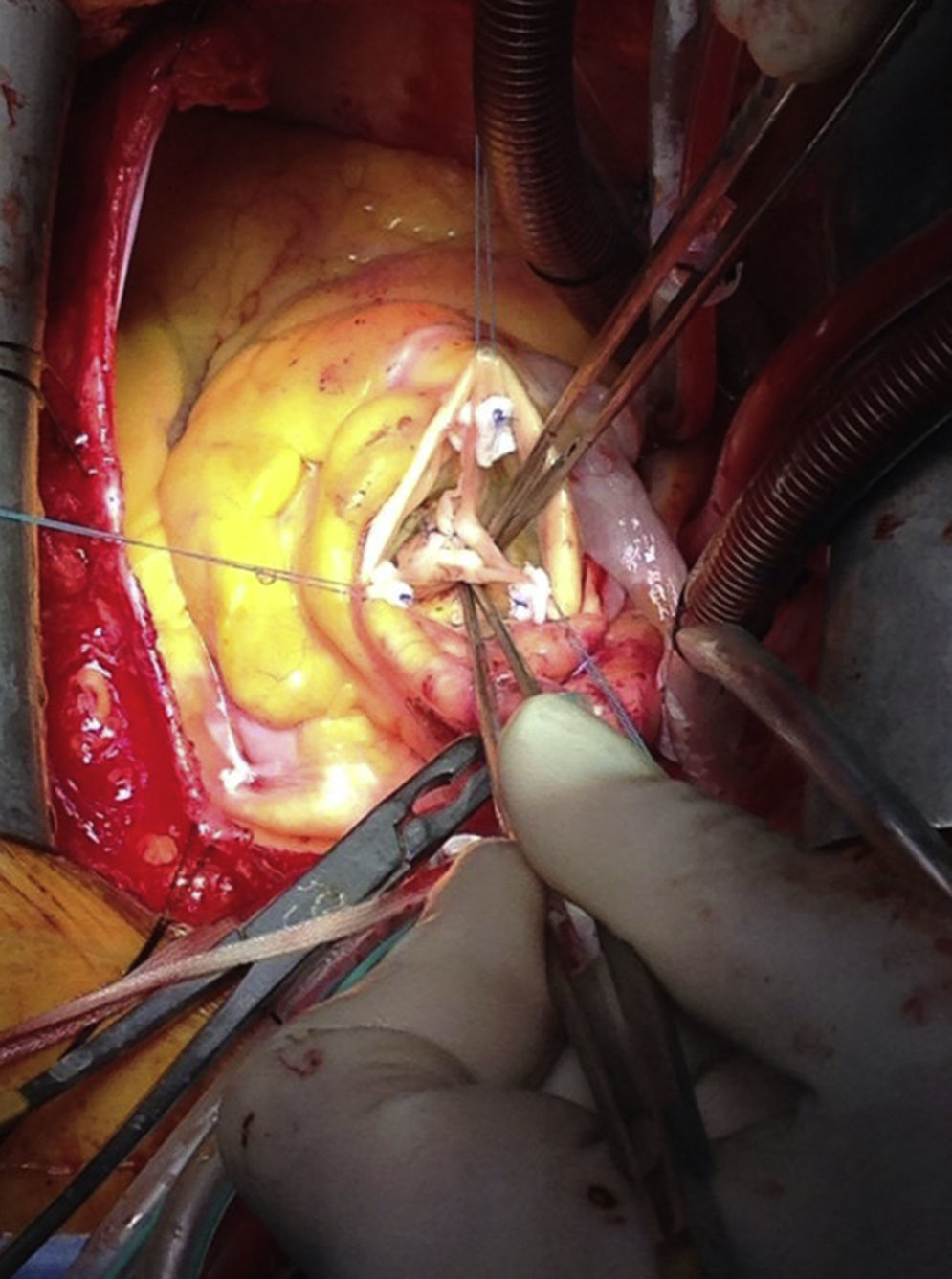
En general, un grado de insuficiencia aórtica ligero o moderado suele ser bien tolerado, y muchos pacientes no tratados de la misma durante una cirugía de disección aórtica tipo A pueden permanecer asintomáticos durante largos períodos de tiempo. Hay que hacer especial énfasis en que esta situación constituye un recurso exitoso, aunque el mismo paciente necesite un procedimiento de sustitución o reparación valvular aórtico años más tarde. Solo aquellos pacientes con un grado de regurgitación significativo (3+) necesitan invariablemente un tipo de actuación concomitante sobre la válvula aórtica, que debe estar dirigido preferentemente a solucionar el mecanismo fisiopatológico que la causa. En el caso de la insuficiencia central, puede ser suficiente con la reducción del diámetro del anillo sinotubular durante la realización de la anastomosis proximal. Otra técnica común y muy reproducible consiste en aproximar las 3 comisuras con puntos en «U» de polipropileno 5/0 con la finalidad de aumentar la superficie de coaptación entre los velos (fig. 2). La supervivencia libre de reintervención por insuficiencia valvular se sitúa entre el 70 y el 80%24. Prolapsos más complejos o roturas de alguno de los velos requieren técnicas específicas de reparación valvular, y en estos casos puede ser más recomendable realizar una sustitución valvular, sobre todo si existen dudas sobre la fiabilidad de la reparación.
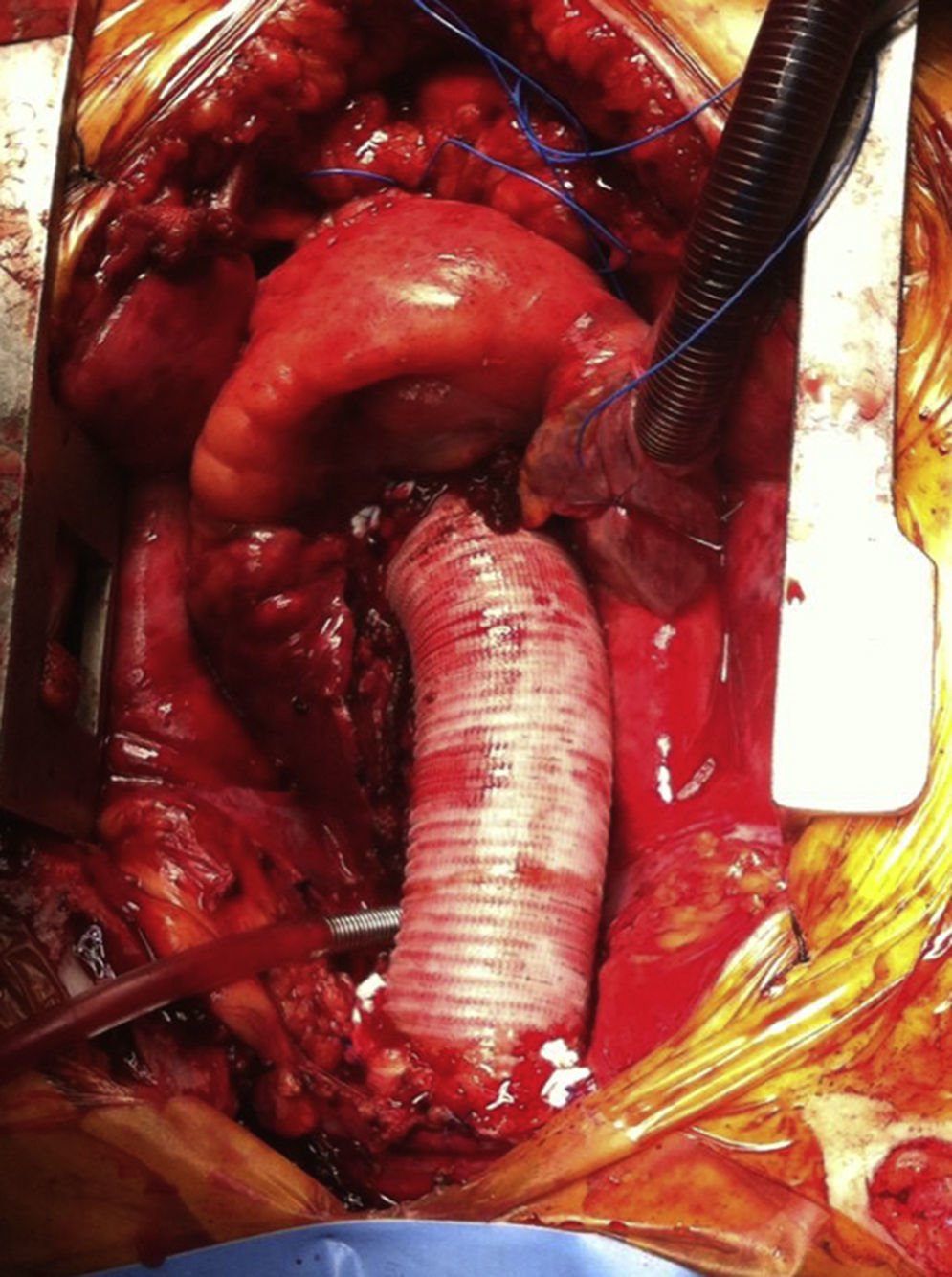
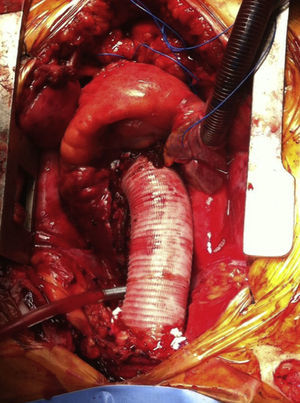
Por otra parte, ante la presencia de una anulectasia aórtica franca, en pacientes con conectivopatías tipo Marfan, o ante la presencia de un desgarro principal incluido en la raíz aórtica, la sustitución de la aorta con un conducto supracoronario puede no ser suficiente, siendo necesaria la interposición de un conducto valvulado para realizar una sustitución completa de raíz con reimplante de los botones coronarios (fig. 3). En este tipo de pacientes no solo se evita la necesidad de una segunda intervención a medio o largo plazo, sino que también se asegura la sutura proximal al anillo aórtico, evitando el tejido de mala calidad a nivel de la raíz.
ConclusionesLa cirugía de la disección aórtica tipo A es una situación clínica que asocia invariablemente una elevada mortalidad. El principal desafío al que se enfrenta el cirujano consiste en mantener con vida al paciente una vez superado el episodio agudo, independientemente de la evolución de la afección residual aórtica y de la necesidad o no de reintervención posterior. Los objetivos quirúrgicos se dirigen a reinstaurar el flujo a través de la luz verdadera, eliminar el desgarro (rotura) principal, y restablecer la anatomía de la raíz y la competencia de la válvula aórtica para limitar los efectos de la malperfusión visceral y coronaria, el riesgo de rotura y taponamiento cardiaco, así como el estado de shock.
Existe evidencia suficiente en relación con que la canulación periférica con permeabilización de la luz verdadera es preferible a la canulación central, y que el pinzamiento aórtico posee un alto riesgo de lesiones yatrogénicas. Por tanto, la sustitución de aorta ascendente que incluya el desgarro principal es el tratamiento de elección en pacientes con una disección de aorta tipo A. La anastomosis distal más segura debería ser abierta bajo condiciones de parada circulatoria con perfusión cerebral selectiva (evitando el pinzamiento aórtico) y extendida o no como hemiarco en función de la situación en cada caso. Para ello, la perfusión anterógrada por vía subclavia derecha directa o con interposición de injerto parece asegurar un mayor porcentaje de éxito y un menor número de complicaciones. El recambio completo del arco aórtico debería realizarse en pacientes con disección tipo A en los que el desgarro principal se localiza incluyendo o más allá de alguno de los troncos supraaórticos, o bien en aquellos que presentan una dilatación aneurismática marcada del mismo (>50mm). El recambio de la raíz aórtica y la sustitución por un conducto valvulado está indicado en pacientes en los que el desgarro principal se localiza o se extiende en los senos coronarios izquierdo o derecho, o ante un diámetro de la raíz aórtica superior a 45mm. El estudio minucioso de la tomografía prequirúrgica es fundamental de cara a identificar el desgarro principal y los diámetros aórticos en cada segmento, así como de las luces verdadera y falsa en el momento de la planificación quirúrgica. Sin embargo, el contexto clínico de cada paciente, así como la infraestructura disponible y la experiencia del cirujano, determinan, en último lugar, la técnica más adecuada a aplicar.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
Trabajo presentado en la XIX Reunión de Médicos Residentes en Cirugía Cardiovascular.