La patología de la aorta supone un reto para la medicina. Tanto a nivel diagnóstico, como terapéutico, el volumen de variables implicado ha hecho que dicha patología sea abordada por una ingente cantidad de especialistas. El manejo quirúrgico de dichas patologías implica un esfuerzo extraordinario por parte de muchos profesionales, dada la complejidad técnica y tecnológica empleada. A lo largo de estos años, dichos esfuerzos están dando sus frutos en forma de mejoras de resultados, gracias a un abordaje sistemático y protocolizado en el seno de un grupo de expertos (Comités de aorta o ``Aortic team'') en el que se han de implicar cardiólogos, cirujanos cardíacos, cirujanos vasculares, anestesiólogos y radiólogos, principalmente.
En este documento, consensuado entre los grupos de trabajo de Aorta de las sociedades españolas de Anestesiología (SEDAR) y Cirugía Torácica-cardiovascular (SECTCV) se busca difundir los modos de trabajo más consensuados entre los centros de mayor actividad del país por parte de ambas especialidades, en lo que al tratamiento quirúrgico se refiere de la patología de aorta ascendente y arco aórtico se refiere, así como del tratamiento de la disección aguda de aorta.
Somos conscientes de la evolución constante de la terapéutica, lo cual sin duda puede hacer cuestionables algunas opiniones aquí expresadas y que sin duda irán modificándose en futuras ediciones.
Este documento aspira a ser una herramienta de trabajo para los diferentes profesionales implicados en el tratamiento de la patología aórtica.
The pathology of the aorta is a challenge for medicine. Diagnostic and therapeutica move a huge volume of variables. This has let this pathology to be addressed by a big number of specialists. The surgical management of these pathologies implies an extraordinary effort on the part of many professionals, given the technical and technological complexity employed. Throughout these years, these efforts are paying off in the form of improved results, thanks to a systematic and protocolized approach within a group of experts (Aortic Committees or ``Aortic team'') in which they have to involve cardiologists, cardiac surgeons, vascular surgeons, anesthesiologists and radiologists, mainly.
In this document, agreed between the Aorta working groups of the Spanish societies of Anesthesiology (SEDAR) and Thoracic-Cardiovascular Surgery (SECCE), it is sought to disseminate the most agreed working modes among the centers of greatest activity in the country by both specialties, as far as surgical treatment is concerned with ascending aortic and aortic arch pathology, as well as the treatment of acute aortic dissection.
We are aware of the constant evolution of therapeutics, which can undoubtedly make some of the opinions expressed here questionable and that will undoubtedly be modified in future editions.
This document aims to be a working tool for the different professionals involved in the treatment of aortic pathology.
La patología de la aorta, desde sus inicios, ha supuesto un reto para la medicina. Tanto a nivel diagnóstico como terapéutico, el volumen de variables implicado ha hecho que dicha patología sea abordada por una ingente cantidad de especialistas. El manejo quirúrgico de dichas patologías implica un esfuerzo extraordinario por parte de muchos profesionales, dada la complejidad técnica y tecnológica empleada. A lo largo de estos años, dichos esfuerzos están dando sus frutos en forma de mejoras de resultados, gracias a un abordaje sistemático y protocolizado en el seno de un grupo de expertos (Comités de aorta o «Aortic team») en el que se han de implicar cardiólogos, cirujanos cardíacos, cirujanos vasculares, anestesiólogos y radiólogos, principalmente.
En este documento, consensuado entre los grupos de trabajo de Aorta de las sociedades españolas de Anestesiología (SEDAR) y Cirugía Torácica-Cardiovascular (SECTCV), se busca difundir los modos de trabajo más consensuados entre los centros de mayor actividad del país por parte de ambas especialidades, en lo que al tratamiento quirúrgico se refiere.
Somos conocedores de la complejidad y de la constante evolución de las opciones terapéuticas, por lo que presentamos esta primera versión de la Guía anestésico-quirúrgica en el tratamiento de la cirugía de la aorta ascendente y del arco aórtico, con la certeza de dejar cosas en el tintero y pensando en que próximas versiones irán añadiendo nuevas técnicas que, aunque ya puedan estar usándose, todavía no son recomendables en cuanto a su uso generalizado en todos los centros. También irán cambiando las técnicas a medida que estas vayan evolucionando gracias al esfuerzo de expertos de las diferentes especialidades implicadas.
La EACTS/ESVS, en el último documento de consenso de expertos, define el concepto de «Aortic team»1. El equipo debe estar estrechamente involucrado desde el diagnóstico hasta el tratamiento; finalmente, el seguimiento debe ser dirigido por miembros de cirugía cardíaca y vascular en colaboración con anestesiología, cardiología, radiología y genética. Se recomienda la centralización de la atención de las patologías del arco aórtico en grandes centros porque es la única forma de comprender de manera efectiva el curso natural de la enfermedad, proporcionar toda la gama de opciones de tratamiento bajo un mismo paraguas y tratar las posibles complicaciones de cada terapia de forma individual. Debe estar disponible una vía de atención de emergencias simplificadas (disponibilidad 24h/7días), con capacidades adecuadas de transporte y transferencia, así como una activación rápida del equipo multidisciplinario (tabla 1).
Recomendaciones EACTS/ESVS para patología del arco aórtico
| Recomendación 1. Se recomienda la toma de decisiones para el tratamiento de las patologías del arco aórtico por un equipo aórtico | Clase I | Nivel C |
| Recomendación 2. Se recomienda centralizar la atención de las patologías del arco aórtico | Clase I | Nivel C |
| Recomendación 3. Se recomienda que el tratamiento de la patología electiva del arco aórtico se realice en centros especializados que ofrezcan cirugía cardiovascular abierta y endovascular | Clase I | Nivel C |
| Recomendación 4. Se recomienda el seguimiento continuo del paciente con patología del arco aórtico antes y después del tratamiento en un centro de especialidades | Clase I | Nivel C |
| Recomendación 5. Se recomienda un quirófano híbrido para la reparación endovascular de la aorta torácica con afectación del arco aórtico | Clase I | Nivel C |
| Recomendación 6. El tratamiento de los aneurismas aislados del arco aórtico debe considerarse con un diámetro ≥ 55mm | Clase IIA | Nivel C |
| Recomendación 7. Se recomienda la evaluación preoperatoria de la patología del arco aórtico con angio-TC como la modalidad de imagen de primera línea | Clase I | Nivel C |
| Recomendación 8. Se recomienda evaluar la permeabilidad y la morfología del polígono de Willis cuando el tratamiento afecta al arco aórtico | Clase I | Nivel C |
| Recomendación 9. Se recomienda la evaluación de los vasos supraaórticos extracraneales hasta el nivel de la bifurcación cuando está implicado el arco aórtico | Clase I | Nivel C |
Fuente: tomado de las Guías EACTS/ESVS1.
El objetivo principal de este protocolo es, basándose en la última evidencia científica, explicar y estandarizar las diferentes pautas de actuación y manejo de esta cirugía compleja.
Profesionales a los que va dirigido el protocoloEl protocolo se dirige a todos los médicos (anestesiólogos, cirujanos cardíacos, médicos intensivistas y cardiólogos) y personal involucrado en el manejo perioperatorio de esta cirugía, tanto patología crónica como aguda.
Definiciones. Indicaciones quirúrgicas. Población dianaTodos los pacientes sometidos a cirugía de aorta ascendente y arco aórtico.
En cuanto a la patología crónica, los criterios de clasificación más habituales de los aneurismas aórticos son el aspecto macroscópico y la localización. Según la morfología, los aneurismas se clasifican en:
- -
Saculares.
- -
Fusiformes.
Según la localización, el diafragma nos delimita dos territorios:
- -
Aneurismas de aorta torácica.
- -
Aneurisma de aorta abdominal.
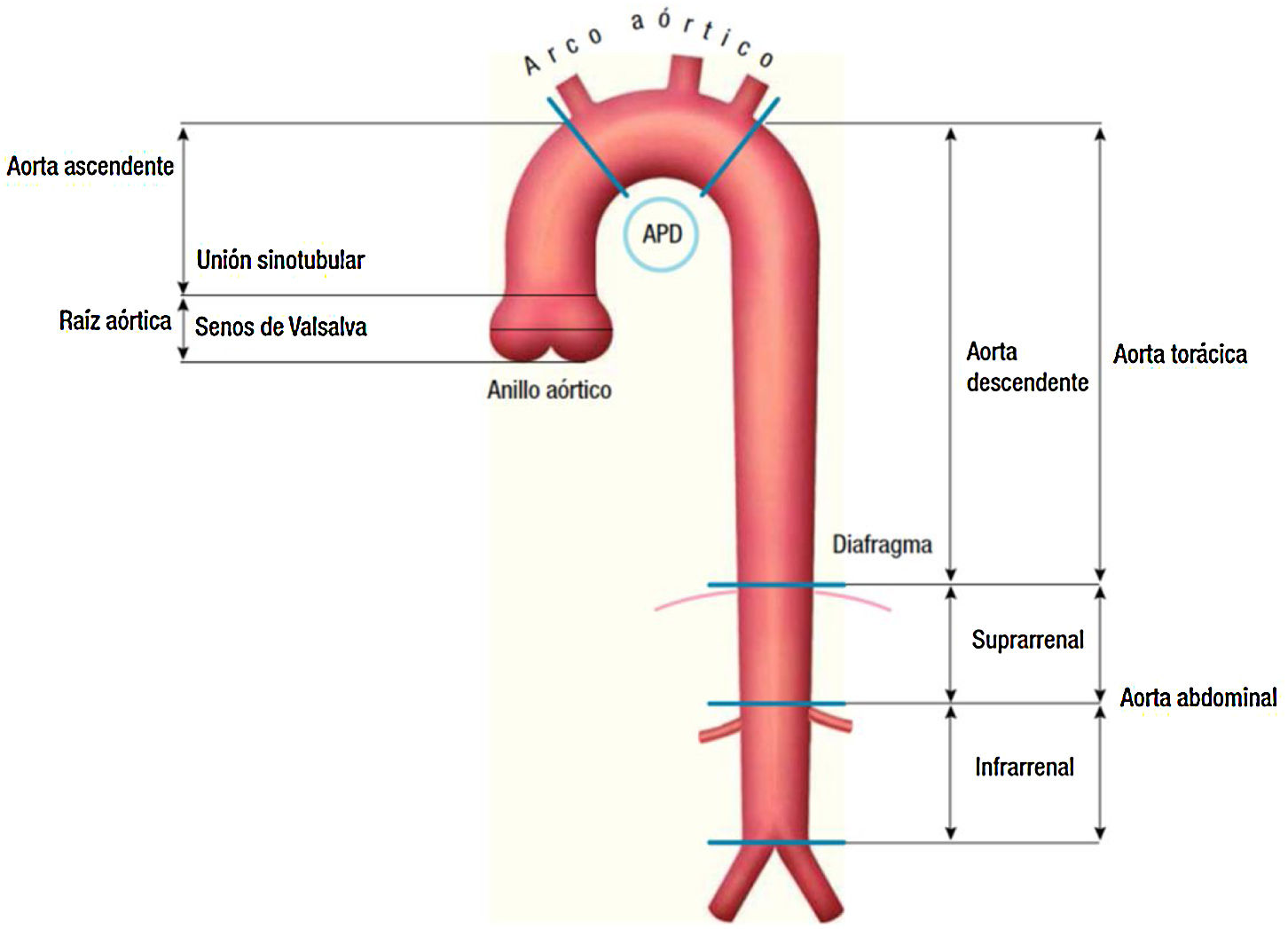
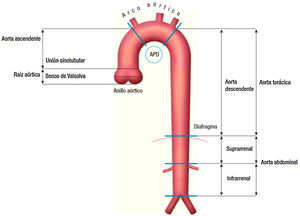
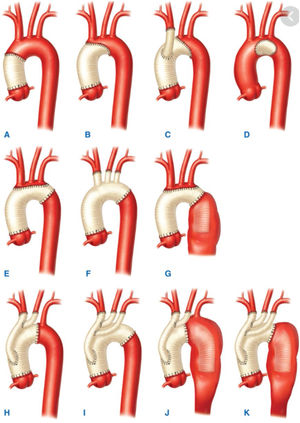
Dentro de los primeros, veremos los aneurismas de aorta ascendente y arco aórtico (fig. 1).
Clasificación anatómica de la aorta.
Fuente: tomado de «2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult»2.
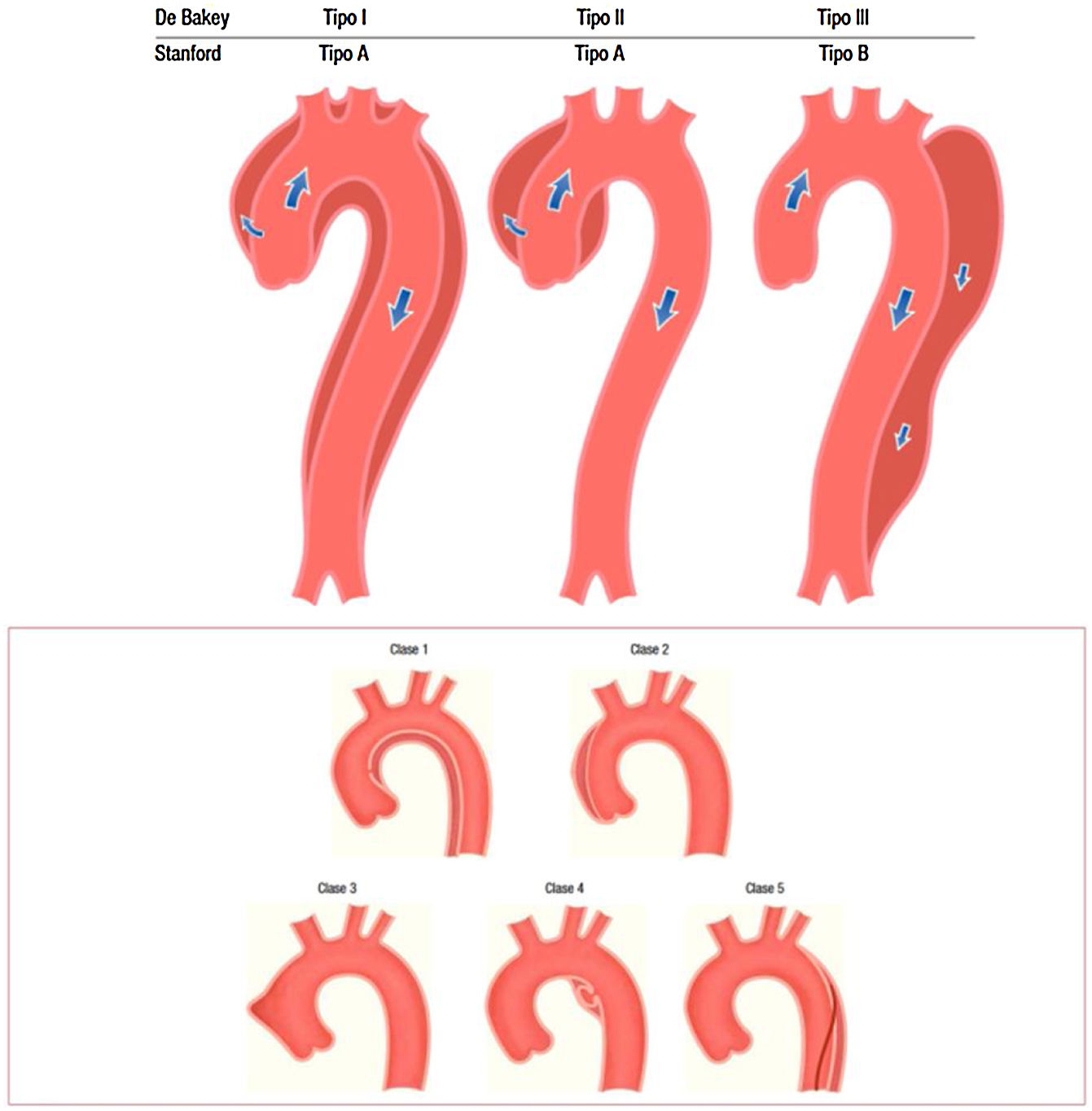
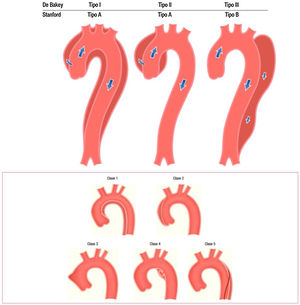
En cuanto a la patología aguda, las clasificaciones habitualmente utilizadas son la DeBakey y la de Stanford (fig. 2).
Clasificación de los tipos de disección aórtica.
Fuente: tomado de «2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult»2.
Las indicaciones para la cirugía se basan principalmente en el diámetro aórtico y se extraen de los hallazgos hechos en la historia natural al sopesar el riesgo de complicaciones frente al riesgo de la cirugía electiva. Otro motivo para indicar la cirugía en esos aneurismas es la tasa de crecimiento anual, aunque la tasa de dilatación por encima de la cual ha de indicarse la cirugía es objeto de debate. En las últimas guías (2014) de diagnóstico y tratamiento de la patología de la aorta de la European Society of Cardiology (ESC)2 esta tasa se sitúa por encima de los 3mm/año. En los casos en que esta tasa de dilatación sea el motivo de indicar la cirugía se ha de tener en cuenta que las mediciones han de hacerse con la misma técnica de imagen, de elección la TC, con el punto de medida perpendicular a la dirección del flujo sanguíneo y en el mismo nivel de la aorta. Incluso es conveniente comprobar las mediciones con otras técnicas alternativas (ecocardiografía transtorácica o C-RM) y que haya coherencia entre los resultados.
Nos basaremos en las guías de la ESC anteriormente mencionadas para recomendar la cirugía2.
Aneurismas de la aorta ascendenteCualquier aneurisma de la aorta ascendente con un diámetro máximo superior a 55mm debe ser intervenido en ausencia de conectivopatías, inclusive si presenta una válvula aórtica bicúspide (VAB). Este diámetro se reducirá a >50mm si el paciente además presenta una VAB y factores de riesgo (coartación de aorta, hipertensión sistémica, antecedentes familiares de disección o aumento del diámetro aórtico >3mm/año).
Si el paciente presenta cualquier conectivopatía (síndrome de Marfan, síndrome de Loeys-Dietz, síndrome de Ehlers-Danlos) este diámetro se reducirá hasta los 50mm. En algunos estudios se propone ser todavía más agresivo en los pacientes con síndrome de Loeys-Dietz y proponen un diámetro >42mm para indicar la cirugía, pero esto no está recogido en las guías de la ESC, que recomienda el mismo umbral que para los pacientes con síndrome de Marfan. En el síndrome de Marfan el diámetro >50mm se reduce a >45mm en el caso de coexistencia de factores de riesgo (antecedentes familiares de disección de aorta o aumento del tamaño >3mm/año).
En los casos límite se deben tener en cuenta los antecedentes del paciente y de la familia, la edad y el riesgo previsto de la intervención.
Estas recomendaciones se recogen en la tabla 2.
Indicaciones quirúrgicas de los aneurismas de la aorta ascendente
| Recomendación | Clase | Nivel |
|---|---|---|
| La cirugía está indicada para pacientes con aneurisma de la raíz aórtica, con diámetro aórtico máximo >50mm para pacientes con síndrome de Marfan | I | C |
| Se debe considerar la cirugía para pacientes con aneurisma de la raíz aórtica con diámetros aórticos ascendentes máximos:• > 45mm para pacientes con síndrome de Marfan y factores de riesgo• > 50mm para pacientes con válvula bicúspide y factores de riesgo• > 55mm para otros pacientes sin conectivopatía | IIa | C |
| • Los umbrales más bajos para las intervenciones pueden tenerse en cuenta según el área de superficie corporal en pacientes de pequeña estatura o en caso de rápida progresión, regurgitación de la válvula aórtica, embarazo programado o preferencia del propio paciente | IIb | C |
Fuente: tomado de «2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult»2.
Hay pocos datos sobre la historia natural de los aneurismas aislados del arco aórtico, ya que generalmente van asociados a aneurismas adyacentes en la aorta ascendente, la aorta descendente o ambos, por lo que en este caso es más difícil establecer un diámetro límite para la indicación de cirugía.
En general se considera que los pacientes con diámetros >55mm, aunque sean asintomáticos, se podrían beneficiar de la cirugía.
También se debe considerar la cirugía en aneurisma de arco aórtico con diámetro >55mm si el paciente va a ser sometido a una cirugía por un aneurisma de aorta ascendente o descendente3 (tabla 3).
Indicaciones quirúrgicas de los aneurismas del arco aórtico
| Recomendación | Clase | Nivel |
|---|---|---|
| Se debe considerar la cirugía para pacientes con aneurisma del arco aórtico aislado y un diámetro máximo >55mm | IIa | C |
| Se puede considerar la reparación del arco aórtico para pacientes con aneurisma del arco aórtico que ya tienen una indicación para cirugía de un aneurisma adyacente localizado en la aorta ascendente o descendente | IIa | C |
Fuente: tomado de «2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult»2.
A la hora de indicar una cirugía de arco hemos de tener en cuenta los riesgos asociados a la protección cerebral y a la mayor complejidad técnica. Está documentado que la mortalidad y la tasa de accidente cerebrovascular son mayores en esta cirugía que en la de los aneurismas de aorta ascendente o descendente.
En los pacientes en los que el riesgo perioperatorio de someterlos a una cirugía abierta convencional con hipotermia (con o sin perfusión anterógrada) sea excesivo nos podemos plantear un debranching +reparación endovascular de la aorta torácica (TEVAR).
ContraindicacionesDebe contraindicarse la cirugía en pacientes que presenten una baja esperanza de vida debido a sus comorbilidades y en aquellos con disfunción neurológica importante. En este último caso especialmente para la cirugía del arco aórtico.
Aunque la edad en sí misma no constituye una contraindicación absoluta para la cirugía de los aneurismas de aorta ascendente o arco, no debemos olvidar que no tratamos síntomas, sino que tratamos de aumentar la supervivencia de los pacientes. Por tanto, los pacientes muy añosos deben tener este concepto muy claro, así como el riesgo/beneficio de esta cirugía. Numerosos son los artículos que advierten o ponen en controversia la cirugía compleja de la aorta en pacientes por encima de los 80años.
Indicaciones en patología aguda de aorta ascendente y arco aórtico: indicaciones en síndrome aórtico agudo (SAA)- 1.
Disección aórtica (DA) tipo A
La indicación es cirugía urgente en todos los casos, con algunas excepciones que habría que individualizar:
- •
Pacientes mayores de 80 años.
- •
Coma profundo.
- •
Disfunción orgánica severa ocasionada por la DA (cerebral, infarto agudo de miocardio, renal).
- •
Expectativa de vida limitada por comorbilidad.
- •
Deterioro hemodinámico grave no secundario a taponamiento cardiaco.
- 2.
Disección aórtica tipo B
- •
No complicada: tratamiento médico.
- •
Complicada: dolor persistente o recurrente, hipertensión no controlada a pesar de medicación, expansión aórtica precoz, mala perfusión y signos de rotura (hemotórax, aumento de hematoma aórtico o mediastínico), extensión a la aorta ascendente. En estos casos el tratamiento será endovascular (TEVAR), pudiéndose considerar el tratamiento quirúrgico. Los objetivos del TEVAR son cerrar la puerta de entrada y los puntos de perforación en aorta descendente.
- 3.
Hematoma intramural (HI)
- •
Tipo A. La indicación es quirúrgica, tal como en la DA. En pacientes ancianos con dilatación aórtica <50mm y con grosor del HI <11mm una opción razonable podría ser el tratamiento conservador.
- •
Tipo B. La indicación es tratamiento médico, excepto en pacientes con: dilatación de aorta severa (>60mm), persistencia de dolor y/o signos de rotura inminente. En esos casos se planteará tratamiento endovascular (TEVAR).
- 4.
Úlcera aórtica penetrante
La localización en la aorta ascendente es inusual, por lo que se debe individualizar la actitud terapéutica. El objetivo es evitar la rotura aórtica y la evolución a DA aguda.
Las indicaciones para su tratamiento son: dolor recurrente o refractario, así como derrame pleural o hematoma periaórtico.
Pacientes asintomáticos con cuellos de úlcera >10mm y diámetro >20mm podrían ser candidatos a intervenciones precoces.
Aunque no hay estudios comparativos, el tratamiento endovascular (TEVAR) sería la primera opción en la aorta torácica.
Situaciones especiales- •
Taponamiento con hipotensión. Indicar cirugía emergente.
- •
Afectación de troncos arteriales aórticos.
- -
Accidente cerebrovascular: confirmar la afectación del tronco supraaórtico (TSA) y realizar valoración neurológica. Individualizar la indicación quirúrgica en función de la afectación neurológica y de la patología aórtica.
- -
Isquemia intestinal establecida: no intervención en la aorta hasta confirmar la viabilidad del paciente.
- -
Isquemia en extremidades inferiores:
- a.
Tipo A: cirugía aórtica o fenestración en primer lugar y, si es posible, reparación de la isquemia de las extremidades en el mismo acto operatorio.
- b.
Tipo B: cirugía de revascularización de la extremidad afecta.
- •
Paciente con derrame pleural y/o hematoma mediastínico: descartar rotura aórtica
- •
Afectación de arterias renales: valorar la posibilidad de fenestración.
- •
DA tipo A descubierta accidentalmente: cirugía preferente pero no de forma urgente
- •
Disección/hematoma postraumático:
- -
El diagnostico se realizará mediante TC o ecocardiografía transesofágica (ETE).
- -
Hematomas de aorta ascendente: se planteará inicialmente el tratamiento médico en ausencia de signos incipientes de rotura aórtica, dada su mayor tendencia a la reabsorción espontánea.
- -
Cirugía/endoprótesis en pacientes con desarrollo de pseudoaneurisma (TEVAR).
- •
Disección/hematoma iatrogénico: la indicación de cirugía se hará si hay claros signos de rotura aórtica o disección de la aorta ascendente. El resto de las situaciones se manejarán mediante tratamiento médico. Se realizará un control cada 48-72h hasta observar la regresión de las lesiones.
En este punto vamos a hablar del manejo preoperatorio de la patología de aorta ascendente y arco aórtico global, haciendo referencia de forma explícita los puntos a considerar en la patología aguda (DA).
Para la optimización de nuestros pacientes nuestro trabajo debe comenzar desde el preoperatorio. La evaluación preoperatoria debe estar adaptada al grado de urgencia pero debe ser similar para los candidatos tanto a cirugía endovascular de aorta como a cirugía abierta programada.
Derivado del uso de contrastes radiológicos en la cirugía endovascular, puede ser de utilidad la hidratación preoperatoria como profilaxis de la nefropatía por contraste, principalmente en pacientes con los siguientes factores de riesgo: filtrado glomerular <60ml/min, diabéticos, proteinuria, fallo cardiaco o hepático, mieloma múltiple, trasplante renal o uso de fármacos nefrotóxicos concomitantes, como AINE o inhibidores de la calcineurina4.
Además de las últimas recomendaciones sobre la evaluación preoperatoria en cirugías electivas de las diversas sociedades: EJA 20185, NICE 20166, ESC/ESA 20147 y manejo de medicación en el preoperatorio de cirugía cardiaca EACTS 20178. La evaluación preoperatoria debe basarse fundamentalmente en los factores de riesgo cardiovascular, en la optimización de todos los sistemas implicados (cardiovascular, respiratorio, neurológico, renal, etc.) y en las potenciales complicaciones derivadas de la cirugía.
Los objetivos de la evaluación preanestésica en cirugía cardiaca son9:
- 1.
Revisar la historia clínica del paciente, el examen físico y las pruebas de diagnóstico cardíacas y otras pruebas disponibles para evaluar y minimizar los riesgos para la intervención propuesta.
- 2.
Si se identifican condiciones que pueden optimizarse, la cirugía debe retrasarse si se cumplen todos los criterios siguientes: la cirugía es electiva, la condición médica del paciente puede mejorar significativamente y el riesgo de posponer la cirugía es menor que el beneficio de optimizar la condición del paciente.
- 3.
Explicar el plan anestésico propuesto y obtener el consentimiento informado.
- 4.
Aliviar la ansiedad del paciente.
Más específicamente, se recomienda en estos pacientes:
- 1.
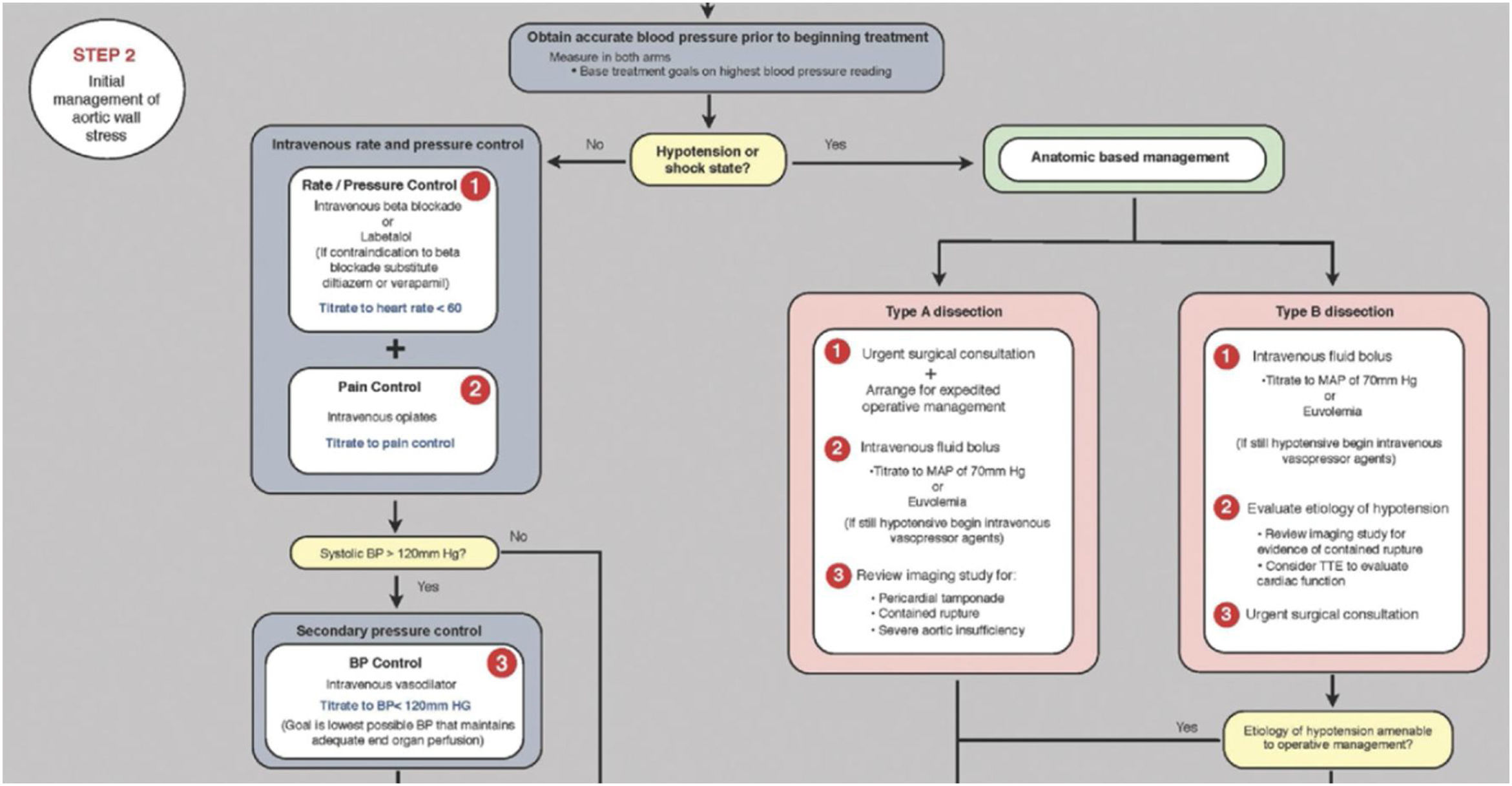
Control estricto de la presión arterial (PA). En caso de patología aórtica aguda el objetivo principal es normalizar la PA con β-bloqueantes, reduciendo así la fuerza de eyección ventricular izquierda (dP/dt), que son los principales determinantes de la extensión y la ruptura de la luz falsa. Para la mayoría de los pacientes se puede alcanzar una PAS entre 100 y 120mmHg con una frecuencia cardíaca de 60latidos/min gracias a los β-bloqueantes intravenosos, esmolol/labetalol. Se puede usar verapamilo o diltiazem si los β-bloqueantes están contraindicados. El control del dolor con cloruro mórfico y, en caso de precisar, tratamiento vasodilatador intravenoso (primera línea: nitroprusiato, nicardipino; segunda línea: clevidipino, nitroglicerina10) (fig. 3).
- 2.
En caso de patología aórtica aguda es imprescindible conocer de antemano, por las pruebas diagnósticas realizadas, si existe taponamiento cardiaco, isquemia miocárdica o insuficiencia aórtica, que condicionarían una situación de hipotensión/shock, así como la extensión de la afectación orgánica. Para ello es mandatorio la realización de una ecocardiografía transtorácica. En algunos protocolos se contraindica el empleo de ETE en pacientes con sospecha o diagnóstico de disección aguda de aorta.
- 3.
Estrategias de ahorro de hemoderivados, protocolos de hemorragia masiva y guía del manejo de sangrado en cirugía cardiaca como prevención del shock hemorrágico8. La complejidad de la cirugía de aorta torácica abierta dicta tiempos quirúrgicos largos y técnicas que alteran la hemostasia, como la hipotermia, que generan pérdidas sanguíneas importantes.
- 4.
Inicio de técnicas de fisioterapia respiratoria/prehabilitación11.
- 5.
Adecuado manejo de los antiagregantes y anticoagulantes en el perioperatorio. Se recomienda revisar la última guía de consenso de manejo perioperatorio y periprocedimiento del tratamiento antitrombótico: documento de consenso de SEC, SEDAR, SEACV, SECTCV, AEC, SECPRE, SEPD, SEGO, SEHH, SEMERGEN, SEMFYC, SEMG, SEMICYUC, SEMI, SEMES, SEPAR, SENES, SEO, SEPA, SERVEI, SECOT y AEU12.
El anestesiólogo debe revisar toda la información disponible para obtener una compresión clara de las indicaciones de la cirugía, el plan quirúrgico y los riesgos individuales del paciente con el fin de adaptar adecuadamente el plan anestésico.
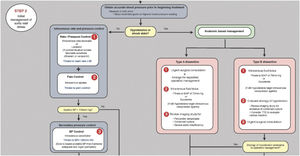
IntraoperatorioPreparación del quirófano y monitorización anestésicaLa cirugía abierta de aorta torácica ascendente es el estándar de atención para el manejo de una variedad de patologías aórticas: aneurisma aórtico torácico ascendente, SAA con afectación de aorta ascendente, enfermedades genéticas con afectación de la aorta, etc. El anestesiólogo puede enfrentarse a diversas situaciones clínicas que suponen en ocasiones un verdadero reto a sus capacidades. Nos podemos encontrar desde casos de extrema urgencia, como la rotura o disección de un aneurisma, a la cirugía programada de un aneurisma ya diagnosticado. Por ello, la técnica anestésica y la monitorización deben adaptarse a las necesidades individuales del paciente. Es imprescindible la colaboración y el trabajo en equipo de los cirujanos, anestesiólogos, perfusionistas y enfermería13 (fig. 4).
A la llegada del paciente a quirófano se deben seguir los procedimientos de seguridad habituales dentro del programa de checklist quirúrgico. Además, se tendrán que realizar las siguientes comprobaciones y verificaciones de material específico:
- •
Circuito de circulación extracorpórea (CEC) presente, purgado y preparado, con línea arterial en Y para posible perfusión selectiva de troncos supraaórticos.
- •
Recuperador de sangre operativo.
- •
Ecógrafo en funcionamiento.
- •
Desfibrilador, incluidas palas externas, internas y parches.
- •
Pila y cables de marcapasos.
- •
Mantas de calentamiento.
- •
Sonda vesical de temperatura.
La monitorización debe ser lo más completa posible, sin demorar por su preparación el tratamiento quirúrgico en caso de cirugía urgente. Por otro lado, el tratamiento anestésico debe adaptarse a cada situación en particular.
La reparación quirúrgica abierta de la aorta ascendente requiere del uso de la CEC y en ocasiones precisa parada circulatoria y medidas específicas para proteger el cerebro, la medula espinal, los riñones, las vísceras y las extremidades inferiores. No todas las medidas serán comentadas en este capítulo, por encontrarse desarrolladas más adelante (patología de la aorta descendente).
Además de la monitorización estándar de la American Society of Anesthesiologists (oxigenación, ventilación, circulación y temperatura): electrocardiografía continua (con derivacionesII yV5 con tendencia informatizada del segmento ST para detectar isquemia y/o arritmias), oximetría de pulso, mediciones intermitentes de la PA y EtCO2(end tidal CO2)14. La monitorización habitual en los procedimientos de cirugía de aorta ascendente y arco aórtico incluye:
Monitorización cardiovascular- -
Monitorización continua de la PA invasiva canalizada habitualmente previa a la inducción anestésica para detectar y optimizar el tratamiento de la hipo/hipertensión que puede tener lugar durante la misma, así como extraer controles analíticos seriados. Para la selección del sitio de punción debemos tener en cuenta la afectación anatómica de la aorta (p.ej., extensión de la disección aórtica), la técnica quirúrgica y las estrategias de perfusión que vayamos a realizar. La reparación quirúrgica abierta del arco aórtico requiere períodos de oclusión y perfusión selectiva de las ramas supraaórticas al menos temporalmente y con frecuencia de forma secuencial. Una línea arterial de un solo sitio no es suficiente para la monitorización ininterrumpida de las presiones de perfusión de órganos vitales. La medición bilateral invasiva de la presión de la arteria radial permite controlar la presión de perfusión cerebral sin interrupción durante la canulación en subclavia directa o con injerto y durante la reparación. Cuando la perfusión cerebral anterógrada axilar derecha se realiza a través de un injerto canulado a la arteria, es posible la monitorización simultánea de la presión de entrada de perfusión cerebral anterógrada axilar derecha y la presión radial izquierda resultante. Esto puede proporcionar información sobre la integridad funcional del polígono de Willis y/o el flujo sanguíneo de la arteria subclavia izquierda a la aorta torácica descendente. Sin embargo, la monitorización bilateral de la presión radial se usa en la cirugía del arco aórtico solo en aproximadamente el 50% de los centros europeos. La monitorización adicional de la presión de la arteria femoral (preferiblemente en la arteria femoral no quirúrgica o no disecada) permite evaluar la eficacia de la perfusión distal del cuerpo antes y después de la parada circulatoria hipotérmica (PCH) y la detección tras la reparación de los gradientes de presión a través del arco. Es importante siempre tener en cuenta que una arteria femoral debe estar disponible para una posible canulación. Tras el recalentamiento de PCH y durante varias horas después de la salida de CEC, la presión radial a menudo subestima la presión aórtica central, que se aproxima mejor por la presión de la arteria femoral (hasta 20mmHg en PAM y 35mmHg en PAS). Por lo tanto, para la reparación quirúrgica del arco aórtico, la PA invasiva bilateral de la extremidad superior debe controlarse de forma rutinaria. En este tipo de cirugía con CEC prolongada y períodos de PCH, también se debe considerar la medición de referencia de presión aórtica central directa intermitente y/o la monitorización adicional de la presión de la arteria femoral1.
- -
Catéter venoso central (con frecuencia de alto flujo para poder abordar perdidas masivas y súbitas de la volemia) por vena yugular interna y 1-2 accesos intravasculares de gran calibre.
- -
Catéter de arteria pulmonar (si está indicado) para medir presiones pulmonares y en cuña. La medición del gasto cardiaco mediante dispositivos periféricos tipo PICCO (PICCO®, PULSION Medical Systems, Reino Unido) o Vigileo (Vigileo®, Edwards Lifesciences Corporation, EE.UU.) o de contorno de pulso (Mostcare®) para orientar la salida de bomba y el manejo postoperatorio15.
- -
Ecocardiografía transesofágica (ETE). Es indiscutible el papel de la ETE para el manejo de los pacientes sometidos a cirugía cardiaca y en patología de aorta torácica16,17. Ofrece evaluación cardiovascular morfológica y funcional bidimensional y tridimensional en tiempo real como una modalidad de imagen semiinvasiva. Los sistemas de ecocardiografía utilizados en los programas del arco aórtico deben incluir opciones y sondas para ecografía epiaórtica y epicárdica. Existe consenso en las guías actuales y se recomienda para todos los procedimientos quirúrgicos aórticos torácicos abiertos en adultos, es decir, también los que involucran el arco aórtico. Durante los procedimientos aórticos torácicos híbridos y endovasculares, al menos debería estar disponible1 (tabla 4).
Tabla 4.Recomendaciones EACTS/ESVS para patología deñ arco aórtico
Recomendación 10. Se recomienda la ETE durante todos los procedimientos quirúrgicos de aorta torácica abierta Clase I Nivel B Se recomienda la ETE en todos los pacientes intubados inestables con sospecha de SAA Clase I Nivel B La ETE debe estar disponible en procedimientos aórticos torácicos híbridos y endovasculares Clase IIA Nivel B Recomendación 11. Durante la cirugía para la reparación del arco aórtico se debe considerar la monitorización bilateral invasiva de la PA en las extremidades superiores Clase IIA Nivel C Durante la cirugía para la reparación del arco aórtico se debe considerar la monitorización de la PA femoral Clase IIA Nivel C Durante la cirugía para la reparación del arco aórtico se debe considerar la medición intermitente de la PA central en la aorta Clase IIA Nivel C Fuente: tomado de «2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult»2.
Derivado del tipo de cirugía y las implicaciones anatómicas en referencia a la aorta ascendente y arco aórtico, la neuromonitorización ocupa un punto importante de la monitorización (tabla 5). Las modalidades de monitorización más empleadas en la práctica de cirugía del arco aórtico son: electroencefalograma (EEG), BIS, oximetría cerebral (NIRS) y potenciales evocados somatosensoriales (PESS) y motores (PEM). Pero además en la literatura se describen otros métodos ampliamente validados: doppler transcraneal, saturación venosa de oxígeno en el seno de la yugular y monitorización acido-base3,18-22.
Recomendaciones EACTS/ESVS para patología del arco aórtico
| Recomendación 12. Durante la cirugía de reparación de arco aórtico se recomienda el uso de la oximetría cerebral bilateral NIRS combinada con el uso de un algoritmo de actuación ante desaturaciones | Clase I | Nivel B |
| Recomendación 13. En situaciones de daño medular tardío se recomienda la colocación de drenaje de LCR como parte del tratamiento | Clase I | Nivel C |
Fuente: tomado de «2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult»2.
1. EEG
Independientemente de la etiología, la reducción de suministro de O2 produce una disminución en la amplitud de las ondas de mayor frecuencia del EEG: alfa (8-12Hz) y beta (12-20Hz) o delta (1-4Hz). El EEG es un método de monitorización no invasivo, específico para detectar isquemia cerebral cuando la dosificación de anestesia es estable, cuando un evento adverso es repentino y si el EEG preoperatorio es normal. Sin embargo, el EEG solo monitoriza las capas superficiales de la corteza cerebral. La profundidad anestésica, la hipotermia, los medicamentos, la actividad electromiográfica intrínseca, la actividad convulsiva, la interferencia eléctrica por cauterización y la lesión cortical preexistente son factores que limitan la sensibilidad del EEG para detectar la isquemia cerebral.
Ha sido una medida de neuromonitorización ampliamente empleada en cirugía de arco aórtico, pero en los últimos años las técnicas de neuroprotección han evolucionado y la neuromonitorización ha ido adaptándose a estos cambios. Inicialmente se empleaban técnicas de parada circulatoria completa en hipotermia profunda (PCHP), siendo esta hipotermia profunda la técnica de protección cerebral empleada. Puesto que existe cierta variabilidad interindividual en cuanto al efecto de la hipotermia profunda y el riesgo isquémico, la monitorización del EEG permitía confirmar la supresión eléctrica y metabólica antes de la parada circulatoria.
Hoy en día, muchos centros emplean técnicas de parada circulatoria con hipotermia moderada y perfusión cerebral anterógrada (PCA) o retrógrada (PCR), con las que se registran bajas tasas de complicaciones neurológicas. El objetivo de la hipotermia en estos casos no es ya la supresión eléctrica cerebral, sino una reducción del metabolismo y el consumo de oxígeno, y la EEG se reenfoca en la detección de isquemia cerebral y niveles anestésicos inadecuados.
Aunque es una monitorización no invasiva, tiene ciertas limitaciones, y en la actualidad la EEG se emplea en alrededor de un tercio de los centros como medida de monitorización1.
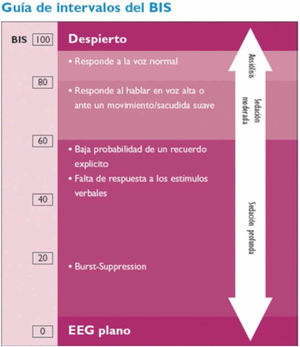
2. BIS
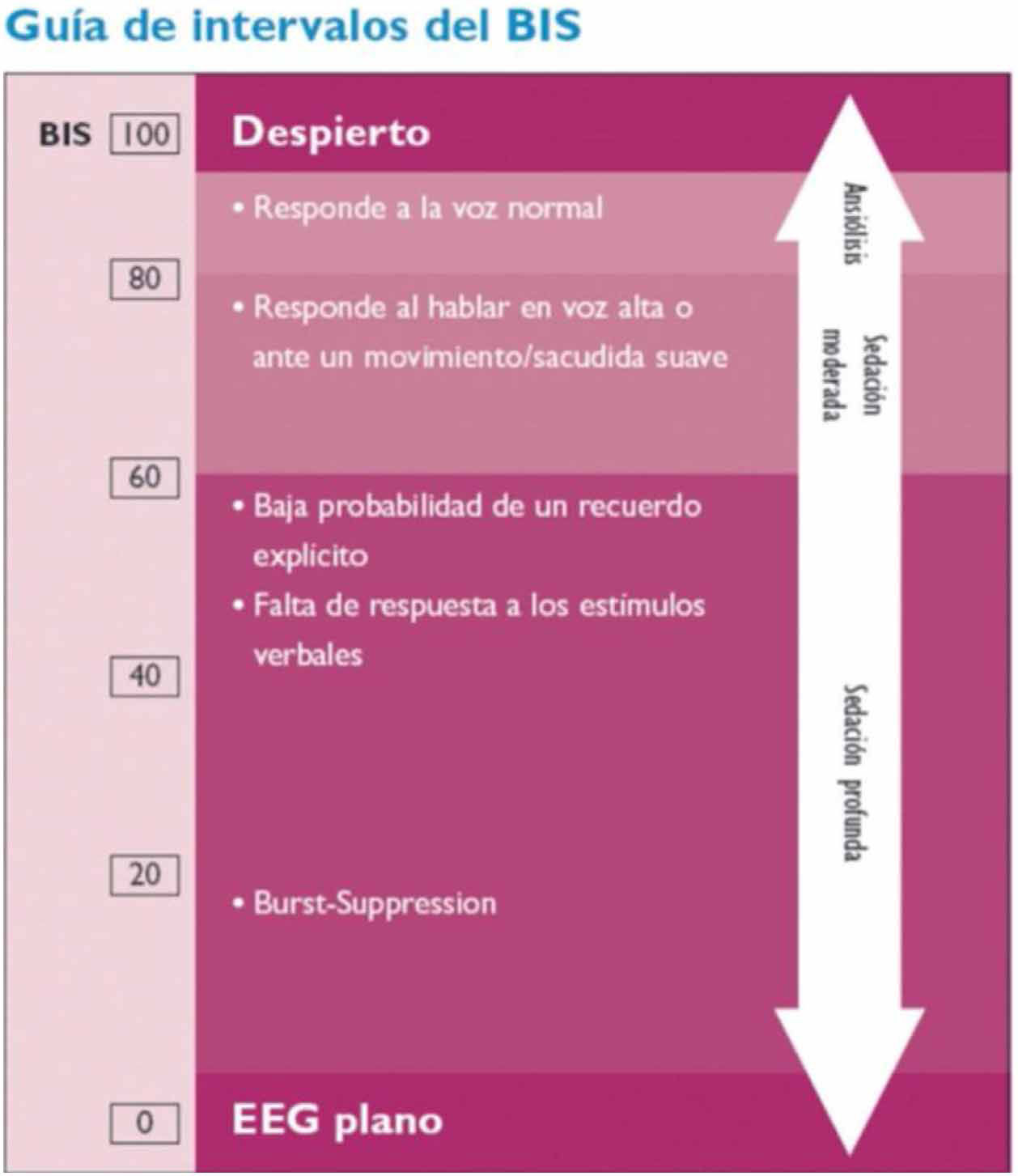
El monitor BIS® se emplea para la monitorización de la profundidad anestésica. Está aprobado por la Food and Drug Administration (FDA) para la monitorización de la profundidad anestésica mediante el análisis biespectral del EEG (Aspect Medical Systems™ Inc., Natick, MA, EE.UU.) (www.biseducation.com).
La monitorización con el monitor BIS® se inicia con la adquisición de múltiples parámetros electroencefalográficos y, tras su análisis posterior, ofrece un valor numérico o índice biespectral (BIS) que oscila entre 0 (silencio eléctrico cerebral) y 100 (paciente despierto)23.
El monitor registra además la tasa de supresión (TS), que representa el porcentaje de tiempo de supresión del EEG en los últimos 63segundos; es decir, el tiempo en que permanece el EEG en silencio eléctrico. Los valores varían entre 0 (EEG activo) y 100 (EEG suprimido, sin actividad). Una TS>80 indica que el EEG está suprimido.
El análisis puede ser unilateral (sensor de 4 electrodos) o bilateral (sensor de 6 electrodos), que tiene la ventaja de aportar además información sobre asimetrías en la actividad de ambos hemisferios cerebrales.
El registro BIS permite una monitorización continua y no invasiva, y puede representar la primera señal de un deterioro neurológico: si bien el BIS es un monitor de profundidad anestésica, diversos trabajos muestran que los descensos bruscos y no controlados del BIS se relacionan con hipoperfusión cerebral en diferentes escenarios clínicos, lo que sugiere que el BIS podría ser útil para detectar períodos agudos de hipoperfusión cerebral24 (fig. 5).
Hoy en día, a falta de más estudios, no se puede recomendar como única medida de monitorización neurológica.
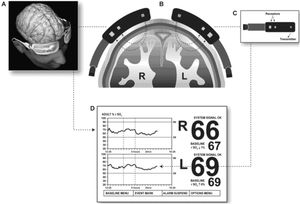
3. Oximetría cerebral (NIRS/INVOS)
La oximetría cerebral no invasiva utiliza la tecnología near infrared spectroscopy (NIRS) para determinar la saturación de oxígeno en una pequeña región de los vasos cerebrales corticales. Se emplea para monitorizar, de forma continua y no invasiva, cambios en el metabolismo cerebral: el balance entre el aporte y el consumo de oxígeno (fig. 6).
Los sensores se colocan en la frente del paciente, a ambos lados de la línea media. La zona que se monitoriza es la región perfundida por las arterias cerebrales media y anterior. El sensor emite en una longitud de onda de 700-1.000nm que atraviesa los tejidos hasta una profundidad de 3-4cm. El valor que recoge es la saturación regional de oxígeno cerebral (rSO2), considerándose como valor normal un registro >50%.
No existe un umbral de desaturación establecido a partir del cual sea necesario intervenir. En la práctica se utilizan dos criterios:
- 1.
Disminución de un 20% de la rSO2 respecto a los valores basales.
- 2.
Valor absoluto de rSO2 <50%.
Una asimetría basal de más de 10 puntos se considera también anormal.
Existen distintos factores que pueden condicionar, en el contexto de cirugía de arco aórtico, una disminución de la rSO2: hipoperfusión global o unilateral, congestión venosa cerebral, malposición de cánulas, disección vascular, hipotensión sistémica, hemodilución, anemia, hipoxia, hipocapnia, bajo gasto cardíaco.
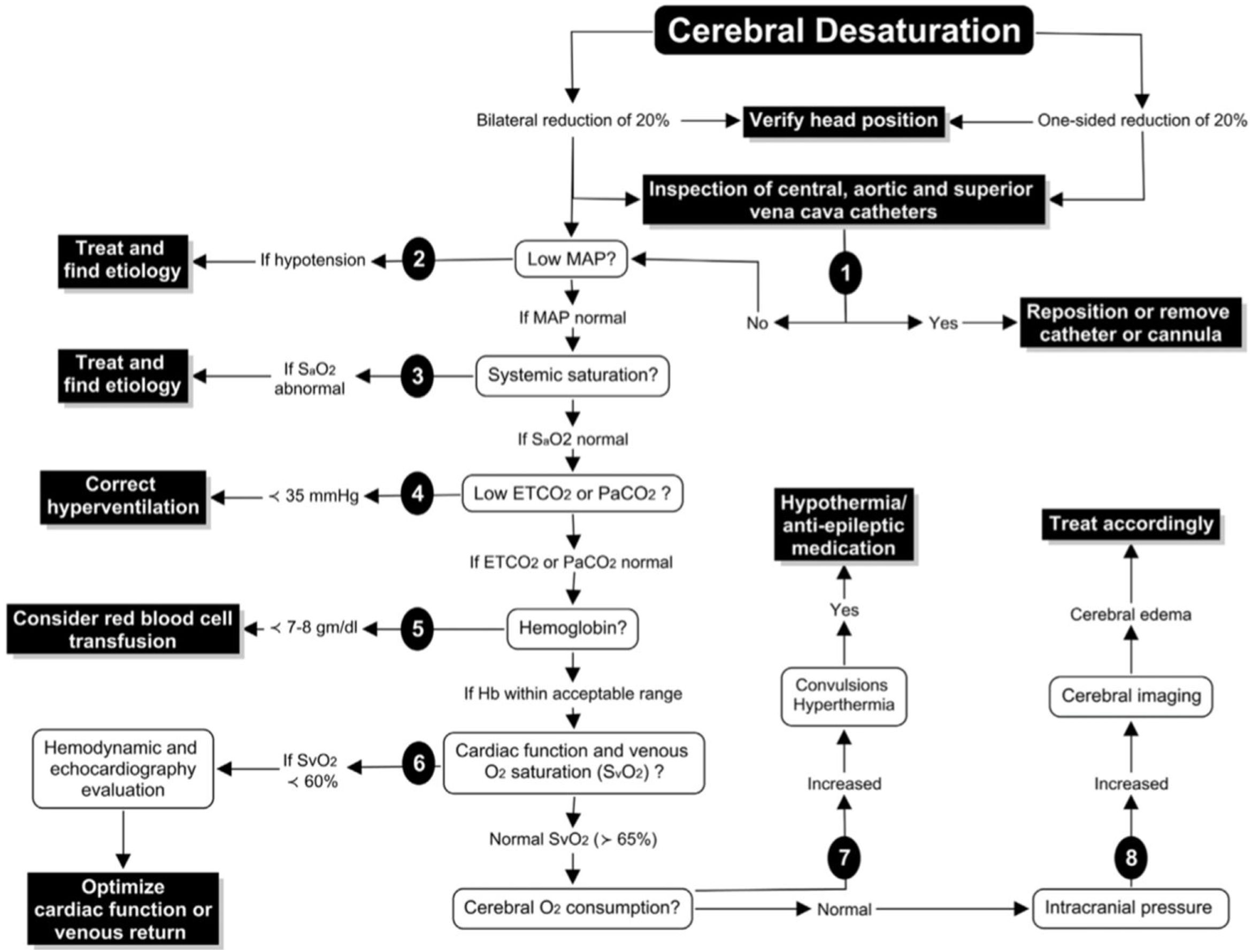
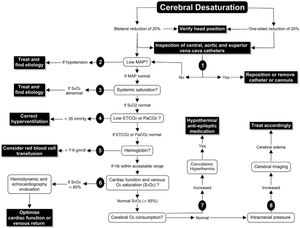
Denault et al.25 proponen un algoritmo para el empleo de la monitorización con INVOS, basado en la optimización de factores que pueden afectar a la relación entre el aporte y la demanda de oxígeno:
- 1.
El primer paso cuando se detecta una desaturación sería descartar una obstrucción mecánica:
- a.
Malperfusión arterial: obstrucción mecánica al flujo cerebral.
- b.
Obstrucción de la vena cava superior: la presión de perfusión cerebral representa la diferencia entre el flujo de entrada (PAM) y salida (presión vena yugular), por lo que una obstrucción en el drenaje puede comprometer la perfusión cerebral.
- 2.
Aumentar la PAM.
- 3.
Verificar la oxigenación sistémica.
- 4.
Normalizar la PaCO2.
- 5.
Optimizar la hemoglobina.
- 6.
Otros: evaluar la función cardíaca, disminuir el CMRO2 (fig. 7)
Figura 7.Algoritmo de decisiones ante la detección de desaturación cerebral.
Fuente: tomado de «A proposed algorithm for the intraoperative use of cerebral near-infrared spectroscopy»25.
(0.24MB).
Hoy en día se recomienda la monitorización con INVOS para la reparación quirúrgica o híbrida de arco aórtico, y es, de hecho, la monitorización más empleada.
4. Doppler transcraneal bilateral
La monitorización del flujo sanguíneo cerebral de las principales arterias cerebrales (la media con más frecuencia) a través del doppler transcraneal tiene varios usos en la cirugía cardiaca, indicando la presencia y dirección de flujo sanguíneo en varias situaciones clínicas, como en el PCH mediante PCR o PCA; o en la detección de una incorrecta colocación de cánulas o disección aórtica, donde observamos una caída brusca y repentina del flujo sanguíneo cerebral, permitiendo una correcta intervención para evitar la hipoperfusión o la isquemia cerebral.
Las guías de neuromonitorización durante la cirugía cardiovascular consideran el doppler transcraneal como un indicador de claseIII para controlar la embolización cerebral o la hipoperfusión. Es una técnica no invasiva, barata, continua, en tiempo real, y permite una valoración bilateral o unilateral3,18,21,26,27. Las limitaciones de esta técnica incluyen la experiencia del clínico, es observador-dependiente y la dificultad en algunos casos de obtener una buena ventana. Actualmente no se usa como técnica de monitorización durante la CEC, aunque recientes estudios se están llevando a cabo en pacientes sometidos a cirugía cardiaca18,28.
5. Monitorización invasiva de oximetría en el bulbo yugular
Se realiza colocando un catéter a nivel del bulbo de la yugular, canulando de forma retrógrada la vena yugular. Actualmente la monitorización con INVOS ha reemplazado también a esta técnica, que resulta más compleja e invasiva.
6. Potenciales evocados somatosensitivos (PESS) o motores (PEM)
Técnica de neuromonitorización de la actividad del tronco encefálico y la corteza cerebral, a través de la estimulación de nervios periféricos. Útil en la detección de paraplejia postoperatoria, permitiendo una detección temprana en el paciente anestesiado.
7. Monitorización ácido-base
La detección de la acidemia durante la parada circulatoria es un marcador de isquemia cerebral. Predominan dos estrategias de monitorización: alfa-stat y pH-stat18,29.
Alfa-stat se basa en un pH contante en normotermia o, más bien, evitando la corrección de las medidas de pH del paciente durante el aumento normal que acompaña a la hipotermia. La disminución de la disociación de los iones de hidrógeno conduce a una alcalosis, produciendo un descenso del flujo cerebral y oxihemoglobina al tejido cerebral. Por lo tanto, mantiene una buena relación entre el metabolismo cerebral y el flujo de sangre cerebral, pudiendo reducir el daño microembólico. Sin embargo, la monitorización pH-stat se relaciona con la temperatura del paciente.
En la actualidad hay controversia sobre qué monitorización sería las más adecuada18 (tabla 6).
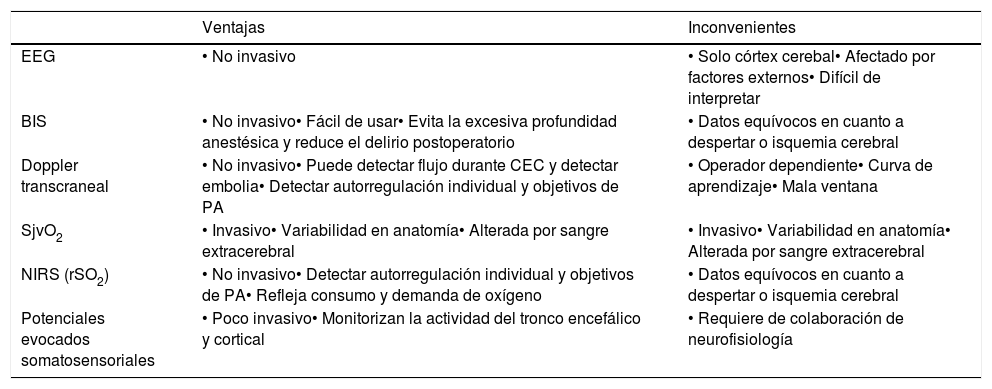
Ventajas e inconvenientes de los diferentes métodos de neuromonitorización
| Ventajas | Inconvenientes | |
|---|---|---|
| EEG | • No invasivo | • Solo córtex cerebal• Afectado por factores externos• Difícil de interpretar |
| BIS | • No invasivo• Fácil de usar• Evita la excesiva profundidad anestésica y reduce el delirio postoperatorio | • Datos equívocos en cuanto a despertar o isquemia cerebral |
| Doppler transcraneal | • No invasivo• Puede detectar flujo durante CEC y detectar embolia• Detectar autorregulación individual y objetivos de PA | • Operador dependiente• Curva de aprendizaje• Mala ventana |
| SjvO2 | • Invasivo• Variabilidad en anatomía• Alterada por sangre extracerebral | • Invasivo• Variabilidad en anatomía• Alterada por sangre extracerebral |
| NIRS (rSO2) | • No invasivo• Detectar autorregulación individual y objetivos de PA• Refleja consumo y demanda de oxígeno | • Datos equívocos en cuanto a despertar o isquemia cerebral |
| Potenciales evocados somatosensoriales | • Poco invasivo• Monitorizan la actividad del tronco encefálico y cortical | • Requiere de colaboración de neurofisiología |
BIS: monitorización profundidad anestésica; EEG: electroencefalograma; NIRS (rSO2): saturación transcraneal de oxígeno.
El control de temperatura durante la cirugía cardiaca es rutinario. Como peculiaridades de la cirugía de aorta ascendente/arco con necesidad de PC se recomienda la medición en múltiples sitios para monitorizar el enfriamiento durante la hipotermia deliberada y el recalentamiento gradual posterior para evitar la hipertermia no intencional. Los sitios habituales de monitorización: nasofaríngeo, sangre (a través del termistor del catéter de arteria pulmonar), vejiga (a través del termistor del catéter urinario), rectal, canal auditivo, en el circuito de CEC tanto en la sangre de salida arterial que perfunde al paciente como en la entrada de sangre venosa que vuelve al circuito30.
Durante la cirugía abierta del arco aórtico se recomienda controlar las temperaturas nasofaríngea y timpánica para garantizar un enfriamiento adecuado del cerebro y prevenir la hipertermia cerebral y la lesión asociada del sistema nervioso central durante el recalentamiento. Además, la temperatura central de la vejiga proporciona la mejor información disponible para la protección de las vísceras, los riñones, las extremidades inferiores y finalmente la médula espinal (tabla 7).
Recomendaciones STS/SCA/ASECT en el manejo de la temperatura
| Se recomienda utilizar la temperatura (T) arterial en la salida arterial del oxigenador como medición de la T cerebral durante la CEC | Clase I | Nivel C |
| Para controlar la T de perfusión cerebral durante el recalentamiento se debe suponer que la T de la sangre a la salida arterial del oxigenador subestima la T de perfusión cerebral | Clase I | Nivel C |
| Los equipos quirúrgicos deben limitar la T de la sangre arterial a <37°C para evitar la hipertermia cerebral | Clase I | Nivel C |
| Los gradientes de T entre la salida arterial y la entrada venosa en el oxigenador durante el enfriamiento en CEC no deben exceder los 10°C para evitar la generación de émbolos gaseosos | Clase I | Nivel C |
| Los gradientes de T entre la salida arterial y la entrada venosa en el oxigenador durante el recalentamiento en CEC no deben exceder los 10°C para evitar excesiva disolución de los gases en la sangre que regresa al paciente | Clase I | Nivel C |
| El registro de la T de la arteria pulmonar o nasofaríngea es razonable para el destete y medición inmediata de la T post-CEC | Clase IIa | Nivel C |
| Recalentamiento cuando la T de salida de la sangre arterial ≥30°C:1. Para alcanzar la T deseada a la salida de CEC es razonable mantener un gradiente de T entre la salida arterial y la entrada venosa ≤4°C2. Para alcanzar la T deseada para a salida de CEC es razonable mantener una velocidad de recalentamiento ≤0,5°C/min | Clase IIa | Nivel B |
| Recalentamiento cuando la T de salida de la sangre arterial <30°C: para alcanzar la T para la salida de CEC es razonable un gradiente máximo de 10°C entre la T arterial y la entrada venosa | Clase IIa | Nivel C |
No se proporciona una recomendación para la T óptima de salida de CEC debido a la insuficiente evidencia publicada.
Fuente: tomado de «The Society of Thoracic Surgeons, The Society of Cardiovascular Anesthesiologists, and The American Society of ExtraCorporeal Technology: Clinical Practice Guidelines for Cardiopulmonary Bypass — Temperature management during cardiopulmonary bypass»30.
1. Point-of-care clinical testing
- a)
Coagulación (tiempo de coagulación activado [ACT] y tromboelastografía [TEG]/tromboelastometría rotacional [ROTEM])31,32. La reparación quirúrgica y endovascular del arco aórtico requiere anticoagulación reversible con heparina no fraccionada (HNF). Aunque la cirugía abierta en CEC conlleva un riesgo sustancialmente mayor de pérdida de sangre importante y transfusión, las complicaciones hemorrágicas aumentan la morbilidad y la mortalidad con cualquier enfoque. Tanto la anticoagulación durante el procedimiento como la hemostasia postoperatoria requieren una monitorización para minimizar las complicaciones hemorrágicas y trombóticas. La prueba de ACT con sangre completa es un método funcional a cabecera del paciente que se recomienda para guiar la anticoagulación con HNF, así como su reversión con protamina, y se indica como un requisito mínimo durante el arco aórtico quirúrgico, híbrido o endovascular reparar. Sin embargo, el ACT no es muy específico para la actividad de HNF y puede confundirse con hipotermia, hemodilución, pérdida de plaquetas y factores de coagulación, todo lo cual ocurre típicamente durante la cirugía abierta del arco aórtico. Por lo tanto, y de acuerdo con las directrices EACTS/EACTA 201731, cuando se usa heparina para la cirugía de arco con CEC prolongada y PCH se debe considerar el uso de monitorización cuantitativa de las concentraciones circulantes de HNH en lugar de simple medición de ACT en serie (tabla 8). Los sistemas de prueba de coagulación viscoelástica de sangre total (tromboelastometría rotacional [ROTEM]/tromboelastograma [TEG]) proporcionan análisis a la cabecera del paciente sobre la generación y estabilidad de coágulos con tiempos de respuesta cortos33-35. Junto con los algoritmos de tratamiento, se ha demostrado que son útiles en el diagnóstico diferencial y el tratamiento de la hemorragia post-CEC. La evidencia de nivel moderado de los ensayos de cirugía cardíaca electiva con CEC indica que el uso de TEG o estrategias de transfusión guiadas por ROTEM puede reducir la exposición a productos sanguíneos alogénicos y posiblemente una nueva exploración quirúrgica para el sangrado36-39. En la cirugía abierta del arco aórtico se debe considerar su uso junto con los algoritmos de tratamiento perioperatorio para pacientes sangrantes, a fin de reducir la exposición y el costo de la transfusión alogénica.
Tabla 8.Recomendaciones EACTS/ESVS para patología del arco aorta
Recomendación 14. Durante la cirugía de arco aórtico se recomienda la medición de la temperatura en múltiples sitios (mínimo nasofaríngea, timpánica, vesical o rectal) Clase I Nivel B Recomendación 15. Durante la cirugía de arco aórtico se recomienda uso de test de coagulación en el «point of care» junto con un algoritmo de transfusión de los productos sanguíneos Clase IIA Nivel A Fuente: tomado de «2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult»2.
- b)
Mediciones de gases en sangre con pH y déficit de base, hemoglobina, electrólitos, calcio, glucosa y lactato.
2. Inducción y mantenimiento anestésico. Periodo pre-CEC
El manejo intraoperatorio del paciente candidato a la reparación de aorta torácica debe centrarse en mantener una estabilidad hemodinámica evitando aumentos agudos de la PA, que puede precipitar la ruptura aórtica y mantener una buen perfusión orgánica40.
Inducción anestésica. Debe ser suave y, a la vez, evitar los picos hipertensivos que pueden favorecer la rotura de la pared aórtica. Con frecuencia, se retirarán transitoriamente las perfusiones de medicación vasodilatadora antes del inicio de la inducción. En todo momento se debe coordinar con el equipo la posibilidad de inicio de medidas de soporte circulatorio ante eventos críticos. En general, si presentan buena función miocárdica pueden utilizarse inductores como el propofol (1-2mg/kg) o el tiopental (3-5mg/kg), o bien la asociación midazolam-etomidato (0,05mg/kg y 0,3mg/kg, respectivamente) en caso de mala función ventricular o inestabilidad hemodinámica. En cuanto a los opioides, podemos utilizar cualquiera, siendo más frecuentes el fentanilo y el remifentanilo, titulados para evitar crisis hipertensivas. Podemos ayudarnos de otros fármacos para evitar el estrés de la intubación, como lidocaína (1mg/kg) o esmolol (1mg/kg). Debemos considerar en los casos urgentes la posibilidad de «estómago lleno», por lo que la intubación orotraqueal se hará con secuencia rápida y maniobra de Sellick. Los relajantes musculares serán los habituales (cisatracurio o rocuronio, este último de preferencia en el caso de secuencia rápida). La profilaxis antibiótica debe administrarse preferiblemente 30min antes de la inducción. Uso de antifibrinolíticos según protocolo del servicio.
Mantenimiento anestésico. En líneas generales, el mantenimiento anestésico no difiere mucho del de otros procedimientos de cirugía cardiaca, con la peculiaridad de que suele ser necesario el empleo de PCH más o menos profunda en caso de afectación de arco. Está indicado el uso de anestésicos halogenados durante todo el procedimiento, ajustados para evitar la depresión miocárdica, debido a sus propiedades de preacondicionamiento isquémico. Asociaremos opioide a demanda según el estrés quirúrgico, y relajantes neuromusculares en perfusión para procurar inmovilidad y evitar escalofríos en la fase hipotérmica. En caso de monitorización con PESS/PEM, de preferencia se utilizará TIVA (total intravenous anesthesia) con propofol y remifentanilo, y si utilizamos relajante muscular, deberá ser ajustado para que el registro sea adecuado (al menos dos respuestas en el tren de cuatro (train of four [TOF]) en todo momento. Otra opción útil sería: dexmedetomidina (0,2-1μg/kg/h) junto con remifentanilo y sevoflurano <0,5CAM. El control hemodinámico debe ser estricto durante la fase de disección y canulación para evitar la rotura de la aorta. Nos ayudaremos de los fármacos descritos anteriormente (esmolol, labetalol, clevidipino). Se deberá equilibrar el uso de vasodilatadores con un adecuado relleno vascular y aumento del flujo de la bomba.
La preparación para el inicio de la CEC es estándar, incluidas la anticoagulación y la administración de antifibrinolíticos.
La canulación arterial para CEC puede realizarse centralmente a través de la aorta, o en los sitios arteriales axilares, innominados o femorales. Este aspecto crítico del plan quirúrgico y las técnicas alternativas deben discutirse previamente entre el equipo del quirófano (cirujano, anestesiólogo, perfusionista, enfermería). Si el plan propuesto cambia debido a hallazgos intraoperatorios, el equipo necesario, los monitores y las técnicas de perfusión deben estar disponibles.
Además del examen ecocardiográfico intraoperatorio estándar para pacientes de cirugía cardíaca, la ETE se utiliza para confirmar y caracterizar el alcance de la patología aórtica13,40,41.
En el período de prebypass: la ETE se utiliza para verificar el diagnóstico y detectar complicaciones debido a la patología aórtica. La válvula aórtica se examina para determinar si hay una IAo significativa y para cuantificar su gravedad. También se usa para evaluar la estructura y la función de las otras válvulas cardíacas, para evaluar la función regional y global del ventrículo izquierdo y derecho, y para evaluar el estado del volumen. Permite un diagnóstico rápido de las causas de la inestabilidad hemodinámica.
Durante la canulación aórtica: se utiliza para guiar la colocación de las cánulas aórticas y venosas. Aunque no existen criterios definitivos de ETE para distinguir la luz verdadera de la falsa en la disección aórtica, las características típicas de la luz verdadera incluyen: más pequeño que la luz falsa, continuidad con la válvula aórtica, expansión durante la sístole, bordes redondeados, flujo sanguíneo a través de fenestraciones intimales, con dirección del flujo desde la luz verdadera hacia la luz falsa. Las características típicas de la luz falsa incluyen: más grande que la luz verdadera, una forma de media luna, un borde afilado donde el colgajo intimal se une a la adventicia, presencia de contraste ecocardiográfico espontáneo o trombo debido a un estado de flujo bajo.
3. CEC y parada circulatoria
En la cirugía de arco aórtico resulta imprescindible la interrupción total de la circulación sistémica, incluida la circulación cerebral, durante un período de tiempo variable.
El cerebro depende totalmente de la glicólisis aerobia, por lo que, con la reducción y, más aún, con el cese del aporte de oxígeno, se inicia un proceso patológico que lleva a la aparición de lesiones isquémicas cerebrales irreversibles. En condiciones de normotermia, el cerebro no toleraría interrupciones del aporte sanguíneo, de ahí que la hipotermia sea el primer y más efectivo método de protección neurológica.
La hipotermia es la medida de protección orgánica estándar durante el período de parada circulatoria, puesto que disminuye las necesidades metabólicas del organismo. La PCH se inicia una vez alcanzada la temperatura objetivo.
La tolerancia a la isquemia es variable según los diferentes órganos, siendo la médula espinal y sobre todo el cerebro los más sensibles. La tolerancia a la isquemia hipotérmica de pulmón, riñón e hígado es mayor, hasta el extremo de que pueden recuperar una función normal después de 60min de PCC en hipotermia profunda.
La hipotermia puede retrasar, pero no prevenir indefinidamente, la aparición de lesiones isquémicas, ni el deterioro neurológico. Se han definido, como veremos posteriormente, ciertos intervalos de seguridad durante la parada circulatoria completa a diferentes temperaturas. Pero estos intervalos no son exactos y no garantizan la ausencia de lesiones isquémicas y sus secuelas.
Estrategias de protección cerebralEl empleo de medidas de protección cerebral es una recomendación de las guías clase Ib.
1. Hipotermia
El espectro de lesiones neurológicas en cirugía de arco aórtico es amplio, desde la disfunción neurológica temporal, sin reflejo en pruebas de imagen (confusión, agitación, delirio…), hasta lesiones permanentes, como el infarto cerebral42.
La hipotermia sistémica ha sido el primer método empleado para la protección orgánica durante la parada circulatoria, puesto que reduce la actividad metabólica, los radicales libres y el edema cerebral postisquemia.
En el cerebro normal:
- a)
Consumo cerebral de oxígeno (CMRO2): normal, 3,5ml/100g/min. El cerebro representa el 2% del peso corporal y consume el 20% del total del aporte de oxígeno.
- b)
Flujo sanguíneo cerebral (FSC): 50ml/100g/min (15% del gasto cardiaco). El FSC en la sustancia gris es de 75-80ml/100g/min, y en la sustancia blanca es de 20-30ml/100g/min.
- c)
La autorregulación permanece constante, con valores de PAM de 60-160mmHg. La isquemia conlleva la pérdida de autorregulación debido a la parálisis vasomotora.
- d)
Presión de perfusión cerebral (PPC): 50 a 150mmHg. Diferencia entre PAM y presión intracraneal (PIC): PPC=PAM − PIC.
- e)
Reactividad al CO2: el FSC varía del 3 al 4% por cada mmHg de variación en PaCO2 entre 20 y 80mmHg.
- f)
Aporte de oxígeno (DO2): cantidad de oxígeno administrado al cerebro por minuto. DO2=CaO2×FSC. El CaO2 normal oscila entre 16 y 20ml de O2/100ml de sangre arterial.
- g)
PIC. Determinada por el volumen intracraneal total: parénquima cerebral (80-85%), sangre (4-8%) y LCR (10-12%). La PIC normal es de 5-13mmHg y debe ser tratada cuando pasa de 20.
- h)
Elastancia intracraneal. El aumento de volumen intracraneal se compensa inicialmente por los desplazamientos del FSC y la sangre, hasta que este mecanismo se ve sobrepasado. Posteriormente, pequeños aumentos de volumen provocan aumentos importantes en la PIC y deterioro clínico.
- i)
Tasa metabólica cerebral de glucosa (CMRgl). Es de 5mg/100g de tejido cerebral/min. Más del 90% de la glucosa se metaboliza aeróbicamente por fosforilación oxidativa, el resto anaeróbicamente en ácido láctico. El proceso aeróbico es extremadamente eficaz: cada molécula de glucosa produce 38 moléculas de trifosfato de adenosina (ATP). Por el contrario, la glicólisis anaeróbica produce solo 2 moléculas de ATP por cada molécula de glucosa.
La hipotermia ha demostrado disminuir exponencialmente el metabolismo celular: A una temperatura cerebral de 25°C, la tasa metabólica cerebral disminuye hasta un 37% de la basal. A 15°C, la tasa metabólica cerebral se reduce en un 84-85%, lo que supone un 15% de la basal. En promedio, la tasa metabólica cerebral de oxígeno (CMCO2) se reduce en un 6-7% por cada 1°C de disminución de temperatura, desde 37°C.
Esto, combinado con la reducción lineal en el FSC con la hipotermia, da como resultado el desacoplamiento del FSC y CMCO2, y fundamentalmente a partir de los 20°C. A 18°C, el 60% de los pacientes tendrán un EEG isoeléctrico, y dicho porcentaje aumentará al disminuir la temperatura.
Sin embargo, existe cierta variabilidad individual, e incluso a temperaturas tan bajas como 14°C se ha demostrado que hay entre un 14 y un 22% de pacientes que no alcanzan el silencio eléctrico21.
El primer reemplazo con éxito del arco aórtico fue llevado a cabo por DeBakey en 1957.
En 1975, Griepp popularizó el uso de la hipotermia profunda con parada circulatoria, que consiguió mejorar los resultados de la técnica: en este año, Griepp et al. publicaron la primera serie de casos de cirugía de arco aórtico con parada circulatoria empleando hipotermia profunda a 18°C.
El éxito de la PCH está limitado por el tiempo de seguridad antes de que se produzcan efectos secundarios neurológicos y sistémicos significativos. Este tiempo de seguridad de PCH es controvertido y depende, entre otros factores, del grado de hipotermia alcanzado: a mayor grado de hipotermia, mayor tiempo «de seguridad» de isquemia. En hipotermia profunda (14-20°C), este tiempo «de seguridad» se ha establecido en torno a los 30-40min. Grados de hipotermia más profunda (<14°C) no proporcionan ventajas en cuanto a disminución de metabolismo cerebral, pero sí aumentan las complicaciones asociadas a la hipotermia.
La PCHP sola, sin técnicas de perfusión cerebral asociadas, representa el método más «sencillo» de protección cerebral:
Al iniciar la CEC, la hipotermia sistémica se alcanza enfriando la sangre en el intercambiador de calor de la bomba de perfusión. El enfriamiento ha de realizarse de forma gradual, de tal manera que el gradiente de temperatura (arterial-venoso) no ha de superar los 10°C, para evitar la embolia gaseosa30.
La temperatura de salida del oxigenador no debe superar los 37°C para evitar la hipertermia cerebral.
La temperatura ha de monitorizarse en diferentes lugares, como hemos visto previamente. Una vez alcanzada la temperatura deseada, se interrumpe la circulación y se realiza la reconstrucción del arco. Finalizada la misma, se reinicia la circulación extracorpórea y el recalentamiento. Durante el recalentamiento, como veremos posteriormente, tampoco debe haber un gradiente de temperatura >10°C.
Esta técnica ha demostrado ser efectiva en casos de parada circulatoria <40min. Pero la hipotermia profunda conlleva importantes efectos secundarios adversos (acidosis, respuesta inflamatoria sistémica, vasoespasmo, lesiones por reperfusión, coagulopatía…). De hecho, el empleo de hipotermia profunda como única medida de protección neurológica se ha asociado a lesiones permanentes en el 3 al 12% de los pacientes, disfunción renal en el 5 al 14%, insuficiencia respiratoria en el 5 al 39% e insuficiencia cardíaca en el 7 al 34% de los pacientes21.
Por otra parte, cuanto mayor es el tiempo de parada circulatoria, mayores son las complicaciones neurológicas asociadas.
Desde que los cirujanos realizan técnicas de reparación de arco más complejas, se necesitan mayores tiempos de parada circulatoria para dicha reparación, por lo que se han desarrollado técnicas de perfusión cerebral como medida de neuroprotección, que, asociadas al paro circulatorio en hipotermia, mejoran el pronóstico. La PCR y la PCA, combinadas con niveles de hipotermia menos profunda43, permiten prolongar los tiempos de parada circulatoria y disminuir las complicaciones.
En 1986, Guilmet et al. en Europa y Kazui en Japón emplearon por primera vez con éxito estas técnicas de perfusión cerebral asociadas a hipotermia menos profunda.
En resumen:
- •
La PCHP es una técnica utilizada para facilitar la cirugía de arco aórtico compleja.
- •
La hipotermia reduce el metabolismo celular y protege de la isquemia durante el paro circulatorio.
- •
Incluso a temperaturas centrales muy bajas, el metabolismo cerebral no resulta abolido completamente, por lo que la duración de la PCHP debe ser lo más corta posible para reducir las complicaciones.
- •
Además de las complicaciones habituales de la cirugía cardiaca y la CEC, la hipotermia profunda se asocia a diversos efectos adversos.
- •
La neuroprotección farmacológica y los métodos de perfusión cerebral codyuvante se usan a menudo para mejorar la seguridad de la técnica.
- •
Grados de hipotermia:
- -
Ligera: 36-28,1°C.
- -
Moderada: 28-20,1°C.
- -
Profunda: 20-14,1°C.
- -
Muy profunda: <14°C.
- •
Tiempos estimados de seguridad en caso de PCH18:
- -
No están claros los períodos de seguridad de esta técnica: en general, el período de seguridad, sin otra técnica de perfusión cerebral asociada, se ha estimado en torno a 40 minutos, a una temperatura de 20°; aunque no hay claro consenso al respecto.
- •
La hipotermia tiene también efectos secundarios:
- -
Aumento de la viscosidad de la sangre.
- -
Trastornos hematológicos: coagulopatía, sangrado postoperatorio…
- -
Aumenta las resistencias vasculares sistémicas.
- -
Aumenta el tiempo de CEC.
- -
Mayor riesgo de síndrome de respuesta inflamatoria sistémica.
- -
Mayor riesgo de fracaso multiorgánico.
- -
Disfunción endotelial vascular cerebral.
2. Perfusión cerebral retrógrada
La PCR fue descrita por primera vez por Mills y Oschner en 1980 para el tratamiento de una embolia pulmonar masiva durante un bypass cardiopulmonar, pero fue Ueda en 1990 quien la empleó por primera vez en cirugía de aorta. Se realiza canulando la vena cava superior e infundiendo sangre hipotérmica desde el circuito de extracorpórea a la vena cava superior para, de forma retrógrada, perfundir el cerebro durante el tiempo de parada circulatoria. Generalmente, se emplean flujos de 300 a 500ml/min y presiones en vena cava superior de 25-35mmHg.
Los beneficios teóricos de la PCR son:
- •
Permite «lavar» material embólico (gas o partículas) de la circulación cerebral.
- •
Permite una distribución homogénea de la hipotermia cerebral y colabora en el mantenimiento de la misma.
- •
Permite mantener el metabolismo cerebral, proporcionando cierto flujo cerebral durante el tiempo de parada circulatoria. Sin embargo, parece que el flujo proporcionado por la PCR se limita a un 10-20% del normal, debido a la existencia de shunts venosos, etc. De todas formas, en condiciones de hipotermia profunda podría considerarse «suficiente».
Desventajas: el riesgo de edema cerebral, proporcional al flujo y al tiempo.
El hecho de asociar la PCR a la PCHP ha mejorado los resultados tras la cirugía de reconstrucción de arco aórtico44, disminuyendo la proporción de lesiones neurológicas.
Sin embargo, a pesar del empleo de estas dos técnicas asociadas, se registran aún en distintas series porcentajes de defectos neurológicos temporales en torno al 25%.
3. Perfusión cerebral anterógrada
Esta técnica fue descrita por primera vez por Cooley y DeBakey en 1956. La técnica fue inicialmente abandonada por resultados insatisfactorios, pero reintroducida por Frist et al., Bachet et al. y posteriormente popularizada por Kazui et al. en 1994. Datos experimentales confirman la eficacia de esta técnica para proporcionar un flujo cerebral adecuado durante la parada circulatoria hipotérmica, con lo que se consigue reducir el tiempo de isquemia cerebral y permite emplear una hipotermia menos profunda.
La perfusión se realiza con flujo en ambas carótidas a 6-10ml/kg/min y habitualmente con presiones de perfusión de 40-60mmHg en la arteria radial o 60-70mmHg en la carótida, para evitar el edema cerebral. Un flujo inferior podría inducir isquemia cerebral, mientras que uno mayor podría inducir edema o hemorragias cerebrales.
En Europa, dos tercios de los centros emplean PCA a 22-26°C y un tercio con menor temperatura3.
Técnicas:
- •
Unilateral: a través de la canulación arterial axilar, subclavia o innominada. Requiere competencia del polígono de Willis (completo en el 42-47% de la población). Puede resultar en menor perfusión del hemisferio izquierdo.
- •
Bilateral: cánulas de perfusión en los ostium del TBC y la CI, a través del arco abierto, durante la parada circulatoria hipotérmica. La desventaja de este método es el riesgo de introducir material aterosclerótico o aire en la circulación cerebral.
Perfusión cerebral retrógrada vs anterógrada
En realidad, no se ha demostrado la superioridad de la PCA sobre la PCR, así como tampoco se ha demostrado la superioridad de la técnica de PCA unilateral con respecto a la bilateral44-47, desde punto de vista estadístico. No obstante, resultan claras las diferencias clínicas cuanto mayor resulta el tiempo de parada.
La PCA es hoy en día la técnica de elección en cirugía de arco aórtico en muchos centros hospitalarios, y en diversos trabajos, en los que se comparan ambos tipos de perfusión, aunque no se encuentran diferencias significativas en cuanto a lesiones neurológicas permanentes, sí parece que la PCA se asocia a menor disfunción neurológica temporal45.
Perfusión cerebral unilateral vs bilateral
En cuanto al empleo de PCA unilateral o bilateral, tampoco hay unanimidad: la PCA bilateral supone mayor complejidad técnica y requiere mayor manipulación de troncos supraaórticos, mientras que la PCA unilateral podría ser insuficiente en caso de anomalías anatómicas del polígono de Willis, infartos previos…
Algunos autores recomiendan, si se espera un tiempo de PCC>40-50min, el empleo de PCA bilateral. También en caso de pacientes con infarto cerebral previo, estenosis carotídea significativa o alteraciones conocidas del polígono de Willis48.
En un metaanálisis del año 201949, Tian et al. concluyen que la evidencia disponible hasta el momento contempla el empleo de PCA unilateral o bilateral como medidas coadyuvantes del paro circulatorio hipotérmico, sin que exista suficiente evidencia de la superioridad de una técnica con respecto a la otra.
- •
El empleo de PCA es recomendación IIa nivel de evidencia B, tanto en las guías americanas como en las europeas.
- •
En las guías americanas del año 2010 se otorga el mismo nivel de evidencia y recomendación para otras técnicas de protección cerebral: PCHP y PCR.
4. Parada circulatoria en hipotermia moderada (PCHM)
La asociación de la PCA selectiva como coadyuvante de la parada circulatoria en hipotermia ha permitido emplear grados de hipotermia más moderados: puesto que se mantiene el flujo cerebral durante la parada circulatoria, la hipotermia sistémica se emplea fundamentalmente como medida de protección orgánica.
La hipotermia moderada es una alternativa más «fisiológica», acorta los tiempos de enfriamiento y calentamiento, acorta el tiempo de bypass, disminuye la respuesta inflamatoria sistémica, el fracaso multiorgánico, la coagulopatía y el sangrado postoperatorio.
En distintos estudios se ha demostrado la seguridad y las ventajas de esta técnica50.
La tasa metabólica de los distintos órganos y del músculo esquelético es menor que la cerebral, por lo que se requieren menores grados de hipotermia para la protección de los mismos. Además, los distintos órganos son más tolerantes a la isquemia que el cerebro.
Cuestión aparte es la protección de la médula espinal. Kamiya et al. fueron los primeros en referir el riesgo de complicaciones neurológicas (paraplejia) en PCC en hipotermia moderada (28°C). Múltiples trabajos se han publicado desde entonces. Recientes datos clínicos y experimentales (Mount Sinai Group) defienden como intervalo de isquemia espinal seguro:
- •
20 min en normotermia (37°C).
- •
50 min en hipotermia ligera (32°C).
- •
75 min en hipotermia moderada (28°C).
- •
120 min en hipotermia profunda (20°C).
Hoy en día, la PCHM, en combinación con la PCA selectiva representan la técnica elegida en muchos centros para este tipo de cirugía, y la que supone menos complicaciones desde el punto de vista neurológico.
Un paso más allá: la perfusión de los tres troncos supraaórticos (TSA). Cuando todavía no existen datos concluyentes que demuestren la superioridad de la perfusión cerebral anterógrada bilateral vs unilateral, ya existen algunos grupos que propugnan la perfusión de los tres TSA. La justificación para dicha técnica es evitar los problemas neurológicos derivados de un polígono de Willis incompleto a nivel posterior. En estos pacientes, si aportamos sangre a través de la arteria vertebral izquierda se podrían disminuir dichos problemas.
Un reciente metaanálisis, del año 2018, compara las cuatro principales medidas de protección neurológica en cuanto a defectos neurológicos permanentes y mortalidad perioperatoria: PCHP, PCHP+PCA, PCHP+PCR y PCHM+PCA, con las siguientes conclusiones51:
- •
La PCR puede reducir la mortalidad y no aumenta los riesgos de defectos neurológicos permanentes, en comparación con PCA, cuando se emplea PCHP.
- •
En caso de parada circulatoria en hipotermia moderada, se recomienda asociar técnicas de PCA.
- •
Tanto la PCHP+PCR como la PCHM+PCA son estrategias adecuadas de protección cerebral en cirugía de arco aórtico.
Más reciente todavía es el metaanálisis de Hameed et al.52 (año 2019: 68 estudios, 26.968 pacientes) comparando PCHP, PCA y PCR, del que se extraen las siguientes conclusiones:
- •
La PCA y la PCR presentan mejores resultados que la PCHP, sin evidenciarse diferencias entre las perfusiones cerebrales anterógrada y retrógrada.
- •
La mejor técnica para cirugía de arco aórtico con parada circulatoria prolongada es el empleo de técnicas de PCA o PCR. Pero para cirugías menos extensas, con tiempos de parada circulatoria menos prolongados, la PCHP continúa siendo una buena opción.
5. Control de la hiperglucemia
La hiperglucemia empeora el pronóstico neurológico por diferentes mecanismos:
- •
Favorece la inflamación y el stress oxidativo.
- •
Lesiona la microcirculación cerebral.
- •
Conduce a una glucólisis anaerobia, generando una acumulación rápida de lactato y acidosis intracelular durante el periodo de parada, etc.
Niveles de glucosa >250mg/dl empeoran el pronóstico NRL.
La Society of Thoracic Surgeons ha publicado unas guías para el control perioperatorio de la glucemia en cirugía cardíaca, recomendando mantener niveles <180mg/dl53.
6. Hemodilución
La hemodilución produce una disminución de la viscosidad de la sangre, evitando además la agregación de los hematíes.
Ha demostrado limitar las lesiones cerebrales, puesto que mejora el flujo cerebral a bajas temperaturas.
7. Equilibrio ácido-base
La hipotermia aumenta la solubilidad del CO2 en plasma, aumentando su presión parcial, aunque el contenido total sea el mismo. La pCO2 arterial es un factor regulador del flujo sanguíneo cerebral. Existen dos formas de control: alfa-stat y PH-stat. El control PH-stat implica la corrección de pCO2 a la temperatura alcanzada en la fase de hipotermia, y con el control alfa-stat no se realiza dicha corrección.
El método habitualmente empleado en cirugía cardíaca es el alfa-stat: está indicado mantener cifras de CO2 en torno a 45mmHg para favorecer la vasodilatación cerebral (control alfa-stat).
8. Medidas farmacológicas de protección cerebral
La intervención farmacológica tiene como objetivo disminuir la actividad metabólica cerebral y el consumo de oxígeno, y se utiliza como medida coadyuvante de la hipotermia. Se han empleado distintos tipos de fármacos como coadyuvantes, aunque no existen estudios aleatorizados al respecto que hayan demostrado su eficacia18. De hecho, en la actualidad no existe ningún fármaco o combinación de fármacos que haya demostrado disminuir el riesgo o la severidad de los daños neurológicos en cirugía de aorta54.
Entre los más empleados:
- ∘
Corticoides: metilprednisolona
- •
Son potentes antiinflamatorios, y uno de los fármacos más empleados como medida de protección farmacológica, aunque la evidencia es insuficiente.
- •
Tienen acción estabilizadora de las membranas liposomales, disminuyen el edema cerebral y actúan además como antioxidantes.
- •
Provocan hiperglucemia, lo que podría empeorar la lesión neurológica.
- •
La dosis habitual es entre 0,5 y 1g (hasta 10mg/kg).
- ∘
Barbitúricos: tiopental
- •
Dosis habitual: 10mg/kg.
- •
Considerados el standard en cuanto a neuroprotección, puesto que disminuyen el consumo de O2 cerebral.
- •
Los estudios con barbitúricos han mostrado resultados controvertidos.
- •
A pesar de la escasa evidencia, siguen empleándose: en Europa, en un estudio en 450 centros, se objetivó que se emplean como neuroprotección en un 60%.
- ∘
Anestésicos inhalados
- •
Posible efecto neuroprotector, que se atribuye a la disminución de la excitotoxicidad.
- ∘
Propofol
- •
Efecto antioxidante y antiinflamatorio, parece que tiene efecto neuroprotector en isquemia focal y global, aunque sin que se haya demostrado dicho efecto en estudios aleatorizados.
- ∘
Lidocaína
- •
Efecto neuroprotector sin evidencia científica clara.
- •
Mantiene el gradiente electroquímico de la neurona, disminuye la demanda regional de oxígeno…
- ∘
Estatinas
- ∘
Dexmedetomidina
- ∘
Magnesio
- •
Reduce las concentraciones de calcio intracelular.
- •
Reduce el vasoespasmo.
- •
Estabiliza gradientes electroquímicos.
- •
Sin evidencia científica firme.
- ∘
Insulina
- •
Efecto beneficioso condicionado al control de la hiperglucemia (empeora el daño cerebral y aumenta la posibilidad de lesiones neurológicas). Efecto neuroprotector cerebral y medular contra la isquemia.
- ∘
Manitol
- •
Diurético osmótico, efecto vasodilatador y efecto antirradicales libres de oxígeno; reduce los requerimientos de oxígeno y modula el óxido nítrico plasmático (tabla 9).
Tabla 9.Estrategias de protección cerebral en la cirugía del arco aórtico
Las estrategias de protección cerebral en cirugía de aorta ascendente y arco aórtico se deben abordar de forma multidisciplinar (cirugía, anestesiología, perfusionista) con el fin de evitar eventos isquémicos cerebrales transitorios o permanentes Clase I Nivel B PCHP o PCHM con/sin perfusión cerebral anterógrada/retrógrada son técnicas que minimizan razonablemente la lesión cerebral en cirugía de aorta ascendente y arco aórtico. Un factor importante es la experiencia del centro en la técnica utilizada Clase IIa Nivel B En cirugía de aorta ascendente y/o arco. la hipertermia cerebral perioperatoria no solo no está indicada sino que puede ser perjudicial Clase III Nivel B Fuente: tomado de «2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult»2.
- 1.
Neuromonitorización
- •
INVOS: saturación regional de O2 cerebral.
- •
Valores >40.
- •
Evitar disminución del 20% con respecto al basal.
- •
BIS: grado de hipnosis.
- 2.
Monitorización de la temperatura
- •
Central: nasofaríngea (o timpánica)
- •
Periférica: rectal (o vesical).
- 3.
Parada circulatoria
- ∘
Hipotermia
- •
Hipotermia media-moderada (26-30°C).
- •
Durante el enfriamiento: mantener un gradiente de temperatura entre el agua del intercambiador y la sangre inferior a 10°C, así como un gradiente de 2-4°C entre la temperatura cerebral y la sistémica.
- •
Numerosos son los equipos que usan hielo tópico craneal, controvertido o inútil para otros. Tendrá que separarse el hielo de la piel a fin evitar lesiones cutáneas por congelación. Probablemente la perfusión cerebral anterógrada bilateral ha reducido su utilidad en los últimos años.
- ∘
Perfusión cerebral
La decisión de emplear o no técnicas de perfusión cerebral será consensuada con el equipo quirúrgico.
- •
Sin perfusión cerebral.
- •
Retrógrada.
- •
Anterógrada: es la técnica más empleada, hoy en día, en la mayoría de los centros.
- ∘
Uni o bilateral, en función de cada caso, del tiempo esperado de parada circulatoria según la complejidad de la cirugía y del registro INVOS.
- •
Medidas de protección farmacológica
- ∘
Hipnótico: barbitúrico (pentotal), propofol.
- ∘
Corticoides: metilprednisolona, 500mg.
- ∘
BNM
- ∘
Evitar hiperglucemia
- •
Mantener cifras de glucemia <180mg/dl, evitando siempre cifras >250mg/dl.
- ∘
Equilibrio ácido-base
- •
Mantener pCO2 en torno a 45mmHg (lectura de GAS a 37°C, control alfa-stat).
- ∘
Hemodilución
- 4.
Recalentamiento
- ∘
Lento y progresivo.
- ∘
Evitar gradiente de temperatura ±2°C entre la temperatura sistémica y la temperatura cerebral; e inferior a 10°C entre el agua del intercambiador y la sangre.
- ∘
Evitar hipertermia.
Tras la reparación aórtica, debemos realizar un recalentamiento progresivo para evitar efectos deletéreos por hipertermia cerebral. En los casos en lo que ha sido necesaria la PCHP, se reinicia la bomba manteniéndose todavía esta hipotermia profunda al menos 10min, a fin de reperfundir el cerebro con sangre fría para reducir la lesión isquémica de la reperfusión. El recalentamiento debe ser lento y se suele limitar a incrementos de <0,5°C/min, llegando a precisar hasta 90min de tiempo. La temperatura central debe ser <36,5°C, ya que pretende evitar que la hipertermia produzca lesión neurológica.
La decanulación arterial debe ser suave, para evitar la liberación de placas de ateroma que favorezcan una embolia cerebral y ensombrezcan el pronóstico de estos pacientes. En ocasiones es preciso el apoyo inicial con fármacos inotrópicos y/o vasoactivos, y su manejo no dista del de otras cirugías cardiacas. Se debe mantener una buena presión de perfusión visceral, sobre todo renal, optimizando la precarga, aunque inicialmente no conviene una PAS >100mmHg para favorecer la hemostasia de las suturas.
La hemostasia y el manejo de la coagulopatía son otro aspecto importante en este momento. La cirugía de aorta es una de las cirugías cardiacas que más recursos consumen en hemoderivados.
Es necesario corregir los defectos de coagulación con productos derivados sanguíneos, como son plasma, plaquetas y fibrinógeno, para favorecer la hemostasia primaria y minimizar el sangrado postoperatorio. Es conveniente la reposición de las pérdidas hemáticas, ya sea usando concentrados hemáticos o bien usando el cell saver o recuperador sanguíneo.
La cirugía de arco aórtico se complica frecuentemente con sangrado excesivo y con elevados requerimientos de hemoderivados alogénicos. Los motivos fisiopatológicos parecen relacionados con33,34,36,37,55:
- ∘
Activación del sistema hemostático incluso antes del inicio de la cirugía y que claramente después de la CEC y de la hipotermia se agrava. Previo a la cirugía los niveles de dímeros D y de productos de degradación del fibrinógeno son ya más elevados, acompañándose de una hipofibrinogenemia progresiva (como consecuencia de una formación y degradación de fibrina, que sugiere una intensa activación de la fibrinólisis) y un tiempo R bajo preoperatorio (asociado a consumo de factores y coagulopatía temprana). La hipofibrinogenemia progresiva de manera gradual se va recuperando tras el primer día de la cirugía, pero lo hace más rápido si se suplementa fibrinógeno.
- ∘
Turbulencia del flujo sanguíneo (en caso de disección aórtica por la falsa vía, tubo aórtico supracoronario o valvulado), que activaría el sistema de coagulación.
- ∘
La hipotermia y la CEC se asocian a una reducción de la síntesis del fibrinógeno y también a una mayor afectación de la disfunción y del recuento plaquetario. Si bien es cierto que existe un recuento plaquetario, bajo parece que este se resuelve de manera más precoz. La formación de fibrina está aún más dañada que la disfunción plaquetaria. La reducción de la cantidad de plaquetas infundidas es un factor pronóstico.Además de la recomendación de realizar una cirugía con un protocolo que incluye prevención de coagulopatía (uso de ácido tranexámico), se debe realizar una hemostasia guiada mediante ROTEM/TEG. Es aconsejable además activar los protocolos de actuación ante la presencia de una hemorragia masiva o situaciones de hemorragia incoercible vigentes en el hospital. Esto permite disponer de los recursos de hemoderivados de manera coordinada contando con un equipo multidisciplinar (banco de sangre, enfermería, celadores, resto de equipo quirúrgico…).
- ∘
Se recomienda vigilar y corregir la tríada letal de hipotermia (manteniendo una temperatura central >33°C bien mediante calentadores de fluidos, mantas o colchones térmicos), acidosis (bicarbonato y modificar parámetros respiratorios) y coagulopatía (que agravan el pronóstico, sobre todo si se asocia a hipoxia e hiperglucemia). La hipocalcemia debemos corregirla también si es preciso con cloruro/gluconato cálcico.
- ∘
Es necesario conocer y usar los dispositivos de infusión rápida de líquidos de que disponemos.
- ∘
Entre los criterios hemodinámicos para hablar de hemorragia masiva podemos hablar de una pérdida y reemplazo del 50% del volumen en 3h, una pérdida de 1,5ml/kg de peso en 20min, la transfusión de 4 o más concentrados de hematíes en menos de 1h.
- ∘
Es aconsejable, además de un buen manejo de la fluidoterapia, mantener una oxigenación adecuada, evitar la hipotermia usando calentadores de suero y mantas térmicas, así como el uso de vasopresores necesarios y evitar la hipocalcemia38,39.
Un estudio reciente, HEROES-CS (Hemostasis Registry of Patients in Cardiac Surgery)56, concluye que el uso de ROTEM para guiar las necesidades de transfusión mejora de manera significativa la pérdida de sangre, así como reduce el consumo de estos hemoderivados mejorando la estancia media y realizando un importante ahorro frente a algoritmos clásicos. Este trabajo propone como algoritmo a seguir:
- -
Un primer paso donde se indicaría dar 50mg de protamina si: CT intem ≥240s, CT heptem ≤240s.
- -
Se indicarían 2-4g de fibrinógeno o se considera añadir 10-15ml/kg de plasma fresco congelado (PFC) si A10 extem ≤40mm o A10fibtem ≤8mm.
- -
Si nos encontramos con A10 extem ≤40mm y un A10 fibtem ≥10mm, considerar ya la transfusión de pool de plaquetas.
- -
Si el CT extem ≥90s o el CT fibtem ≥280s se indica transfusión de 10-15ml/kg de PFC e incluso 20-30UI/kg de complejo protombínico (PCC).
- -
Nuevamente se vuelve a valorar los parámetros de A10 extem ≤40mm y un A10 fibtem ≥10mm por si se vuelven a pautar plaquetas.
Onge56,57 realiza un reciente estudio donde también encuentra beneficios de la implementación de un algoritmo para guiar el uso de hemoderivados según ROTEM para pacientes sometidos a procedimientos complejos de cirugía de aorta:
- -
Se considera que una pérdida de más de 300ml/h (o por consenso médico-quirúrgico traducido en una pérdida considerable de sangre) se debe realizar un análisis completo de sangre, gasometría y ROTEM (si son normales, se debe considerar revisión o reexploración quirúrgica).
- -
Se recomienda corregir Hto>22%, hipotermia >35°C, hipocalcemia >1,09mmol/l, acidosis pH>7,35, hipertensión (PAM 55-65mmHg).
- -
Si en el Intem el CT es alargado y el CFT es normal, miramos en Heptem, y si este es normal, damos 50mg de protamina; si no fuese normal, DDAVP 0,3μg/kg hasta un máximo de 28μg.
- -
Si el MCF ≤40mm en el Extem y en el Intem y las plaquetas son menores de 100.000/μl, se aconsejaría pautar hasta concentrados de plaquetas (si se ha pautado previamente clopidogrel se consideraría dar incluso aunque fuesen mayores de 100.000).
- -
Si el MCF ≤ 7mm en el Fibtem estarían indicado 2g de fibrinógenos y crioprecipitados. Si en el Extem es patológico el CT, el CFT o el MCF, valoraremos si es normal el ventrículo derecho y se iniciará PFC a 15ml/kg; si hubiese disfunción del ventrículo derecho, se aconsejaría PCC a 15U/kg.
- -
Por último en caso de hemorragia refractaria se aconsejará FVII recombinante 1 o 2mg, repitiendo a los 30min57.
Por último, durante la salida de CEC no debemos olvidar el manejo analgésico. La epidural o los bloqueos neuroaxiales son beneficiosos porque reducen la demanda de oxígeno miocárdico al disminuir las resistencias vasculares, la frecuencia cardíaca y la supresión de la respuesta simpática tras la estimulación quirúrgica. Por otro lado, aumentan la perfusión miocárdica y esplácnica derivada de la simpatectomía producida en el tórax y la disminución de la respuesta al estrés quirúrgico Estos pacientes son manejados habitualmente con perfusión de remifentanilo durante la mayor parte de la cirugía que se deben reajustar tras la PCHP o la CEC. La aplicación de técnicas regionales debe valorarse en cada paciente de manera individualizada, teniendo en cuenta los tratamientos previos del paciente, las alteraciones de las coagulopatías asociadas a la cirugía y el elevado riesgo de sangrado.
Consideraciones anestésicas en el tratamiento endovascular de arco aórticoAunque la cirugía abierta sobre el arco aórtico sigue siendo el gold standard, es un procedimiento agresivo que requiere CEC y PC. Además, a pesar de la mejora de los cuidados perioperatorios y de la protección cerebral, aún se asocia con una mortalidad entre el 4 y el 13% y con lesiones cerebrales entre el 3 y el 13%58.
Los procedimientos híbridos combinan cirugía abierta para realizar un debranching de troncos supraaórticos con cirugía endovascular. Si el aneurisma afecta a gran parte de aorta ascendente, puede ser necesaria la CEC e incluso breves periodos de PC; en cambio, en aneurismas más distales es posible evitar la CEC. En principio parece una cirugía menos agresiva que la abierta pura, aunque no ha demostrado mejoría de resultados respecto a la cirugía abierta59.
Por todos estos motivos, y porque hasta un 25% de pacientes con estas patologías no son quirúrgicos por los métodos clásicos debido a sus comorbilidades, se han ido desarrollando las técnicas endovasculares puras, aunque hasta ahora no hay metaanálisis que comparen estas técnicas con las abiertas.
El tratamiento endovascular del arco aórtico es menos agresivo, ya que no precisa esternotomía ni CEC. Los abordajes quirúrgicos son femorales, y dependiendo de donde se coloque la endoprótesis, pueden ser necesarios abordajes en el cuello para realizar by-pass extraanatómicos carótido-carotídeos y/o carótido-subclavios y para introducir guías por la carótida derecha que sirvan para colocar ramas hacia troncos supraaórticos.
Hay que tener en cuenta que estas cirugías deben realizarse en quirófanos híbridos, que están equipados con dispositivos avanzados de formación de imágenes médicas. Esto tiene influencia en el trabajo del anestesiólogo fundamentalmente por dos razones:
- 1.
El arco radiológico en C fijo que ocupa gran parte del quirófano hace que el lugar del trabajo del anestesiólogo en estos procedimientos quede apartado de la cabeza del paciente, por lo que debe tenerse en cuenta para la disposición de todo el aparataje de monitorización; además, se necesitarán tanto circuitos del respirador como líneas venosas y arteriales más largas de lo habitual.
- 2.
Deben adoptarse todas las medidas de protección radiológica.
En cuanto a la monitorización hemodinámica, depende de la situación clínica del paciente, pero lo más habitual será utilizar:
- -
Una línea arterial invasiva cuyo lugar de colocación debe consensuarse con el cirujano, porque con frecuencia debe ocluirse alguna arteria subclavia temporal o permanentemente. Habitualmente se usa la arteria radial derecha, pero también puede utilizarse la radial izquierda o una arteria femoral compartida con el cirujano a través de un introductor 7F.
- -
Buenos accesos venosos periféricos.
- -
El uso de un catéter venoso central no es imprescindible, pero puede ser conveniente sobre todo si se necesitan fármacos vasoactivos. Si se opta por su uso, será preferible colocarlo a través de una vena femoral o una vena central de acceso periférico, ya que las venas yugulares y subclavias quedan dentro del campo quirúrgico.
- -
Al ser procedimientos menos agresivos y no necesitar pinzamientos de aorta ni CEC, es raro necesitar la medición del gasto cardiaco, pero si por la situación basal del paciente se considerase de utilidad, es preferible recurrir a métodos de análisis de la onda de pulso. Es muy raro necesitar un Swan-Ganz en estas cirugías; en cualquier caso, debería colocarse por una vena femoral.
- -
ETE. Es una monitorización que puede aportar importante información. Se usa sobre todo en dos periodos: antes del despliegue de la endoprótesis, sobre todo en caso de disecciones con múltiples fenestraciones, para asegurarse que las guías están en la luz verdadera. y después del despliegue, para valorar la competencia de la válvula aórtica u otra lesión iatrogénica.
La neuromonitorización es fundamental, porque existe riesgo importante de isquemia cerebral al manipular los TSA durante los by-pass extraanatómicos o al desplegar la endoprótesis en el arco. Los métodos más usados son la oximetría cerebral, el BIS (de recomendación bilateral) y el EEG.
La oximetría cerebral es una técnica muy sensible a la disminución de aporte de oxígeno cerebral, si bien se está monitorizando solo una parte de la corteza frontal. Alteraciones en el valor del BIS tanto en el número como en la asimetría, sin que existan cambios en la profundidad anestésica ni en la temperatura, pueden servir como detector de isquemia cerebral, sobre todo si además se combina con disminución del INVOS.
En caso de sospecha de isquemia cerebral, las medidas a tomar por parte del anestesiólogo irán encaminadas a: 1)incrementar el aporte de oxígeno al cerebro aumentando la PAM y actuando sobre todos los factores que intervienen en el transporte de oxígeno arterial (PaO2, Hb y Qc valorado fundamentalmente por ETE), y 2)disminuir el consumo de O2 cerebral profundizando la anestesia o tratando la hipertermia, como se ha visto previamente.
- -
Inducción y mantenimiento anestésico. Se usarán los fármacos habituales, como se explica en otras partes de esta guía, teniendo en cuenta que es conveniente usar técnicas de fast-track, porque se intentará despertar y extubar al paciente en el quirófano al final de la intervención para hacer una valoración neurológica completa.
- -
Heparinización. Se administra 100 a 150U/kg de heparina sódica para lograr TCA alrededor de 300s. Al no necesitar CEC ni PC, las alteraciones de la coagulación son mucho más raras que en la cirugía abierta o en los procedimientos híbridos, y es raro tener que recurrir a test viscoelásticos para guiar la hemostasia.
- -
Protección renal. Es importante mantener buena hidratación como protección renal frente al daño por los contrastes yodados.
- -
Manejo de la temperatura. En estos procedimientos, al no existir apertura de grandes cavidades corporales no hay pérdidas importantes de calor, pero por otra parte las cirugías pueden ser largas. Es interesante monitorizar la temperatura para evitar tanto la hipotermia (con mantas de aire convectivo y calentamiento de sueros) como la hipertermia, que sería perjudicial en caso de isquemia cerebral.
- -
Sobreestimulación con marcapasos provisional (MCP). Durante el despliegue de la endoprótesis es necesario reducir la PA para evitar el desplazamiento del stent debido a las fuerzas pulsátiles. Esta hipotensión transitoria puede lograse fundamentalmente por tres métodos: 1)farmacológicos; 2)un balón de oclusión en la desembocadura de la vena cava inferior en la aurícula derecha, y 3)MCP endocavitario para producir sobreestimulación ventricular, que es el método más utilizado y más seguro y fiable. El MCP puede colocarse a través de un introductor 6F en una vena femoral o, lo que es más cómodo (en nuestro hospital es lo que se hace), aprovechando la disección quirúrgica del cuello se coloca por una vena yugular o subclavia. Se introduce hasta la punta del ventrículo derecho y se considera que está bien colocado cuando el umbral de captura es <5mA60. Durante los segundos que dura el despliegue de la endoprótesis se hará sobreestimulación con una frecuencia cardiaca (FC) de unos 180latidos/min y con una salida del doble del umbral inicial. De esta forma suelen lograrse las metas de una PAS <60mmHg y pérdida de pulsatilidad. Al cesar la estimulación suele recuperarse la FC y la PA basal en menos de 10s. Si no ocurriese, es generalmente debido a cierto aturdimiento miocárdico, sobre todo en pacientes con disfunción ventricular previa, y en ese caso se administrarán pequeños bolos de fármacos vasoactivos (efedrina, fenilefrina, noradrenalina…). Si a pesar de estos fármacos no se recupera la PA, es conveniente realizar una ETE para descartar otras complicaciones, que aunque son raras, entran dentro de lo posible, como disección retrógrada con insuficiencia aórtica aguda o anormalidades regionales de la contractilidad ventricular, que indicarían isquemia miocárdica.
1. Preparación del quirófano
El quirófano debe cumplir con la normativa vigente sobre condiciones ambientales y control del clima, suministros de energía eléctrica, aislamiento eléctrico, suministro de gases anestésicos, flujo laminar, proceso de productos desechables y sistemas de seguridad.
Las dimensiones de los quirófanos son necesarias por el gran volumen de aparatos utilizados en CCV y anestesia, así como por el elevado número de personas que pueden verse involucradas en los procedimientos61. La iluminación del campo quirúrgico debe permitir el trabajo en varias zonas al mismo tiempo —en esta patología en concreto, en la región axilar y/o femoral y/o torácica—, y la mesa quirúrgica debe ser grande y estar adaptada a técnicas de imagen y técnicas de endovascular. Óptimamente, el quirófano debe estar conectado por fibra óptica con otras áreas hospitalarias, para la posible participación de otros especialistas, como las áreas de ecocardiografía o angiorradiología, o ser un quirófano híbrido que permita el implante de prótesis híbridas, en especial en la patología a la que nos estamos refiriendo, y disponer de varias terminales de informática conectadas a la red hospitalaria con acceso regulado para uso de los cirujanos, enfermería, anestesia y perfusión. Desde dichas terminales se debe tener acceso a toda la información clínica e imágenes de los pacientes62,63.
Los procedimientos de seguridad, así como las comprobaciones y verificaciones previas al inicio, se han descrito previamente61.
El quirófano tiene que estar preparado rápidamente con todo el aparataje y personal recomendado. Dada la posible inestabilidad hemodinámica de estos pacientes de SAA, en el traslado a quirófano, e incluso en el paso del paciente a la mesa de quirófano o en la inducción anestésica, se recomienda que todo el personal esté preparado en quirófano y el cirujano presente, e incluso lavados en quirófano desde el inicio. Importante que el/los cirujanos estén físicamente presentes en el quirófano en este momento, con un plan para la preparación rápida, canulación de emergencia y entrada en CEC si se presenta un deterioro repentino. Es imprescindible contar con una PA invasiva mediante canalización de la arteria radial antes de la inducción anestésica (si no se ha realizado previamente en la unidad de intensivos), así como control estricto de las cifras de PA, como hemos visto previamente.
2. Vías de abordaje
El abordaje quirúrgico adecuado es un aspecto esencial en la cirugía de aorta, y según la localización del SAA, el abordaje o exposición será distinto. Para ello es necesario un breve repaso de la clasificación del SAA64.
La clasificación más práctica es la de la Universidad de Stanford. Distingue la afectación de la aorta ascendente (tipoA) de la afectación de la aorta ascendente (tipoB), con independencia de dónde se encuentre la puerta de entrada (fig. 2).
Otra clasificación de las más utilizadas es la de DeBakey, en la que se establecen inicialmente tres tipos según la zona afectada: tipoI, afectación de aorta ascendente y descendente; tipoII, afectaría exclusivamente a la aorta ascendente; tipoIII, se iniciaría después del cayado aórtico, y puede afectar a la aorta torácica (IIIA) o abdominal (IIIB) (fig. 2).
Se expone un breve repaso de referencias anatómicas que son importantrúrgico.
a) Referencias topográficas
Se detallan algunas referencias topográficas anatómicas útiles de cara al acceso quirúrgico aórtico65 (tabla 10 y fig. 8).
- ∘
Confluencias yúgulo-subclavias: articulación esternoclavicular.
- ∘
Aorta ascendente: porción medial del 3.er cartílago costal izquierdo hasta la 2.a articulación condroesternal derecha.
- ∘
Tronco arterial braquiocefálico: porción central de manubrio hacia la articulación esternoclavicular derecha.
- ∘
Arteria carótida común izquierda (ACCI): porción izquierda del manubrio buscando la articulación esternoclavicular izquierda.
- ∘
Mamilas de varón: 4.° espacio intercostal a nivel de línea medioclavicular.
- ∘
El borde inferior del pectoral mayor en varones es marcador del trayecto de la 5.a costilla hacia la axila.
- ∘
6.° cartílago costal: bifurcación de la arteria mamaria interna en ramas terminales.
- ∘
Cartílago costal 10.°: marcador del borde inferior del margen costal, estando a nivel de línea axilar media.
Referencias topográficas (nivel vertebral)
| C7 | Ápex pulmonar |
| T2 | Escotadura supraesternal |
| T4 | Ángulo de Louis. Inserción esternal 2.a costilla. Borde inferior arco aórtico. Carina |
| T5 | Hilio pulmonar derecho |
| T6 | Hilio pulmonar izquierdo |
| T8 | Hiato vena cava inferior (detrás del 6.° cartílago costal derecho, a 2,5cm de la línea media, en el centro frénico) |
| T9 | Unión xifoesternal. Punta de escápula (borde inferior) sobre la 8.a costilla |
| T10 | Hiato esofágico (detrás del 7.° cartílago costal izquierdo, 2,5cm a la izquierda de la línea media) |
| T12 | Hiato aórtico (aproximadamente 9cm por debajo de la unión xifoesternal). Tronco celíaco |
| L1 | Arteria mesentérica superior. Plano transpilórico |
| L1/L2 | Arterias renales |
| L2 | Termina la médula espinal |
| L3 | Arteria mesentérica inferior |
| L4 | Bifurcación aórtica. Ombligo |
| L5 | Bifurcación de la vena cava inferior |
Abordajes quirúrgicos anteriores de la aorta torácica.
A: esternotomía ±cervicotomía; B: Clamshell; C: esternotomía +toracotomía anterolateral izquierda en T; D: esternotomía +cervicotomía transversa en T; E: toracotomía bilateral +esternotomía oblicua; F: hemi-Clamshell ±cervicotomía supraclavicular o «trap-door».
b) Tórax
Variantes anatómicas del arco aórtico más frecuentes a tener en consideración en el abordaje quirúrgico de la patología aórtica de SAA: arco bovino (salida conjunta de tronco braquiocefálico y ACCI), nacimiento de arteria vertebral izquierda independiente (típicamente entre ACCI y arteria subclavia izquierda [ASI]), arteria subclavia derecha aberrante (desde el istmo aórtico y cruzando línea media, habitualmente retroesofágica). Menos frecuentes son: arco derecho, doble arco o arco cervical.
c) Abordajes de aorta. Aorta torácica
Los accesos anteriores facilitan las reconstrucciones a nivel cervical, así como la canulación de troncos supraaórticos (especialmente la arteria axilar derecha)66,67 (tabla 11 y fig. 8).
Abordajes quirúrgicos de aorta torácica (accesibilidad)
| Accesos | AoAs | Arco | ATDp-m | ATDd |
|---|---|---|---|---|
| Esternotomía media | + | + | – | – |
| Esternotomía media +toracotomía ALI | + | + | + | – |
| Hemi-Clamshell izquierdo | + | + | + | – |
| Clamshell | + (limitado en técnicas de raíz complejas) | + | + | +? |
| Toracotomía posterolateral izquierda | AoAs distal (HCA) | Arco prox (HCA)Arco distal + | + | + |
ALI: anterolateral izquierda en T; AoAs: aorta ascendente; ATDd: aorta torácica descendente distal; ATDp-m: aorta torácica descendente proximal y media; HCA: hypothermic circulatory arrest; prox: proximal.
En los casos del SAA es de elección:
- 1.
Disección de arteria axilar derecha o arteria femoral, según la técnica de perfusión elegida (ver apartado siguiente) y control proximal y distal del vaso.
- 2.
Esternotomía media convencional. Si por TC o ECO tenemos información de ruptura aórtica contenida, será mandatorio tener canulado algún acceso arterial, bien sea femoral o subclavio.
- 3.
Vías de establecimiento de CEC y tipos de CEC
La clave del éxito es una cirugía inmediata antes de que aparezca cualquier inestabilidad o deterioro hemodinámico.
El tratamiento convencional de la DA tipo A de Stanford (tipos I, II de DeBakey) consiste en la reconstrucción quirúrgica de la aorta ascendente con resección completa o parcial del segmento aórtico disecado.
Debido a que la mortalidad operatoria oscila entre el 15 y el 35%, incluso en centros de excelencia, se han utilizado medidas complementarias tales como la PCHP y la PCR de los vasos de la cabeza en el tratamiento quirúrgico de la reparación del arco o de la anastomosis abierta distal68. Mientras que la perfusión cerebral selectiva ha ganado recientemente aceptación debido a una mejora de los resultados con una supervivencia a los 5años del 73±6%, la parada circulatoria con hipotermia profunda no ha logrado mejorar las complicaciones iniciales, la supervivencia y las tasas de nueva operación distal en los pacientes con una DA de tipoA. Así, las estimaciones de supervivencia a los 30días, al cabo de un año y a los 5años fueron del 81±2, del 74±3 y del 63±3%, respectivamente y, por lo tanto, no se diferenciaron de las de otras técnicas que utilizan análisis retrospectivos con ajustes de propensión69.
Existen distintas alternativas quirúrgicas para tratar de evitar la canulación arterial sobre la zona afectada de la aorta ascendente: algunos grupos defienden la canulación directa de la aorta ascendente69, fundamentalmente en situaciones de inestabilidad hemodinámica, pero esta técnica tiene riesgo de entrar en la falsa luz, de progresión de la disección e incluso un riesgo alto de accidente cerebrovascular70, y hay otros que prefieren canular la arteria femoral fundamentalmente cuando el paciente está inestable71.
Actualmente la mayoría de los grupos quirúrgicos prefieren canular la arteria axilar derecha, bien directamente o a través de un injerto de Dacron de 7-8mm. Esta técnica proporciona ventajas tanto para la perfusión cerebral como para la perfusión aórtica distal. Su superioridad sobre la canulación femoral se ha demostrado recientemente en un metaanálisis72, y también ha demostrado un menor riesgo de accidente cerebrovascular en comparación con la canulación central. Mediante este tipo de canulación podemos facilitar el uso de cánulas en Y con el fin de poder perfundir simultáneamente la axilar derecha y la carótida izquierda durante la parada circulatoria, estableciendo una buena PCA de troncos supraaórticos. En una reciente revisión del grupo de la Universidad de Bolonia73 se confirma la superioridad de la canulación axilar y la perfusión cerebral anterógrada, aunque no consiguió demostrar la superioridad de la canulación carotídea bilateral sobre la unilateral.
Si se sospecha la rotura aórtica contenida intrapericárdica, se puede plantear la canulación venosa a través de vena femoral antes de la esternotomía.
Por regla general, tras la canulación arterial se procede a la apertura del pericardio y a la canulación venosa mediante monocánula insertada a través de la aurícula derecha. Colocación de cardioplegia retrógrada y «vent» a través de la vena pulmonar superior derecha.
Entrada en CEC, controlando una correcta perfusión cerebral y sistémica, pasando entonces a un enfriamiento paulatino dependiendo de la técnica a practicar. Cuando llegamos a la temperatura adecuada (hipotermia moderada entre 25 y 28°C), disminuimos el flujo de la bomba hasta 10ml/kg/min, aislamos los troncos supraaórticos y abrimos longitudinalmente la aorta ascendente introduciendo la segunda cánula de perfusión cerebral en la carótida izquierda, manteniendo el flujo cerebral anterógrado. Se procede a la exploración completa y detallada tanto de la aorta ascendente como del cayado y se plantea la técnica quirúrgica a practicar (se comenta en el apartado siguiente). Simultáneamente se perfunde cardioplegia por vía anterógrada (ostia coronarios) y/o retrógrada (por seno coronario). El pinzamiento de la aorta ascendente se puede realizar sobre la zona de aorta disecada que se va a resecar, pero se considera que esta técnica no es la mejor alternativa, ya que se puede romper la pared y crear falsas imágenes de puertas de entrada que no existían previamente y que pueden alterar el plan quirúrgico establecido.
El grupo de la Universidad de Washington74 ha estudiado las diferentes técnicas quirúrgicas y considera que la que mejor resultados de supervivencia presenta es la de no pinzamiento aórtico, hipotermia moderada y perfusión cerebral anterógrada.
Para la protección cerebral se han planteado muchas alternativas, desde la hipotermia profunda inicial a la hipotermia con perfusión cerebral retrógrada, y hoy en día la hipotermia moderada con perfusión anterógrada unilateral o bilateral es la técnica de elección75.
Una vez que el paciente está en CEC y preferiblemente, como hemos comentado, con PCA, se moviliza la aorta para visualizar la arteria innominada y la raíz aórtica y se procede a realizar la técnica quirúrgica que proceda (se describen en el apartado de técnicas quirúrgicas).
Las estrategias endovasculares en el SAA tipoA no tienen aplicación clínica alguna, excepto la de aliviar una perfusión críticamente deficiente antes de la cirugía de la aorta ascendente, bien por medio de la inserción de una endoprótesis vascular autoexpandible en la aorta torácica descendente, bien mediante una fenestración distal en los raros casos de extensión toracoabdominal (tipoI de DeBakey) con complicaciones isquémicas periféricas. La reconstrucción de la verdadera luz intravascular colapsada podría permitir el restablecimiento de la circulación en las ramas laterales y el restablecimiento del riego distal76-78. La mayoría de los casos de síndrome de mala perfusión son susceptibles de un tratamiento endovascular, si se tiene en cuenta que las tasas de mortalidad quirúrgica en los pacientes con complicaciones vasculares isquémicas periféricas agudas son similares a las observadas en la isquemia mesentérica, alcanzando una mortalidad intrahospitalaria del 89%79.
En un metaanálisis de 143 pacientes se encontró que los que presentaban lesiones de la aorta ascendente mostraron una mortalidad más baja con la cirugía que con el tratamiento médico (14% frente al 36%). Los pacientes con lesiones de la aorta descendente presentaron una mortalidad similar con tratamiento médico o quirúrgico (14% frente al 20%)80. Las sociedades cardiológicas y quirúrgicas han llegado a la conclusión de que el HI agudo que afecta a la aorta ascendente debe tratarse quirúrgicamente debido a que la mortalidad que conlleva el tratamiento médico es demasiado alta81. Teniendo en cuenta dichas incertidumbres, muchos expertos recomiendan la reparación aórtica en el caso de HI agudos de la aorta ascendente, igual que en la disección de tipoA, y un tratamiento médico intensivo para los HI de la aorta descendente, igual que en la DA tipoB.
Aunque el tratamiento definitivo de las DA de tipoA incluye la cirugía, aproximadamente el 20% de los pacientes no son intervenidos quirúrgicamente. Las razones que se han citado para justificar la preferencia del tratamiento médico han sido la morbilidad con enfermedades asociadas, la vejez (media de edad de 80años) y la negativa del paciente. El mejor tratamiento de una DA del arco aórtico sigue siendo un asunto aún por resolver. En la actualidad hay un consenso cada vez mayor de que cualquier arco aórtico disecado debe explorarse durante una parada circulatoria en hipotermia82.
- 4.
Técnicas quirúrgicas posibles
La cirugía es el único tratamiento eficaz en la DA tipoA. Tiene como objetivo principal evitar la muerte por rotura aórtica, taponamiento cardíaco, insuficiencia aórtica aguda, parada cardiaca, isquemia cerebral o visceral83. Y como objetivo secundario, tratar la isquemia de los órganos afectos.
Como norma general, todos los pacientes con DA tipoA deben ser sometidos a cirugía, porque de lo contrario su supervivencia es muy limitada84. El International Registry of Acute Aortic Dissection (IRAD)85 demostró superioridad de la cirugía sobre el tratamiento médico incluso en pacientes mayores de 70años. Hay algunos factores predictivos de resultado negativo (derrame pericárdico, shock cardiogénico, isquemia cerebral o estado de coma), pero únicamente en casos excepcionales la cirugía no ofrece mejoría en la tasa de supervivencia (pacientes con infartos cerebrales múltiples, isquemia intestinal prolongada o pacientes ya sometidos a resucitación cardiopulmonar prolongada) por asociarse a una prohibitiva mortalidad operativa86.
La mayoría de pacientes con DA tipoA son intervenidos por cirujanos con experiencia limitada en cirugía de la aorta, lo que puede explicar la alta morbimortalidad de esta enfermedad87. Pero aun así, referir estos pacientes a cirujanos experimentados puede no ser adecuado, porque lo que podría lograrse sobre la reducción del riesgo operatorio podría perderse en mortalidad preoperatoria, retrasando la cirugía. Así que el objetivo debe ir encaminado a conseguir una técnica quirúrgica que todo cirujano cardíaco sea capaz de realizar, puesto que si está bien planeada y ejecutada pueden reducirse las tasas de morbimortalidad88.
El estudio prequirúrgico minucioso de la TC y de la ecocardiografía transtorácica es fundamental de cara a identificar la puerta de entrada, los diámetros aórticos en cada segmento, las luces verdadera y falsa y los datos de hipoperfusión periférica para una adecuada planificación quirúrgica. Aun así, el contexto clínico de cada paciente, la infraestructura disponible y la experiencia del cirujano determinan, en último lugar, la técnica más adecuada a aplicar89.
La mortalidad actual de la DA, incluso en las mejores manos86, es aproximadamente del 20%, dependiendo fundamentalmente de la técnica quirúrgica necesaria y de la selección de los pacientes83. Aunque la mortalidad quirúrgica inicial es alta, la supervivencia a largo plazo en los pacientes que sobreviven a la cirugía es excelente, siendo aproximadamente del 90% a los 3años. A los 10años la tasa de supervivencia y libertad de eventos secundarios a la DA representa alrededor de un 50%, con un índice de reintervención del 18 al 22%.
Estudios recientes han identificado variables que predisponen a un mal resultado a largo plazo tras la intervención quirúrgica de la DA tipo A, tales como90:
- 1.
Hipertensión arterial previa y diámetro de la aorta torácica descendente superior a 35mm91.
- 2.
Persistencia de permeabilidad en la falsa luz92,93, bien por una resección incompleta de la puerta de entrada principal o por la existencia de otras puertas de entrada secundarias (parece que la presencia de una luz parcialmente trombosada representa un factor pronóstico peor que la persistencia de la falsa luz permeable94).
- 3.
Diámetro de la falsa luz en la aorta descendente superior a 22mm95.
- 4.
Desgarro principal superior a 10mm.
Tras todo lo expuesto, los objetivos principales en la cirugía de la DA tipoA son tres:
- 1.
Reinstaurar el flujo a través de la luz verdadera.
- 2.
Eliminar el desgarro (puerta de entrada) principal.
- 3.
Restablecer la anatomía de la raíz y la competencia de la válvula aórtica.
Distintas técnicas quirúrgicas se pueden realizar para sustituir la aorta afectada, pero todas tienen por objetivo sustituir la zona de la aorta en la cual se encuentra el desgarro intimal (puerta de entrada principal). La aplicación de la técnica específica depende de la ubicación de la disección y de la puerta de entrada, de su extensión en la aorta y de la afectación o no de la VAo96.
El tipo de cirugía a practicar depende tanto de factores propios del paciente —edad, estado general previo a la cirugía, comorbilidades— como de la experiencia del equipo quirúrgico.
Ha llegado el momento de la toma de decisión respecto a la técnica a utilizar.
- a)
Anastomosis aórtica distal
Cuando la puerta de entrada se sitúa en la aorta ascendente (hasta el 70% de los casos) y el diámetro del arco aórtico es normal, la sustitución de aorta ascendente «a cielo abierto» es la técnica de elección.
Cuando la puerta de entrada se extiende hasta el arco aórtico y/o la aorta descendente, la cirugía no debe limitarse a la aorta ascendente. Debemos abrir e inspeccionar el arco aórtico, y la anastomosis distal debe realizarse con las mayores garantías posibles.
En la mayoría de las ocasiones es suficiente con el reemplazo del hemiarco aórtico, con buenos resultados a largo plazo. De hecho, tras una intervención exitosa de este tipo, la tasa de reintervención por progresión de la enfermedad a los 10años (en los casos no complicados) se sitúa en torno al 5% según las series de Cleveland97 y Yale98, con un crecimiento promedio del diámetro aórtico de 0,26cm/año, es decir, comportándose de una manera relativamente benigna tras la primera intervención.
La necesidad de realizar sustitución completa del cayado aórtico en el mismo acto quirúrgico es motivo de debate en la actualidad, debido al considerable incremento en morbimortalidad del procedimiento respecto a la sustitución de aorta ascendente aislada, así como a la mayor dificultad técnica del mismo (constituyendo en ocasiones un verdadero desafío quirúrgico). Antes de tomar la decisión, debemos conocer que existen signos de mal pronóstico que orientarían hacia un manejo más intensivo de la lesión aórtica, aconsejando una sustitución completa de cayado, entre los que se encontrarían88:
- 1.
Aneurisma de cayado aórtico preexistente >50mm.
- 2.
Puerta de entrada principal localizada en el cayado aórtico distal (no abordable mediante una exclusión tipo «hemiarco» convencional).
- 3.
Desgarro intimal secundario con una longitud >10mm.
- 4.
Signos clínicos evidentes de isquemia visceral.
- 5.
Signos radiológicos de isquemia visceral potencial.
- 6.
Diámetro de la falsa luz >22mm.
- 7.
Diámetro de la aorta torácica descendente >35mm.
Algunos grupos más experimentados recomiendan la sustitución completa del arco solo en pacientes determinados, y fundamentalmente si el arco aórtico tiene un diámetro >4cm o cuando con la técnica del hemiarco no se pueda resecar completamente la puerta de entrada99 (principalmente si esta afecta al origen de los troncos supraaórticos). De hecho, el grupo de la Universidad de Calgary en Canadá, tras una revisión sistemática y un metaanálisis, propone una clasificación en cuatro grupos para facilitar la comparación de resultados a corto y a largo plazo de las diferentes técnicas quirúrgicas de la reparación del arco aórtico100. El Canadian Thoracic Aortic Collaborate (CTAC) recomienda sustitución del arco cuando su diámetro es >45mm en pacientes jóvenes con trastornos del tejido conectivo101.
Para la reparación quirúrgica del arco aórtico puede ser suficiente la «técnica de pastilla», que incluye los tres troncos o la necesidad de un injerto bi o trifurcado, principalmente en el caso de disección de los troncos supraaórticos.
Hay que tener en cuenta que estas técnicas esencialmente convierten la DA tipoA en una disección crónica tipoB, y por ello, aunque esto elimina el riesgo de complicaciones cardiacas y taponamiento, persiste el potencial de la isquemia de los órganos, particularmente del hígado y de los intestinos.
Tratamos de adelantarnos a las posibles complicaciones futuras mediante la técnica de «trompa de elefante», desarrollada para reemplazar el arco aórtico y preparar para el futuro el reemplazo de la aorta descendente. Tras el remplazo completo del arco, dejamos una prótesis de dacrón que cuelga en la aorta descendente102, facilitando el reemplazo de la aorta descendente en una operación posterior o proporcionando un buen asiento para una endoprótesis si fuese necesario (por aumento de los diámetros o por isquemia). Aunque esta técnica es ampliamente utilizada en cirugía de aneurisma aórtico y disección crónica, su valor durante la cirugía de la DA en términos de mejora de la mortalidad hasta el momento no ha sido comprobado, por lo que únicamente debería ser considerada en pacientes con muy alto riesgo de dilatación posterior (principalmente jóvenes con conectivopatías).
En un intento de reducir el tiempo de intervalo entre el primer y el segundo procedimiento se ha desarrollado la técnica de «trompa de elefante congelada»103. El arco aórtico se sustituye por un injerto combinado: un tubo de dacrón directamente conectado con un stent endovascular integrado que se despliega de manera anterógrada en la aorta descendente, mientras que el arco aórtico se sustituye completamente98.
Otro aspecto a tener en cuenta son las disecciones retrógradas, que representan un 7% del total, con puerta de entrada en aorta descendente, que progresan al cayado aórtico solamente o incluso a cayado y aorta ascendente. En un estudio multicéntrico de Nauta et al.104 se concluye que este tipo de disecciones presentan menos complicaciones neurológicas y menor posibilidad de ruptura, sobre todo si solo afectan al arco, por lo que su tratamiento puede ser más conservador.
Sea cual sea la técnica a utilizar, es de suma importancia en este tipo de aortas mantener la mayor cantidad posible de adventicia y atravesar toda la pared aórtica en ángulo recto, evitando desgarros y/o dislaceraciones, realizando la sutura con la mayor delicadeza, con una sutura de monofilamento con la aguja más fina posible y, a criterio del cirujano, reforzada con una franja de dacrón, politetrafluoroetileno o pericardio bovino con el objetivo de impedir la necesidad de «puntos extra» posteriormente.
Tras la finalización de la anastomosis distal —sea cuál sea— se procede al despinzamiento de los troncos supraaórticos, restauración del flujo total, extracción de aire y repinzamiento a nivel del tubo de dacrón. Tras ello, comprobamos la estanqueidad de la sutura.
Algunos cirujanos se decantan por el uso de «pegamentos», que en todo caso deben ser utilizados con cautela. Se han utilizado en la clínica fundamentalmente tres: Gelatine-resorcin-formalin (GRF) que aparece en 1977; Fibrin glue (FG), en 1991, y BioGlue, en 1997. Cada pegamento quirúrgico tiene sus propios beneficios e inconvenientes. Los beneficios en DA parece que pueden superar sus potenciales riesgos. La fuerza adhesiva de FG es obviamente menor que la de GRF o BioGlue, pero en su beneficio se puede decir que no ha habido informes de eventos tóxicos en la reparación de las aortas disecadas. Por otra parte, la toxicidad del BioGlue parece menor que la del GRF105. El entusiasmo inicial por los pegamentos biológicos ha disminuido tras describirse casos de necrosis de pared, fallo de sutura y formación de seudoaneurismas106.
- b)
Anastomosis aórtica proximal
El riesgo de dilatación de la raíz aórtica a medio-largo plazo y la complejidad de una reintervención sobre dicha zona debe marcar la actuación inicial sobre la raíz.
Si la raíz aórtica no está dilatada, la puerta de entrada no está en dicha zona (el 70% de las puertas de entrada se localizan en aorta ascendente) y la VAo está intacta (o únicamente distorsionada por el flap aórtico), puede realizarse una sustitución de la aorta ascendente suprasinusal, con o sin resuspensión de la válvula aórtica, puesto que es una técnica con menor riesgo quirúrgico.
Los principales mecanismos que generan regurgitación aórtica son la regurgitación central por dilatación de la raíz, el prolapso de alguno de los velos o la inversión de un flap intimal que se interpone en el plano de coaptación valvular, siendo la válvula aórtica estructuralmente normal hasta en un 70%107. Salvo la última situación (que se soluciona per se con la sustitución de la aorta ascendente), puede ser necesario algún tipo de actuación sobre la válvula aórtica o la raíz.
Debemos valorar la sustitución de la raíz aórtica en pacientes jóvenes, especialmente si presentan enfermedad del tejido conectivo (como síndrome de Marfan, síndrome de Ehlers-Danlos), puesto que presentan riesgo de dilatación de la raíz a medio plazo. Si se objetiva dilatación de la raíz aórtica con anulectasia, pero las cúspides de la VAo están intactas, se recomienda una cirugía de sustitución de aorta ascendente completa con preservación valvular aórtica (tipo David) en centros con amplia experiencia en estas técnicas86-88. Incluso en pacientes con insuficiencia valvular aórtica severa, la válvula nativa puede ser preservada89,90 principalmente si se asocia a anulectasia aórtica.
En casos de afectación estructural de la VAo o en centros sin experiencia en técnicas de preservación de la válvula aórtica, debemos también sustituir la válvula, generalmente por un conducto valvulado biológico o mecánico. En este sentido, la sustitución por una raíz biológica aórtica debe ser considerada porque presenta buenos resultados hemodinámicos108 y excelentes resultados quirúrgicos109, aunque hay que considerar la edad del paciente, ya que una posible reoperación por disfunción de la prótesis biológica supone una intervención de alto riesgo. Las indicaciones sobre prótesis mecánica o biológica deben ser superponibles a las que se utilizan para la cirugía convencional.
- c)
Tratamiento endovascular complementario
A pesar de realizar una técnica quirúrgica en la que se incluya toda la puerta de entrada principal, persiste poscirugía una disección de aorta residual en aorta descendente nada desdeñable en un 64-90%110-113.
El tratamiento endovascular completo de la DA tipo A se ha realizado en cirugía experimental, pero actualmente no debe ser la norma en la práctica clínica. Por ello el tratamiento endovascular debe ser considerado cuando persisten signos de malperfusión distal o cuando el crecimiento de la aorta residual aconseja su tratamiento.
En el caso del síndrome de isquemia causado por obstrucción dinámica de la luz verdadera por un flap intimal después de la cirugía convencional de la DA tipoA, la fenestración percutánea puede ser útil para restablecer la comunicación entre la luz verdadera y la falsa. No es raro que sea necesario colocar un stent endovascular para aliviar la isquemia persistente114.
Aneurismas de aorta ascendente y arco aórtico1. Vías de abordaje
Consideramos la esternotomía media como la técnica de elección para la reparación de los aneurismas de la aorta ascendente y del arco aórtico. Dicha esternotomía puede extenderse con una cervicotomía derecha, izquierda o ambas.
Existen otras vías de abordaje que pueden ser útiles en algunas situaciones:
- -
Esternotomía media con toracotomía izquierda: se realiza para poder realizar una reparación distal al arco. Hoy en día se prefiere realizar la reparación en dos tiempos para disminuir la mortalidad y las complicaciones.
- -
Esternotomía media con laparotomía.
- -
Toracotomía derecha: solo utilizada en las variantes de arco aórtico derecho.
- -
Clamshell: técnica útil para la cirugía compleja del arco y también para la reparación en un tiempo de un aneurisma de arco y de aorta torácica.
- -
Toracotomía izquierda y toracofrenolaparotomía: es útil en afectación del arco distal y la aorta torácica o toracoabdominal. Para actuar sobre el arco mediante este acceso se requiere PCT con hipotermia profunda o hipotermia moderada con perfusión cerebral anterógrada. La actuación sobre la aorta ascendente con este acceso es complicada.
En los últimos años, algunos centros incluso realizan estas intervenciones mediante miniaccesos; no obstante, dada la transcendencia de la cirugía, la mayoría de equipos prefieren un acceso completo a fin de sortear cualquier eventualidad a cambio de un mínimo impacto estético.
2. Vías de establecimiento de CEC y tipos de CEC
Vías de establecimiento de la CEC:
- •
Canulación arterial: existen diferentes accesos vasculares por los que realizar la canulación arterial para establecer la CEC. Cada uno puede tener su utilidad y ser preferible a otro acceso según el escenario al que nos enfrentemos.
- ∘
Canulación de la aorta ascendente: útil en aquellos casos en los que se realiza de forma simultánea la reparación de aneurisma de aorta ascendente y arco. No sería recomendable en los casos de disección aguda de aorta, a excepción de que se realice la canulación tipo samuray, que supone una canulación aórtica transapical en caso de imposibilidad de canulación aórtica o periférica.
- ∘
Canulación del arco aórtico: útil en aquellos casos en los que el aneurisma se extiende a la aorta ascendente±raíz aórtica, pero sin afectar al arco y tenemos suficiente cuello para realizar el pinzamiento aórtico.
- ∘
Canulación del tronco braquiocefálico: misma utilidad que la anterior pero cuando no tenemos cuello para realizar el pinzamiento y/o queremos evitar la disección de la arteria subclavia derecha. Habitualmente se realiza mediante la interposición de una prótesis vascular de dacrón de 8mm.
- ∘
Canulación de la arteria subclavia/axilar derecha: de elección en casos de disección aguda de aorta. Se puede realizar de manera directa o mediante la interposición de una prótesis vascular de dacrón de 8mm.
- ∘
Canulación de la arteria femoral: útil para establecer la circulación extracorpórea antes de realizar la esternotomía (p.ej., cuando se sospecha rotura aórtica en una disección o en las reintervenciones si la aorta está en contacto con el esternón).
- •
Canulación venosa: el drenaje venoso del corazón se realiza habitualmente con cánula única, a excepción de la existencia de procedimientos concomitantes que requieran una doble canulación. Habitualmente se procede a la canulación de la aurícula derecha. En los casos en que sea recomendable iniciar la circulación extracorpórea antes de realizar la esternotomía, podemos utilizar la vena femoral.
3. Técnicas quirúrgicas posibles
La finalidad de la cirugía reparadora de la aorta ascendente y del arco aórtico es restablecer los diámetros normales de la aorta para evitar las complicaciones derivadas de su aumento de tamaño.
La elección de la técnica dependerá de las zonas anatómicas de la aorta que estén afectadas.
a) Aorta ascendente
En los casos en los que la afectación anatómica esté limitada a la porción de la aorta comprendida entre la unión sinotubular y el inicio del cayado aórtico, podemos optar por un reemplazamiento simple de la aorta ascendente o técnica de Wheat.
Cuando el aneurisma se extiende a la raíz aórtica deberemos optar por técnicas que conserven la válvula aórtica, siempre y cuando esto sea factible. La válvula aórtica bicúspide no es una contraindicación para realizar una técnica conservadora.
El abanico de técnicas disponibles se expone en el gráfico de la figura 9.
A continuación procederemos a detallar cada una de las técnicas115.
- -
Sustitución de la aorta ascendente o técnica de Wheat. Tras el establecimiento de la CEC se procede a la disección de la aorta ascendente. Tras el pinzamiento y la administración de cardioplegia (por raíz o por ostia coronarios en función de la existencia o no de insuficiencia aórtica) se procede a la resección de la aorta ascendente desde la unión sinotubular hasta el arco proximal. Se realiza la sutura proximal de la aorta a la prótesis vascular con sutura continua de polipropileno 4/0 usando o no refuerzo con bandeleta de teflón o pericardio según la calidad del tejido. Posteriormente se realiza la sutura distal del mismo modo que la proximal. Finalmente se finaliza la isquemia cardiaca y se procede a la salida de la CEC. El orden de las anastomosis puede invertirse en los casos de disección aguda de aorta en los que se opte por no pinzar la aorta y se realice una exploración del arco aórtico a cielo abierto.
- -
Técnica de Bentall de-Bono. Tras el establecimiento de la CEC se procede a la disección de la aorta ascendente. Tras el pinzamiento y la administración de cardioplegia (por raíz o por ostia coronarios en función de la existencia o no de insuficiencia aórtica) se procede a la resección de la aorta ascendente, la raíz y la válvula aórtica con preparación de los botones de los ostia coronarios. Primeramente se realiza la sutura de la prótesis vascular valvulada al anillo valvular aórtico con puntos de poliéster trenzado 2/0 reforzados con teflón. Seguidamente se realiza la anastomosis de los ostia coronarios a la prótesis con sutura continua de polipropileno 5/0 o 6/0, iniciando por el ostium izquierdo habitualmente. Finalmente realizaremos la anastomosis distal a la aorta con sutura continua de polipropileno 4/0 reforzada o no con bandeleta de teflón o pericardio. Tras completar las suturas se despinza la aorta y se procede a salir de CEC. La elección de la prótesis vascular con prótesis mecánica o biológica dependerá de las características del paciente.
- -
Técnica de Cabrol. Esta técnica es igual a la anterior, con la salvedad de que los ostia coronarios no se reimplantan directamente a la prótesis vascular valvulada por la imposibilidad de movilizarlos (ya sea por grandes aneurismas o por reintervención). En este casos, tras completar la anastomosis proximal al anillo aórtico se procede a conectar los ostia coronarios con una prótesis de dacrón de 8mm. Tras la finalización de la sutura distal se procede a realizar la anastomosis de la prótesis de dacrón que interconecta los ostia coronarios a la prótesis vascular valvulada.
- -
Técnica de Yacoub o remodelado. En esta técnica se reseca la aorta ascendente y la raíz, dejando un centímetro de pared aórtica superior a la inserción de los velos aórticos. Para la realización de la anastomosis proximal de debe preparar la prótesis vascular de dacrón con tres faldones que correspondan con los senos de Valsalva. Tras la preparación de la prótesis se procede a su sutura al remanente de pared aórtica con sutura continua de polipropileno 4/0. Seguidamente se reimplantan los ostia coronarios y finalmente se realiza la sutura distal. En los pacientes con anuloectasia o con conectivopatías se recomienda realizar también una anuloplastia aórtica para la estabilización del anillo y evitar futuras dilataciones que acarreen la reaparición de la insuficiencia aórtica y reintervenciones.
- -
Técnica de David o reimplante. Existen múltiples variaciones de la técnica de David. La gran diferencia de esta técnica con la anterior es que se realiza una doble sutura a nivel de la raíz aórtica. Una primera sutura con puntos en U de poliéster trenzado 2/0 reforzados con teflón justo inmediatamente inferior a la inserción de los velos valvulares. Esta primera sutura tiene como finalidad la estabilización del anillo. La segunda sutura es hemostática y une el remanente de pared aórtica a la prótesis vascular de dacrón con una sutura continua en zigzag en cada seno de polipropileno 4/0. En este momento es importante la altura a la cual se reimplantan las comisuras de los velos dentro de la prótesis vascular. Antes de proseguir con la intervención se deben inspeccionar los velos aórticos para garantizar su coaptación, y si no es así, realizar técnicas accesorias sobre los mismos para lograrla. Tras realizar las suturas proximales y garantizar la coaptación aórtica se procede a la sutura de los ostia coronarios y, finalmente, la anastomosis distal.
- -
Técnica de Ross. Esta técnica fue diseñada inicialmente para niños, pero en las últimas décadas también se ha utilizado para adultos jóvenes que querían evitar la anticoagulación. En esta técnica, tras instaurar la circulación extracorpórea se disecan la aorta ascendente y la arteria pulmonar. Seguidamente se pinza la aorta y se procede a la resección de la zona aneurismática de la aorta (raíz ±aorta ascendente) y la válvula aórtica. Se preparan los botones coronarios. A continuación se reseca el tronco de la arteria pulmonar con la válvula pulmonar, teniendo especial cuidado en no dañar ninguna arteria coronaria septal. Este será nuestro injerto para reparar el aneurisma aórtico. El orden las anastomosis sería igual al de las técnicas anteriores: proximal, ostia coronarios y distal. Tras reparar la aorta nos dispondremos a solucionar la discontinuidad de tejido entre el ventrículo derecho y las arterias pulmonares. Para ello se dispone de diversos injertos (homoinjerto, yugular bovina, prótesis de dacrón…), y el orden de las suturas en este caso será primero la distal y después la proximal.
b. Arco aórtico
Existen múltiples técnicas para la reparación de la patología del arco, dependiendo de la extensión, del tipo de lesión y de la preferencia del equipo quirúrgico.
Ante cualquier cirugía de arco hemos de plantearnos la estrategia de reparación para intentar minimizar la isquemia corporal, la isquemia cardíaca y la «isquemia» cerebral116,117. Existen diferentes estrategias:
- -
Distal first (distal primero) o enfoque tradicional, en el que tras la entrada en CEC y el enfriamiento sistémico se procede a la parada. En este caso se realiza primero la sutura distal y después la proximal. Finalmente se reimplantan los TSA durante el recalentamiento.
- -
Arch first. En esta técnica primero se reimplantan los TSA, después se realiza la sutura distal y finalmente la proximal durante el recalentamiento.
- -
Proximal first. En este caso se realiza la reparación proximal durante el enfriamiento del paciente con pinzamiento aórtico provisional que se retira para realizar la parada y proceder a la sutura de distal y de los TSA. Esta última durante el recalentamiento.
En nuestro centro la práctica habitual es la estrategia distal first en el caso que solo se vaya a actuar sobre el arco ±la aorta descendente, y la técnica proximal first si tenemos que actuar sobre la raíz aórtica y/o la válvula aórtica.
La sustitución del arco puede ser parcial (hemiarco) o total. En el caso de la sustitución total del arco, un punto que ha cambiado en los últimos años es la zona de la aorta donde se realiza la anastomosis distal. Tradicionalmente se realizaba la sutura a nivel de la zona3 (distal a la arteria subclavia izquierda), pero últimamente se está realizando en la zona2 (entre la arteria carótida izquierda y la subclavia izquierda). Las ventajas de este método son que la zona de anastomosis está más accesible, por lo que es más fácil la sutura, y ello redunda en un menor tiempo de parada circulatoria y también en que facilita la hemostasia posterior. En cuanto a los inconvenientes de esta variante, está que hace imposible la reimplantación de los TSA en bloque y que plantea diversas opciones de cómo realizar la revascularización de la arteria subclavia izquierda.
Sustitución de hemiarco. Es el procedimiento más sencillo en el abordaje del arco aórtico, ya que consiste en la resección de la curvatura menor del mismo sin actuar sobre los troncos supraaórticos.
Está indicada cuando el aneurisma de aorta ascendente se extiende hasta la parte proximal del arco y es técnica habitual en las disección aguda de aorta tipoA con puerta de entrada en la aorta ascendente e integridad de la íntima a nivel del arco.
A pesar de ser la técnica más sencilla, la anastomosis distal requiere ser realizada de forma abierta, por lo que será preciso una parada circulatoria, que puede ser en hipotermia profunda o en hipotermia moderada con perfusión cerebral anterógrada. Esta última de elección.
Sustitución de arco completo. La sustitución completa del arco la realizamos cuando este está afectado hasta nivel de la subclavia izquierda. La etiología en estos casos suele ser un aneurisma crónico degenerativo o aterosclerótico, pseudoaneurisma o disección crónica118,119.
En la sustitución completa del arco debemos estar atentos a no dañar estructuras nerviosas que se encuentran en la zona (nervio frénico, nervio vago y nervio recurrente).
Reimplante en bloque de los TSA o técnica de isla. Podemos optar por esta técnica cuando el origen de los TSA no esté afectado por el proceso subyacente. No es recomendable realizarla si el paciente está afecto de conectivopatía.
En esta ocasión se reseca por completo el arco conservando la unidad de los TSA en su origen. La sutura distal debe realizarse en zona3.
Reimplante individual de los TSA. Técnica recomendada en caso de pacientes con conectivopatía o si el origen de los TSA está afectado. En esta técnica se utilizan prótesis de dacrón con ramas de diferente tamaño que permiten la anastomosis individualizada de cada tronco de forma más fácil.
En esta técnica, descrita por Kazui, primero se realiza la sutura distal con parada circulatoria en hipotermia moderada y con perfusión cerebral anterógrada. Tras realizar esta sutura se reinicia la circulación sistémica y se inicia el calentamiento mientras se procede a la sutura proximal en aorta ascendente y posteriormente los TSA. Antes de realizar la sutura de los TSA se procede a despinzar la prótesis para finalizar la isquemia cardiaca.
El orden de reimplante de los TSA es habitualmente: arteria subclavia izquierda, arteria carótida izquierda y tronco braquiocefálico. En los casos en que la anastomosis distal se realice en zona2 se puede plantear realizar una revascularización extraanatómica de la arteria subclavia izquierda. Si ello es así se procederá a su ligadura a nivel de su origen, y la anastomosis distal se realizará una vez finalizada la CEC, sin protaminizar, a nivel subclavio.
Otra forma alternativa de realizar esta cirugía fue descrita por Spielvogel en 2002 y consiste en la utilización de un injerto trifurcado. Esta técnica debe realizarse en parada circulatoria con hipotermia profunda como única técnica de protección cerebral, y se procede mediante una estrategia de proximal a distal. Primero se realiza la anastomosis proximal. Después se establece la parada circulatoria y se realizan las anastomosis de cada tronco con su correspondiente rama del injerto trifurcado para iniciar perfusión cerebral al terminar. Posteriormente se realiza la anastomosis distal y finalmente el injerto trifurcado a la prótesis de aorta ascendente.
Sustitución de arco con trompa de elefante120. La sustitución del arco con trompa de elefante se realizará cuando se quiera actuar en un segundo tiempo sobre la prolongación del aneurisma más allá de la arteria subclavia izquierda, ya sea de forma endovascular o de forma abierta.
Podemos diferenciar entre la trompa de elefante clásica, que se realiza con la misma prótesis de dacrón invaginándola a nivel de la sutura distal y posteriormente extendiéndola unos 7-10cm en la aorta torácica proximal (no más larga para disminuir el riesgo de paraplegia), y la trompa de elefante congelada, en la que la prótesis que se introduce en la aorta torácica presenta un stent, lo que le da firmeza.
La elección de una prótesis de dacrón o una prótesis con stent dependerá de factores del paciente, de la patología subyacente y del plan previsto para reparar el aneurisma de la aorta torácica. En general, en los pacientes con conectivopatías se recomienda la trompa de elefante clásica. La trompa de elefante congelada se realiza en cualquier otra etiología del aneurisma, y también cuando se planea una reparación endovascular posterior. Cabe resaltar que la realización de una trompa de elefante congelada no contraindica la cirugía abierta en un segundo tiempo.
En la actualidad existen injertos con «collar» que facilitan la realización de la anastomosis distal cuando existe desproporción entre el muñón aórtico y la prótesis.
En estos casos la reimplantación de los TSA en bloque o de forma individualizada dependerá del tipo de prótesis seleccionada para la reparación. En los casos de reimplantación individualizada podemos realizar la anastomosis distal en zona2 y valorar la técnica para la reimplantación de la adteria subclavia izquierda.
Otra decisión importante en los casos de disección crónica es si se redirige todo el flujo a la luz verdadera o si se realiza a dos luces. En el segundo caso habrá que resecar parte de la membrana para asegurar el flujo que deseamos. La elección de uno u otro tipo dependerá de la extensión de la disección y del origen de los troncos viscerales y renales en la luz verdadera o falsa.
PostoperatorioDada la complejidad del mismo, no podemos más que hacer hincapié en tres puntos: un exquisito control de la PA, del sangrado, e intentar una valoración neurológica precoz. El resto de consideraciones no difiere mucho del de otros procedimientos de cirugía cardiaca y no se describirán en esta guía.
- -
Manejo de fármacos inotrópicos y/o vasoactivos, así como de fármacos para el control de la PA (esmolol, clevidipino, urapidilo) según necesidades del paciente para mantener una buena presión de perfusión visceral optimizando la precarga y guiados por la monitorización escogida (monitores de gasto cardiaco o de contorno de pulso/ecocardiografía transtorácica), para mantener una PAS <100-120mmHg para favorecer la hemostasia de las suturas.
- -
Valoración neurológica precoz.
- -
Control de la hemostasia con TEG/ROTEM y protocolos de transfusión/revisión quirúrgica según resultados y sangrado a través de los drenajes pericárdicos/pleurales.
- -
Adecuado control del dolor según los protocolos de manejo de dolor agudo hospitalarios.
- -
Control de la temperatura corporal y tratamiento de la hipertermia.
En caso de cirugía endovascular de arco aórtico, el manejo postoperatorio dependerá de la evolución, pero lo habitual es que el paciente ingrese consciente y extubado. Es necesaria una estrecha vigilancia neurológica durante las primeras horas. Es importante vigilar también la existencia de sangrados y hematomas en los abordajes del cuello por el posible compromiso de la vía aérea. Los requerimientos analgésicos no son grandes, y habitualmente la analgesia parenteral basada en analgésicos menores y opiáceos débiles puede ser suficiente. Si no existen complicaciones, se podría reintroducir medicación oral el mismo día de la cirugía y la estancia en la unidad será de 24 o 48h.
Conflicto de interesesEl Dr. Jacobo Silva es Editor-Jefe de la revista CIRUGÍA CARDIOVASCULAR.