El síndrome aórtico agudo tipo A abarca un grupo de patologías que tienen en común su presentación clínica y un mal pronóstico si no reciben un tratamiento oportuno. El tratamiento de elección es la cirugía urgente, y el gold standard es la sustitución de la aorta ascendente y del hemiarco, con anastomosis distal abierta en parada circulatoria. No obstante, en las últimas dos décadas la trompa de elefante congelada se ha convertido en la técnica de elección cuando existen criterios para sustituir el arco aórtico. El objetivo de este artículo es revisar la evidencia actual disponible al respecto, así como describir la técnica quirúrgica, los resultados perioperatorios y los resultados a largo plazo.
Type A acute aortic syndrome involves a group of pathologies with similar clinical presentation and poor prognosis if not opportunely treated. Urgent surgery is indicated and the gold standard for intervention consists in ascending and hemiarch aortic replacement with open anastomosis under circulatory arrest. Nonetheless, in the last two decades, the frozen elephant trunk has become the treatment of choice when criteria for aortic arch replacement are present. The goal of the present article is to review the current evidence, describe the surgical technique, perioperative results and long-term outcomes.
El síndrome aórtico agudo (SAA) abarca un grupo de patologías (disección aguda, hematoma intramural, disección incompleta y úlcera penetrante) que tienen en común su presentación clínica (el dolor aórtico) y el mal pronóstico, pues dejadas a su libre evolución pueden llevar a la rotura aórtica y a la muerte del paciente. Es poco frecuente pero con una elevada morbimortalidad, no solo por su propia historia natural sino también por la complejidad de su tratamiento1-3. En el SAA tipoA el tratamiento de elección es la cirugía urgente, considerándose como gold standard la sustitución de la aorta ascendente y parte del arco (hemiarco), con anastomosis distal abierta en parada circulatoria y perfusión cerebral anterógrada unilateral o bilateral. De esta manera abordamos las principales causas de muerte: la rotura de la falsa luz en la aorta ascendente, la malperfusión y la insuficiencia aórtica2,4.
La trompa de elefante congelada (frozen elephant trunk [FET]) con prótesis híbridas permite una reparación más extensa de la aorta en un solo tiempo, incluyendo el arco y la aorta descendente proximal. De esta forma excluye las reentradas en el arco y en la aorta descendente proximal, reexpande la luz verdadera corrigiendo la malperfusión y promueve la trombosis de la falsa luz distal, disminuyendo así la incidencia de eventos aórticos en el seguimiento2,5,6.
El objetivo de este artículo es revisar la evidencia actual disponible al respecto, así como describir la técnica quirúrgica, los resultados perioperatorios y los resultados a largo plazo.
El síndrome aórtico agudoSe trata de una patología poco frecuente, con una incidencia de 6-7 casos por 100.000 habitantes/año. La disección aórtica aguda es la patología más frecuente, siendo 2 de cada 3 de tipoA. Afecta con mayor frecuencia a los hombres, y su incidencia aumenta con la edad, siendo el principal factor de riego la hipertensión arterial. La historia natural del SAA tipoA es ominosa, estimándose que el 50% fallecen antes de llegar al hospital, y que de los que llegan, sin cirugía, hasta el 50% fallecen en las primeras 48horas, siendo las principales causas de muerte la rotura aórtica con taponamiento cardiaco y la malperfusión1,2,7.
Según el tiempo de evolución, el SAA se clasifica en agudo (menor o igual de 14días), subagudo (entre 15 y 90días) o crónico (>90días). El grupo del International Registry for Aortic Dissection [IRAD]) ha propuesto una clasificación que distingue una fase hiperaguda que corresponde a las primeras 24horas, y restringe la fase aguda a la primera semana3,7. La clasificación más utilizada desde el punto de vista anatómico es la de Stanford, pues es sencilla (A o B, según esté o no afectada la aorta ascendente) y tiene valor pronóstico y terapéutico8,9. No obstante, esta clasificación no considera el escenario donde existe afectación del arco aórtico sin afectación de la aorta ascendente, por lo que en 1994 Von Segesser et al.10 propusieron el término no-A no-B para los casos donde la zona de rotura intimal se encuentra en el arco o en la aorta descendente con afectación del arco de manera retrógrada. Desde un punto de vista clínico, la Universidad de Pennsylvania propone una clasificación que estratifica grupos de riesgo según la situación hemodinámica y la presencia de malperfusión11. Recientemente se ha propuesto la clasificación TEM (type, entry site, malpefusion), la cual integra los aspectos clínicos y anatómicos, describe mejor la extensión de la enfermedad, orienta sobre el procedimiento a realizar y tiene valor pronóstico12.
Resultados actuales de la cirugíaComo se ha señalado previamente, la técnica de elección en la mayoría de los pacientes es la sustitución de la aorta ascendente y la concavidad del arco aórtico proximal, realizando la anastomosis proximal en la unión sinotubular, resuspendiendo la válvula aórtica, y la anastomosis distal abierta en parada circulatoria con perfusión cerebral anterógrada. Se trata de una técnica sencilla y reproducible, considerada el gold standard para el tratamiento de esta patología. En registros nacionales contemporáneos la mortalidad perioperatoria oscila entre el 15 y el 25%, y la incidencia de ictus postoperatorio, entre el 11 y el 13%13-18.
¿Cuándo considerar la sustitución del arco en el SAA?En general aceptamos que la sustitución del arco puede plantearse en dos contextos clínicos en el seno del SAA: cuando se considera que es imprescindible para salvar la vida del paciente o cuando pueda disminuir la incidencia de eventos aórticos a medio/largo plazo19.
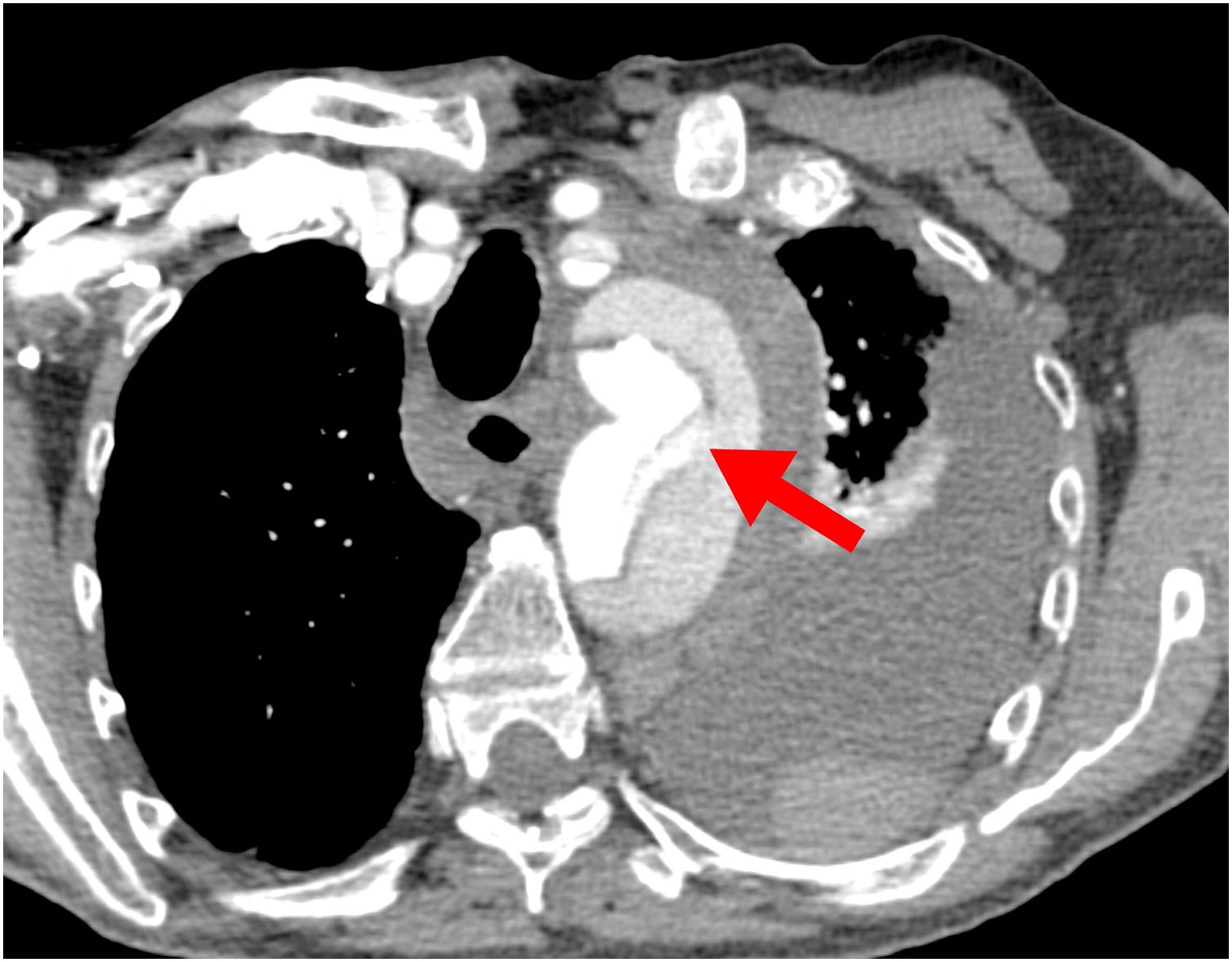
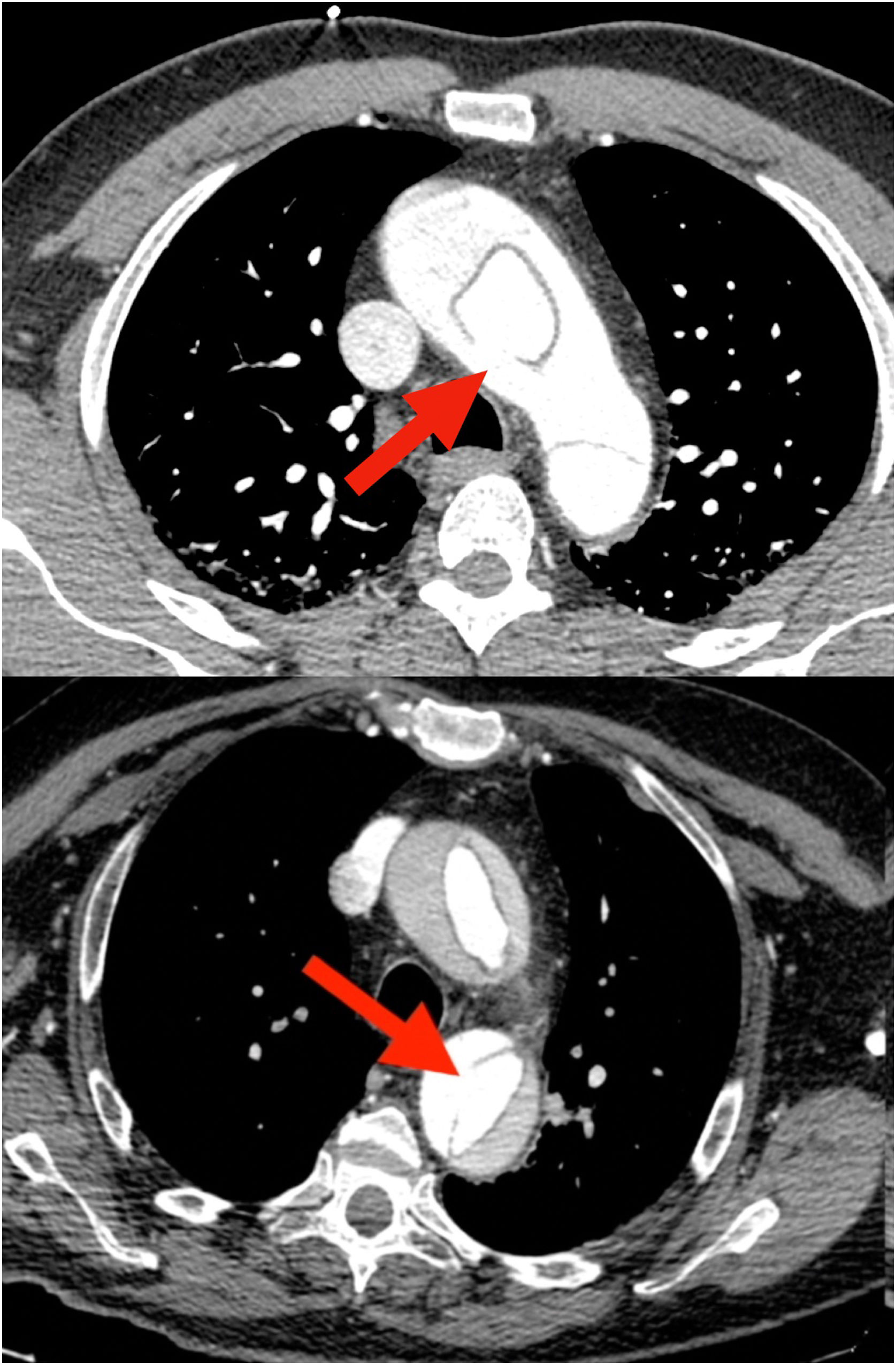
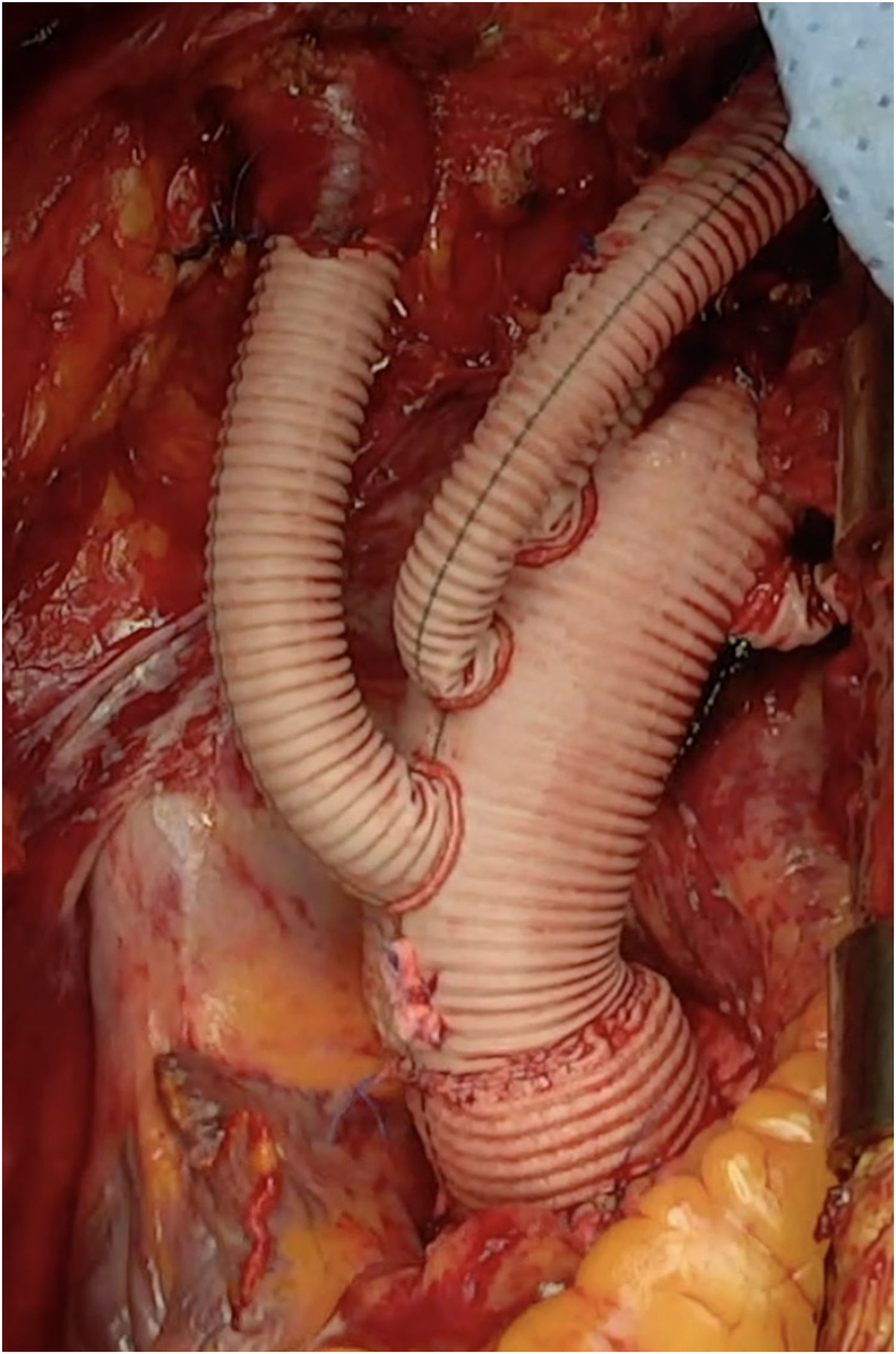
Probablemente la única situación en la que sea imprescindible para salvar la vida del paciente es cuando la falsa luz esté rota a nivel del arco, situación poco frecuente (figs. 1 y 2). Más frecuente es la presencia de malperfusión cerebral estática (por disección de uno o varios de los troncos supraaórticos, con oclusión de la luz verdadera) o de malperfusión visceral dinámica (por colapso de la luz verdadera, generalmente por reentradas en el arco o en la aorta descendente proximal). En estas dos circunstancias, aunque no es mandatorio, la sustitución del arco aórtico sí es la manera más eficaz de corregir la malperfusión20 (figs. 3 y 4).
Por otro lado, hay un subgrupo de pacientes donde, aunque la cirugía conservadora sería a priori la técnica de elección, una actitud agresiva sobre el arco aórtico puede disminuir la incidencia de eventos aórticos en el seguimiento. La literatura es contradictoria, pero existe consenso en aceptar que al menos debe plantearse en las siguientes circunstancias19-21:
- -
Rotura intimal o reentrada grande en el arco o aorta torácica descendente proximal.
- -
Dilatación del cayado o de la aorta torácica descendente proximal (>45mm).
Para indicar una cirugía más agresiva y técnicamente más compleja, además de las consideraciones anatómicas previamente reseñadas, deben tenerse en cuenta también las características basales del paciente (edad y comorbilidades asociadas, conectivopatía, historia familiar, sospecha de sustrato genético…), la situación clínica (ventilación mecánica preoperatoria, shock cardiogénico, fracaso renal, malperfusión…) y la experiencia del equipo médico-quirúrgico, con la finalidad de evaluar adecuadamente la relación riego/beneficio, sin olvidar que el objetivo principal de la intervención sigue siendo salvar la vida del paciente20-22.
La trompa de elefante congelada en el síndrome aórtico agudoLa reparación extendida de la aorta puede realizarse mediante la sustitución del arco con la técnica estándar, o mediante «trompa de elefante» clásica o congelada. La técnica de la trompa de elefante fue descrita originalmente por Borst en 1983 con el fin de facilitar el segundo tiempo en la patología extensa de la aorta toracoabdominal23-26. Con el desarrollo de técnicas endovasculares, en 1996 Kato et al.27 describieron la sustitución del arco combinando una prótesis convencional y una endovascular, denominando a esta técnica «trompa de elefante congelada». Posteriormente se han desarrollado prótesis híbridas que combinan una endoprótesis en el segmento distal y una prótesis convencional en la porción proximal, permitiendo una reparación extendida en una sola etapa de diversas patologías que involucran el arco aórtico28-31.
En el contexto del SAA, la FET es la técnica de elección para la sustitución del arco aórtico, ya que permite excluir las reentradas en el arco y la aorta descendente, promueve la expansión de la luz verdadera, la trombosis de la falsa luz, e induce un remodelado favorable de la aorta torácica32-35. Estas características hacen que su uso no esté restringido únicamente al SAA tipoA; en el tipo no-A no-B, y para los casos de tipoB con anatomía desfavorable para implante de endoprótesis (zona de anclaje proximal con diámetro >40mm, angulación del arco), imposibilidad de acceso vascular o disección de la arteria subclavia izquierda con reentradas distales que pudiesen mantener la luz falsa a pesar de un despliegue adecuado de la endoprótesis, la FET es una alternativa que no se ve limitada en estos escenarios36. Además, permite tratar patología concomitante de la aorta proximal en el mismo procedimiento, elimina el riesgo de endofuga tipo 1a, proporciona una zona de anclaje adecuada en caso de requerir un procedimiento en la aorta distal y, aunque es infrecuente, elimina el riesgo de disección retrógrada que puede ocurrir durante el implante de una endoprótesis37-39.
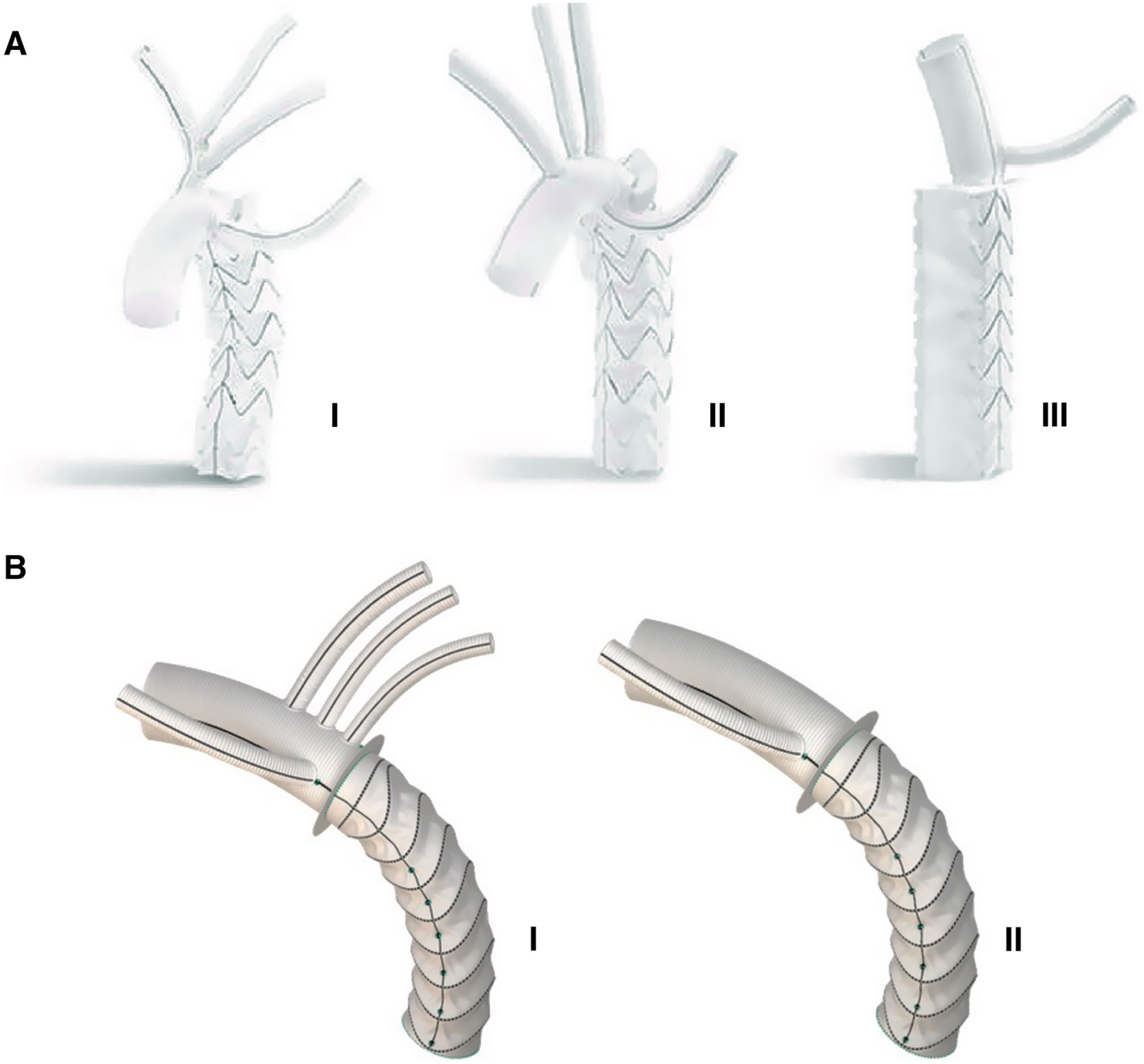
Las dos prótesis híbridas comercializadas en Europa en la actualidad son la prótesis Thoraflex (Vascutek,Terumo, Inchinnan, Reino Unido) y la prótesis E-Vita Open Neo (JOTEC, Hechingen, Alemania). Ambas prótesis tienen un diseño similar, con un injerto proximal y un stent distal de nitinol cubierto29,40. La prótesis E-Vita Open se ha desarrollado con tres configuraciones diferentes y la prótesis Thoraflex está disponible como tubo protésico y como prótesis ramificada (fig. 5). Ambas prótesis se encuentran disponibles en diferentes diámetros y longitudes tanto del stent como de la prótesis vascular y poseen un sistema de liberación que permite un posicionamiento y un despliegue sencillos y de manera controlada.
Consideraciones perioperatoriasLa parada circulatoria con hipotermia, conceptualizada por Bigelow et al. en 1950 y popularizada por R.B Griepp a mediados de la década de 1970, es un componente esencial en la cirugía del SAA. El implante de la FET es una técnica más agresiva asociada a mayor tiempo de circulación extracorpórea (CEC) y de parada circulatoria en comparación con la cirugía convencional, por lo que es clave tanto la selección de pacientes como una adecuada planificación preoperatoria para definir la estrategia quirúrgica más adecuada en función del perfil clínico y anatómico del paciente41,42.
Planificación preoperatoria. La tomografía axial computarizada (TAC)Un aspecto fundamental es dedicar un tiempo al análisis detallado de la angioTAC preoperatoria. Tenemos que decidir la estrategia de canulación y de protección cerebral, la zona de anastomosis distal, identificar la luz verdadera, la localización de la rotura intimal, las reentradas, la afectación o no de los troncos supraaórticos y valorar el riesgo de malperfusión, entre otros. Con respecto al tamaño de la prótesis a implantar, hay diversas formas de calcular el diámetro del stent a implantar (diámetro total, área de la luz verdadera…), pero el aspecto más importante es evitar su sobredimensionamiento, ya que puede causar nuevas reentradas (desgarro intimal distal inducido por el stent [dSINE]) y producir malperfusión visceral en el postoperatorio inmediato o remodelado negativo de la luz falsa en el seguimiento43-45.
Monitorización intraoperatoriaCon respecto a la monitorización intraoperatoria queremos destacar 4 componentes que consideramos claves: el ecocardiograma transesofágico (ETE), la medición de la saturación cerebral de oxígeno, la monitorización de la presión arterial y el tromboelastograma. El ETE nos permitirá evaluar la función ventricular, la presencia de derrame pericárdico, el grado de insuficiencia aórtica y su mecanismo, localizar la luz verdadera, posicionar las guías y la prótesis y valorar la reexpansión de la luz verdadera en la aorta torácica al finalizar el procedimiento. La monitorización continua de la saturación de oxígeno del tejido cerebral mediante espectroscopia de infrarrojo cercano (near-infrared spectroscopy [NIRS]) permite detectar precozmente el compromiso de la oxigenación cerebral. Ante disminuciones mayores del 20% con respecto a los valores basales, deben identificarse las diferentes causas posibles y resolverse inmediatamente (acodamiento de una cánula, flujo insuficiente, hipotensión, anemia, etc.)46. Monitorizar la presión arterial al menos a 2 niveles, e idealmente 3 (ambas radiales y una femoral) ayuda a controlar la perfusión sistémica durante la CEC y a detectar precozmente malperfusión regional. Por último, el importante consumo de factores de coagulación y de plaquetas asociado al SAA, junto con la hipotermia y la circulación extracorpórea, condicionan alteraciones severas de la hemostasia en la mayoría de los pacientes. El tromboelastograma nos permite el manejo dirigido de la coagulación durante todo el procedimiento, limitando la politransfusión y sus consecuencias deletéreas47,48.
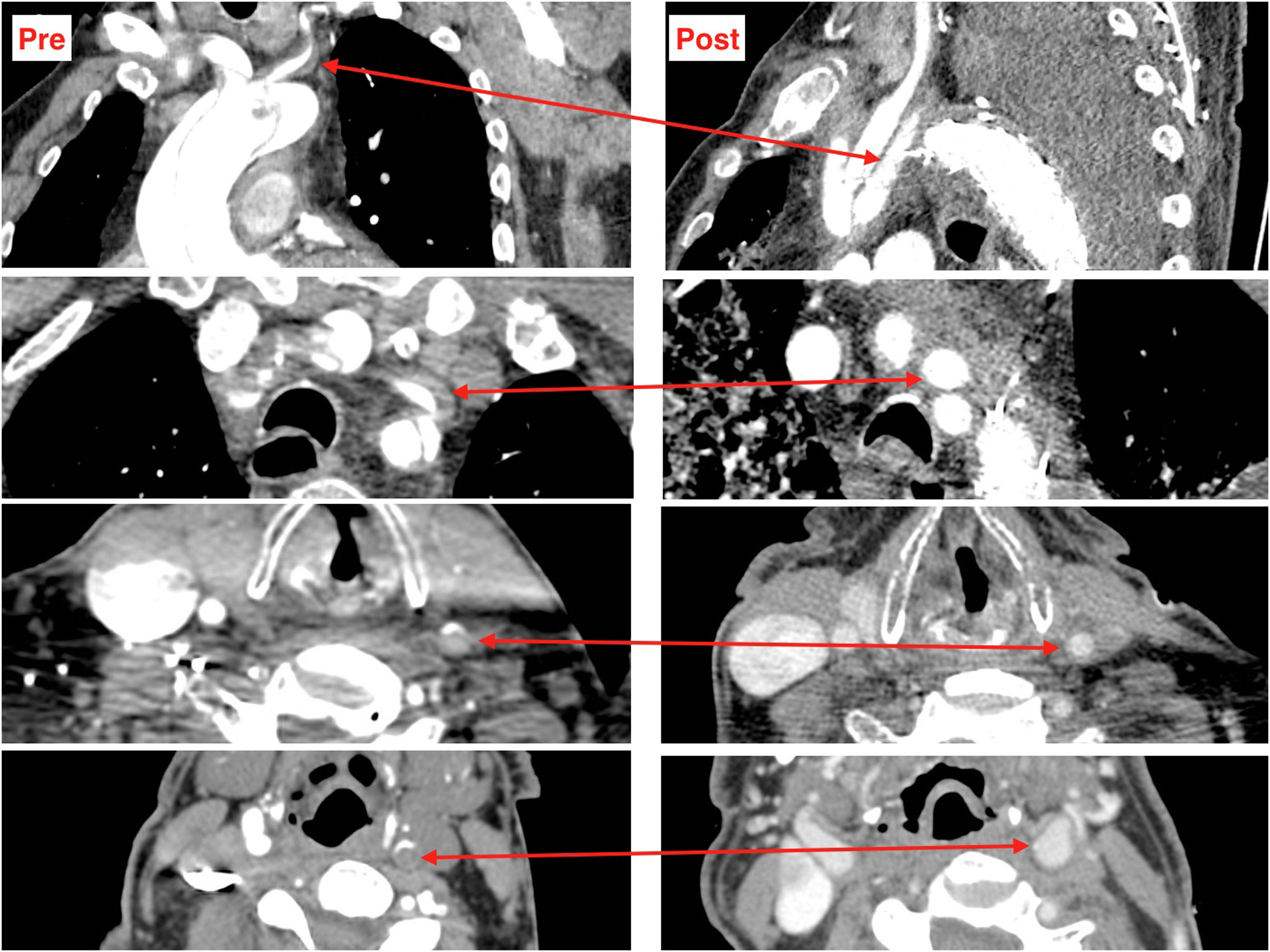
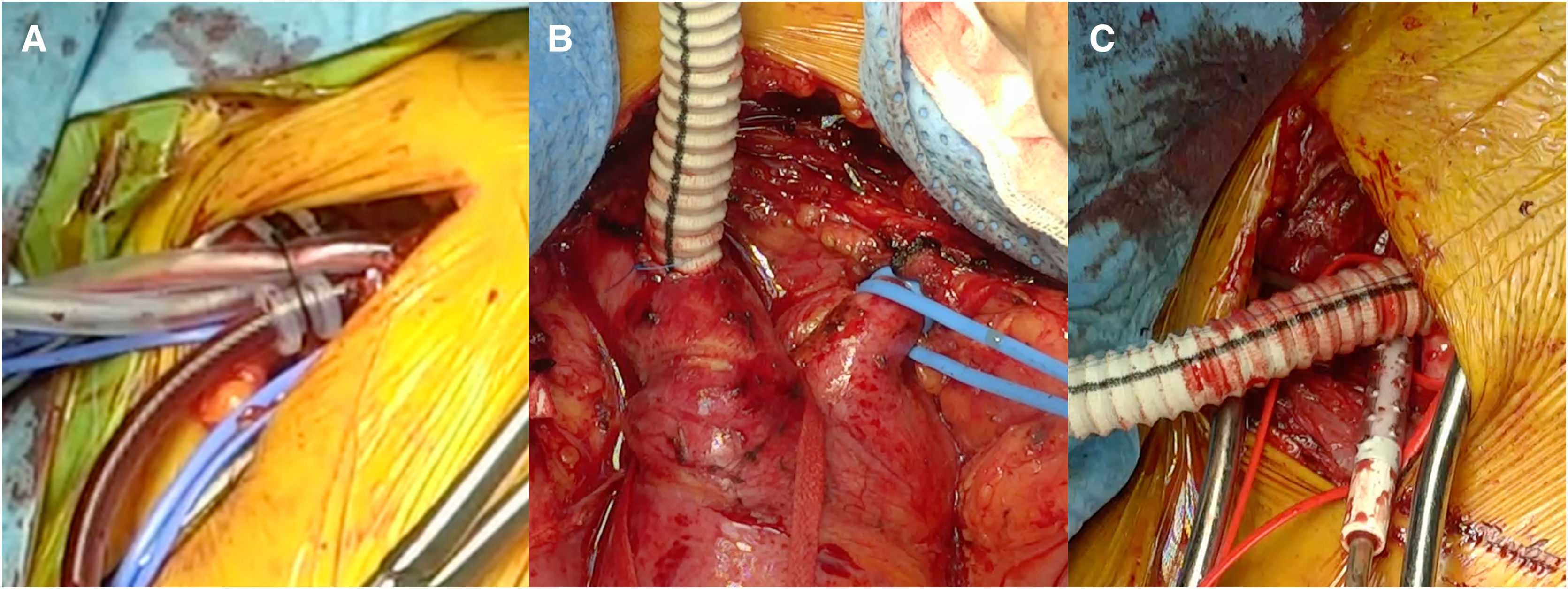
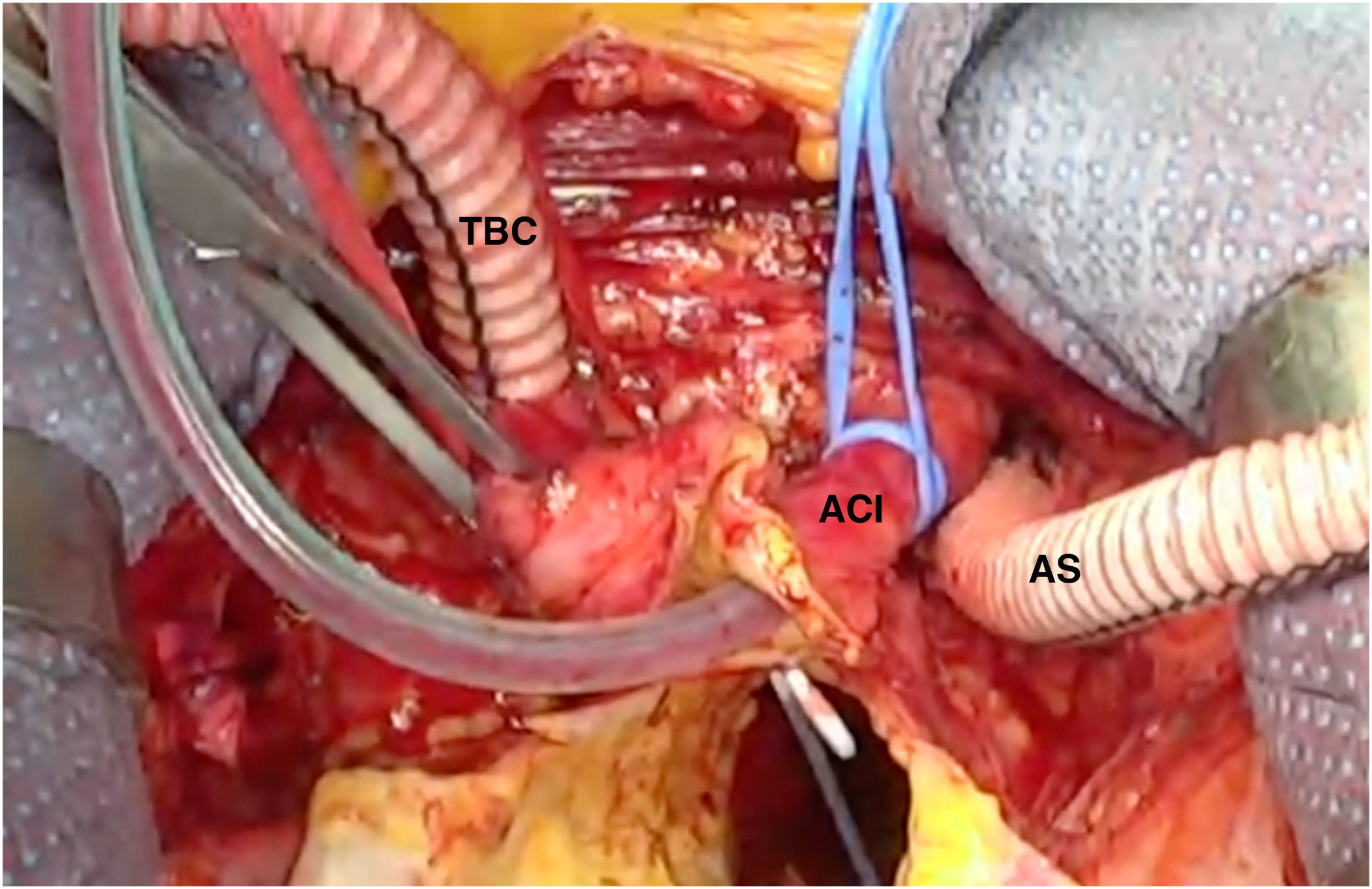
Canulación arterialLa canulación arterial debe realizarse a través de un tronco supraaórtico, generalmente la arteria axilar derecha o el tronco braquiocefálico (bien mediante canulación directa o con interposición de un tubo protésico). La elección de uno u otro dependerá de la anatomía, buscando siempre la arteria más sana, por lo que a veces la carótida derecha o izquierda serán una buena alternativa si la arteria axilar o el tronco braquiocefálico están afectados o existe malperfusión cerebral por oclusión de la luz verdadera de una o ambas carótidas (fig. 6). La canulación femoral se ha preferido históricamente por su sencillez técnica y por su rapidez, pero se asocia con una mayor morbimortalidad debido al flujo retrógrado, que aumenta el riesgo de complicaciones neurológicas y de malperfusión visceral19,41,49. Por lo tanto, solo debe utilizarse en situaciones de emergencia donde es necesario establecer la CEC con rapidez.
La protección miocárdicaComo ya se ha señalado, en general los tiempos quirúrgicos suelen ser más prolongados, por lo que una adecuada protección miocárdica va a ser fundamental. Aunque no hay evidencia de peso sobre qué solución es más adecuada para este tipo de procedimientos, la cardioplejía cristaloide en dosis única permite «olvidarse» de la protección miocárdica una vez administrada y centrarnos en la técnica quirúrgica50. Por otro lado, el diseño de las prótesis híbridas permite acortar el tiempo de isquemia, ya que hacemos la anastomosis proximal antes de reimplantar los troncos supraaórticos, consiguiendo con frecuencia tiempos de isquemia de menos de 60minutos si no hay patología asociada que tratar. Incluso en pacientes con disfunción severa del ventrículo izquierdo se ha descrito el procedimiento con perfusión continua del miocardio sin isquemia51,52.
Protección cerebralHipotermiaLa necesidad de la parada circulatoria para al menos realizar la anastomosis distal obliga a plantear medidas adicionales para la protección cerebral, dada su baja tolerancia a la isquemia. Antes del desarrollo de las técnicas de perfusión cerebral, dicha protección recaía exclusivamente en la hipotermia. Aunque la hipotermia disminuye el consumo de oxígeno, nunca será cero, por lo que el tiempo que tenemos para hacer el procedimiento con seguridad es limitado. Se estima que a 20°C el margen de seguridad está en torno a los 30minutos, por lo que tiempos de parada más prolongados requieren de técnicas de protección adicionales. Además, la hipotermia profunda genera morbimortalidad por sí misma, al requerir tiempos de CEC más prolongados y producir alteraciones importantes de la hemostasia6,41,53,54.
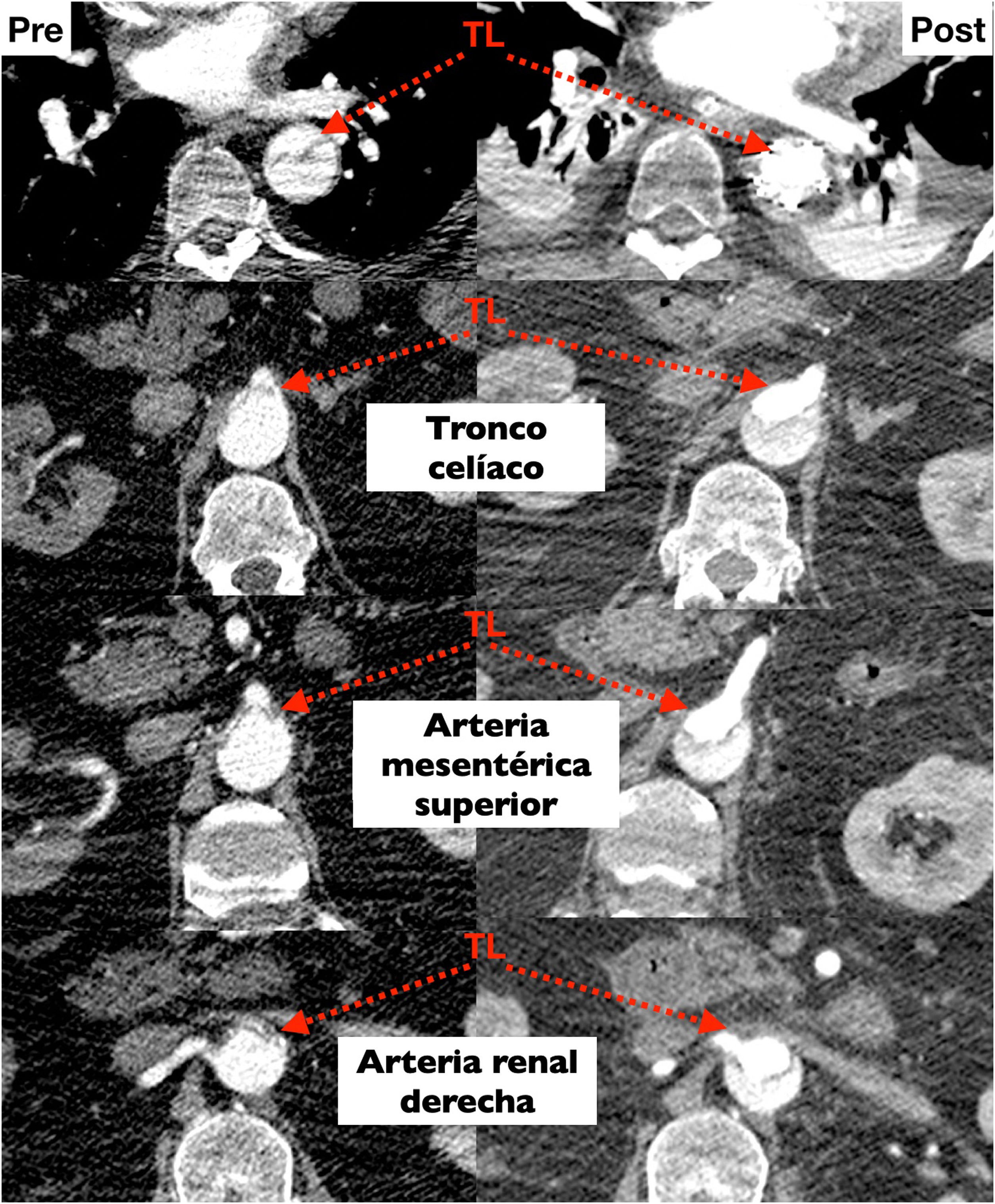
Perfusión cerebralLa tasa metabólica cerebral elevada, junto con la ausencia de depósitos de glucosa a dicho nivel, hacen que la mejor estrategia de protección cerebral sea mantener la perfusión sanguínea durante la parada circulatoria sistémica. Inicialmente esto se hacía de manera retrógrada, a través de la cava superior. El argumento era evitar la manipulación de los troncos supraaórticos, con frecuencia afectados, y confiar en la perfusión retrógrada del tejido cerebral, a lo que se unía el efecto lavado de detritus y aire sobre el lecho vascular cerebral y el enfriamiento producido por la circulación de la sangre. Aunque aún hay grupos que la siguen utilizando con excelentes resultados55, la mayoría de los centros utilizan la perfusión cerebral anterógrada a través de los troncos supraaórticos. La canulación arterial a través de un tronco supraaórtico permite hacer la perfusión cerebral unilateral sin necesidad de cánula ni de circuitos accesorios. Para tiempos de perfusión cerebral cortos la vía unilateral es suficiente gracias a la circulación colateral a través del polígono de Willis y de las carótidas externas. A partir de los 30minutos de perfusión unilateral aumenta de manera significativa el riesgo de muerte y de daño neurológico, por lo que en cirugías que se prevea superar ese tiempo, como es el caso que nos ocupa, la perfusión cerebral debe ser bilateral (fig. 7)6,19,46,53.
La perfusión cerebral anterógrada elimina la necesidad de la hipotermia profunda, pudiendo realizarse esta cirugía con seguridad a temperaturas de 28-32°C, por lo que se acortan los tiempos de CEC. Aunque incluso puede plantearse hacer esta cirugía en normotermia56, creemos que el riesgo que se asume excede al beneficio de la hipotermia moderada, no solo por la mejor protección de la médula y de las vísceras abdominales, sino porque además proporciona un colchón de seguridad ante la aparición de imprevistos durante la parada circulatoria.
La médula espinal y las vísceras abdominales durante la parada sistémicaSe ha descrito una mayor incidencia de daño medular en los procedimientos de FET frente a la sustitución del cayado por la técnica clásica. El mecanismo es múltiple, interviniendo factores preoperatorios, intraoperatorios y postoperatorios. Durante la perfusión cerebral bilateral en hipotermia moderada la médula espinal solo es perfundida por la arteria espinal anterior hasta el nivel de T6/T7, por lo que la protección medular recae casi exclusivamente en la hipotermia. Si el tiempo de parada sistémica se prolonga por encima de los 50minutos a 32°C, el riesgo de daño medular aumenta de manera significativa56. Por ello es recomendable siempre utilizar cierto grado de hipotermia y acortar al máximo el periodo de parada circulatoria reiniciando la perfusión de la aorta toracoabdominal una vez hecha la anastomosis distal, a través de la rama lateral de la prótesis. Además, es muy importante también la estabilidad hemodinámica durante todo el proceso, con presiones medias de perfusión adecuadas. Un aspecto técnico que también tiene impacto en esta complicación es la longitud del stent implantado. Sabemos también que cuando su extremo distal queda más allá de T6/T7 el riesgo de paraplejia aumenta de manera significativa, por lo que es muy importante en el análisis de la TAC preoperatoria no solo decidir el diámetro del stent, sino también su longitud, evitando llegar a dicho nivel si no es imprescindible. No está claro el papel de la perfusión de la arteria subclavia izquierda durante la parada circulatoria, aunque podría aumentar el flujo de sangre a la médula al perfundir ambas arterias vertebrales57,58.
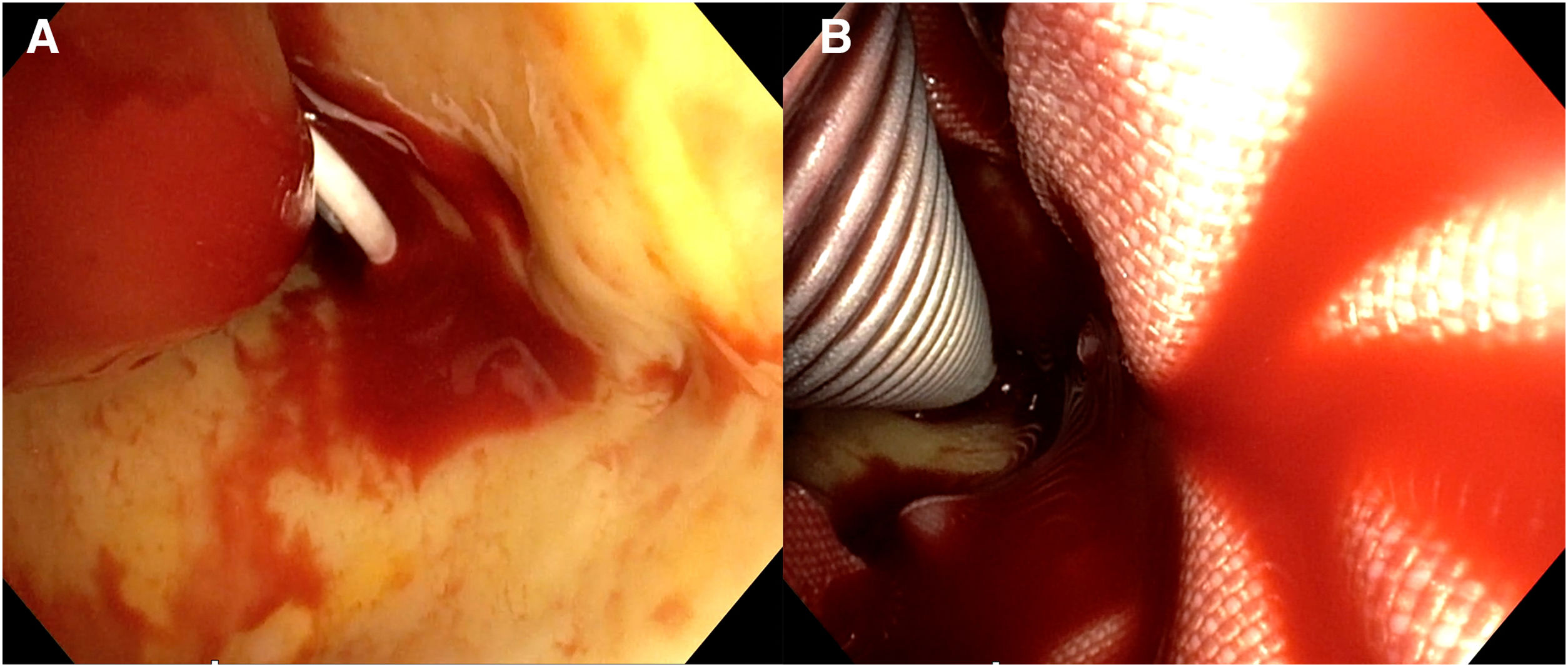
Nuestra técnica de implante de la prótesis híbrida paso a pasoTras la esternotomía, en todos los pacientes realizamos una ligadura de la vena innominada con el fin de mejorar la exposición y el acceso a los troncos supraaórticos. Colocamos un introductor de 5Fr en una de las arterias femorales y avanzamos un catéter pigtail a la aorta torácica descendente proximal con control mediante ETE. Actualmente nuestra arteria de primera elección para la canulación es el tronco braquiocefálico, mediante interposición de tubo de dacrón de 8mm. No precisa de incisiones adicionales y el acceso es rápido y sencillo. En la disección aórtica enfriamos a 28°C, y en los casos electivos, a 32°C. Durante el enfriamiento procedemos a la ligadura de la arteria subclavia izquierda en el origen y la canulamos directamente o realizamos un bypass con tubo de dacrón de 8mm, donde conectamos una línea de perfusión arterial, para así realizar perfusión de los tres troncos supraaórticos durante la parada circulatoria. La protección miocárdica la realizamos con Custodiol® (Dr. F. Köhler Chemie, Bensheim, Alemania) administrado por vía anterógrada. Si hay que actuar sobre la válvula aórtica, sobre la raíz o se requieren procedimientos asociados, se realizan durante el enfriamiento, antes de la parada circulatoria. La parada circulatoria se inicia con perfusión cerebral a través de la carótida derecha y la subclavia izquierda. Resecamos el arco generalmente hasta antes del origen de la arteria subclavia izquierda. Entonces canulamos la arteria carótida izquierda y comienza la perfusión cerebral por los tres troncos supraaórticos (fig. 7). Exploramos la aorta torácica descendente con un fibroscopio flexible, para confirmar la posición correcta del pigtail en la luz verdadera y buscar reentradas a dicho nivel (fig. 8A).
Para el implante de la prótesis híbrida intercambiamos el pigtail por una guía de soporte (Amplatz Super Stiff®, Boston Scientific, Marlborough, Estados Unidos), y sobre ella liberamos la prótesis. Realizamos la anastomosis distal en zona2 en la mayoría de los casos, con sutura continua de Prolene de 3/0 apoyada en teflón. De nuevo confirmamos la posición correcta del stent y su expansión con el fibroscopio (fig. 8B). Conectamos la rama lateral de la prótesis a la línea arterial y reiniciamos la perfusión sistémica y el calentamiento. Primero realizamos la anastomosis proximal con sutura continua de Prolene de 4-0 apoyado en teflón, finalizando la isquemia miocárdica. Finalmente realizamos la anastomosis secuencial de los troncos supraaórticos a las ramas de la prótesis con Prolene de 6/0 (fig. 9).
Aunque hay grupos que realizan el reimplante de la arteria subclavia izquierda mediante un bypass extraanatómico para evitar una anastomosis que puede ser incómoda y fuente de problemas, la ligadura de la vena innominada, junto con la disección amplia de la carótida izquierda, facilitan enormemente su exposición, permitiendo su reimplantación en posición anatómica. Cuando a pesar de estas maniobras la exposición de la arteria subclavia continúa siendo insuficiente, mejora de manera significativa si extendemos unos centímetros la esternotomía hacia el cuello por delante del músculo esternocleidomastoideo izquierdo.
Resultados de la FET en el SAAAunque la mortalidad ha disminuido en los últimos años, en el contexto del SAA oscila entre el 6,2% y el 20%59-62. Desde un punto de vista clínico, los principales predictores de mortalidad son la presencia de shock y de malperfusión. Como en cualquier técnica demandante, la experiencia del equipo quirúrgico tiene un impacto directo en la mortalidad56,63,64.
Las complicaciones neurológicas son las más graves y temidas. La incidencia de ictus perioperatorio se encuentra entre el 5% y el 15%, y sus principales factores de riesgo son la edad, la afectación de los troncos supraaórticos, la presencia de clínica neurológica preoperatoria, el tipo de canulación utilizada y el tiempo de parada circulatoria56,60,64. La paraplejia ocurre hasta en el 3-5%, y sus principales factores de riesgo son el tiempo de parada circulatoria y la longitud del componente endovascular de la prótesis híbrida, donde longitudes del stent >15cm o una cobertura distal a T8 se relacionan significativamente con una mayor incidencia de esta complicación64-66.
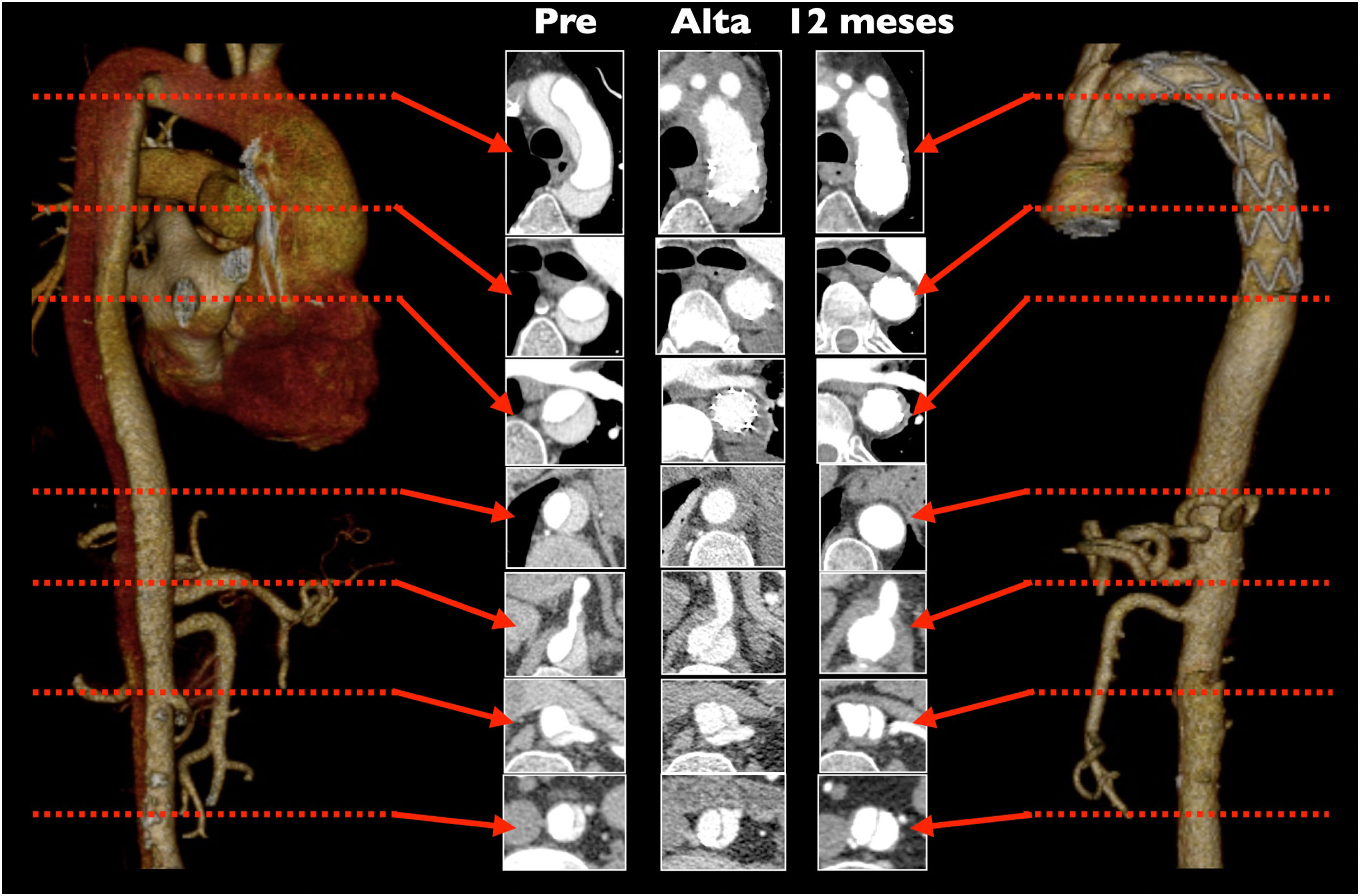
Aunque no existe evidencia de peso, diversos estudios observacionales sugieren un beneficio en términos de supervivencia y reintervención sobre la aorta distal en los pacientes con SAA en los que se realiza un tratamiento agresivo sobre el arco aórtico67-70. El mecanismo sugerido se deriva de una mayor incidencia de trombosis de la falsa luz en la aorta distal frente al tratamiento convencional, y por ello, menor crecimiento de la misma71,72. En torno al 90% de los pacientes presentan trombosis de la falsa luz a nivel de la endoprótesis, y del 60 al 70% a nivel de la aorta torácica descendente distal. El máximo beneficio se produce en aquellos pacientes con mayor riesgo de dilatación de la falsa luz en el seguimiento, que son los jóvenes, los portadores de colagenopatías y aquellos con reentradas a nivel del cayado aórtico, troncos supraaórticos y aorta torácica descendente (fig. 10)19,73,74. Como se ha señalado ya, es muy importante la selección del tamaño adecuado del stent. Un stent demasiado pequeño puede llevar al cierre inadecuado de la entrada en la aorta descendente y a una menor tasa de trombosis de la falsa luz22,75-77. Por otro lado, un tamaño demasiado grande aumenta la incidencia de dSINE, y con ello hay un mayor riesgo no solo de malperfusión, sino también de dilatación de la luz verdadera distal en el seguimiento43. En series contemporáneas se estima una tasa de endofuga 1b menor al 5% y la tasa de dSINE en torno al 15% tras la FET78,79.
La tasa de reintervención tras la FET está en torno al 8-23%, con una supervivencia libre de reintervención a los 5años del 88%, aunque varía en función de la patología de base79-81. Las principales causas de reintervención son la progresión del diámetro aórtico (44%), la presencia de endofuga (23%) y la presencia de dSINE (11%)82,83. En muchos casos la reintervención puede realizarse mediante un abordaje endovascular, pues el stent de la prótesis híbrida constituye una zona de anclaje ideal para la endoprótesis72,84,85.
ConclusionesEl SAA es una emergencia quirúrgica donde el objetivo principal es salvar la vida del paciente. En los pacientes con indicación de sustitución del arco aórtico, la FET es el tratamiento de elección, ya que al excluir las reentradas en el arco y la aorta torácica descendente y expandir la luz verdadera, mejora la perfusión distal y promueve la trombosis de la falsa luz distal, disminuyendo la dilatación de la misma y las reintervenciones en el seguimiento.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Consideraciones éticasDada la naturaleza de este trabajo, el consentimiento informado de los pacientes no fue requerido.
Conflicto de interesesNinguno que declarar.