Las arritmias en el periodo postoperatorio de la cirugía cardíaca requieren, en su particular contexto, un tratamiento específico. La presente revisión expone y actualiza la evidencia científica en los diversos tratamientos de las taquiarritmias postoperatorias en la cirugía cardíaca del adulto.
Arrhythmias in the postoperative period of cardiac surgery require, in their particular context, specific treatment. This review presents and updates scientific evidence on various treatments of postoperative tachyarrhythmias in adult cardiac surgery.
Las taquiarritmias pueden complicar la evolución de cualquier intervención reglada de cirugía cardíaca o ser una manifestación de otra complicación subyacente (taponamiento, hemorragia, insuficiencia respiratoria…) que requiera un tratamiento urgente, y, por lo tanto, estas situaciones deben descartarse, en especial en aquellos pacientes que no mejoran tras el control del ritmo cardíaco.
No todos los episodios requieren de tratamiento farmacológico, ya que muchos son autolimitados o responden a las medidas generales y profilácticas. El correcto tratamiento de las arritmias postoperatorias requiere de sistemas de detección eficaces (telemetría o la realización de exploraciones periódicas), la detección precoz de los factores precipitantes o complicaciones, y de protocolos de actuación para iniciar lo más rápidamente posible el tratamiento.
Esta revisión pretende actualizar y exponer la evidencia científica en los diversos tratamientos de las taquiarritmias en la cirugía cardíaca del adulto.
DiagnósticoLos sistemas de monitorización telemétrica con alarmas automáticas son los ideales para la detección y tratamiento precoz de las arritmias. Estos sistemas deben mantenerse no sólo en el postoperatorio inmediato en la unidad de cuidados intensivos, sino, si es posible, durante todo del ingreso hospitalario, ya que las arritmias auriculares tienen un pico de incidencia entre el segundo y tercer día postoperatorio, y las ventriculares suelen aparecer a los 3,9 días de la cirugía (con el 60% de los episodios después del 2.o día postoperatorio); además, un elevado porcentaje de los pacientes presenta una recurrencia durante el ingreso1,2.
Si es posible, se debe registrar un electrocardiograma (ECG) de 12 derivaciones para distinguir las arritmias ventriculares de las auriculares con conducción aberrante, y se recomienda la realización de un auriculograma con los cables epicárdicos temporales que puede detectar las ondas de flutter, la actividad errática de la fibrilación auricular (FA), la disociación auriculoventricular (AV) típica de las arritmias ventriculares y otros mecanismos asociados. Posteriormente, de forma continua o a intervalos, se debe tener registro de ECG para confirmar la reversión a ritmo sinusal3.
TratamientoHay medidas generales como corregir cualquier comorbilidad médica subyacente que pueda desencadenar o perpetuar la arritmia. Para ello se ha recomendado la realización de un análisis de sangre si no se dispone de uno reciente dentro de las primeras 6h (para arritmias auriculares) o de forma urgente (para arritmias ventriculares) con gasometría, para comprobar el estado de hemoglobina, leucocitos, potasio, función renal… Se deben mantener unos niveles de potasio sobre los 4,5mmol/l. Se recomienda un control diario de iones si la arritmia se mantiene3. Optimizaremos la saturación arterial (mantener por encima del 95%) y el estado de volemia (corregir hipo/hipervolemia).
El tratamiento de elección de aquellas arritmias que condicionan inestabilidad clínica o hemodinámica es la cardioversión eléctrica urgente. Para las arritmias estables se han ensayado distintos enfoques terapéuticos que se resumen a continuación (Tabla I).
Recomendaciones para el tratamiento de las taquiarritmias postoperatorias
| – | Los β-bloqueadores parecen ser los fármacos de primera línea para el control de la frecuencia cardíaca (recomendación clase I; nivel de evidencia B) |
| – | Como fármacos de segunda línea para el control de la frecuencia se pueden utilizar calcioantagonistas (recomendación clase IIa; nivel de evidencia B) |
| – | La amiodarona puede ser una alternativa en el control de la frecuencia (recomendación clase IIa; nivel de evidencia C), aunque su indicación es la cardioversión farmacológica, en especial en pacientes con disfunción ventricular (recomendación clase I; nivel de evidencia B) |
| – | La digoxina puede ser útil en el control del ritmo en pacientes con disfunción ventricular (recomendación clase IIa; nivel de evidencia B). No es útil en la reversión del ritmo (recomendación clase IIb; nivel de evidencia B) |
| – | La cardioversión es recomendable en FA postoperatoria refractaria, prestando atención a las necesidades de tratamiento antitrombótico. Son deseables los sistemas de energía bifásicos para este procedimiento (recomendación clase IIa; nivel de evidencia B) |
| – | En pacientes con TV se recomienda usar los antiarrítmicos de forma similar a pacientes no quirúrgicos, aunque la amiodarona puede ser de primera elección en pacientes con disfunción ventricular (recomendación clase IIa; nivel de evidencia B) |
| – | Es razonable la continuación de la terapia antiarrítmica durante 4–6 semanas tras la reversión de la arritmia (recomendación clase IIa; nivel de evidencia C) |
| – | No se deben utilizar fármacos de clase Ic en el contexto perioperatorio ni en pacientes isquémicos (recomendación clase III; nivel de evidencia B) |
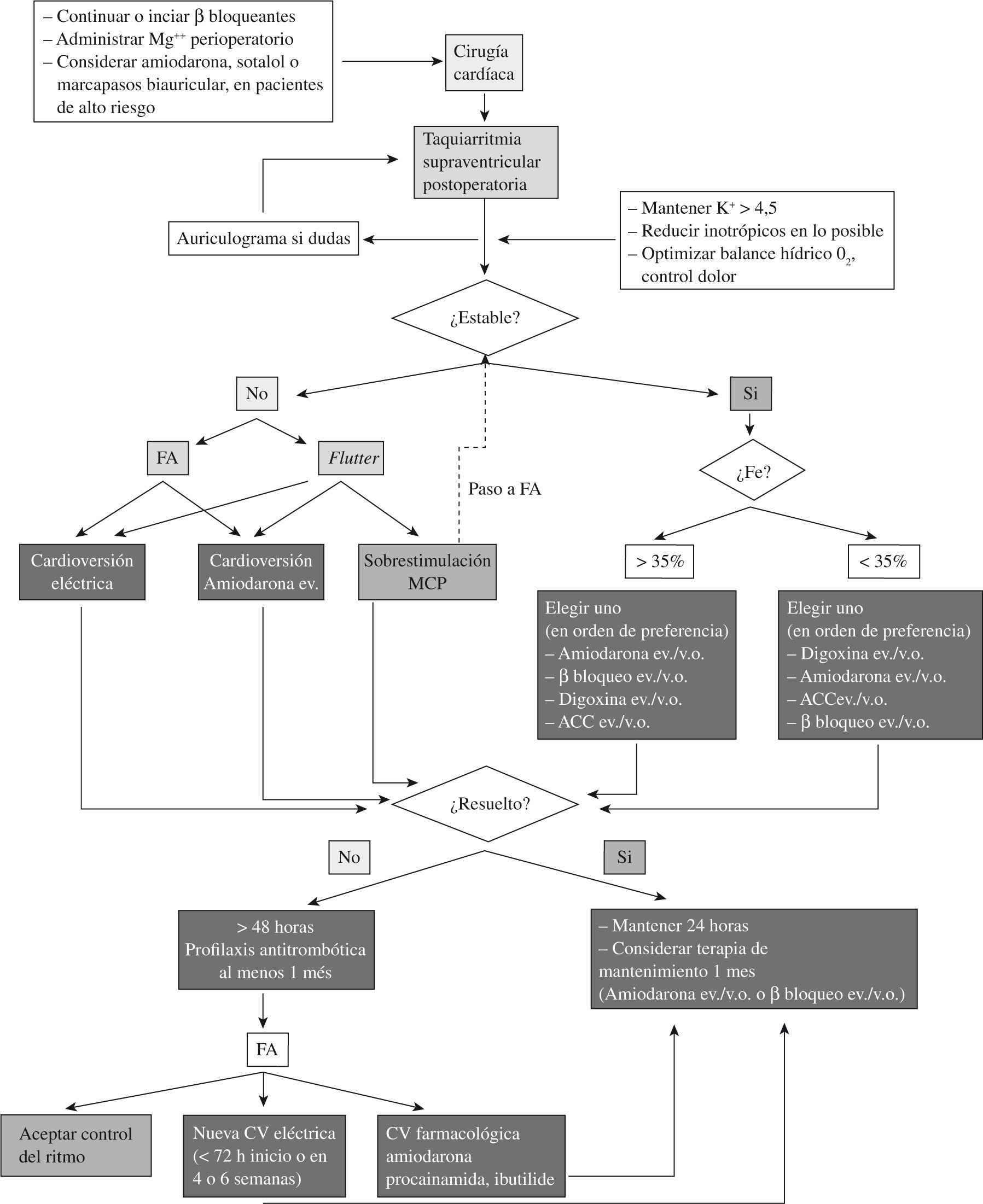
Aunque la FA postoperatoria (FAP) suele autolimitarse, y algunos episodios son muy breves, el inicio del tratamiento precoz suele conducir a una resolución más rápida, y a unas tasas de éxito mayores (Fig. 1). Se han evaluado dos estrategias terapéuticas que pueden resumirse en: control del ritmo y control de la frecuencia cardíaca. Actualmente la evidencia apunta hacia una estrategia precoz de control del ritmo, ya que mejora la situación hemodinámica, disminuye la necesidad de cardioversión, aumenta la duración en ritmo sinusal, es útil cuando hay contraindicación a la anticoagulación y disminuye la estancia hospitalaria4,5.
- –
Control de frecuencia: en ocasiones el control de la frecuencia es difícil por el aumento del tono adrenérgico posquirúrgico, aunque se deben tener en cuenta otras causas como la disfunción ventricular de base, fiebre, anemia, etc., que pueden contribuir. Los fármacos de elección para el control de la frecuencia son los β-bloqueadores, especialmente en pacientes isquémicos. No hay estudios frente a placebo, pero comparados con otros tratamientos estos fármacos son ligeramente superiores a diltiazem y digoxina3,6. A dosis altas suelen acompañarse de hipotensión frecuente (especialmente con esmolol), por lo que se deben evitar en el contexto posquirúrgico inmediato, iniciándose de forma progresiva. El sotalol muestra un ligero beneficio sobre metoprolol, probablemente por su acción grupo III7.
Si los β-bloqueadores no son tolerados o están contraindicados se utilizan calcioantagonistas no dihidropiridínicos como segunda opción. Diltiazem en uso endovenoso controla la frecuencia de forma similar a esmolol. La dosis media es de 0,25mg/kg en 2min, seguida de una infusión de 5mg/h (deben usarse perfusiones por su corta vida media). Se observaron también episodios de hipotensión. El verapamilo no ha mostrado claros efectos y los estudios con este fármaco muestran deficiencias7. La amiodarona, especialmente endovenosa, se ha usado con este fin en pacientes refractarios a las medidas convencionales e inestables, aunque los estudios son de tamaño de muestra reducido y no hay comparación con placebo6,8. La digoxina tiene una tasa muy baja de efectos secundarios, siendo una opción útil especialmente si hay disfunción ventricular, insuficiencia cardíaca o hipotensión; aunque el control de la frecuencia parece ser menor que con diltiazem y amiodarona, y los estudios son pequeños. Su efecto llega a los 60min, con un pico de acción a las 6h. Para potenciar su efecto suele recomendarse la asociación con β-bloqueadores, que es más beneficiosa que con calcioantagonistas9.
- –
Control del ritmo: se han empleado diversos fármacos antiarrítmicos para la reversión de la FA a ritmo sinusal. Hay que tener en cuenta que si la duración es mayor de 48h se debe iniciar la profilaxis antitrombótica, con un control estrecho de la anticoagulación por las interacciones medicamentosas de los antiarrítmicos. Los fármacos de elección por su seguridad y efecto β-bloqueador son los del grupo III, aunque la falta de estudios frente a placebo hace que los fármacos sean difícilmente comparables. Se recomienda tener cables epicárdicos en estos pacientes, ya que con frecuencia durante la reversión a ritmo sinusal se producen bradicardias y pausas sinusales, que además son factores de riesgo para el desarrollo de taquicardia ventricular (TV) tipo torsade de pointes.
- •
Fármacos clase I: los estudios de fármacos clase IA (procainamida, quinidina y disopiramida) son pequeños y no muestran beneficios o son marginales. Aunque los fármacos IC (propafenona, flecainida) parecen los más eficaces y son de elección en pacientes no quirúrgicos, no deben ser usados en coronarios al aumentar la mortalidad10. Todos estos fármacos deben usarse con mucha precaución por sus efectos proarrítmicos.
- •
Fármacos clase II: los estudios con β-bloqueadores muestran una eficacia superior frente a los calcioantagonistas y digoxina, aunque no hay control con placebo, y presentan limitaciones (en el brazo control se suspende a veces tratamiento β-bloqueador previo). Es probable que la cardioversión que originan sea secundaria al control de la frecuencia6.
- •
Fármacos clase III: la amiodarona se muestra superior a digoxina y ligeramente inferior a propafenona y quinidina, aunque a las 24h las tasas de cardioversión son similares, lo que parece indicar un efecto cardioversor más tardío11. El perfil de seguridad es alto, con efectos secundarios no muy graves (hipotensión, bradicardia) en alrededor del 10% de los pacientes tratados. Es igualmente útil para la FA y el flutter auricular. El protocolo más empleado es la carga endovenosa de 5mg/kg (300mg) en 5–30min, seguido de una perfusión de mantenimiento de 15mg/kg (900mg/día). Para evitar los efectos irritativos de la perfusión se han propuesto protocolos orales de carga y mantenimiento que además ocasionan una menor hipotensión. El sotalol parece mejor que los β-bloqueadores, aunque los estudios son pequeños y sin resultados concluyentes. Ibutilida parece eficaz, sobre todo en los casos de flutter, aunque como la dofetilida puede provocar TV hasta en el 4% de los pacientes (en especial en mujeres, insuficiencia cardíaca, o fracción de eyección baja), por lo que se recomienda su uso con monitorización al menos 3 días, y control de la función renal6,12.
- •
Fármacos clase IV: los fármacos clase IV (diltiazemy verapamilo) y la digoxina son menos eficaces que los previos en la conversión a ritmo sinusal, por lo que su uso no está indicado. De hecho, la digoxina parece aumentar el número de episodios de FA paroxística13.
- •
- –
Sobreestimulación auricular: el flutter auricular suele ser más refractario al tratamiento y puede beneficiarse de la sobreestimulación auricular para su reversión o paso a FA, que es mejor tolerada y tratable. Es más eficaz en el flutter tipo I, y sobre todo si se acompaña del efecto de fármacos antiarrítmicos, que alteran la duración del circuito. Su realización necesita de generadores que permitan sobreestimulación, y asegurarse que están conectados a los cables auriculares. Para mayor seguridad, se recomienda realizar una prueba estimulando a unos 10–15latidos sobre el ritmo de base y confirmar la falta de captura ventricular. Se intenta capturar el flutter estimulando a unos 10–30lpm sobre su frecuencia y posteriormente aumentándola hasta cambiar su morfología (suele ocurrir al 25% de la frecuencia auricular del flutter) durante unos 30–60 s. Si se consigue, se debe interrumpir bruscamente y comprobar el ritmo resultante2,14.
- –
La cardioversión eléctrica: está indicada de entrada si el paciente está inestable o muy sintomático. Si el paciente está estable, se suele indicar si la arritmia persiste a pesar del tratamiento, y antes de las 48h si existe contraindicación para la anticoagulación. La cardioversión en el periodo postoperatorio se asocia a un bajo porcentaje de efectos secundarios, por estar el paciente en un ambiente más controlado y con marcapasos temporal de rescate. Debemos evitar la toxicidad digitálica, aunque la discontinuación del tratamiento no se recomienda de rutina15. El flutter suele requerir energías menores que la FA. La tasa de éxito es mayor si se ha impregnado previamente con amiodarona al paciente. El porcentaje de conversión está en torno al 78%. El uso de ondas bifásicas es más efectivo, y suele requerir de menores energías, con el consiguiente menor daño tisular16. Se recomienda iniciar la cardioversión con energías mayores de 200 J, ya que el éxito a 100 J es tan sólo del 14%, mientras que a 360 J es del 95%. Para evitar fenómenos tromboembólicos se inicia anticoagulación con heparina de bajo peso molecular si la FA dura más de 24–48h. Si la duración es mayor de 48h y no se ha iniciado la anticoagulación, se debería realizar un ecocardiograma transesofágico para descartar la presencia de trombos, o anticoagular durante 3–4 semanas antes de la cardioversión de forma ambulatoria. Se recomienda prolongar la anticoagulación 3–4 semanas por la presencia de aturdimiento auricular10.
Para el seguimiento se recomienda la realización de al menos un ECG previo a la visita posquirúrgica, o incluso más frecuente en caso de bradicardia o si la medicación se inició antes de 48h del alta, por el riesgo de prolongación del QT. El tratamiento antiarrítmico debe mantenerse entre 4–6 semanas tras el alta si no existen recurrencias.
El pronóstico y la necesidad de tratamiento dependen del tipo de arritmia y el grado de lesión miocárdica. En general se sigue el mismo esquema de tratamiento agudo que en los pacientes no quirúrgicos.
- –
Latidos ventriculares prematuros: los latidos ventriculares prematuros aislados son muy frecuentes en el postoperatorio, a veces asociados a alteraciones electrolíticas. No se ha observado una mayor tendencia a desarrollar arritmias más complejas, no suelen requerir tratamiento más allá de seguir las medidas generales. El tratamiento β-bloqueador, si no está contraindicado, se recomienda como medida general17.
- –
Taquicardia ventricular no sostenida: los latidos ventriculares frecuentes (>30/h) y la TV no sostenida parecen no tener un aumento de mortalidad a corto plazo, aunque sí parece haberlo a largo plazo33. En estos casos se ha empleado lidocaína con éxito, aunque sin mostrar beneficios en morbimortalidad. Se ha empleado sobreestimulación con marcapasos en modo AAI o DDD para disminuir el número de arritmias, aunque no hay evidencia al respecto18. Si no hay respuesta se puede emplear amiodarona.
- –
Taquicardia ventricular sostenida. Fibrilación ventricular (FV): son episodios infrecuentes (0,41–2%) y muchas veces asociados a disfunción ventricular. El pico de incidencia de la TV sostenida sitúa en las 48h, media 3,9 días1. Su aparición tardía se asocia a un peor pronóstico. La FV suele aparecer en las primeras 24h y generalmente es reflejo de una situación clínica muy grave (bajo gasto, infarto perioperatorio grave…)19. Si es estable se suele usar de primera opción la lidocaína (dos dosis de carga de 1–1,5mg/kg en 10–15min, perfusión de 2–4mg/min), prestando atención a los pacientes ancianos o con disfunción hepática. Se ha usado procainamida (carga 20–50mg/min hasta 15mg/kg, perfusión 1–4mg/min, parar si ensancha el complejo QRS o aparece hipotensión), con especial atención en caso de insuficiencia renal, y tosilato de bretilio (carga 5–10mg/kg en 10min, perfusión 1–2mg/min). La amiodarona endovenosa u oral también es útil (bolus de 150mg, perfusión 0,5–1mg/min), procurando limitar la dosis a 2g/día para prevenir hepatotoxicidad, y vigilar la hipotensión. Suele ser mejor tolerada que los otros antiarrítmicos, en especial si hay disfunción ventricular18. Si la TV es lenta se puede sobreestimular con los marcapasos temporales. Algunos casos de TV recurrentes precoces se han relacionado con excitabilidad de las fibras de Purkinje y reentrada a dicho nivel, tanto en pacientes coronarios como valvulares, que han sido sometidos correctamente a ablación por radiofrecuencia20,21.
Las arritmias pueden conducir al desarrollo de insuficiencia cardíaca y a la aparición de embolias sistémicas. En las postoperatorias, este riesgo puede agravarse por las suturas de la pared cardíaca o el material protésico endovascular implantado, la alteración del sistema de coagulación secundario a la circulación extracorpórea y la estasis circulatoria secundaria a la arritmia, es decir, la clásica tríada de Virchow para el desarrollo de trombosis. En el caso de la FAP se ha observado el doble de accidente cerebrovascular (ACV) que en pacientes sin FA22, aunque la mayoría suele presentar otros factores de riesgo para embolia. El riesgo de ACV parece estar en muy estrecha relación con las comorbilidades asociadas de la población quirúrgica, ya que se ha observado que el tratamiento profiláctico que disminuye la incidencia de FAP no reduce de forma significativa los infartos cerebrales23. El flutter auricular suele ser más autolimitado y parece tener una menor tasa de ACV24, pero en grupos no quirúrgicos se ha asociado igualmente con fenómenos embólicos, por lo que debe ser manejado de forma similar.
BeneficiosExiste un incremento del riesgo de ACV hospitalaria en los pacientes con FAP, del 1,4% sin FA frente al 3,3% en pacientes con FA, con una odds ratio de incremento del riesgo de ACV en torno a 1,722,25. Este riesgo comienza a partir de las 48h del establecimiento de la arritmia y es mayor en pacientes con factores de riesgo como la edad avanzada, enfermedad valvular reumática, la hipertensión, el fallo cardíaco, etc. Sin embargo no hay estudios en cirugía cardíaca que demuestren que la anticoagulación de la FA disminuya el riesgo de ACV. En población no quirúrgica está demostrado que la anticoagulación oral reduce el riesgo de ACV, con un número necesario de tratamiento (NNT) para evitar un episodio de 37, y en pacientes con historia de ACV previo un NNT de 1226,27. Por ello, la mayoría de los autores y las guías de práctica clínica recomiendan de forma unánime la anticoagulación oral, en ausencia de contraindicaciones, para los pacientes con FA no valvular que presenten un riesgo alto de embolia cardíaca.
Identificar el riesgo de embolia es difícil y se basa en datos epidemiológicos para definir las características de poblaciones de enfermos que puedan sufrir estos eventos. De hecho, en las guías se puede observar algunas discrepancias a la hora de clasificar y tratar a los pacientes en los distintos grupos de riesgo. El estudio Atrial Fibrillation Investigators28, un metaanálisis de varios ensayos clínicos aleatorizados de anticoagulación oral frente a placebo o antiagregación en FA, establece predictores independientes de eventos embólicos en el grupo de pacientes que en dichos ensayos no había sido sometido a anticoagulación; a partir de ello, se identifican como tales la hipertensión arterial, edad, diabetes mellitus y los eventos embólicos cerebrales previos (ACV y accidentes isquémicos transitorios). El estudio Stroke Prevention and Atrial Fibrillation29 identificó los siguientes predictores de eventos, la presión arterial sistólica superior a 160mmHg, evento isquémico cerebral previo, insuficiencia cardíaca reciente o disfunción sistólica ventricular izquierda por ecocardiografía, y también la combinación edad avanzada (≥ 75 años) más sexo femenino.
En la actualidad la comunidad científica parece haber consensuado un acuerdo a través del score Congestive heart failure, Hipertension, Age, Diabetes, Stroke (CHADS2)30. Esta puntuación estratifica el riesgo cardioembólico en la FA no valvular, y consiste en asignar un punto a cada una de las condiciones siguientes: insuficiencia cardíaca reciente, hipertensión arterial, edad igual o mayor de 75 años y diabetes mellitus, y dos puntos al antecedente de ACV o accidente isquémico transitorio (Tabla II). Un aumento de puntuación del CHADS2 conlleva un aumento lineal del riesgo de embolia con una correlación bastante exacta, recomendándose anticoagulación oral mantenida en aquellos pacientes con score mayor o igual a 2. Es un sistema de puntuación sencillo y de fácil aplicación, pero no ha sido evaluado de forma sistemática en poblaciones diferentes de la referida. En el caso de los pacientes sometidos a cirugía cardíaca no existen escalas de riesgo validadas que permitan determinar que subpoblaciones de pacientes tienen más riesgo de desarrollar un proceso embólico cuando presentan arritmias postoperatorias.
Evaluación del riesgo embólico según el score CHADS2
| Factor de riesgo | Puntuación | |
| C | Insuficiencia cardíaca | 1 |
| H | Hipertensión (aún controlada con tratamiento) | 1 |
| A | Edad>75 años | 1 |
| D | Diabetes mellitus | 1 |
| S2 | ACV o AIT previos | 2 |
| Puntuación | % ACV/año (IC 95%) | |
| 0 | 1,9 (1,2–3,0) | |
| 1 | 2,8 (2,0–3,8) | |
| 2 | 4,0 (3,1–5,1) | |
| 3 | 5,9 (4,6–7,3) | |
| 4 | 8,5 (6,3–11,1) | |
| 5 | 12,5 (8,2–17,5) | |
| 6 | 18,2 (10,5–27,4) |
En la tabla podemos apreciar el riesgo anual de accidente tromboembólico cerebral en función de la puntuación del score CHADS2. Estos resultados corresponden a un estudio poblacional de pacientes en FA aislada sin tratamiento anticoagulante ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio.
Estos criterios clínicos de riesgo tromboembólico no tienen en cuenta otros factores como las características morfológicas de las cavidades cardíacas, fundamentalmente tamaño de aurícula izquierda y velocidad de flujo en su interior, los trastornos de la sincronía en la motilidad ventricular, así como la presencia de cardiopatía estructural, sobre todo valvular mitral, por lo que han sido objeto de discusión en su aplicación clínica. En diversos estudios31,32 se ha determinado una serie de criterios ecocardiográficos, entre los que se incluyen: presencia de trombos en aurícula izquierda, contraste espontáneo en aurícula izquierda (humo), dilatación auricular superior a 45mm, disfunción ventricular izquierda moderada-grave, calcificación del anillo mitral, placas de ateroma en arco aórtico. Sin embargo, el hecho de que la sensibilidad de la ecocardiografía transtorácica sea baja para evaluar alguno de los hallazgos anteriores, y que se precise el empleo de ecocardiografía transesofágica, ha propiciado que aún no se haya establecido la importancia relativa de los criterios ecocardiográficos en la producción de fenómenos tromboembólicos. Por ello, el papel de la ecocardiografía en la indicación de anticoagulación o antiagregación de estos pacientes es discutido32.
Otro punto de controversia es la duración del tratamiento. La mayoría de las guías establecen un periodo de 4 semanas de mantenimiento tras la reversión de la FA, basada en la observación de Dadoud, et al.33 del aturdimiento de la contractilidad auricular postoperatoria y su periodo de recuperación.
RiesgosExiste un riesgo de hemorragia en el postoperatorio, por lo que no se recomienda seguir una política agresiva inicial, y evitar el uso de heparina sódica puente a la anticoagulación oral. Aunque la anticoagulación estrechamente monitorizada tiene pocas complicaciones después de la cirugía cardíaca, se ha relacionado con la presencia de derrames pericárdicos graves y taponamiento cardíaco, especialmente si el cociente internacional normalizado (INR) está elevado34. Se debe prestar una especial atención a los pacientes en los que se asocia amiodarona, dada su interacción con la anticoagulación oral, precisando en ocasiones una reducción del 40–60% en las dosis35.
Recomendaciones (Tabla III)Los supuestos que se pueden dar para el manejo de pacientes quirúrgicos cardíacos que desarrollan arritmias postoperatorias, más concretamente flutter/FA, se pueden clasificar como sigue:
- –
Pacientes con indicación de anticoagulación preoperatorio/pacientes con procedimiento operatorio que condiciona anticoagulación. En aquellos pacientes que ya presentaban indicación de anticoagulación por arritmias o valvulopatía previos a cirugía, o bien en aquellos que por la naturaleza del procedimiento quirúrgico (p. ej. implante de prótesis valvular) precisan mantener anticoagulación crónica, el desarrollo de FAP no genera cambios en el manejo del protocolo de anticoagulación. En este sentido, las recomendaciones han sido establecidas para el manejo de los pacientes portadores de prótesis valvulares cardíacas36 y las recomendaciones de esta publicación serán derivadas de ellas.
- –
Pacientes con procedimientos de ablación quirúrgica. Mismo régimen que los del apartado anterior.
- –
Pacientes sin indicación de anticoagulación pre ni intraoperatoria. Como hemos comentado, no existen escalas de estratificación de riesgo de tromboembolia tras cirugía cardíaca, y, como se ha dicho, no sólo la presencia de FAP sino también las comorbilidades asociadas tienen un fuerte impacto en el desarrollo de ACV. Por ello, parece que los mismos factores asociados a sistemas clínicos como el CHADS2 aumentan la posibilidad de que se produzcan estos eventos. Diversas guías han abordado este problema sin especificar pacientes de riesgo bajo o alto. Las guías del American College of Chest Physicians (ACCP) de 2008 sobre terapia antitrombótica en la FA37 recomiendan el uso de anticoagulantes orales si la FA dura igual o más de 48h. Se recomienda un INR de 2,5 (rango: 2–3) y mantenerlo 4 semanas tras la reversión a ritmo sinusal, sobre todo si hay factores de riesgo. Estas recomendaciones son las mismas que las expuestas por la European Association for Cardio-thoracic Surgery (EACTS) en sus guías de FAP de 20063. El ACCP sugiere en sus guías de FA postoperatoria de 2005 la posibilidad de iniciar el tratamiento con heparina en pacientes de alto riesgo38. Las guías del ACC/AHA/ESC de 2006 sobre la FAP10 recomiendan seguir las mismas pautas que en pacientes no quirúrgicos. Se sugiere anticoagular si la FA dura más de 48h, sin decir durante cuánto tiempo. Las guías del ACC/AHA de 2004 sobre revascularización miocárdica39 recomiendan la anticoagulación si la FA dura más de 24h, manteniéndola un total de 4 semanas. Algunos autores40 han sugerido que en pacientes de bajo riesgo se administren 325mg de aspirina diarios, ya que ésta es la dosis que ha demostrado la reducción de ACV en la FA41.
Recomendaciones para la anticoagulación de la fap
| – | En pacientes quirúrgicos con indicación de anticoagulación previa a la cirugía o con procedimientos quirúrgicos que impliquen anticoagulación crónica, se debe mantener dicha anticoagulación en los niveles recomendados, independientemente del desarrollo o no de arritmias postoperatorias (recomendación clase I; nivel de evidencia B) |
| – | En aquellos pacientes sin indicación de anticoagulación previa, que presentan FA en el postoperatorio y dura más de 48h, parece razonable considerar anticoagulación oral de forma similar a pacientes no quirúrgicos manteniendo un INR entre 2–3 (recomendación clase IIa; nivel de evidencia B). El tratamiento antitrombótico se debe mantener durante 4 semanas tras la reversión de la arritmia (recomendación clase IIa; nivel de evidencia C) |
| – | Aquellos pacientes que desarrollen una FA persistente deben ser manejados con anticoagulación oral de igual manera que los pacientes no quirúrgicos (recomendación clase I; nivel de evidencia B) |
| – | En pacientes de bajo riesgo o alto riesgo de complicaciones con la anticoagulación oral, parece razonable la administración de 325mg de aspirina diarios como alternativa (recomendación clase IIa; nivel de evidencia C) |