El implante percutáneo de la válvula aórtica es la técnica de primera línea en pacientes mayores de 75años. El acceso transfemoral es el más usado, pero del 15% al 20% de los pacientes presentan enfermedad vascular periférica grave, que impide su uso. Como alternativa se usa la vía axilar, y últimamente la vía carotídea.
En este trabajo presentamos nuestra experiencia, describimos nuestra técnica y comunicamos nuestros resultados con seguimiento máximo de 40meses y medio de 8,32±10,12meses.
Material y métodosSe intervinieron 25 pacientes en dicho intervalo (enero 2020-junio 2023), 84% hombres, edad 78,88±6,3 años, 100% hipertensos y con arteriopatía periférica importante, STS score 4,46±0,87, 80% dislipémicos, 60% NYHAIII-IV, 44% insuficiencia renal crónica, 80% cardiopatía isquémica crónica, 28% AVC previo, EPOC 48%, 16% bypass mamaria a ADA permeable, y 24% de cirugía cardiaca previa. Las prótesis empleadas fueron Sapien3 (36%), Portico-Navitor (60%) y Accurate Neo (4%).
ResultadosLa mortalidad a los 30 días 4%, al año 9%, AVC 4%, IAM 4%. Éxito del implante 100%. Implante de marcapasos definitivo, 12%. No obtuvimos reagudización de IRC, sangrado mayor o menor, perforación de VI o derrame pericárdico, ni mala colocación o implante de más de una prótesis, ni obstrucción coronaria. La insuficiencia periprotésica más que ligera fue del 4%.
ConclusionesEl implante transcatéter transcarotídeo es factible, con buenos resultados, y debe considerarse su uso cuando los accesos femoral y axilar no son idóneos.
Transcatheter aortic valve implantation is the first-line technique in patients older than 75years. The transfemoral access is the more frequently used, but 15% to 20% of patients have severe peripheral vascular disease, which precludes its use. As an alternative, the axillary route is used and recently the carotid route.
In this paper we present our experience, describe our technique, and report our results with a follow up of 40 months maximum and mean (8,32±10,12 months).
Material and methods25 patients were operated on during this interval (January 2020-June 2023), 84% men, age 78.88±6.3, 100% hypertensive and with significant peripheral arterial disease, STS score 4.46±0.87, 80% dyslipidemic, 60% NYHAIII-IV, 44% chronic renal failure, 80% chronic ischemic heart disease, 28% previous stroke, COPD 48%, 16% patent left internal mammary bypass, and 24% of previous cardiac surgery. The prostheses used were Sapien3 (36%), Portico-Navitor (60%) and Accurate Neo (4%).
ResultsMortality at 30 days 4%, at one year 9%, AVC 4%, AMI 4%. Implant success 100%, pacemaker implantation 12%. We did not obtain CRF exacerbation, major or minor bleeding, perforation of LV or pericardial effusion, malpositioning or implantation of more than one prosthesis, or coronary obstruction. More than mild periprosthetic insufficiency was 4%.
ConclusionsThe transcarotid transcatheter implantation is feasible, with good results, to take into account its use when the femoral and axillary accesses are not suitable.
El implante percutáneo de válvula aórtica (transcatheter aortic valve implantation [TAVI]) es la modalidad de tratamiento preferida para pacientes con síntomas graves de estenosis aórtica severa en todos los riesgos quirúrgicos de pacientes mayores de 75años1. El acceso transfemoral es en la actualidad la vía más frecuentemente usada para el TAVI, pero su uso en pacientes con enfermedad vascular periférica grave puede ser un reto, y aproximadamente del 15% al 20% de los pacientes no son candidatos para el abordaje transfemoral debido a anatomía iliofemoral desfavorable2,3. La enfermedad arterial periférica se asocia con mayor riesgo de hemorragia y mortalidad en pacientes que se someten a TAVI transfemoral4,5. Por ello, se describieron varios accesos alternativos, como el transapical, el transaórtico, el transaxilar, el transcava y el transcarótida.
Los accesos transapical y transaórtico están siendo abandonados, debido al aumento de la mortalidad inherente al uso de dichas vías6,7, en favor de la vía transaxilar, que ha demostrado reducir la mortalidad e incluso presentar resultados comparables con la vía transfemoral, según algunos estudios8.
El acceso transcarotídeo fue descrito por Modine et al.9 en 2010 como abordaje alternativo en el TAVI. Desde entonces, el acceso transcarotídeo ha ido sumando adeptos como segunda alternativa tras el acceso transaxilar, o incluso como la primera alternativa según algunos autores10.
En nuestro servicio comenzamos a usar el acceso carotídeo en 2020, como alternativa al axilar, y en este trabajo pretendemos describir nuestra técnica y presentar nuestros resultados.
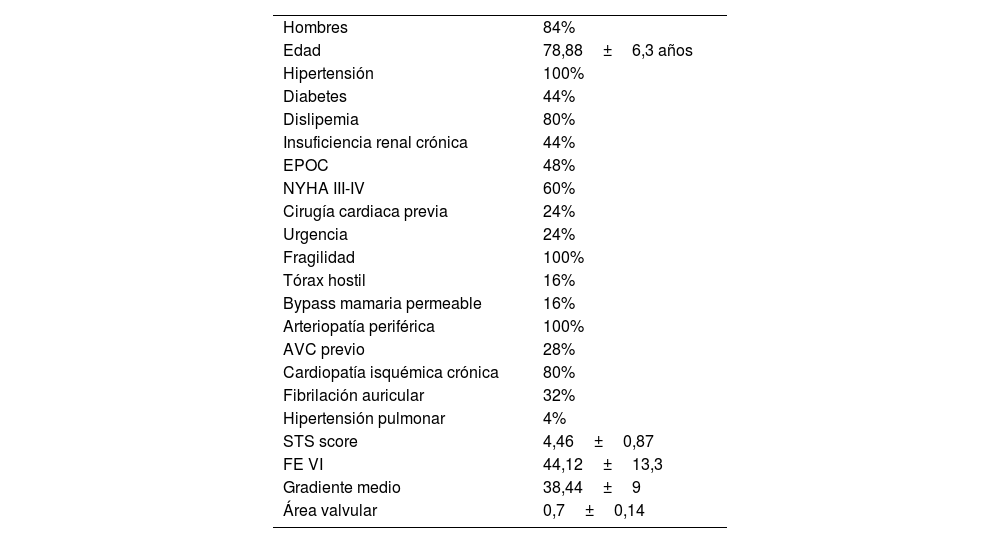
Material y métodosSe intervinieron 25 pacientes en el intervalo de tiempo entre enero de 2020 y junio de 2023. Las características clínicas de los pacientes se describen en la tabla 1. Todos los pacientes presentaban enfermedad arterial periférica grave, con imposibilidad de realizar el procedimiento por vía femoral o axilar.
Características de la población
| Hombres | 84% |
| Edad | 78,88±6,3 años |
| Hipertensión | 100% |
| Diabetes | 44% |
| Dislipemia | 80% |
| Insuficiencia renal crónica | 44% |
| EPOC | 48% |
| NYHA III-IV | 60% |
| Cirugía cardiaca previa | 24% |
| Urgencia | 24% |
| Fragilidad | 100% |
| Tórax hostil | 16% |
| Bypass mamaria permeable | 16% |
| Arteriopatía periférica | 100% |
| AVC previo | 28% |
| Cardiopatía isquémica crónica | 80% |
| Fibrilación auricular | 32% |
| Hipertensión pulmonar | 4% |
| STS score | 4,46±0,87 |
| FE VI | 44,12±13,3 |
| Gradiente medio | 38,44±9 |
| Área valvular | 0,7±0,14 |
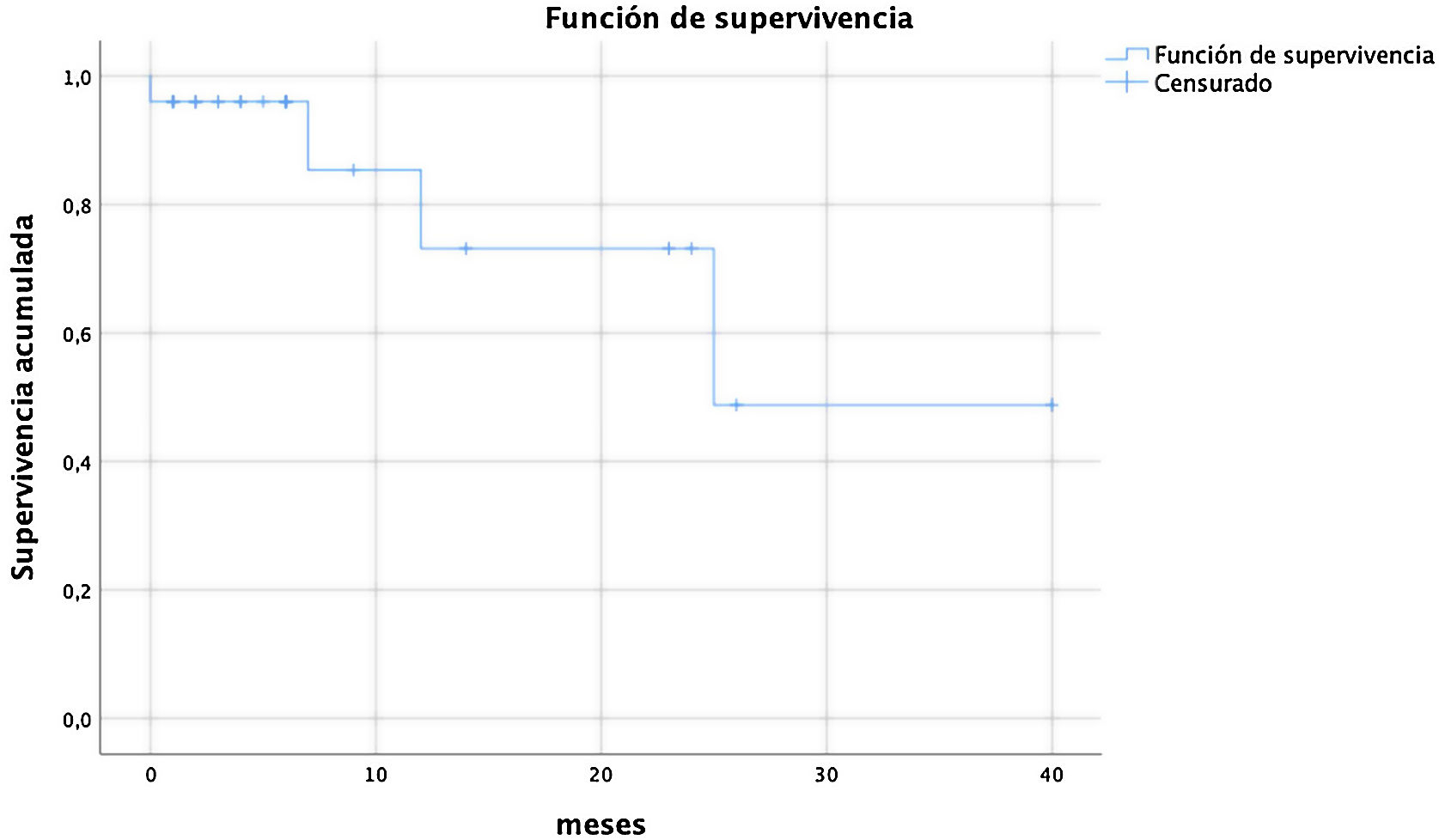
Los datos anonimizados fueron tratados con el software SPSS26. Las variables categóricas se expresaban en porcentajes, y las variables continuas, con la media y la desviación estándar. Se usó el test de Kaplan Meyer para analizar la supervivencia.
Técnica quirúrgicaSe usa anestesia general, se canaliza la arteria radial derecha para el control invasivo de la presión arterial y la ecocardiografía transesofágica para controlar el resultado del implante, y catéter de marcapasos transitorio por la vena yugular derecha.
Se practica punción ecoguiada de la arteria femoral derecha, se coloca un introductor 6F para la introducción de catéter pigtail en el seno no coronariano, encima del velo no coronario, que posibilitaba la realización de aortografías y guiaba el implante.
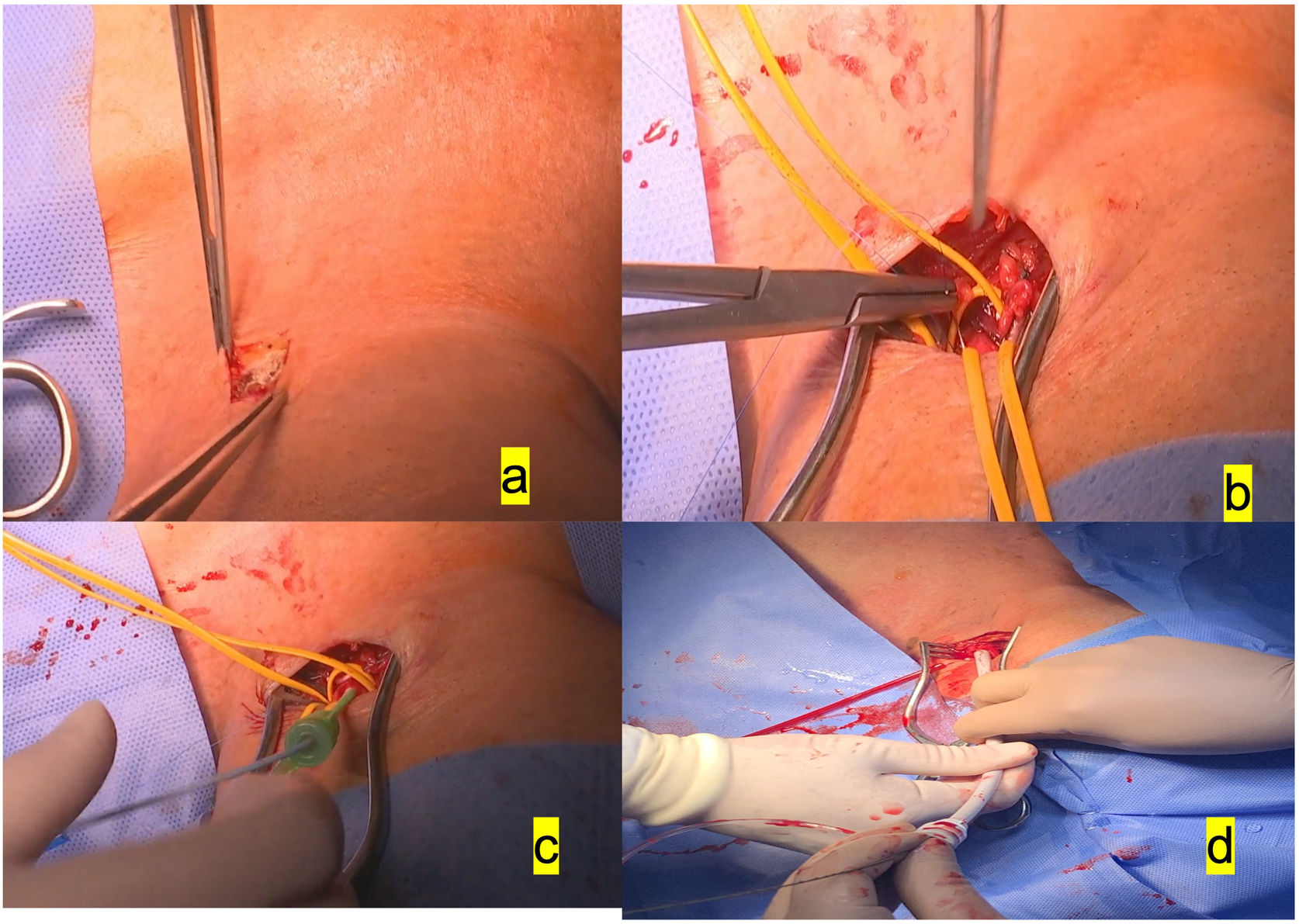
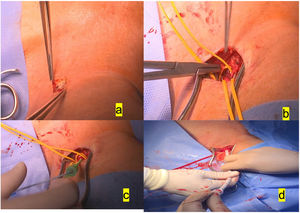
Preferimos el empleo de la carótida izquierda para el implante, sobre todo por la disposición del quirófano, acostumbrados a utilizar la subclavia izquierda, donde el equipo de anestesia, el monitor y el equipo radiológico se colocan a la derecha del paciente, aparte de un gran monitor fijo a la pared derecha del quirófano, dejando amplio espacio a la izquierda para la cirugía. Se practica una incisión de 3-4cm, encima del borde del esternocleidomastoideo, tras disección de este. Teniendo cuidado de no lesionar el nervio vago, se accede fácilmente a la arteria carótida común, se pasan 2 vessel loops y se practica bolsa de tabaco alargada apoyada en teflón (fig. 1).
a)Incisión de 3-4cm anterior al esternocleidomastoideo izquierdo. b)Disección de la arteria carótida izquierda común y aplicación de la bolsa de tabaco con Prolene 5/0. c)Colocación del introductor 6F dentro de dicha bolsa de tabaco. d)Colocación del introductor 16F para la valvuloplastia previa al implante de prótesis autoexpandible.
Llegado este momento, se administra heparina sódica, se practica punción dentro de la bolsa de tabaco para colocar un introductor 6F, y a continuación se usa un catéter AL con guía teflonada 0,035” curva, que se intercambia por guía 0,035” recta para cruzar la válvula aórtica. Tras cruzar la válvula aórtica se introduce el catéter AL en el ventrículo izquierdo y se intercambia la guía recta por guía de alto soporte preformada Safari. A continuación, en los casos de prótesis balón expandible, se retira el introductor 6F y se coloca el introductor de la prótesis a implantar, y en los casos de prótesis autoexpandible se usa introductor Dryseal de 16F para la realización de la valvuloplastia, algo que no realizamos al emplear prótesis balón expandibles.
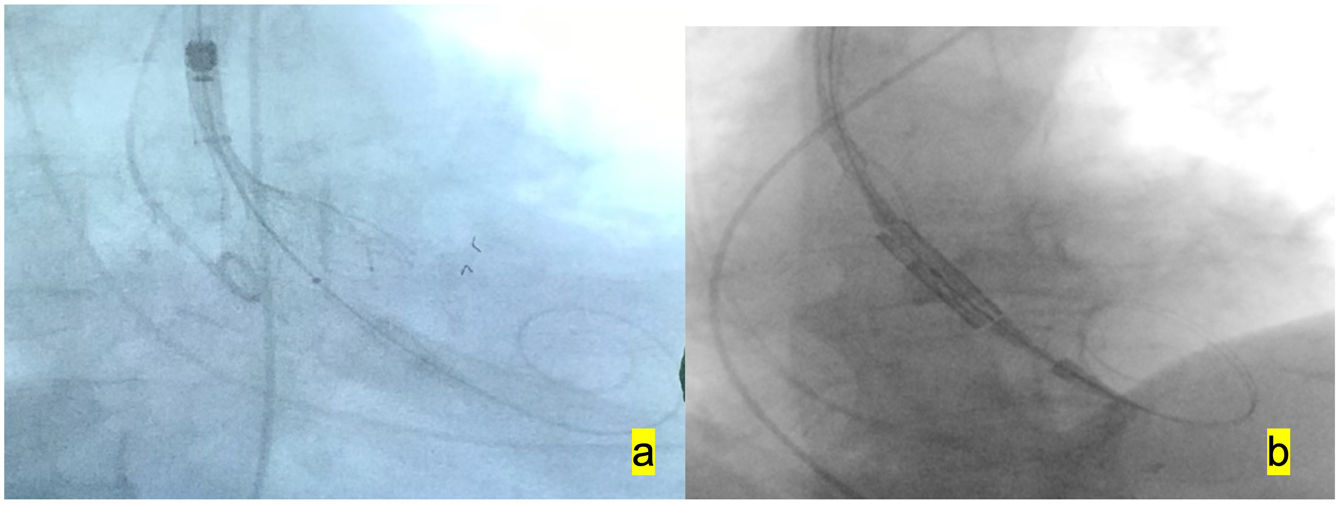
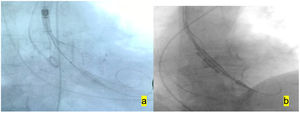
A continuación se retira el Dryseal y se introduce la prótesis autoexpandible para su implantación, y, como comentamos anteriormente, la prótesis balón expandible se implanta sin valvuloplastia previa, con sobreestimulación a 180 latidos por minuto (fig. 2).
A continuación se comprueba con ecocardiografía transesofágica la adecuada posición y función del implante, para posteriormente retirar la guía Safari y efectuar el cierre de la bolsa de tabaco, procediendo al cierre habitual de la herida quirúrgica.
Se usa Angioseal para el sellado de la punción femoral, tras la retirada del pigtail.
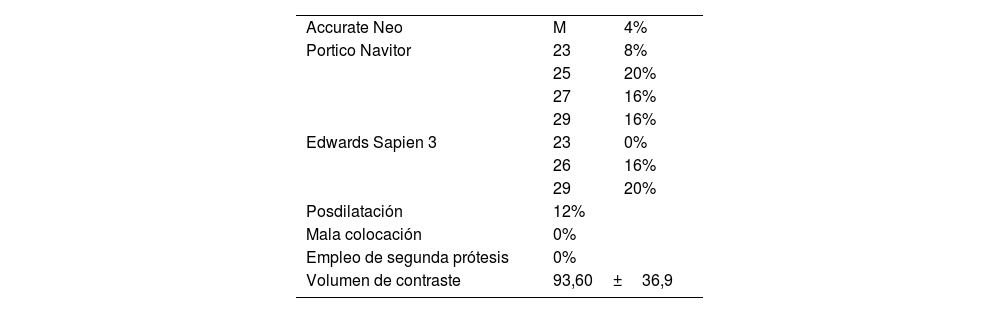
ResultadosLas prótesis empleadas fueron Portico y Navitor, de Abbott Laboratories, Sapien3, de Edwards Lifesciences, y Accurate Neo, de Boston Scientific. Los tamaños y el tipo de prótesis empleadas se describen en la tabla 2. Se obtuvo el éxito del implante en el 100% de los casos, se tuvo que posdilatar en el 12% de los casos, no hubo ninguna mala colocación o empleo de segunda prótesis, y el volumen de contraste medio fue de 93,60±36,9ml.
No tuvimos complicaciones vasculares mayores o menores, ni sangrado que comprometiera la vida, mayor o menor, no hubo insuficiencia renal aguda, ni perforación del ventrículo izquierdo, ni obstrucción coronaria, ni conversión a cirugía convencional.
Tuvimos un caso de fibrilación auricular postoperatoria (4%), un solo caso de IAM, caracterizado por elevación de troponinas importante (4%) y disfunción del ventrículo izquierdo; en ese mismo caso se constató AVC sin alteraciones en la TAC realizada, caracterizada por muy mal despertar; dicho paciente es el único fallecimiento que tuvimos a los 30días (4%): se trataba de paciente de 87 años con STS score de 7,2, con cirugía coronaria previa, bypass mamario izquierda a ADA permeable. La mortalidad al año fue del 9%. La tabla 3 resume los resultados obtenidos.
Resultados
| IAM | 4% |
| AVC | 4% |
| Sangrado compromete la vida | 0% |
| Sangrado mayor | 0% |
| Sangrado menor | 0% |
| Insuficiencia renal aguda | 0% |
| Complicaciones vasculares mayores | 0% |
| Complicaciones vasculares menores | 0% |
| Bloqueo A-V postoperatorio | 12% |
| Fibrilación auricular postoperatoria | 4% |
| Colocación de MP definitivo | 12% |
| Conversión a CEC | 0% |
| Éxito del implante | 100% |
| Taponamiento cardiaco | 0% |
| Perforación de VI | 0% |
| Insuficiencia aórtica mayor que ligera | 4% |
| Obstrucción coronaria | 0% |
| Mortalidad a los 30 días | 4% |
| Mortalidad al año | 9% |
La tasa de marcapasos fue del 12%, y llama la atención que los 3 casos fueron con el implante de Sapien3 de 29mm; no tuvimos ningún implante de marcapasos con las prótesis Portico o Navitor.
La insuficiencia aórtica más que ligera fue del 8%, pero no hubo ningún caso de insuficiencia aórtica severa.
La supervivencia estimada a 40 meses de seguimiento máximo, y medio de 8,32±10,12 meses, fue de 27,81±4,8. La curva de supervivencia de Kaplan Meyer se describe en la tabla 4.
DiscusiónEl implante TAVI es hoy en día una técnica consolidada en el tratamiento de la estenosis aórtica severa, sobre todo por vía transfemoral, pero no todos los pacientes pueden ser idóneos debido a estenosis, intensas calcificaciones o angulaciones. Además, a pesar de la mejora y de la disminución del calibre de los sistemas de liberación, las complicaciones vasculares, con el aumento de morbimortalidad que conllevan, siguen estando por encima del 4%11.
Las vías alternativas transapical y transaórtica son intrínsecamente más agresivas, con mayor tasa de morbimortalidad en comparación con la vía transaxilar12,13, por lo que muchos centros la han adoptado como la primera alternativa a la femoral, por la anatomía favorable que presenta14 y por sus buenos resultados.
Desafortunadamente, algunos casos no presentan arterias axilares idóneas para el implante, y se recurre a las vías transapical, transaórtica o transcava, y como es nuestro caso, nos hemos resistido al empleo de la vía transcarotídea, por el miedo a los accidentes cerebrovasculares que podría conllevar.
La amplia experiencia que presenta nuestro centro por la vía transaxilar, la mejora y disminución del calibre de los sistemas de liberación, así como los resultados que se han ido publicando sobre la vía transcarotídea, nos animaron a su empleo desde 2020; nuestros resultados iniciales con una mortalidad del 4% inferior a la descrita por Mylotte et al.15, del 6,3%, y muy parecida a los resultados del registro francés16, del 3,97%. En dicho estudio comparan los resultados de la vía femoral (19.995 pacientes) frente a no femoral, tanto axilar (702 pacientes) como carotídea (914 pacientes), encontrando similares resultados, salvo menor tasa de complicaciones en el brazo de la no femoral. La tasa de AVC en dicho estudio es del 3,35%, parecida a la nuestra, y la de implante de marcapasos del 17,79%, que contrasta con nuestros resultados del 12%, haciendo hincapié en que fueron 3 pacientes con intensa calcificación anular y prótesis Edwards 29mm, no implantando ningún marcapasos en las prótesis autoexpandibles. Pensamos que este hallazgo es, cuanto menos, llamativo, y podría corresponder a la depuración técnica, procurando un implante muy alto, y con el paso del tiempo se ajustará a la tasa media de implante que se describe para dichas prótesis.
En un metaanálisis dirigido por Abraham17, donde se compara la vía carotídea frente a la femoral y a otras vías no femorales, el resultado primario estudiado fue la mortalidad por todas las causas. Los resultados secundarios incluyeron sangrado mayor, complicaciones vasculares mayores, accidente cerebrovascular, infarto de miocardio, implantación de marcapasos e insuficiencia periprotésica. Se incluyeron 22 estudios observacionales, con un total de 11.896 pacientes. El abordaje transcarotídeo tuvo mayor mortalidad al mes (3,7% frente a 2,6%, p=0,02) pero menos complicaciones vasculares mayores durante la hospitalización (1,5% frente a 3,4%, p=0,04) que el acceso transfemoral. Se presentaron menos complicaciones vasculares mayores (2% frente a 2,3%, p=0,04) que la transaxilar/subclavia, pero mayor sangrado mayor (5,3% frente a 2,6%, p=0,03). La comparativa frente a la vía transaórtica presenta una mayor hospitalización (11,7% frente a 1,9%, p=0,02) y tasas de mortalidad a un mes (14,4% frente a 3,9%, p=0,007). La comparativa con la vía apical arroja menor mortalidad (2,6% frente a 8,7%) complicaciones vasculares (2,4% frente a 5%, p=0.39) y hospitalización (5,8% frente a 8,1, p=0,07). No hubo diferencia en el riesgo de accidente cerebrovascular entre el acceso transcarotídeo y otros accesos.
En otro estudio, Kriker et al.18 compararon los resultados de las vías axilar y carótida a partir de los datos obtenidos del registro americano entre los años 2015-2019, incluyendo 3.103 pacientes tratados por vía axilar y 801 por vía carotídea. Los resultados fueron una similar tasa de mortalidad a los 30días (4,3% frente a 5,2%, p=0,34) pero un riesgo significativamente menor de accidente cerebrovascular (4,2% frente a 7,4%; hazard ratio: 0,56; intervalo de confianza del 95%: 0,38-0,83; p=0,003). Otros resultados que favorecieron a la vía carotídea sobre la axilar incluyeron un tiempo de procedimiento más corto (117,0 frente a 132,4minutos; p<0,001) y tiempo de fluoroscopia (16,6 frente a 21,6min; p<0,001), menor volumen de contraste (78,5 frente a 96,7ml; p<0,001), estancia más corta en la unidad de cuidados intensivos (24,3 frente a 25,0 horas; p=0,02) y hospitalaria (2,0 frente a 3,0 días; p=0,002), y más pacientes dados de alta a domicilio (82,9% frente a 74,6%; p<0,001).
Estos resultados corroboran la tendencia actual a usar vías periféricas parecidas a la femoral, confirmando la seguridad de la vía transcarotídea.
Conclusiones y limitacionesLos resultados de nuestra serie, en consonancia con los descritos en la literatura, animan a emplear la vía carotídea como alternativa válida en determinados pacientes donde el acceso femoral o axilar no sean idóneos. Una limitación importante de nuestro estudio es el número pequeño de casos, su naturaleza observacional, describiendo los resultados obtenidos en un solo centro.
Consideraciones éticasTodos los pacientes fueron informados y firmaron el consentimiento informado para la publicación de trabajos relacionados con la cirugía.
Conflicto de interesesEl Dr. Omar A. Araji es Proctor de Navitor Abbott Laboratories.
El resto de autores no presentan conflicto de intereses.