El linfoma de células del manto (LCM) representa el 4% de los linfomas en Estados Unidos, y entre el 7-9% en Europa, se diagnostica en pacientes con una mediana de edad de 60 años, y es más frecuente en los varones (relación 2:1)1. A pesar de localizarse a nivel extraganglionar (tracto digestivo, estómago, colon, hígado, piel, glándulas lagrimales y sistema nervioso central)1, la afectación de la mama es infrecuente2. Presentamos el caso clínico de un varón con un LCM a nivel de la mama, en el que la cirugía permitió un control local adecuado.
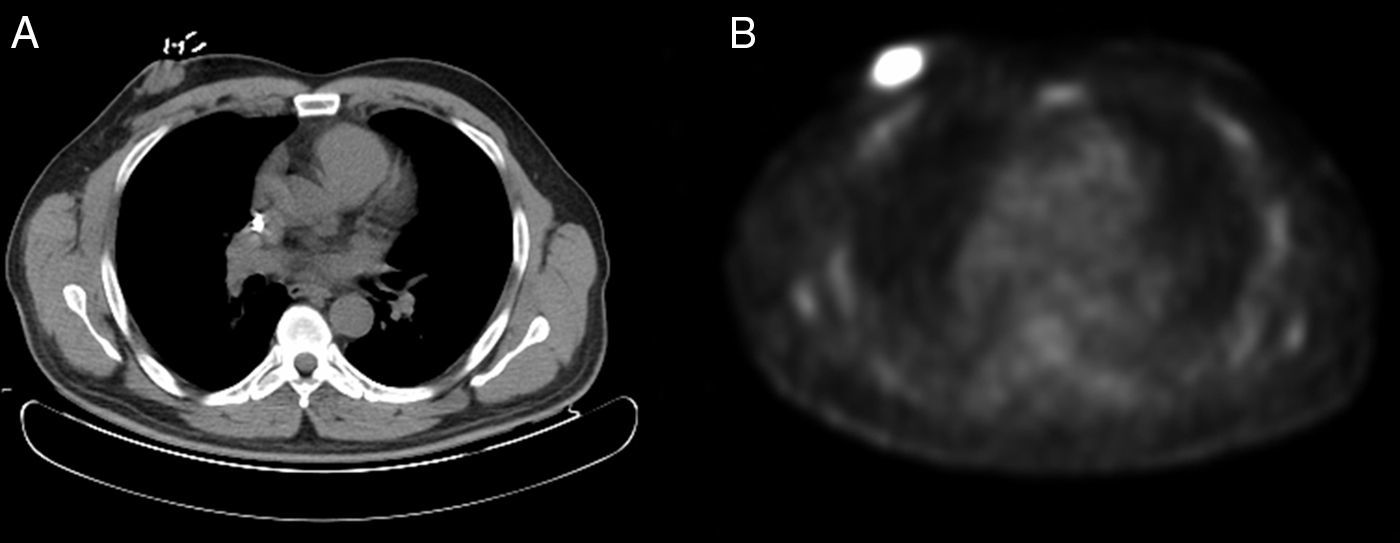
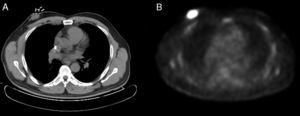
Varón de 56 años, diagnosticado de un LCM blastoide en estadio IIA, a raíz de unas adenopatías cervicales y axilares derechas. Fue tratado inicialmente con radioterapia del campo afecto (dosis total 47Gy) y rituximab (4 dosis), ya que no quiso recibir poliquimioterapia. Alcanzó una remisión completa, pero a los 2 meses de finalizar el tratamiento presentó una recaída con adenopatías supradiafragmáticas y una masa retroareolar a nivel de la mama derecha, cuya biopsia fue compatible con un LCM blastoide (Ki-67: 75%). Por este motivo, se comenzó una segunda línea de tratamiento con quimioterapia según el esquema alternante R-CHOP/R-DHAP (4 ciclos). Tras evaluar la respuesta al mes, se evidenció una respuesta parcial, observando en la PET-TC una persistencia de la masa retroareolar derecha (fig. 1).
Ante una respuesta parcial del tratamiento y debido a la localización única del linfoma a nivel de la mama derecha, se decidió realizar resección quirúrgica de la masa. Se intervino a través de una incisión de Stewart, hallando una tumoración con retracción del pezón y realizando una mastectomía simple. El análisis histopatológico puso de manifiesto una tumoración de 4×2,5×3,7cm, próxima al borde profundo de resección, correspondiendo a un LCM (variante agresiva o blastoide), con 20-22 mitosis por 10 campos de gran aumento. En el estudio inmunohistoquímico expresaba CD20, CD79a, Bcl-2, PAX5 y CD5, sobreexpresaba de forma intensa ciclina D1, mostraba restricción para cadenas ligeras de tipo lambda, el índice proliferativo (Ki-67) era del 70%, y se identificó una sobreexpresión moderada de p53.
Tras una nueva evaluación de la enfermedad, al mes de la intervención, se evidenció una remisión completa, decidiendo la realización de un trasplante autólogo de sangre periférica. A los 11 meses del trasplante, se evidenció una nueva recaída sistémica, y 2 meses después, el paciente falleció por una infección fúngica invasiva tras fiebre neutropénica.
El linfoma primario de mama es raro, comprendiendo el 1% de los linfomas no Hodgkin, y menos del 3% de los linfomas extranodales2. La definición de linfoma primario de mama aportada por Wiseman y Liao3 y modificada por Hugh et al.4, requiere la presencia de tejido mamario muy próximo al linfoma, la ausencia de antecedentes personales de linfoma y la no diseminación extramamaria, salvo los ganglios linfáticos ipsilaterales. El linfoma de mama secundario, más frecuente, se define como la presencia de linfoma sistémico con afectación de la mama simultánea o posterior. En la práctica clínica es difícil distinguir entre afectación mamaria primaria con diseminación secundaria y afectación primaria a otro nivel con afectación mamaria secundaria2. En el caso que se presenta se trataba de un linfoma secundario.
El LCM es un linfoma no Hodgkin caracterizado por la afectación de los ganglios linfáticos, bazo, sangre y médula ósea, con un periodo corto de remisión tras las terapias convencionales1. Existen 3 patrones de crecimiento histológico (zona del manto, nodular y difuso) y 4 variantes citológicas (clásica, de células pequeñas, pleomórfica y blástica)5. La translocación cromosómica t(11:14) es la alteración molecular distintiva, con una sobreexpresión de ciclina D1. Según el índice pronóstico internacional del LCM, los pacientes de bajo riesgo tienen supervivencia global a 5 años del 60%, los de riesgo intermedio una mediana de supervivencia global de 51 meses y los de alto riesgo una mediana de supervivencia global de 29 meses1.
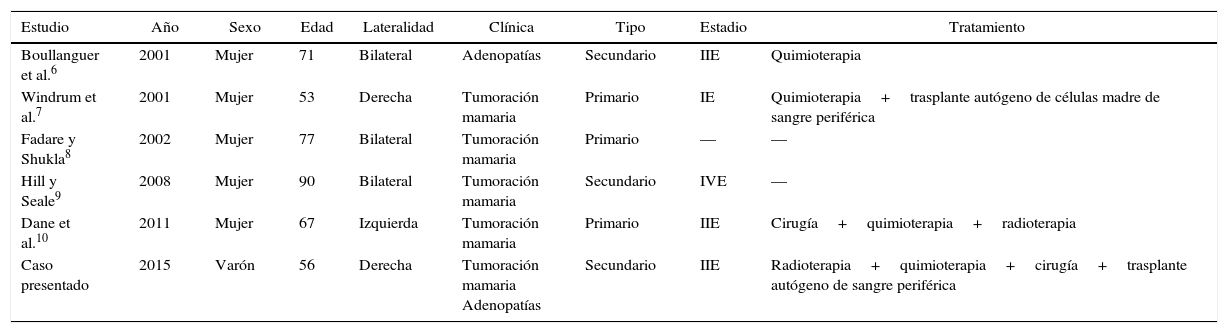
Pocos son los casos descritos en la literatura de LCM a nivel mamario (tabla 1)6–10, y este caso, en el conocimiento de los autores, es el primero en el que se describe un LCM a nivel de la mama en un varón.
Casos de linfoma de células del manto a nivel mamario, documentados en la literatura
| Estudio | Año | Sexo | Edad | Lateralidad | Clínica | Tipo | Estadio | Tratamiento |
|---|---|---|---|---|---|---|---|---|
| Boullanguer et al.6 | 2001 | Mujer | 71 | Bilateral | Adenopatías | Secundario | IIE | Quimioterapia |
| Windrum et al.7 | 2001 | Mujer | 53 | Derecha | Tumoración mamaria | Primario | IE | Quimioterapia+trasplante autógeno de células madre de sangre periférica |
| Fadare y Shukla8 | 2002 | Mujer | 77 | Bilateral | Tumoración mamaria | Primario | — | — |
| Hill y Seale9 | 2008 | Mujer | 90 | Bilateral | Tumoración mamaria | Secundario | IVE | — |
| Dane et al.10 | 2011 | Mujer | 67 | Izquierda | Tumoración mamaria | Primario | IIE | Cirugía+quimioterapia+radioterapia |
| Caso presentado | 2015 | Varón | 56 | Derecha | Tumoración mamaria Adenopatías | Secundario | IIE | Radioterapia+quimioterapia+cirugía+trasplante autógeno de sangre periférica |
La terapia óptima incluye el régimen de quimioterapia R-CHOP y radioterapia loco-regional, que parece reducir el riesgo de recidiva local1,2. La resección quirúrgica de un linfoma de mama ha demostrado un mal control local. En pacientes tratados solamente con cirugía, en el estadio IE y IIE la supervivencia global a 5 años es del 40,5 y 20,5%, respectivamente. Por todo esto, la resección quirúrgica debe evitarse e indicarse únicamente para la obtención de biopsias2. De los casos de LCM mamarios descritos en la literatura, solamente en uno se realizó resección quirúrgica, qué combinada con quimioterapia y radioterapia, tuvo una supervivencia global de 73 meses10. En nuestro caso, se consiguió una remisión completa durante 11 meses.
Por tanto, considerando la excepcionalidad y el hecho de ser un único caso, en contra de lo que se acaba de exponer como comunicado en la literatura, en el LCM a nivel de la mama, la cirugía podría considerarse un gesto útil para incrementar el periodo en remisión completa.