La enfermedad diseminada metastásica es la principal causa de muerte de los pacientes con cáncer colorrectal Manuscrito recibido el 12-12-2003 y aceptado el 7-6-2004. pero, a diferencia de otros procesos patológicos, su presencia tanto en la cavidad abdominal como a distancia, en el hígado y el pulmón, no impide en la actualidad plantear un tratamiento con intención curativa en grupos seleccionados de pacientes.
La elevada incidencia del cáncer colorrectal, el tumor digestivo más frecuente, la afección carcinomatosa en el 10-20% de los pacientes, tanto inicial como durante la enfermedad, la historia natural de los pacientes con diseminación peritoneal por cáncer colorrectal con supervivencias < 6 meses cuando son tratados con esquemas terapéuticos convencionales y el fracaso de la quimioterapia sistémica en el tratamiento de estos desafortunados pacientes a pesar de la aplicación de nuevos fármacos y esquemas de quimioterapia han obligado al desarrollo de nuevas actitudes y alternativas terapéuticas.
Desde 1982, Sugarbaker planteó la diseminación peritoneal como un estadio locorregional de la enfermedad y desarrolló una nueva alternativa terapéutica basada en el tratamiento de la enfermedad macroscópica mediante cirugía citorreductora radical oncológica, merced a las peritonectomías por él desarrolladas, seguido del tratamiento de la enfermedad residual microscópica con la aplicación directa intraabdominal de quimioterapia de intensificación locorregional modulada por hipertermia intraoperatoria y de quimioterapia intraabdominal postoperatoria precoz.
Pues bien, con este nuevo esquema terapéutico, su grupo está obteniendo supervivencias a los 5 años del 30% tras citorreducciones completas y, en grupos seleccionados, incluso curaciones de enfermos hasta ahora erróneamente considerados terminales1 .
Estos resultados espectaculares nos obligan a presentar la revisión actualizada de las bases y fundamentos de esta alternativa terapéutica que desde el año 1997 se está implantando y desarrollando en nuestro medio de trabajo, aquí en España.
Historia natural de la carcinomatosis no tratadaIncidencia de la carcinomatosis peritoneal por cáncer colorrectal
El cáncer colorrectal constituye un problema de salud pública en los países occidentales, al ser la segunda neoplasia más frecuente en los varones y la tercera en las mujeres. La incidencia mundial de cáncer colorrectal se estima en 945.000 pacientes por año2 . Según los registros de tumores de nuestro país, en el año 2000 se registraron 19.166 nuevos casos de cáncer colorrectal en España3 .
Muchos de estos pacientes se presentan con metástasis, un 10% en el momento del diagnóstico inicial4 y hasta el 50% desarrollará metástasis durante la enfermedad. Los lugares de presentación de las metástasis, en orden de frecuencia, son el hígado, el peritoneo, el pulmón, los huesos y el cerebro5 .
La incidencia exacta de carcinomatosis peritoneal como lugar de recurrencia no se conoce con certeza, pues la mayoría de los estudios analíticos y de imagen utilizados en el seguimiento de los pacientes con cáncer colorrectal no permiten detectar la enfermedad en estadios iniciales. Se estima que la recurrencia inicial en el peritoneo es de un 10-20% después de cirugía curativa exerética por cáncer de colon. Aunque se sabe que la diseminación peritoneal aparece en el 40-70% de los pacientes con enfermedad recurrente, tan sólo el 5-8% presenta la enfermedad confinada exclusivamente al peritoneo6 .
En laparotomías realizadas en pacientes sintomáticos con evidencias analíticas o radiológicas de progresión de la enfermedad clínica, se ha observado diseminación carcinomatosa en la mitad de ellos, mientras que ha sido el lugar único de recurrencia en sólo el 2-18% de los casos. La revisión de Brodsky et al7 sobre el devenir de los pacientes tratados curativamente por un cáncer colorrectal mostró que el 25-35% presentó una recidiva peritoneal y que, en el 15% de ellos, esta recidiva peritoneal era la única localización metastásica de la enfermedad. Es este reducido grupo de enfermos, conocido como con diseminación peritoneal predominante8 , el que puede beneficiarse de un tratamiento con intención curativa de la carcinomatosis peritoneal, con la condición de que la resección sea completa.
Historia natural de la carcinomatosis de origen colorrectal
El término carcinomatosis peritoneal fue empleado inicialmente por Sampson en 19319 para describir la diseminación regional del cáncer en el carcinoma ovárico; se consideraba que el mecanismo de diseminación era principalmente la implantación, aunque la diseminación venosa y linfática se contemplaba en algunos casos. Este concepto ha sido aceptado en general hasta la actualidad.
La carcinomatosis peritoneal es una forma de diseminación locorregional intraabdominal de los cánceres gastrointestinales, ginecológicos y de otros tumores, con o sin evidencia de enfermedad metastásica sistémica. Se manifiesta por la presencia de nódulos tumorales de tamaño, número y distribución variables en la superficie peritoneal. Hay una enorme variedad de manifestaciones individuales de la enfermedad, que van desde la presencia de algunos nódulos pequeños superficiales en la vecindad del tumor primario hasta cavidades abdominales completamente ocupadas por grandes depósitos tumorales invasivos10 .
Esta afección regional de la enfermedad cancerosa se ha asociado tradicionalmente con un mal pronóstico y casi de manera uniforme con incurabilidad. En el tratamiento de estos pacientes se han incuido desde laparotomías para la toma de biopsias hasta resecciones extensas de tumor, con la posterior remisión de los enfermos a sus oncólogos para recibir quimioterapia sistémica11 .
La mayoría de estos pacientes sufría terriblemente y en una media de 9 meses fallecía a causa de una obstrucción intestinal o de inanición terminal12 .
En ocasiones, los pacientes requerían una intervención quirúrgica por oclusión intestinal, hemorragia, perforación y ascitis profusa. Debido a los bajos índices de supervivencia de estos pacientes, algunos cirujanos sugerían mantener una actitud abstencionista en casos seleccio-nados 13,14 .
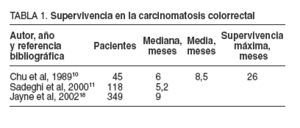
TABLA 1.Supervivencia en la carcinomatosis colorrectal
La carcinomatosis peritoneal es la causa de muerte más común en pacientes con una resección por cáncer intraabdominal15 . Según Sugarbaker16,17 , la persistencia de células tumorales en la cavidad abdominal o en la pelvis es la causa de la muerte del 30-50% de los pacientes.
Las metástasis peritoneales del cáncer colorrectal se consideran en el momento actual de igual manera que la enfermedad metastásica a distancia o diseminada y, por tanto, son tratadas con quimioterapia sistémica o con cirugía junto con quimioterapia sistémica, ambas únicamente con intención paliativa6 .
Pocos son los estudios publicados sobre la historia natural de la carcinomatosis de origen colorrectal. La mediana de supervivencia observada en pacientes con carcinomatosis colorrectal fue de 6 meses para Chu et al10 , de 5,2 meses en el estudio multicéntrico EVOCAPE de Sadeghi et al11 y de 9 meses en la serie más importante y reciente de Jayne et al18 (tabla 1).
La carcinomatosis peritoneal es una forma común de progresión de la enfermedad en pacientes con cáncer colorrectal. De 2.756 pacientes con esta enfermedad, en 349 (13%) se identificó una carcinomatosis peritoneal, que en 214 era sincrónica y en 135 metacrónica. Un total de 125 (58%) pacientes con enfermedad sincrónica estaban libres de enfermedad metastásica y 80 de ellos tenían la enfermedad con una carcinomatosis peritoneal localizada, definida como la afección por el tumor de sólo una de las 5 regiones abdominopélvicas. La supervivencia media en los casos con enfermedad localizada fue de 9 meses, y de 4 meses cuando la enfermedad estaba generalizada. En los pacientes con indicación para la intervención quirúrgica, la extensión de la carcinomatosis parece ser el único indicador de supervivencia16,17 .
La incidencia de carcinomatosis peritoneal en este estudio fue del 13%, comparable con la de otros trabajos. Lo más relevante del estudio es el grupo que desarrolla carcinomatosis localizada en ausencia de enfermedad en cualquier otro emplazamiento, ya que seguramente es el que se puede beneficiar de la cirugía citorreductora con quimioterapia intraperitoneal hipertérmica (QTIH)16,17 .
Pestieau y Sugarbaker1 han planteado que si la carcinomatosis de colon es de poco volumen y se tratara mediante cirugía citorreductora con quimioterapia intraperitoneal intraoperatoria, la supervivencia a los 5 años mejoraría. La citorreducción completa es esencial para conseguir una supervivencia a largo plazo. Si todo el cáncer visible puede ser resecado, la enfermedad residual puede ser erradicada mediante una adecuada quimioterapia intraperitoneal perioperatoria. El control efectivo regional pospondrá la muerte en la mayoría de los casos y, posiblemente, curará a algunos pacientes19 .
La historia natural de la enfermedad y la heterogeneidad de los pacientes es tal que con sólo un estudio aleatorizado prospectivo se contestaría adecuadamente a las preguntas sobre si el tratamiento locorregional prolonga la supervivencia.
Aunque los beneficios de la cirugía citorreductora con quimioterapia intraperitoneal intraoperatoria tienen que ser validados por estudios prospectivos aleatorizados, hay un interés y entusiasmo crecientes por esta nueva alternativa de tratamiento, particularmente a la vista del nefasto pronóstico asociado con los tratamientos conven-cionales16,17 .
El 85% de los pacientes con carcinomatosis de origen colorrectal fallece con la enfermedad confinada al abdomen20 .
Tratamientos con quimioterapia sistémica en el cáncer avanzado de colon y recto
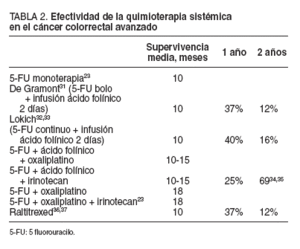
Durante los últimos 40 años, el 5 fluorouracilo (5-FU) ha sido prácticamente la única opción quimioterapéutica eficaz en pacientes con cáncer avanzado de colon y recto, y todavía es considerado el fármaco fundamental, aunque en la práctica sólo produce respuestas completas en el 10% de los pacientes, con una media de supervivencia de 9-12 meses y sólo un 5% de los pacientes vivos a los 3 años21,22 .
Un metaanálisis de las publicaciones disponibles en 1992 demostró una respuesta de un 11% para el 5-FU en monoterapia, frente a un 23% cuando se modulaba con ácido folínico22 . Otro metaanálisis en el que se comparaban las distintas formas de administración del 5-FU mostró una superioridad de la infusión continua frente a los bolos en respuesta y supervivencia23,24 . Las combinaciones de 5-FU/LV con oxaliplatino o irinotecan (CPT-11) son, en la actualidad, los tratamientos disponibles más activos en el cáncer avanzado colorrectal25-29 .
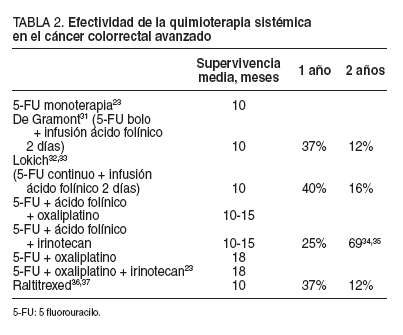
Últimamente se está estudiando otros agentes quimioterapéuticos, como las fluorpirimidinas orales (UFT, capecitabina) y el raltitrexed (tomudex), y se ha demostrando una equivalencia en la tasa de respuestas, una mejor tolerancia que con los esquemas clásicos y la ventaja de su administración oral en muchos casos. Sin embargo, no se ha conseguido mejorar la supervivencia30-32 . Los principales estudios multicéntricos aleatorizados en fase III de quimioterapia adyuvante se exponen en la tabla 2 23,31-37.
Los estudios publicados sobre la terapia sistémica de la enfermedad avanzada colorrectal no se centran en la enfermedad peritoneal diseminada, sino que en su mayoría son estudios sobre la afección hepática, por ser la forma más fácil de medir la enfermedad. El tratamiento para la enfermedad metastásica no se administra con intención curativa, excepto en la situación de metástasis hepática o pulmonar. Sólo en pacientes con resecciones hepáticas curativas se han conseguido supervivencias a los 5 años del 25-40%, aunque en el 60-70% de los casos la enfermedad recidivará en el hígado o el pulmón 38 . Los objetivos principales del tratamiento médico de la enfermedad avanzada colorrectal son, en estos casos, prolongar la supervivencia y mejorar la calidad de vida del paciente 39 , en un intento de cronificar la enfermedad. La mayoría de los casos con metástasis peritoneales de origen gastrointestinal son relativamente resistentes a los fármacos citostáticos sistémicos, con un claro efecto dependiente de la dosis 19 . La quimioterapia sistémica no es suficiente, pero tampoco lo es la cirugía sola 1 .
TABLA 2. Efectividad de la quimioterapia sistémica en el cáncer colorrectal avanzado
A pesar de los avances en los fármacos quimioterapéuticos, no se dispone de tratamientos satisfactorios para la carcinomatosis peritoneal. La principal razón de estos resultados pesimistas puede ser que los fármacos citostáticos administrados no actúen en las metástasis peritoneales en concentraciones suficientemente altas40 .
Peritonectomía y cirugía citorreductoraLa erradicación del tejido tumoral maligno es el objetivo principal de cualquier tratamiento con intención curativa en cirugía oncológica. Este principio ha quedado suficientemente demostrado en la cirugía del tumor primario y en la enfermedad metastásica de hígado y pulmón41 .
El objetivo de la cirugía citorreductora es conseguir una extirpación completa de la enfermedad tumoral macroscópica42 . Fue Sugarbaker quien desarrolló una técnica quirúrgica específica que posibilita la realización de peritonectomías mediante el uso de electrocirugía en pacientes con carcinomatosis peritoneal43 . Se puede precisar hasta 6 diferentes peritonectomías para conseguir suprimir la enfermedad, lo que puede requerir entre 8 y 12 h de cirugía44 . Las peritonectomías se utilizan exclusivamente en áreas con tumor visible y con la intención de reducir la enfermedad a escala microscópica, aunque a esa escala la cirugía sola no puede ser completa19 .El principal inconveniente del tratamiento de la enfermedad peritoneal es la imposibilidad de completar una resección quirúrgica, dado que siempre se produce una diseminación invisible en la cavidad abdominal45 .
La experiencia ha demostrado que, si se utiliza la cirugía sola, el 100% de los pacientes presentará recidiva, a pesar de las aparentes localización de la enfermedad y su completa resección46 .
Cabe esperar la reimplantación de células malignas en las superficies de las peritonectomías en pacientes con carcinomatosis peritoneal, a menos que se use asociada con quimioterapia intraperitoneal peroperatoria. El respeto del peritoneo constituye la primera línea defensiva frente a la carcinomatosis; las peritonectomías se utilizan exclusivamente en áreas con tumor visible17 .
No respetar el peritoneo como primera línea de defensa contra la carcinomatosis produce:
–Mayor diseminación.–Aparición de implantes en estructuras vitales.
–Los implantes más profundos no pueden ser extirpados mediante peritonectomías.
–Menos citorreducciones curativas 44 .
En todos los cánceres, el tratamiento precoz agresivo de la enfermedad diseminada peritoneal en sus niveles mínimos muestra los mejores resultados17 . En la carcinomatosis peritoneal de origen colorrectal sólo se puede conseguir supervivencias prolongadas después de haber resecado todos los implantes visibles y/o los órganos afectados47 .
Sin embargo, en ocasiones no es posible erradicar la enfermedad. Los principales límites son el peritoneo visceral, tanto en el hilio hepatobiliar como en la retracción del mesenterio, y la afección masiva del intestino delgado por infiltración tumoral48 .
Interés de la quimioterapia intraperitonealEl interés por la quimioterapia intraperitoneal no es nuevo. Ya en 1955, Weissberger et al49 recogieron los resultados del tratamiento de 7 pacientes con cáncer de ovario que recibieron quimioterapia intraperitoneal con mostaza nitrogenada.
Los principales estudios farmacocinéticos fueron realizados por Dedrick et al en 197850 , y en ellos encontraron que los fármacos citostáticos hidrófilos pueden mantener un gradiente de concentración significativo por la barrera peritoneo-plasmática cuando se añaden en la cavidad abdominal en grandes volúmenes. Sin embargo, también en sus estudios demostraron que el factor limitativo más importante para el uso clínico de la quimioterapia intraperitoneal era la escasa penetración de los fármacos utilizados en los tejidos tumorales. En la actualidad se cree que la difusión de los citostáticos es máxima en 1-3 mm en la periferia del tumor51 .
Por estos motivos, en la actualidad se acepta, en general, que sólo los pacientes con enfermedad residual mínima después de la cirugía pueden beneficiarse de la quimioterapia intraperitoneal. A menudo no es posible extirpar por completo la enfermedad tumoral macroscópica. La mayoría de los grupos considera que la quimioterapia intraperitoneal sólo es útil si los nódulos residuales tumorales son < 3 mm.
La administración de quimioterapia intraperitoneal tiene el beneficio de proporcionar concentraciones más altas de citostáticos en el lugar donde se encuentra el tumor, a la vez que se minimizan los efectos tóxicos sistémicos en comparación con los producidos por la administración intravenosa sistémica52 .
La quimioterapia intraperitoneal en el tratamiento y prevención de las enfermedades peritoneales fue introducida en los comienzos de la década de los ochenta19 .Ya Sugarbaker aconsejaba la utilización de quimioterapia intraperitoneal en los cánceres avanzados colorrectales en 198553 .
Gilly et al54 aportaron la primera experiencia en Europa siguiendo la escuela de Fujimoto et al y Koga et al55,56 .
Básicamente, el grupo occidental liderado por Sugarbaker se superespecializó en carcinomatosis colorrectal y seudomixoma peritoneal, mientras que los investigadores orientales liderados por Yonemura lo hicieron en carcinomatosis gástrica.
Tres son las causas por las que la utilización de la quimioterapia intraperitoneal ha tenido un éxito limitado y escasa aceptación por los oncólogos:
–La limitada penetración de los fármacos en los nódulos tumorales. Los citostáticos sólo penetran en las capas celulares más externas, lo que obliga a que la enfermedad microscópica residual sea la enfermedad diana para los protocolos de este tipo de tratamiento.–La falta de distribución uniforme de los citostáticos en la cavidad abdominal por las adherencias y la presencia de un tumor de gran volumen.
–La elección inadecuada de los pacientes.
En la actualidad se ha producido un importante cambio en la utilización de la quimioterapia. Se ha modificado la ruta de administración, y ahora la quimioterapia se administra intraperitonealmente, por lo que actúa donde la enfermedad está. También se produce un cambio en el tiempo, dado que la quimioterapia comienza ha administrarse en el mismo quirófano intraoperatoriamente, justo tras finalizar la extirpación citorreductora de la enfermedad macroscópica, cuando tan sólo hay una enfermedad microscópica residual. Por último, un tercer cambio se produce en los criterios de selección de los enfermos candidatos a este tratamiento, al ser necesaria una citorreducción completa de la enfermedad antes de la administración de los citostáticos, por lo que el tamaño de los implantes residuales tiene una importancia crucial17,44,57 .
El mayor cambio está por producirse, y será el cambio de actitud de los oncólogos hacia el tratamiento de la enfermedad avanzada colorrectal. La carcinomatosis peritoneal es potencialmente curable con la aplicación precoz de este nuevo tratamiento combinado17 .
Quimioterapia intraperitoneal con hipertermia. Beneficios de la hipertermiaLa utilización terapéutica del calor es conocida desde el aforismo Hipocrático (sección VII, # 83), que afirmaba que lo que la medicina no cura, lo cura el hierro (bisturí), lo que no cura el hierro, lo cura el fuego, y lo que el fuego no cura, es realmente incurable58 .
La hipertermia por sí misma tiene un efecto citotóxico causado por las alteraciones en la reparación del ADN, la desnaturalización de las proteínas, la inducción de proteínas de shock térmicas, la inducción de la apoptosis y la inhibición de la angiogénesis.
La verdadera hipertermia se define con temperaturas ≥ 41 °C. La sinergia de las citostáticos puede también ocurrir a temperaturas de 39-41 °C.
No hay un consenso todavía sobre la temperatura óptima durante la quimioterapia hipertérmica. Como se ha señalado anteriormente, la sinergia comienza a temperaturas de 39 °C, pero es mayor a temperaturas superiores. Por otro lado, temperaturas > 43 °C no muestran sinergias mayores y sí la aparición de lesiones en el intestino delgado producidas directamente por el efecto térmico59 .
Spratt et al60,61 comenzaron los estudios experimentales para conseguir un tratamiento local en la carcinomatosis que combinara la quimioterapia con la hipertermia. Estos estudios finalmente fructificaron en la primera aplicación de quimioterapia intraperitoneal intraoperatoria en el tratamiento de un seudomixoma peritoneal humano en febrero de 1979.
En el momento actual, los intercambiadores de calor empleados en la práctica habitual han sido diseñados para su utilización en la circulación extracorpórea y, por ello, presentan el límite de temperatura de 41 °C, para evitar la lisis de los hematíes. Por esto y por las pérdidas de temperatura de los circuitos utilizados para la administración de la quimioterapia, no puede conseguirse más que una moderada hipertermia con los instrumentos convencionales disponibles. Nosotros hemos conseguido incorporar en el circuito un calentador supletorio que nos asegura una temperatura uniforme de 42 °C en la cavidad durante todo el procedimiento.
La técnica abierta de la quimiohipertermia permite el control continuado de la solución irrigante, lo que evita los daños que el calor local pueda producir en el intestino por el contacto prolongado en un mismo punto, a la vez que asegura su homogénea distribución por la cavidad sin que queden lugares o recovecos ocultos a su exposición. Los estudios del Instituto del Cáncer de Washington permiten afirmar que no hay ningún riesgo para el personal de quirófano durante la práctica de esta técnica62 .
Elección de los fármacos y farmacocinéticaLas ventajas farmacocinéticas de la quimioterapia intraperitoneal son el factor más importante en el uso racional de la QTIH en la enfermedad maligna de la superficie peritoneal.
El movimiento de los fármacos de peso molecular elevado desde la cavidad peritoneal al compartimiento circulatorio del organismo es mucho más lento que el aclaramiento de los fármacos desde el compartimiento sistémico. Este principio crea un gradiente de concentración debido a la barrera peritoneo-plasmática, fuertemente a favor de la concentración intraperitoneal. Las sustancias con un peso molecular elevado son confinadas en la cavidad abdominal durante largos períodos, lo que permite realizar tratamientos de intensificación. La práctica de peritonectomías con la extirpación del peritoneo parietal no altera este fenómeno de santuario de la cavidad peritoneal 17 .
TABLA 3. Área bajo la curva de los fármacos utilizados en la clínica en el tratamiento de enfermedad peritoneal diseminada
Los fármacos citostáticos utilizados deben reunir las siguientes características:
–Deben tener un elevado peso molecular y ser hidrosolubles.–Deben ser rápidamente aclaradas de la circulación sistémica y su eficacia debe tener sinergia con la hipertermia.
–Deben ser fármacos no específicos de los ciclos celulares debido a que son citotóxicos incluso en períodos de exposición relativamente cortos.
Los fármacos utilizados con más frecuencia y estudiados como agentes quimioterapéuticos intraperitoneales han sido la MMC (mitomicina C) intraoperatoria con un gradiente de concentración peritoneo-plasmático > 63,64 junto con el 5-FU en régimen de quimioterapia intraperitoneal postoperatoria precoz65 . Recientemente se ha estudiado la aplicación intraperitoneal de nuevos fármacos considerados de segunda línea en el tratamiento sistémico de la enfermedad avanzada66,67 . Con estos nuevos esquemas se han conseguido los mejores resultados, con supervivencias a los 2 años del 74%; asimismo, se ha postulado si la adición de irinotecan al oxaliplatino podría incluso mejorar en el futuro la eficacia de este tratamiento de intensificación locorregional intraabdominal47 .
Parece que cuanto más elevada es la temperatura abdominal, mayor es el gradiente de concentración perito-neo-plasmático. La duración de la perfusión no parece guardar relación con el gradiente peritoneo-plasmático. En la mayoría de los estudios, la vida media del fármaco es ≤ 90 min. No hay estudios suficientes sobre la profundidad de penetración de la MMC después de su administración intraperitoneal, pero sí se dispone de estudios sobre la penetración tras la administración por instilación vesical en los que se ha comprobado su presencia en el urotelio, la lámina propia e incluso en capas musculares, lo que sugiere que penetra al menos algunos milímetros68 .
Hay pocos trabajos sobre la dosis máxima tolerada en QTIH. Los estudios farmacocinéticos realizados en el Instituto del Cáncer de Holanda6 han demostrado una inaceptable toxicidad sistémica en dosis de 40 mg/m2 , tras haber fijado el límite en su estándar de tratamiento en 35 mg/m2 . En la tabla 3 se muestran los principales fármacos que pueden ser utilizados en tratamientos con QTIH.
Índice de carcinomatosis peritoneal. Selección de pacientesLa introducción de la cirugía citorreductora combinada con regímenes de quimioterapia intraperitoneal promete aumentar los tiempos de supervivencia en pacientes seleccionados con carcinomatosis peritoneal1 .
Esta alternativa al tratamiento agresivo en la enfermedad diseminada peritoneal comprende la práctica de peritonectomías para el tratamiento de la enfermedad macroscópica, la administración de QTIH para el control de la enfermedad microscópica y una selección juiciosa de los pacientes.
Los parámetros clínicos necesarios para la selección juiciosa de pacientes incluyen: el tipo histológico del tumor (progresión invasiva frente a la expansiva o por aposición), el grado de la enfermedad y el grado de citorreducción conseguido. Es imprescindible la correcta selección de los pacientes para conseguir optimizar los resultados42 .
Se ha utilizado diferentes índices para determinar el grado de afección peritoneal, lo que permite estadificar a los pacientes y correlacionarlos con los resultados obtenidos69 .
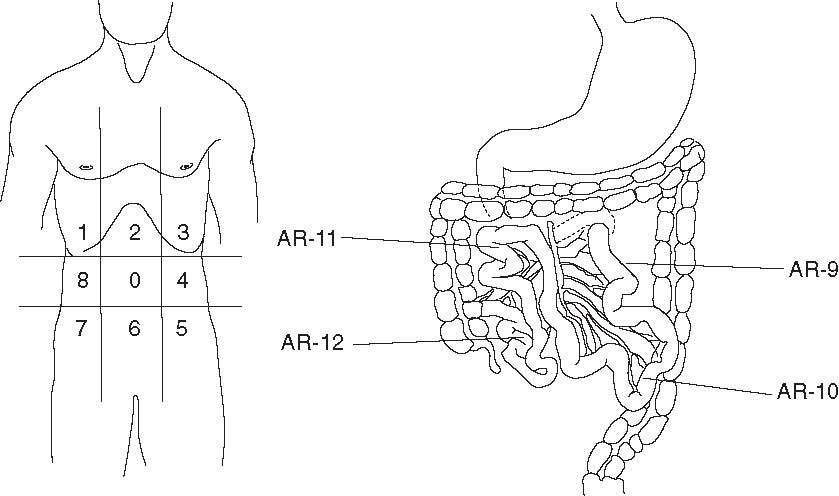
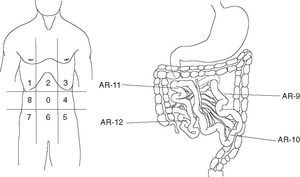
Gómez Portilla et al70-72 han desarrollado un método objetivo para determinar el grado de la enfermedad conocido como Índice de Carcinomatosis Peritoneal (ICP). Con este método se mide la presencia de enfermedad y su tamaño en 13 diferentes regiones abdominales antes de realizar la cirugía citorreductora y se determina con una puntuación el tamaño lesional: LS0 cuando no hay enfermedad visible, LS1 ante tumor ≤ 0,5 cm, LS2 con tumor ≤ 5 cm y LS3 cuando el tamaño tumoral es > 5 cm. El sumatorio del tamaño lesional en cada una de las regiones abdominopélvicas constituye el ICP, como se muestra en la figura 1, donde 39 es la puntuación máxima obtenible (13 regiones × 3).
Al finalizar la citorreducción se determina el grado de enfermedad residual mediante el índice de citorreducción obtenido, que refleja la ausencia de enfermedad macroscópica residual: CC0 indica que no queda enfermedad macroscópicamente visible al finalizar la citorreducción, CC1 significa que tras la citorreducción persisten implantes tu-morales < 2,5 mm, límite del tamaño tumoral que se considera tratable mediante la quimioterapia de intensificación locorregional intraabdominal, CC2 indica un residuo tumoral tras la citorreducción entre 2,5 mm y 2,5 cm y, finalmente, CC3 implica un tamaño > 2,5 cm del tumor residual tras la citorreducción o una confluencia de nódulos no resecados en cualquiera de las regiones abdominopélvicas antes enumeradas. Una citorreducción CC2 o CC3 es considerada paliativa por incompleta y en ella no procede la administración de quimioterapia intraperitoneal, al ser ineficaz.
Ambos índices, el ICP y el índice de citorreducción conseguida, son los principales factores pronósticos en este tipo de enfermedades17 .
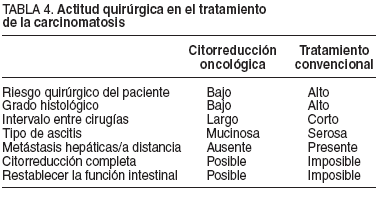
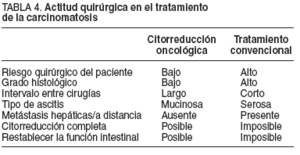
El uso de estos índices será imprescindible, por cuanto nos ayudará a seleccionar a los pacientes y evitará cirugías innecesarias en pacientes de alto riesgo que no se beneficiarán de esta modalidad de tratamiento, ya que sólo se ha conseguido obtener supervivencias prolongadas en pacientes con una citorreducción completa17 .El cirujano debe recordar que no hay supervivientes a largo plazo a no ser que se consiga una citorreducción completa de la enfermedad. La presencia de enfermedad residual en lugares anatómicos difíciles y cruciales puede en ocasiones comprometer un ICP inicialmente favorable44 . Los enfermos con enfermedad sistémica metastásica obviamente no son candidatos a este tratamiento6 .En la tabla 4 se muestran los condicionantes clínicos de la actitud quirúrgica en el tratamiento de la carcinomatosis.
Fig. 1. Regiones abdominopélvicas. Índice de carcinomatosis peritoneal.
La utilización del ICP permitirá en el futuro seleccionar a los pacientes susceptibles de tratamiento oncoquirúrgico; una contraindicación será un índice de carcinomatosis peritoneal > 2467 .
Cuando en el transcurso de una laparotomía se detecta de forma inesperada una enfermedad diseminada peritoneal, la actitud más conveniente para el paciente sería la realización de una estadificación intraoperatoria de la enfermedad según el ICP y la determinación del grado de la enfermedad y su localización lo más detallada posible; esto se debería acompañar del menor gesto quirúrgico que permita solucionar temporalmente la situación. A continuación se remitirá al paciente a un centro de referencia especializado en la aplicación de este tipo de tratamiento combinado, siempre que reúna las características de buen estado general con ausencia de comorbilidad limitante y de enfermedad a distancia extraabdominal o enfermedad metastásica intraabdominal no controlable quirúrgicamente.
ComplicacionesLa morbilidad y mortalidad asociadas con esta terapia combinada de citorreducción oncológica radical y quimioterapia de intensificación abdominal son altas1 .
TABLA 4. Actitud quirúrgica en el tratamiento
Las complicaciones pueden derivar directamente de la cirugía, de la hipertermia, de la quimioterapia o de la suma de todas ellas.
Se han publicado tasas de morbilidad y mortalidad muy diversas, con cifras del 0-43% de morbilidad y del 020% de mortalidad6,53,73-76 . Las principales causas de muerte son la perforación intestinal o la dehiscencia de las suturas. También se ha descrito la formación de fístulas intestinales, fugas biliares, pancreatitis o hemorragias postoperatorias. Entre las complicaciones sistémicas, además de las habituales de toda cirugía compleja (trombosis venosa profunda, embolia pulmonar, neumotórax, insuficiencia cardíaca o infartos cerebrales), la aplasia medular o el desarrollo de efectos tóxicos hematológicos son las más temidas.
Es difícil separar las complicaciones secundarias a la cirugía de las relacionadas con la QTIH, tanto por el calor como por los citostáticos, pero la mayoría de las complicaciones descritas parecen relacionarse sobre todo con el grado de agresión quirúrgica. La complicación intestinal más frecuente sigue siendo la perforación causada por el traumatismo quirúrgico en la superficie intestinal durante la resección de los implantes viscerales, posiblemente agravado por la acción del calor y los fármacos citostáticos 6 . Sin embargo, Shido et al 59 han demostrado que la hipertermia por sí sola no es la causante del daño visceral cuando se usa en procedimientos con QTIH.
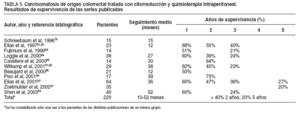
TABLA 5. Carcinomatosis de origen colorrectal tratada con citorreducción y quimioterapia intraperitoneal. Resultados de supervivencia de las series publicadas
TABLA 6. Índice de supervivencia peritoneal
La aplasia medular es un claro resultado de la aplicación de quimioterapia intraperitoneal y depende del fármaco y de la dosis. El nadir de la aplasia medular aparece a las 2 semanas en la quimioterapia intraperitoneal, frente a las 4-6 semanas en la quimioterapia sistémica77 .
La insuficiencia renal tóxica aparece cuando se utilizan esquemas con cisplatino, por lo que precisa siempre la utilización de quelantes tipo tiosulfato.
La mortalidad y la morbilidad están en relación directa con la curva de aprendizaje y la técnica quirúrgica empleada.
Estudios publicadosEstudios en fase II
Los estudios en fase II del tratamiento de carcinomatosis por cáncer colorrectal y peudomixoma son muy numerosos y prometedores1,5,78-94 .
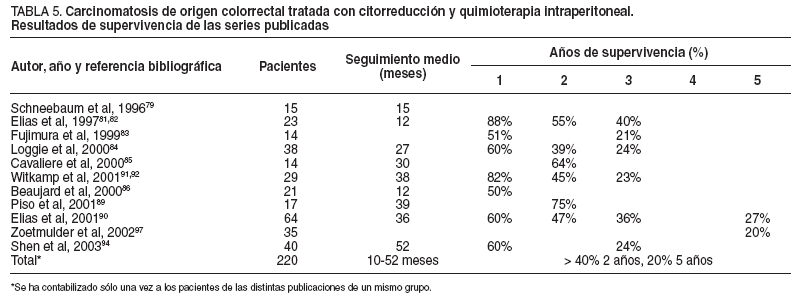
En la tabla 5 se presentan las series publicadas, excluido el grupo de Sugarbaker, con más de 10 pacientes tratados mediante citorreducción y quimioterapia intraperitoneal perioperatoria por carcinomatosis de origen colorrectal.
Esta revisión bibliográfica sugiere de forma clara que se puede obtener al menos un beneficio y en ocasiones la curación en pacientes hasta ahora considerados sólo para tratamientos paliativos. El factor determinante pronóstico en todas estas series ha sido el grado de citorreducción obtenido, dado que la sinergia de la quimioterapia y la hipertermia depende directamente del volumen de la enfermedad residual. La carcinomatosis y, por tanto, la afección peritoneal deben ser consideradas como un órgano, al igual que el hígado o el pulmón, y deben recibir un tratamiento como el que se aplica en éstos, con intención curativa. Las carcinomatosis peritoneales de la mayoría de los cánceres gastrointestinales con bajo ICP, en las que se puede conseguir un buen índice de citorreducción completa, deberían ser tratadas de manera sistemática conforme a los protocolos de la nueva alternativa combinada de tratamiento de citorreducción oncológica radical y quimioterapia de intensificación intraperitoneal perioperatoria. La historia natural de estos pacientes está cambiando, con la aparición de metástasis en lugares más remotos, como el cerebro o el ojo.
En la experiencia personal de Sugarbaker, el 50% de los pacientes con carcinomatsois peritoneal pueden obtener supervivencias prolongadas mediante peritonectomías, quimioterapia intraperitoneal y una selección adecuada de los pacientes15 . En las carcinomatosis de origen colorrectal de su serie con más de 100 pacientes tratados, la supervivencia a los 5 años es del 40%; el principal factor determinante fue el ICP, que condicionó el grado de citorreducción obtenido1,41,82,95,96 (tabla 6).
Estudios en fase III
Hasta el momento, la principal objeción que se planteaba a esta alternativa terapéutica era la falta de estudios prospectivos aleatorizados pero, a pesar de que se han planteado estudios ética y científicamente correctos, los pacientes se negaban a ser incluidos en el tratamiento por azar, por lo que en varias ocasiones hubo que abandonar estos estudios, como ocurrió en todos los planteados en el Instituto Gustave Roussy de París45 .
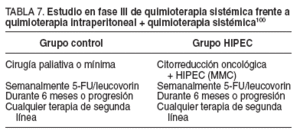
Recientemente, Zoetmulder ha presentado los resultados del primer estudio en fase III realizado en carcinomatosis de origen colorrectal mediante el estudio de la aplicación de quimioterapia intraperitoneal frente a sisté-97-99 , y ya han sido publicados oficialmente100 .
Formaron parte del estudio 105 pacientes; se realizó una comparación entre el grupo control, con tratamiento convencional con 5-FU/leucovorin por vía sistémica, frente al grupo de estudio, en el que además de una cirugía citorreductora se aplicaba tratamiento intraoperatorio intraperitoneal con MMC modulada por hipertermia, seguido de quimioterapia sistémica con 5-FU/leucovorin, como se expone en la tabla 7.
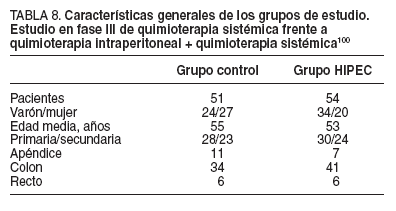
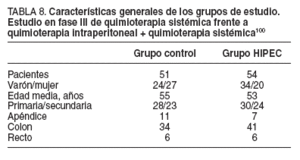
Las características generales de los pacientes de ambos grupos fueron similares y se exponen en la tabla 8.
En el grupo de estudio, el grado de citorreducción oncológica obtenido fue completa (R1), sin enfermedad macroscópica residual, en 18 pacientes (38%). La enfermedad residual fue < 2,5 mm (R2a) en 21 pacientes (43%) y no se consiguió una citorreducción adecuada, con una enfermedad macroscópica > 2,5 mm, en 9 pacientes (19%).
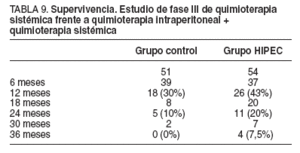
El grado de citorreducción obtenido ha sido el principal factor pronóstico de este estudio y, a pesar de conseguir una citorreducción completa en menos del 40% de los pacientes, la supervivencia obtenida ha sido superior a la de cualquier otro tratamiento conocido hasta el momento (tabla 9).
La mediana de supervivencia de ambos grupos ha sido superior a 1 año. La mediana de supervivencia en el grupo de citorreducción y quimioterapia intraperitoneal ha sido casi el doble de la obtenida en el grupo de tratamiento con quimioterapia sistémica (22,4 frente a 12,6 meses); además, a los 2 años, el 20% de los pacientes tratados con quimioterapia intraperitoneal estaba vivo.
Límites futuros de la cirugía en el cáncer avanzado de colon y rectoSin lugar a dudas, hay razones para continuar con el tratamiento de las carcinomatosis peritoneales de origen colorrectal. Un número cada vez mayor de instituciones y hospitales está adoptando esta estrategia de tratamiento para prevenir y tratar las enfermedades malignas de la superficie peritoneal.
¿Cuándo una investigación clínica debe obtener el grado de práctica habitual? La mayoría de los cirujanos estaría a favor de los estudios en fase III para contestar a las preguntas que plantea el tratamiento de la carcinomatosis de origen colorrectal, pero tradicionalmente la cirugía no ha progresado en el tratamiento de los tumores gastrointestinales con estudios aleatorizados, sino que más bien se ha desarrollado mediante un proceso evolutivo. Sirva como ejemplo el caso del tratamiento quirúrgico de las metástasis hepáticas, que en ausencia de estudios en fase III ha sido validado por muchos grupos y ha evolucionado con los años, llegando después de muchas discusiones a ser considerado un nuevo estándar de práctica médica1 .
Durante 30 años, según preconizó Makuuchi, el tratamiento de las metástasis hepáticas ha sido considerado como paliativo, pero hoy día nadie duda de que el tratamiento quirúrgico radical oncológico de las metástasis sea el estándar de tratamiento con el que confrontar cualquier otra alternativa terapéutica. Igualmente, se acepta la cirugía de las metástasis pulmonares e incluso, en ocasiones, la cirugía de las metástasis cerebrales con intención curativa.
TABLA 7. Estudio en fase III de quimioterapia sistémica frente a quimioterapia intraperitoneal + quimioterapia sistémica100
TABLA 8. Características generales de los grupos de estudio. Estudio en fase III de quimioterapia sistémica frente a quimioterapia intraperitoneal + quimioterapia sistémica100
TABLA 9. Supervivencia. Estudio de fase III de quimioterapia sistémica frente a quimioterapia intraperitoneal + quimioterapia sistémica
Confiamos en que la revisión de los estudios publicados, tanto los de fase II como el estudio en fase III de Zo-etmulder97-100 , permitan que el tratamiento quirúrgico de la diseminación peritoneal en el cáncer colorrectal sea admitido también como estándar de tratamiento en estos pacientes, al ofrecer sin ningún género de dudas los mejores resultados de supervivencia; además, incluso algunos pacientes se encuentran libres de enfermedad después de 5 años, por lo que están potencialmente curados de su enfermedad. En nuestra opinión, nos encontramos, tal y como afirma Sugarbaker, en un punto de no retorno, dado que esta estrategia de tratamiento es eficaz y seguro que su validación como estándar de práctica clínica habitual se producirá conforme se publiquen más estudios en fase II o cuando se consiga realizar un estudio en fase III multicéntrico.
La presencia de metástasis hepáticas ha supuesto hasta ahora un límite en el tratamiento de los enfermos con diseminación peritoneal, al considerarla como una enfermedad sistémica diseminada vía hematógena portal. Sin embargo, Elias et al57 ha demostrado que, en ocasiones, el abordaje simultáneo de la enfermedad peritoneal en el transcurso de cirugías de metástasis hepática ha sido un tratamiento tolerado por sus pacientes y eficiente cuando consigue una citorreducción completa de la enfermedad. Doce de sus pacientes fueron tratados mediante hepatectomía junto con citorreducción completa de la enfermedad peritoneal acompañante y quimioterapia postoperatoria precoz intraperitoneal. En su serie no hubo mortalidad ni complicaciones sistémicas por la quimioterapia, y después de un seguimiento medio de 14,4 meses, no se ha observado la recurrencia de la enfermedad peritoneal en ninguno de los pacientes; además, 7 de ellos están libres de enfermedad. La combinación de hepatectomía y cirugía citorreductora en el tratamiento de la enfermedad avanzada del cáncer colorrectal parece ser, en el momento actual, un tratamiento lógico y realizable con el que se consiguen unos prometedores resultados de supervivencia.
En conclusión, podemos afirmar que el límite actual del tratamiento de la enfermedad colorrectal confinada a la cavidad abdominal (recurrencia locorregional, diseminación peritoneal o metástasis hepáticas) está determinado por que la cirugía asegure una resección radical oncológica de la enfermedad macroscópica, siempre acompañada del tratamiento de la enfermedad microscópica residual mediante la administración simultánea de quimioterapia intraperitoneal perioperatoria.