Introduction. Even when apparently effective curative surgical therapy is performed during the early stages of colorectal cancer, the presence of micrometastases at the time of diagnosis is responsible for distant incurable disease in a significant percentage of patients. The development of metastases in colorectal cancer is a multistep process referred to as the "metastatic cascade". A thorough knowledge of each of these steps and the different factors involved will enable us to identify the more aggressive tumors in order to choose the best therapeutic option available.
Material and methods. A MEDLINE search was carried out to review the literature on the metastatic process associated with colorectal cancer. The purpose was to determine the prognostic value of the molecular markers implicated in the process and assess the new anticancer therapies that target them.
Results and conclusions. The molecular features of highly aggressive human colorectal cancer include mutations of the p53, k-ras, DCC and nm23 genes, which result in the overexpression of proteolytic enzymes (matrix metalloproteinases 2 and 9 and cathepsin B) and adhesion molecules, as well as increased angiogenic activity, indicated by high levels of vascular endothelial growth factor (VEGF) and increased microvascular density (MVD). These factors may become targets for novel gene and antiangiogenic therapies that are still under study.
Introducción
El cáncer colorrectal ocupa el tercer lugar en frecuencia en todo el mundo. En España, aunque la incidencia es más baja que en otros países desarrollados, es el segundo más frecuente en varones después del cáncer de pulmón, con una incidencia del 11,8%. En la mujer la incidencia es del 14,3%, ocupando el segundo lugar después del cáncer de mama. En 1994, 7.266 personas murieron de cáncer colorrectal en nuestro país1.
A pesar de la aparición de nuevos métodos diagnósticos, técnicas quirúrgicas más agresivas2 y mejor terapia coadyuvante, al menos un tercio de los pacientes intervenidos quirúrgicamente debido a cáncer colorrectal con intención curativa mueren a consecuencia de recidiva neoplásica local o a distancia.
La supervivencia global a los 5 años se cifra en un 60%. Sin embargo, el 15-20% de enfermos con cáncer colorrectal en estadios precoces sucumbirán a su enfermedad, y este porcentaje aumentará hasta el 40-80% en estadios avanzados3. Se estima que entre un 10 y un 25% de los enfermos presentan metástasis en el momento del diagnóstico, y que entre un 60 y un 70% de los enfermos que mueren por cáncer colorrectal desarrollan metástasis hepáticas4. La aparición de metástasis representa, por tanto, un serio obstáculo en el tratamiento de estos enfermos. El objetivo de esta revisión es la puesta al día del proceso metastásico en el cáncer colorrectal, así como de las posibles alternativas terapéuticas que se derivan del conocimiento profundo de cada una de las etapas que permiten la aparición de metástasis por cáncer colorrectal.
Proceso metastásico
El proceso metastásico es secuencial y conlleva una serie de etapas que deberán completarse (fig. 1).
1. Crecimiento tumoral inicial.
2. Invasión local.
3. Diseminación sanguínea.
4. Invasión del órgano diana.
5. Establecimiento y crecimiento progresivo en el órgano diana.
No obstante, y a pesar de los efectos devastadores sobre el huésped, el proceso metastático encuentra muchas dificultades para su conclusión. Fidler, en 1970, observa que menos del 1% de las células tumorales radiomarcadas sobreviven en el torrente circulatorio a las 24 h y de éstas, menos del 0,1% son capaces de metastatizar5.
El desarrollo secuencial por etapas del proceso metastásico puede ser considerado ventajoso desde el punto de vista clínico, ya que el conocimiento de las diferentes moléculas que intervienen en cada etapa posibilita la aparición de nuevos métodos terapéuticos.
Crecimiento tumoral inicial
Factores de crecimiento
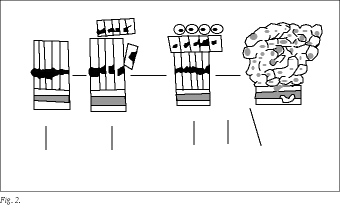
Según el modelo propuesto por Fearon y Vogelstein (1990), el cáncer colorrectal se desarrollaría de una forma ordenada, a través de una serie de cambios genéticos6 (fig. 2). Además, existe la hipótesis que considera la aparición de células tumorales con un fenotipo bioquímico diferente, alta malignidad y poder metastásico, dentro del tumor primitivo y en su progresión a fases avanzadas7.
Entre las alteraciones genéticas específicas cuya expresión molecular se relaciona con el proceso metastásico se encuentra el k-ras (12p), presente en el 40-50% de los cánceres colorrectales esporádicos y relacionado con la formación de adenomas8. La aparición de mutaciones del k-ras disminuye la supervivencia y el período libre de enfermedad en el cáncer colorrectal9-11.
Entre los genes supresores destaca el p53 (17p), cuya mutación aparece en el 70-80% de los cánceres colorrectales12, e interviene en la transformación de adenoma a carcinoma6, siendo fundamental su papel en la angiogénesis. La sobreexpresión de la proteína p53 se utiliza como marcador de las mutaciones del p53, y se relaciona con un peor pronóstico11-18.
La mutación o pérdida del gen delecionado del cáncer colorrectal (DCC), relacionado con las moléculas de adhesión, también intervendrá en la progresión de adenoma a carcinoma19, y se relaciona con tumores en estadios más avanzados20,221 y con peor pronóstico22.
Por último hablaremos del nm23, considerado como gen supresor del proceso metastásico. La expresión de dos proteínas, nm23-H1 y nm23-H2, en el cáncer colorrectal y su significación son controvertidas. Mientras unos autores encuentran que una expresión reducida del nm23 se asocia con estadios avanzados de la enfermedad y metástasis23,24, otros encuentran que la sobreexpresión del nm23 se relaciona con recurrencia, metástasis hepáticas y supervivencia disminuida25-27. Esta aparente contradicción es explicada por Berney27, que cree que la sobreexpresión del nm23 sería debida a una proteína nm23 de tipo mutante como consecuencia de la deleción del nm23. No obstante, otros trabajos recientes no han podido relacionar la expresión del nm23 con la estadificación y/o pronóstico28-30.
Angiogénesis
Es necesario, para mantener el crecimiento tumoral inicial, un aporte suficiente de nutrientes que se realizará mediante la angiogénesis. La angiogénesis consiste en la formación de nuevos vasos a partir de los ya existentes31-33.
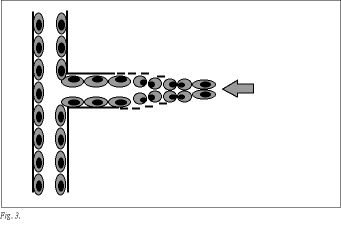
La angiogénesis conlleva un complejo proceso secuencial, en el que se distinguen cuatro etapas tras la activación de las células endoteliales: en un principio se producirá la degradación de la membrana basal y la matriz extracelular por enzimas proteolíticas. Posteriormente existirá proliferación de células endoteliales. Más tarde existirá retracción de los pericitos y migración de las células endoteliales, para formarse cordones celulares sólidos. Por último se formarán los nuevos vasos, anasto mosándose con los vasos ya existentes e iniciándose el flujo34 (fig. 3).
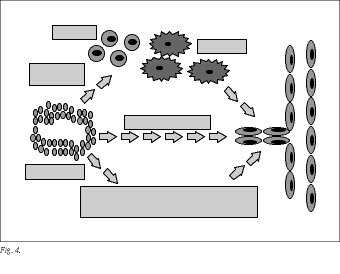
En la angiogenesis tumoral, la activación de las células endoteliales procede de factores angiogénicos elaborados por el propio tumor (autocrino), pero también por células de la estroma tumoral, mastocitos, fibroblastos, macrófagos, etc., reclutados por las células tumorales, así como de factores angiogénicos secuestrados en la matriz extracelular (paracrino)35,36 (fig. 4).
El proceso angiogénico se encuentra regulado por factores activadores e inhibidores, entre los cuales existe un estado de equilibrio, que puede alterarse en condiciones fisiológicas o patológicas.
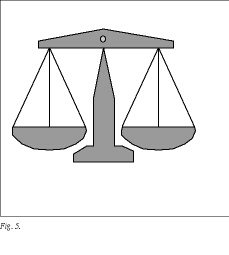
Las células tumorales pueden alterar este equilibrio, ya sea por aumento de los activadores o disminución de los inhibidores, permitiendo la puesta en marcha del llamado "interruptor angiogénico"37 (fig. 5). Esta activación de la angiogénesis viene mediada por la hipoxia tumoral38 y por la aparición de oncogenes y la pérdida de genes supresores. En modelos experimentales, ciertos oncogenes (v-ha ras, v-raf, k-ras) estimulan la angiogénesis induciendo la formación de VEGF39,40 y reduciendo la trombospondina 1, que es un potente inhibidor de la angiogénesis41; la pérdida del p53 produce una disminución de la trombospondina 1 y un aumento del VEGF42. Como regla general la aparición de oncogenes facilitaría la angiogénesis por aumento de los activadores y la deleción del gen supresor facilitaría la angiogénesis por disminución de los inhibidores43. La presencia de oncogenes y la pérdida del p53 se traduciría en una desviación de las células tumorales hacia un fenotipo angiogénico44. La adquisición de este fenotipo angiogénico parece que tiene lugar en etapas tempranas del desarrollo tumoral37.
Activadores de la angiogénesis
VEGF. El VEGF es una glucoproteína de 45.000 daltons, con cuatro isoformas: VEGF 165, 121, 189, 20645,46. Los VEGF121 y 165 se encuentran como proteínas libres, aunque una parte del VEGF165 también se encuentra en la matriz extracelular. El VEGF189 y el 206 se encuentran exclusivamente en la matriz extracelular47.
La actuación del VEGF sobre los receptores endoteliales KDR/Flk-1 regula la diferenciación, multiplicación y quimiotaxis de las células endoteliales48. La actuación sobre los receptores Flt producirá maduración y reestructuración de los vasos neoformados49.
Angiopoyetina 1. La angiopoyetina 1, ligando de otro tipo de receptor endotelial denominado Tie-2, actúa remodelando los vasos neoformados y estabilizando los vasos maduros, mediante la interacción con los tejidos circundantes50. Por su parte, la angiopoyetina 2, en ausencia de VEGF, tendría una acción desestabilizadora sobre los vasos neoformados51,52.
Factor de crecimiento fibroblástico de tipo básico (bFGF o FGF2). El factor de crecimiento fibroblástico de tipo básico (bFGF o FGF2) está producido por células de origen neuroectodérmico y mesodérmico, así como de cierto tipo de células tumorales. Una cantidad significativa se encuentra en la matriz extracelular. Es un potente inductor de la angiogénesis y de acción sinérgica con el VEGF; dicha inducción la ejerce promoviendo la producción de VEGF en las células endoteliales53.
Angiogenina. La angiogenina (ANG) es un polipéptido de 14 kDa, aislado originalmente en una línea celular, HT-29, de adenocarcinoma de colon humano y producido por varios tipos de células54. La función que desempeña en la angiogénesis es doble: por una parte, contribuye a la lisis de la membrana basal y, por otra, facilita la migración y adhesión de las células endoteliales a la matriz extracelular.
Citocinas y otros. Junto a las citocinas, que podrían considerarse específicas, ya que actúan directamente sobre las células endoteliales, existen otras moléculas que, de forma inespecífica, se encuentran implicadas en la angiogénesis. Las metaloproteinasas, fundamentalmente la MMP-2 (gelatinasa A) y la MMP-9 (gelatinasa B), actuarían degradando la matriz extracelular55. La E-selectina facilitaría la migración de las células endoteliales. Las integrinas alfa y beta3 tienen un papel prepoderante en la angiogénesis, ya que sin su presencia mediante la administración de un antagonista, LH609, se produce apoptosis de las células endoteliales de los vasos neoformados, bloqueando el crecimiento tumoral e induciendo la regresión tumoral56,57.
Inhibidores de la angiogénesis
Trombospondina 1. Entre los inhibidores de la angiogénesis destaca la trombospondina 1, que es secretada por las células endoteliales, fibroblastos y macrófagos58, y ejerce su acción interfiriendo la adhesividad, motilidad y actividad proteolítica de las células endoteliales59.
Angiostatina. La angiostatina es una fracción del plasminógeno que impide la degradación de la matriz extracelular59. En modelos de experimentación su administración sistémica produce regresión de tumores60.
Endostatina. La endostatina es un fragmento del colágeno XVIII, cuyo mecanismo de inhibición de la angiogénesis es similar al de la angiostatina y, al igual que ella, es capaz de producir regresión de tumores en animales de experimentación61.
Para cuantificar la capacidad angiogénica de un tumor se utilizan dos métodos: determinación de los valores plasmáticos de VEGF, factor de crecimiento del endotelio vascular (VEGF) y, por otro lado, se realiza el recuento de vasos neoformados en tejido tumoral, expresado como densidad de microvasos (MVD), técnica propuesta por Weidner, inicialmente en el cáncer de mama62. Algunos autores han encontrado concentraciones séricas elevadas de VEGF en enfermos con diversos tipos de tumores, entre ellos el colorrectal, con porcentajes de hasta un 57%, así como su normalización después del tratamiento realizado63,64. Otros autores han encontrado relación entre los valores de VEGF y la estadificación tumoral65,66, hallándose valores elevados en pacientes con enfermedad avanzada67,68. También una mayor cantidad de VEGF en el tejido tumoral se ha relacionado con un peor pronóstico69-71. En cuanto a la cuantificación de la angiogénesis, mediante el recuento de vasos neoformados son numerosos los trabajos que relacionan el MVD con el estadio tumoral, progresión de la enfermedad, recurrencia y presencia de metástasis72,79, aunque existe controversia, ya que otros autores no han encontrado esta relación80-82. Estos resultados contradictorios podrían explicarse en parte por la metodología pero, fundamentalmente, por la heterogeneidad de la vascularización dentro del tumor, con zonas de necrosis, avasculares y otras muy vascularizadas83. Por ello se preconiza una estandarización en la metodología84 y valoración de nuevos métodos morfométricos85.
Invasión local
Moléculas de adhesión
Para que las células tumorales puedan invadir tejidos adyacentes, deben ser capaces de desprenderse del tumor primario, venciendo unas fuerzas de adhesión que tienden a mantenerlas unidas, gracias a unas moléculas de adhesión: cateninas y E-caderina. Enfermos con cáncer colorrectal en estadios avanzados presentan concentraciones bajas de alfacatenina y E-caderina86,87. Por tanto, algunos autores asocian esta reducción con tumores más indiferenciados y peor pronóstico88,89.
Enzimas proteolíticas
A continuación, las células deben abrirse paso a través de la membrana basal, compuesta por glucoproteínas y proteoglicanos, y que descansa sobre la matriz extracelular, un enrejado de fibras de colágeno y elastina embebidas también en proteoglicanos y glucoproteínas. La degradación, tanto de la membrana basal como de la matriz extracelular, es posible gracias a una serie de enzimas proteolíticas que son secretadas al medio extracelular en forma de proenzimas, tanto por células tumorales como por las células del tejido conectivo normal. Hasta el momento se conocen cuatro familias distintas de proteasas: serín proteasas, cisteinil proteasas, aspartil proteasas y metaloproteasas.
El primer componente de la familia de las metaloproteasas fue descrito por Liotta a finales de los años setenta. Se trataba de una proteasa producida por tumores murinos, capaz de degradar el colágeno tipo IV a pH neutro90. Desde entonces, numerosos estudios experimentales han permitido caracterizar otros componentes de esta extensa familia, así como el papel que desempeñan en el dasarrollo de tumores malignos91-94. En la actualidad se sabe que se trata de endopeptidasas dependientes del cinc, que globalmente se caracterizan porque son secretadas al medio extracelular en forma de proenzimas solubles, activadas por acción de otras proteasas de la misma familia o del sistema de activación del plasminógeno. Son susceptibles a la acción de inhibidores endógenos y, en condiciones fisiológicas, participan en los procesos de remodelación tisular, cicatrización y angiogénesis.
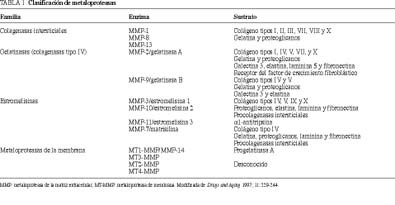
Los componentes de la familia se pueden subdividir en cuatro grupos, según la especificidad de su sustrato y sus características estructurales (tabla 1)91. Dentro de este extenso grupo, las metaloproteasas que más se han relacionado con los procesos de invasión tumoral y metástasis son aquellas que degradan específicamente el colágeno tipo IV: gelatinasa A (MMP-2), gelatinasa B (MMP-9), estromelisina 1 (MMP-3) y estromelisina 2 (MMP-10).
En condiciones fisiológicas, la producción y activación de las metaloproteasas está sujeta a un estricto control, tanto genético como estructural. Existe, además, un tercer mecanismo regulador que viene a reforzar los anteriores, y es la presencia en el organismo de inhibidores específicos. Se conocen al menos cuatro de estos inhibidores, que en conjunto se denominan inhibidores tisulares de las metaloproteasas (TIMP). Todos ellos inhiben a la mayoría de las metaloproteasas en su forma activa, y algunos, además, son secretados formando complejos y bloqueando la proenzima91,95.
Numerosos estudios han demostrado la localización predominante de MMP-9 y MMP-2 en la interfase tumor-estroma, tanto en los tumores colorrectales primarios como en las metástasis hepáticas95,98. Mediante técnicas de hibridación in situ e inmunohistoqímica se ha demostrado la producción mayoritaria de MMP-9 por las células estromales peritumorales (fibroblastos y macrófagos) in vivo. Las células tumorales actuarían induciendo la producción de MMP-9, probablemente por la acción de factores paracrinos, aunque estos mecanismos están aún bajo investigación96-100. Estos datos sugieren que MMP-9 desempeña un papel importante en la capacidad metastásica del carcinoma colorrectal. Dependiendo de la técnica de identificación empleada, la mayoría de los autores coinciden en que existe correlación entre la presencia de valores elevados de MMP-9 y el grado de diferenciación tumoral101,102. Zeng et al demostraron por primera vez, además, el valor pronóstico de MMP-9 ARN: valores elevados se relacionaban con una menor supervivencia y un mayor riesgo de recidiva tras la cirugía103.
Kim55 encuentran una correlación positiva entre MMP-9 y MMP-2 y angiogénesis en el cáncer colorrectal, siendo las metaloproteasas marcadores de agresividad local frente a la angiogénesis, predictora de enfermedad metastásica.
Valores elevados de estromelisina 3, MMP-1 y matrilisina (MMP-7) también se han detectado en el carcinoma colorrectal, frente a valores escasos o ausentes en adenomas y mucosa normal104-106.
Además de las metaloproteinasas, otras enzimas proteolíticas, como la catepsinas, sobre todo la catepsina B, también se encuentran implicadas en este proceso. Las catepsinas son enzimas proteolíticas lisosómicas implicadas en una gran variedad de procesos fisiológicos, ampliamente distribuidas en tejidos sanos, con una concentración mayor en células esplénicas, renales, hepáticas y en macrófagos. Las catepsinas tienen un peso molecular que varía entre 14 y 650 kDa. Son sintetizadas en los ribosomas celulares, desde donde son transferidas al retículo endoplásmico, al aparato de Golgi y, finalmente, a los lisosomas mediante el reconocimiento por un receptor de la manosa 6-fosfato presente en la molécula enzimática. Sintetizadas como pre-proenzimas, posteriormente, tras un proceso de glucosilación y fosforilación, alcanzarán su forma enzimática activa107.
Procesos oncogénicos e inflamatorios hacen posible que se produzca una alteración en el transporte de las catepsinas hasta los lisosomas, lo que provoca su secreción a la matriz extracelular.
Las catepsinas se dividen en exopeptidasas y endopeptidasas, con subdivisión de acuerdo con la actividad lítica y estructura aminoácida en sus centros activos. Las catepsinas B, H, K, L, S y T son endopeptidasas que pertenecen a la familia de las cisteína-proteinasas. La catepsina G también se define como endopeptidasa, aunque dentro de las serina-proteinasas. Las catepsinas D y E son endopeptidasas con aspartato como parte de su centro activo. Por su parte, las catepsinas A y C son clasificadas como serina y dipeptidil exopeptidasas, respectivamente107.
Valores elevados de algunas catepsinas se han asociado con la destrucción patológica de la matriz extracelular, permitiendo el desarrollo de metástasis e interviniendo en la aparición y mantenimiento de múltiples enfermedades: arterioesclerosis, enfisema pulmonar, osteoporosis y artritis reumatoide. Keyszer108, cuantificó los valores séricos de las catepsinas B, H y L en la artritis reumatoide, sin encontrar elevación de las mismas que pudiera justificar el uso de estos valores como marcadores de la actividad de la enfermedad inflamatoria.
Las catepsinas B, L y D intervienen en el proceso degenerativo del tejido extracelular y en la regulación de determinados factores de crecimiento en procesos neoplásicos, como el cáncer de mama, colorrectal y gástrico109-112.
Maciewitz et al113 describen una actividad similar de las catepsinas B y L en la lisis de la matriz extracelular tras cuantificar su actividad en la progresión neoplásica del cáncer co lorrectal mediante un estudio in vitro, de células premalignas y malignas. Por su parte, Schwartz107 y Mayer114 también confirmaron la elevación de la catepsina D en tejido neoplásico colorrectal respecto a determinaciones inmunohistoquímicas en tejido sano. Sin embargo, serían Adenis et al110 quienes, al comparar la actividad tras estudio histológico de las catepsinas B, L y D en tejido neoplásico colorrectal y tejido sano adyacente, demostraron una elevación de todas las catepsinas en el tejido tumoral, aunque consideraron la catepsina B como la enzima de mayor sensibilidad y, por tanto, de gran valor en la progresión del cancer colorrectal.
La catepsina B actúa directamente degradando los componentes de la matriz extracelular mediante una actividad dipeptidilcarboxipeptidasa, o indirectamente estimulando otras proteasas de la matriz extracelular y degradando sus inhibidores proteicos107. Su actividad se realiza en un pH tanto ácido como neutro, lo que facilita la progresión neoplásica y el grado de extensión115,116. La catepsina es una endopeptidasa con cisteína como parte de su centro activo. Se encuentra formada por una cadena ligera cuyo peso molecular es de 5 kDa y que contiene el centro activo, y una cadena pesada de 24 kDa. Es inhibida mediante iodoacetato o 4-cloromercuribenzoato.
La presencia de valores elevados de catepsina B en diferentes procesos neoplásicos fue demostrada por Hirano et al115, mediante el estudio de determinaciones plasmáticas y en orina de enfermos con cáncer colorrectal, gástrico, mamario y de vesícula. Encontraron que las determinaciones en enfermos neoplásicos eran muy superiores respecto a los enfermos con enfermedad benigna, y que incluso en aquellos pacientes con metástasis los valores séricos y urinarios eran más elevados respecto a enfermos sin afectación metastásica. Llegaron a la conclusión de que la catepsina B podría ser un aceptable marcador tumoral, sobre todo a la hora de detectar metástasis remotas. En el cáncer colorrectal, la catepsina B parece ser el parámetro más discriminante y de mayor valor pronóstico respecto al resto de las familias de las catepsinas. Khan et al117 estudiaron el papel de la catepsina B en estadios precoces del cáncer colorrectal, y establecieron la relación entre la elevación de la expresión de la catepsina B y la disminución de la laminina en la membrana basal en el cáncer colorrectal, para concluir que valores elevados de la catepsina B podrían relacionarse con la secuencia de transformación adenoma-carcinoma colorrectal. En estudios recientes, Hirai118 confirma la elevación de la catepsina B en estadios precoces y, como Hirano et al115, destaca su papel a la hora de detectar metástasis remotas. La importancia de la catepsina B en el proceso metastásico del cáncer colorrectal es reafirmada por Van Noorden et al120 en animales de experimentación. Estos autores incluso nos abren nuevos horizontes hacia la utilización de agentes terapéuticos futuros que, inhibiendo la actividad de la catepsina B, permiten el control de la extensión de la enfermedad neoplásica colorrectal. Para ello, introducen el uso por vía oral de un inhibidor selectivo de la catepsina B, Mu-Phe-homoPhe-fluoromethylketone, el cual permitió la reducción a un 60% de la aparición de metástasis hepáticas, así como la disminución en un 80% del volumen de las metástasis hepáticas existentes.
Murnane (1997), analizando las catepsinas B, L y las metaloproteinas 9, ha definido un perfil proteolítico de carcinoma colorrectal: precoz, medio, tardío y alto, relacionándolo con el estadio clínico120.
Todas las células, incluidas las tumorales, cuando pierden contacto entre sí o penetran en la matriz extracelular sufren un tipo de apoptosis (muerte celular programada) denominada anoikis. Las células tumorales son capaces de desarrollar resistencia frente a esta muerte celular, elaborando un tipo de moléculas de adhesión como son las integrinas121. Estudios experimentales de cáncer colorrectal, tanto in vitro como in vivo, demuestran un aumento de las subunidades alfa-6 beta-4 y alfa-5 beta-3 de las integrinas y la relacionan con mayor agresividad del cáncer colorrectal122,123.
La migración de las células tumorales a través de la matriz extracelular les permitirá alcanzar los vasos tumorales neoformados o los del huésped. En esta etapa, una citocina, factor de movilidad autocrina (AMF) facilita una mayor movilidad de las células tumorales. Algunos autores relacionaron una sobreexpresión de los receptores gp78 para el AMF en tumores colorrectales, con un alto índice de recurrencia y menor supervivencia124,125.
Diseminación sanguínea
Una vez en el torrente circulatorio, las células tumorales deben hacer frente al sistema inmunitario para poder acceder al órgano diana. Posiblemente uno de los medios empleados sería la unión a los linfocitos T, la cual se realizaría gracias a una serie de glucoproteínas, como la ICAM-1. Se han encontrado valores elevados de ICAM-1 en pacientes con cáncer colorrectal respecto a individuos sanos. El suero de estos enfermos es capaz de inhibir la agregación celular, disminuyendo el porcentaje de lisis específica. Este efecto desaparece cuando se depleciona el suero de ICAM-1126,127. Por su parte, el antígeno carcinoembrionario (CEA) actuaría como una molécula de adhesión, facilitando la unión de las células tumorales entre sí y entre las células del huésped.
Invasión del órgano diana
Moléculas de adhesión
En los capilares del órgano a metastatizar, las células tumorales, contactan y crean una unión con las células endoteliales, gracias a las moléculas de adhesión. Entre ellas destaca la E-selectina, encontrándose más elevada en pacientes con cáncer colorrectal con metástasis hepáticas que en pacientes sin metástasis128,129. Del mismo modo, destacan unos oligosacáridos de cadena larga, sialyl-LewisX, presentes en los leucocitos y también en células tumorales, los cuales se encuentran elevados en enfermos con cáncer colorrectal y metástasis hepáticas130-133. Por último, consideraremos otra glucoproteína, CD44, presente en linfocitos y algunos tejidos, y que también participan en la unión intercelular y de las células con la matriz extracelular. Las variantes CD44 v6 y v8-10 han sido relacionadas con metástasis y recurrencia de la enfermedad134,135. En cambio, los valores plasmáticos de CD44 no se han podido relacionar con el estadio de la enfermedad136.
Moléculas de adhesión y enzimas proteolíticas
Las células tumorales, después de completada esta unión a las células endoteliales, deben extravasarse y atravesar la matriz extracelular, en un proceso inverso al de la invasión, pero en el que participan los mismos tipos de moléculas: moléculas de adhesión y enzimas proteolíticas.
Asentamiento (mantenimiento y crecimiento progresivo en el órgano diana)
Para el desarrollo completo de la metástasis, las células tumorales precisan de nuevo de la participación de los factores de crecimiento y proceso angiogénico, ya analizados.
Se especula con la posibilidad de que alguna de estas micrometástasis se mantenga inactiva gracias al efecto inhibitorio de la angiostatina, elaborada por el tumor primitivo; la extirpación de éste produciría un descenso significativo de los inhibidores de la angiogénesis, facilitando su crecimiento y desarrollo.
Del mayor conocimiento de la génesis tumoral y proceso metastático se han generado líneas de investigación para el desarrollo de nuevas terapias.
Terapia genética
Se encuentra en fase inicial y se fundamenta en tres pilares:
1. Corrección genética. La reposición del p53 y la inactivación de oncogenes, como el K-ras, mediante la utilización de vectores virales de adenovirus y retrovirus, han demostrado su eficacia in vitro137,138. El mayor problema es la escasa eficacia de la transferencia genética, debida a los vectores virales actualmente disponibles. Los adenovirus promueven en el huésped una respuesta inmunológica que limita el número de administraciones. Los retrovirus, por su parte, no transfieren a las células que no se encuentran en fase de división, limitándose el número de células tumorales infectadas139.
2. Inmunomodulación. Se trata de estimular el sistema inmunológico, frente a las células tumorales, generando una respuesta inflamatoria contra las mismas que provoque su destrucción. Ciertas citocinas, como la interleucina 2, son capaces de activar a los linfocitos contra las células tumorales, pero no pueden administrarse de forma sistémica debido a sus efectos adversos. La transferencia de genes productores de interleucina a las células tumorales, mediante vectores virales, está siendo investigada140. Otro procedimiento inmunoestimulado es la utilización de vacunas frente a antígenos asociados al tumor, como el CEA141,142.
3. Terapia enzima-profármaco dirigida por virus (VDEPT) (terapia gen suicida). Mediante un vector viral, con una enzima codificada, se infectan las células tumorales, las cuales comenzarían a producir la enzima en cuestión. La administración de un citotóxico en forma inactiva que precise de dicha enzima para su activación limitaría la toxicidad a las células tumorales. En esta categoría se encontrarían las combinaciones timidincinasa y ganciclovir, citosina desaminasa y 5-fluorocitosina y nitrorreductasa y el CB1954139.
Terapia antiangiogénica
Para el diseño de agentes antiangiogénicos se han utilizado cuatro estrategias:
1. Bloqueo de los factores angiogénicos.
Anticuerpos monoclonales anti-VEGF.
Inhibición de la producción de VEGF y bFGF con interferón alfa.
Bloqueo de los receptores endoteliales para el VEGF y bFGF con fármacos de síntesis: SU5416 y SU6668.
2. Inhibidores naturales y sintéticos de la angiogénesis. Endostatina, angiostatina, trombospondina 1, TNP-470, talidomida y taxol.
3. Bloqueo de las moléculas que permiten a los vasos invadir tejidos adyacentes. En este apartado se encuentran fundamentalmente los inhibidores de las metaloproteinasas: marimastat, neovastat, batimastat, etc.
4. Incapacitar a las células endoteliales para la formación de nuevos vasos. En este apartado los esfuerzos se han dirigido al bloqueo de las integrinas, bien mediante anticuerpos monoclonales antiintegrinas (Vitaxin), o farmacológicamente EMD121974143.
Una forma emergente de terapia antiangiogenica es la genética; utilizando vectores virales se introducirían falsos receptores del VEGF o de la angiopoyetina, secuestrando estos inductores de la angiogénesis144.
La combinación de agentes antiangiogénicos y citostáticos aumenta la actividad de ambas145.
Conclusiones
De acuerdo con los datos analizados y según los conocimientos actuales, deberíamos responder a dos preguntas:
1. ¿Es posible identificar a pacientes con formas tumorales más agresivas y peor pronóstico?
2. De los nuevos conocimientos en la biología molecular del cáncer colorrectal, ¿pueden derivarse nuevas formas de terapia?
Si trataramos de conseguir un perfil molecular humano del cáncer colorrectal con mayor agresividad, deberíamos considerar tres campos de investigación: genético, enzimático y angiogénico.
Son numerosos los trabajos que han estudiado por separado cada apartado y su posible valor pronóstico. Un análisis conjunto de los tres apartados podría ayudar a la creación de este perfil molecular, que podría estar definido por tumores con mutaciones del p53, expresión de k-ras y mutaciones del DCC y nm23, junto a un elevado contenido de enzimas proteolíticas (metaloproteínas 2,9 y catepsina B) y moléculas de adhesión, además de un índice angiogénico elevado, expresado por un aumento del VEGF plasmático y de la densidad de microvasos (MVD).
La respuesta a la segunda pregunta es la aparición de dos nuevas formas de terapia, genética y antiangiogénica, ambas, como hemos visto, en sus inicios y con problemas por resolver, pero que en un futuro no muy lejano podrán complementar las terapias convencionales.