Introducción. La calcinosis tumoral es una rara entidad de etiología variada. Su incidencia actual parece aumentar en pacientes en hemodiálisis debido a los nuevos protocolos de tratamiento.
Pacientes y métodos. Se estudian retrospectivamente 457 pacientes sometidos a hemodiálisis. Se ha encontrado una calcinosis tumoral en 4 casos.
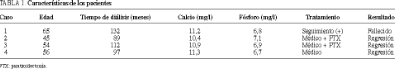
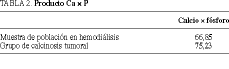
Resultados. Cuatro (0,88%) de los pacientes sometidos a hemodiálisis han desarrollado calcinosis tumoral, mientras que se han observado calcificaciones de partes blandas en 65 ocasiones (14,22%). El producto [Ca] * [P] = 75,23 se encuentra significativamente elevado en estos pacientes en relación con una muestra de la población en diálisis (66,85).
Conclusión. La calcinosis tumoral es un proceso raro. Su incidencia actual parece estar aumentada en la población en diálisis. Un adecuado control de la hiperfosfatemia parece ser fundamental en la prevención y tratamiento de estos procesos.
Introduction. Tumoral calcinosis occurs rarely and the etiology varies. Presently, the incidence appears to be on the rise among patients on hemodialysis owing to new treatment protocols.
Patients and methods. Four hundred fifty-seven hemodialysis patients were studied retrospectively. Calcified masses were encountered in four cases.
Results. Four (0.88%) of the patients subjected to hemodialysis developed tumoral calcinosis, while soft tissue calcinosis was observed in 5 (14.22%). The result of the equation [Ca] * [P] = 75.23 is significantly higher in these patients than that observed in a sample of patients on dialysis (66.85).
Conclusion. Tumoral calcinosis is a rare finding. The incidence presently appears to have increased among patients on dialysis. The proper management of hyperphosphatemia seems to be essential for the prevention and treatment of these processes.
Introducción
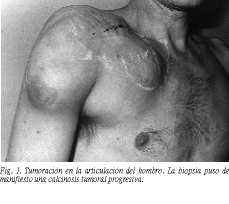
La calcinosis tumoral (CT) es una rara entidad que ha sido englobada dentro de una serie de denominaciones a lo largo de los años: lipocalcinosis tumoral, bursitis calcificante, colagenolisis calcificante, lipocalcinogranulomatosis y hueso de cadera. Puede presentarse de forma esporádica o familiar. Parece ser que su descripción en la forma actual en que la estudiamos corresponde a la realizada por Inclán1 en 1943. La presentación en edades más jóvenes es propia de las formas familiares. Es más frecuente en la raza negra y en varones que en mujeres. Se manifiesta como formas tumorales calcificadas de evolución progresiva, de cualquier localización, aunque con más frecuencia en las proximidades de las grandes articulaciones, habiendo sido descritas formas dérmicas, oculares, pelvianas y viscerales2-5.
Recientes trabajos sugieren un aumento de esta enfermedad en pacientes sometidos a diálisis por las modificaciones introducidas en su tratamiento durante estos últimos años2,3. Por esta razón hemos procedido a revisar a los pacientes sometidos a diálisis, para comprobar la incidencia real de este tipo de afección.
Pacientes y métodos
Entre enero de 1977 y diciembre de 1997, un total de 457 pacientes ha sido sometidos a diálisis en el Servicio de Nefrología del Hospital Nuestra Señora de Aránzazu.
El protocolo de tratamiento médico y control de la osteodistrofia renal seguido en estos pacientes ha incluido los siguientes apartados:
1. Medidas generales.
a) Control de la hiperfosfatemia.
Insuficiencia renal crónica terminal con aclaramiento de creatinina < 25-30 ml/min.
Mantener la concentración [P] entre 3 y 5 mg/100 ml.
Disminuir el P de la dieta.
Administrar hidróxido de aluminio si fracasa lo anterior.
Insuficiencia renal crónica terminal en hemodiálisis.
Mantener la concentración de [P] prehemodiálisis entre 5-6 mg/100 ml.
Evitar la depleción de P posthemodiálisis por debajo de los 3 mg/100 ml.
b) Corrección del déficit de calcio.
Insuficiencia renal crónica. Sin hemodiálisis.
Aclaramiento de creatinina < 25 ml/min. Añadir suple Insuficiencia renal crónica terminal cálcicos. Carbonato cálcico (2-3 g/día).
Insuficiencia renal crónica terminal. En hemodiálisis. Utilizar la concentración de [Ca] adecuada en el dializado, 3-3,5 mEq/l.
2. Tratamiento del agua si es preciso.
3. Diálisis adecuada.
4. Aporte proteico controlado.
5. Evitar los barbitúricos y las fenotiacidas (por su efecto catabólico sobre la vitamina D).
De éstos, hemos encontrado que han desarrollado algún tipo de calcificación de partes blandas en 65 (14,22%) ocasiones. Ha sido posible encontrar formas tumorales de crecimiento correspondientes a calcinosis tumoral en 4 (0,87%) casos. Las características de los pacientes aparecen reflejadas en la tabla 1. Se han determinado las concentraciones preoperatorias de fósforo y calcio en estos 4 pacientes y se los ha comparado con la media de una muestra aleatoria de la población en diálisis, con el fin de determinar el mecanismo fisiopatológico más acorde que justifique el desarrollo de los depósitos cálcicos.
Resultados
Hemos observado un total de 65/457 (14,22%) calcifica ciones de partes blandas en pacientes con insuficiencia renal crónica sometidos a diálisis y 4 casos (0,87%) de calcinosis tumoral demostrada, datos similares a los de otras series consultadas.
Hemos encontrado unos resultados de concentraciones plasmáticas de P y Ca elevados en los casos de CT comparados con la muestra de la población en hemodiálisis. El producto Ca * P era de 75,23 en el grupo patológico comparado con la población objeto de estudio (66,85).
Un caso con forma tumoral claramente manifiesta falleció de accidente cerebrovascular antes de haber establecido cualquier tratamiento. Uno de los pacientes fue controlado médicamente mediante disminución de la dosis de calcitriol y descenso de las concentraciones de fósforo, mediante ajuste de dieta y gel fijador de fosfato plasmático, junto al prurito, dolor y osteodistrofia que padecía, lográndose una detención y regresión parcial de la calcinosis tumoral, no aceptando cirugía complementaria.
En dos casos (50%) se obtuvo la detención y regresión parcial de las lesiones mediante paratiroidectomía total, no siendo necesaria ninguna maniobra quirúrgica complementaria. No se realizó autotrasplante de tejido paratiroideo en estos casos por nuestra experiencia negativa en la funcionalidad posterior de los mismos y el adecuado control médico de las secuelas postoperatorias en pacientes sometidos a estricto control médico y sin claras expectativas de trasplante renal en uno de los casos.
Discusión
La aparición de depósitos cálcicos de forma tumoral con posibilidad de complicaciones asociadas a su tamaño6,7 y localización8-10, pero también de menor tamaño, bien en fases iniciales de desarrollo de las formas tumorales como en la manifestación definitiva de las mismas es la característica fundamental de la calcinosis tumoral. Esta entidad aparece englobada dentro del conjunto de manifestaciones patológicas debidas a la alteración del metabolismo fosfocálcico y sus consecuencias en pacientes afectados de insufiencia renal crónica terminal y sometidos a hemodiálisis11-14. El diagnóstico diferencial de este tipo de enfermedad incluye la calcifilaxia, la miositis osificante, calcinosis cutis distrófica, bursitis calcificante, calcificación metastásica, quistes calcificados, sarcomas y otras neoplasias calcificantes. Se discute si las calcinosis tumorales son una entidad independiente15 o si bien corresponden a formas avanzadas de calcificaciones de partes blandas. También se ha propuesto una clasificación de la CT de acuerdo con su origen patogénico4. Las modernas técnicas radiológicas e isotópicas permiten aportar datos para diferenciar el origen patogénico de las lesiones16,17.
Podemos encontrar lesiones de calcinosis tumoral en lesiones del metabolismo fosfocálcico como el síndrome de la leche y alcalinos, hiperfosfatemia idiopática e intoxicación por vitamina D.
Histopatológicamente deben considerarse dos fases: una inicial, con necrosis de colágeno y formaciones quísticas, y una tardía con calcificación progresiva y creciente. La diferenciación de la fases de desarrollo debe ser tenida en cuenta, ya que la deprivación de fósforo puede tener resultados espectaculares en el freno al desarrollo de lesiones mayores y progresivas en los estadios iniciales.
En un principio se creyó que la naturaleza de la calcinosis tumoral era la de un endotelioma calcificante o una bursitis calcificante, por su mayor asociación a zonas de decúbito, como sucede con el hábito de dormir en suelo duro en poblaciones africanas en las que la incidencia de la calcinosis tumoral es alta18. Se ha asociado la etiología, en estos casos, a miositis calcificante sobre lesiones del colágeno en la zonas de presión.
Un producto calcio * fósforo mayor de 70 mg/l (14,47 mmol/l) en el hiperparatiroidismo secundario es un factor de riesgo ya establecido de calcinosis tumoral, con riesgo similar a otras complicaciones asociadas o no, como la calcifilaxia.
Se han descrito casos familiares de calcinosis tumoral sobre alteraciones metabólicas con elevación de las concentraciones de calcitriol y normocalcemia, sugiriéndose una base genética autosómica y dominante19. El tratamiento con calcitriol en pacientes en insuficiencia renal crónica parece estimular la progresión de calcificaciones metastásicas a calcinosis tumoral a través del aumento del producto Ca * P. No sucede lo mismo en el hiperparatiroidismo primario, en que el descenso de fósforo plasmático por el efecto fosfatúrico de la hormona paratitoidea parece proteger de esta complicación.
Se ha invocado la existencia de anomalías en el transporte de fósforo en pacientes con calcinosis tumoral e hiperfosfatemia. Tezelman et al2 han encontrado hiperfosfatemia en todos sus pacientes con hiperparatiroidismo secundanio como ha sucedido en nuestros casos.
Algunos autores han abogado por una base inmunológica20, basándose en la alteración de inmunoglobulinas e infiltración linfocitaria de los depósitos.
La existencia de traumatismos, bien asociados o bien desencadenantes de las áreas de calcificación, ha sido documentada repetidamente2,21.
La existencia de una onicodisostosis o síndrome de Hood con alteración del desarrollo del colágeno y calcinosis tumoral asociada también ha sido considerada como factor subyacente a este tipo de enfermedad.
Es evidente que la etiología de la calcinosis tumoral no está claramente determinada y ha sido atribuida a diversas causas. No obstante, el aumento en su incidencia que observamos estos últimos años parece tener una relación directa con la introducción de nuevas pautas de tratamiento de los enfermos con insuficiencia renal crónica y diálisis, de los que se nutren la mayoría de las nuevas publicaciones que recogen casos de calcinosis tumoral. Varios factores ha sido implicados en su desarrollo:
1. Aumento del empleo, tanto oral como intravenoso, de calcitriol, como prevención de la osteodistrofia renal en el hiperparatiroidsmo secundario en pacientes sometidos a diálisis.
2. Mayor empleo de preparados de calcio que de aluminio como fijador de fosfato.
3. Mayores concentraciones de calcio en las soluciones de diálisis.
4. Falta de disminución adecuada de las concentraciones plasmáticas de fosfatos.
5. Introducción de la eritropoyetina recombinante como tratamiento de la anemia crónica de estos pacientes. Su efecto se ha atribuido a un aumento de la actividad medular ósea con reabsorción ósea asociada que contribuye a la aparición de la calcinosis tumoral.
La entidad tiene relación con las calcificaciones difusas de partes blandas muy frecuentes en el hiperparatiroidismo secundario y procesos degenerativos, pero se diferencia de ellas en su evolución hacia la formación de tumores, con mayor o menor rapidez evolutiva.
El tratamiento de la calcinosis tumoral vendrá determinado por dos factores fundamentales: a) la etiología de la misma, y b) el estado evolutivo de las lesiones. En la calcinosis tumoral sobre hiperparatiroidismo secundario y en estadios iniciales, la corrección de las concentraciones de fósforo en estadios iniciales de desarrollo ha demostrado ser eficaz en la detención e incluso regresión las lesiones21-23. La acetazolamida ha sido utilizada con éxito en la regresión parcial en algunas ocasiones. Sin embargo, el problema surge en las lesiones más evolucionadas, crecientes y calcificantes24. Si su etiología no es debida a hiperparatiroidismo secundario, la escisión local puede ser una pauta adecuada, bien para solucionar problemas compresivos, estéticos o evolutivos. Si, por el contrario, el desarrollo de la calcinosis se realiza sobre un paciente con hiperparatiroidismo secundario, además del adecuado control del fósforo plasmático, la paratiroidectomía, asociada o no a escisión local según las características de la lesión, parece ser la actitud correcta. En estas circunstancias, sin embargo, la recidiva de las masas tras resección incompleta suele ser la norma2.
Creemos que las actuales pautas de tratamiento de la insuficiencia renal crónica están llevando consigo un aumento de la incidencia de calcinosis tumoral en pacientes en diálisis y será necesario observar la evolución de dicha incidencia y su repercusión en las formas actuales de control médico.