Introducción. Hemos realizado una encuesta de ámbito estatal de la experiencia puntual existente en el tratamiento del cáncer sobre quiste del conducto tirogloso.
Material y métodos. Se han enviado 447 encuestas (237 contestadas).
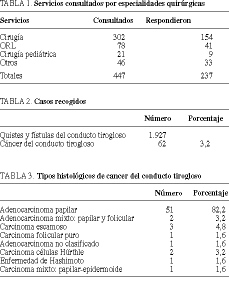
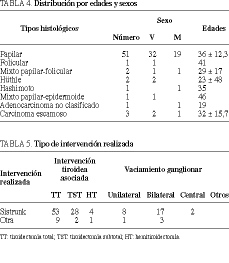
Resultados. Se han registrado 62 casos de cáncer sobre conducto tirogloso, en un período de 20 años: papilar (51), folicular (1), mixto papilar-folicular (2), Hürthle (2), tiroiditis de Hashimoto (1), mixto papilar-epidermoide (1), escamoso (3) y adenocarcinoma no definido (1). La intervención de Sistrunk ha sido empleada en 53 ocasiones. Se han efectuado resecciones atípicas y/o limitadas en 9 ocasiones, complementadas con tiroidectomía en 35 casos (tiroidectomía total en 30 y tiroidectomía subtotal en cinco) y vaciamientos ganglionares en 31 (nueve unilaterales, 20 bilaterales y dos centrales).
Conclusiones. Ante esta enfermedad poco frecuente, con criterios no claramente establecidos se establece un algoritmo diagnóstico-terapéutico.
Introduction. A nationwide survey was conducted to assess the experience accumulated to date in the treatment of cancer arising in a thyroglossal duct cyst.
Material and methods. Out of 447 surveys distributed, 237 were completed and returned.
Results. Over a 20-year period, there have been 62 recorded cases of cancer arising in a thyroglossal duct cyst. The different types of tumor were: papillary (n = 51), follicular (n = 1), mixed papillary-follicular (n = 2), Hürthle cell (n = 2), Hashimoto's thyroiditis (n = 1), mixed papillary epidermoid (n = 1), squamous (n = 3) and adenocarcinoma of undetermined type (n = 1). The Sistrunk procedure was employed in 53 cases. Atypical and/or limited resection was carried out in 9. Surgery included total thyroidectomy in 30 patients and subtotal in 5, and lymph node excision in 31 (unilateral in 9, bilateral in 20 and central in 2).
Conclusions. The survey has helped to establish a diagnostic and therapeutic algorithm for these uncommon lesions for which no clear criteria have been defined to date.
Introducción
El cáncer de tiroides diagnosticado en un quiste tirogloso es un hallazgo infrecuente1, cuya prevalencia se estima en menos del 1% de los quistes tiroglosos intervenidos2. Asistimos ocasionalmente a la publicación de casos aislados en la bibliografía médica de este proceso3-10. El quiste de conducto tirogloso (QCT) es la enfermedad cervical quirúrgica más frecuente, siendo atendida tanto por cirujanos generales, otorrinolaringólogos, cirujanos pediátricos e, incluso, cirujanos plásticos.
Al parecer, fueron Brantano en 1911 y Ucherman en 1915 quienes la describieron por vez primera. En 1927, Owen e Ingelby11 publican el primer caso en la bibliografía inglesa. Existen referencias de casos aislados en nuestro país1,12-14. Las estimaciones actuales cifran en el 1% la incidencia de cáncer papilar en el conducto tirogloso, siendo la cuarta y quinta décadas de la vida el período de mayor incidencia15.
El tratamiento correcto del cáncer tiroideo dentro del conducto tirogloso (CTG) continúa siendo objeto de controversia en el momento actual. La mayoría de los autores consideraban que las lesiones se desarrollarían de novo15-17 dentro del quiste, aunque Crile18 defendió la teoría del conducto tirogloso como vía de extensión de un cáncer tiroideo. Esta hipótesis es menos defendible en la actualidad sobre la experiencia existente. El propósito del presente trabajo es realizar una revisión amplia para intentar aproximarnos a la prevalencia real del proceso con el fin de adoptar un criterio terapéutico correcto y definido sobre la experiencia puntual acumulada.
Material y métodos
Hemos realizado una encuesta entre todos los servicios que en el ámbito estatal hubiesen tenido posibilidad de tratar este tipo de enfermedad. Se consideraron los servicios de cirugía general, otorrinolaringología, cirugía pediátrica, maxilofacial, plástica, cara y cuello. Se envió el cuestionario adjunto. En total fueron enviados 447, habiéndose recibido 237 respuestas tras un período de espera estimada válida de 180 días.
Los datos solicitados se encuentran reflejados en el anexo.
Se recogieron períodos de tiempo válidos para poder efectuar una estimación aproximada de la prevalencia. Los casos recogidos corresponden a un período de 20 años (1979-1999), si bien algunas encuestas recogen períodos de tiempo inferiores por ser centros de nueva creación en los que no existía una recogida de datos adecuada. Con todas las limitaciones evidentes, podemos establecer este período de tiempo para orientar el problema.
Se han analizado la edad, sexo, tipo histológico, intervención realizada, actuaciones complementarias y seguimiento en lo posible de cada caso, siendo conscientes de la enorme variabilidad posible.
Resultados
Se han recibido 237 respuestas a las 447 encuestas enviadas (tabla 1). Hemos recogido un total de 1.927 quistes y/o fístulas de conducto tirogloso, de los que en 62 casos (3,2%) se halló algún tipo de cáncer en su interior (tabla 2). El patrón histológico fue papilar en la gran mayoría de los casos, pero también se encontraron otras variedades neoplásicas de naturaleza diferente (tabla 3). La cuarta década de la vida es la más frecuente en la presentación de este tipo de enfermedad, si bien también ha sido observada en épocas anteriores de la vida (tabla 4).
En todos ellos, menos en 8 casos, el diagnóstico fue postoperatorio, tras el análisis histopatológico de la pieza de resección. Dos casos fueron diagnosticados preoperatoriamente por el progreso local de la enfermedad y en otros 6 casos el diagnóstico se alcanzó mediante punción-aspiración con aguja fina del QCT.
El tratamiento quirúrgico demuestra una falta de homogeneidad en los procedimientos empleados. La intervención de Sistrunk19 es la técnica fundamental en el tratamiento quirúrgico de los QCT y así aparece reflejado. De todas formas, se aprecia una gran variedad de procedimientos utilizados. Asimismo, la ampliación de la cirugía a tiroidectomía, combinada, no con vaciamiento ganglionar, ha estado regida por criterios individuales y en relación a hallazgos operatorios (tabla 5).
No existen datos suficientes para establecer pautas adecuadas de seguimiento y supervivencia global de la muestra.
Discusión
El tiroides se origina de un engrosamiento epitelial de la primera bolsa faríngea durante la tercera semana de la gestación y desciende por la parte anterior del cuello hasta su situación definitiva, permaneciendo comunicado durante este descenso con su origen (posteriormente foramen lingual) por una estructura tubular de revestimiento epitelial denominado conducto tirogloso que se oblitera hacia la quinta o sexta semana para luego fibrosarse. Su persistencia por causas aún desconocidas da lugar a fístulas y quistes tiroglosos.
Hay que tener en cuenta la íntima relación del conducto tirogloso con el hueso hioides, que lo divide en dos segmentos: superior o canal lingual de Bochdaleck (desde el foramen ceccum hasta el hioides), e inferior, desde el hioides hasta el istmo tiroideo (que formará la pirámide de Laloue tte).
En el conducto tirogloso existen restos de tejido tiroideo en una proporción que oscila entre el 1-40%.
Del epitelio de revestimiento toman su origen las neoplasias epidermoides descritas. El resto de ellas debe admitirse que lo hacen a partir de los restos tiroideos existentes. El cáncer de tejido tiroideo en el conducto tirogloso es un raro hallazgo que debe cumplir, según Granado20, tres requisitos: identificar el conducto tirogloso y localizar restos de carcinoma en él o en el quiste; ausencia de cáncer en la glándula tiroides y presencia de folículos tiroideos en el conducto tirogloso, en su pared o en su proximidad para, en estudio histológico, concretar su posible origen neoplásico.
Joseph y Komorowski21 establecieron en 1975 los criterios inequívocos de carcinoma de conducto tirogloso: existencia de restos del conducto que se diferencian de las metástasis ganglionares quísticas por la naturaleza del epitelio de revestimiento, y existencia de nidos celulares en la pared del quiste en un paciente con glándula tiroidea clínicamente normal. Si se cumplen estas condiciones, sin evidencia de metástasis cervicales ni invasión tumoral de la pared del quiste, parece ser suficiente la intervención de Sistrunk sola.
Existe una controversia patente en cuanto al tratamiento. Algunos autores abogan el carácter metastásico de la enfermedad, defendiendo la exéresis del quiste junto a tiroidectomía total obligada15,21-24. Otros consideran que la intervención de Sistrunk es suficiente y curativa25,26.
La linfadenectomía cervical uni o bilateral ha sido defendida con criterios diferenciados en función del hallazgo de adenomegalias cervicales. Hoy día, sabemos que, en el cáncer papilar, la supervivencia a largo plazo no está influida por la existencia de invasión microscópica y sí por la afectación macroscópica ganglionar observable27-29.
Actualmente, creemos que la decisión terapéutica correcta en estos casos vendrá determinada por los siguientes elementos diagnósticos:
1. Diagnóstico preoperatorio, intraoperatorio o postoperatorio.
2. Situación embriológica del desarrollo tiroideo.
3. Enfermedad tiroidea asociada demostrable.
4. Existencia de afectación ganglionar cervical, microscópica o macroscópica.
5. Existencia de enfermedad metastásica.
La controversia en el tratamiento del cáncer papilar de tiroides en el CTG, en el ámbito mundial, se centra en la actitud hacia la glándula tiroides30. La mayoría de autores estiman que las metástasis ganglionares, tanto de carcinoma escamoso como tiroideo, son subsidiarias de cirugía. Sin embargo, sin evidencia clínica datos exploratorios que demuestren la existencia de cáncer en la glándula tiroidea, muchos cirujanos no son partidarios de eliminarla. La controversia continúa. Deben considerarse cuatro pilares básicos a la hora del tratamiento: a) embriología; b) revisión de casos publicados; c) nuestra experiencia, y c) el estado del arte en el tratamiento del cáncer de tiroides.
El cáncer papilar representa entre el 75-85% de los tumores registrados5,21,24,31, seguido por el mixto papilar/folicular (7%); el carcinoma escamoso se encuentra en un 5% de los casos32-34 y tiende a tener peor pronóstico. Se han descrito casos aislados de carcinoma de células de Hürthle35, tiroiditis de Hashimoto36, mixtos papilar-escamoso e incluso anaplásico10. Como era de esperar, no se han descrito casos de carcinoma medular en el CTG, tanto por su origen embrionario como celular, parafolicular tiroideo. Este hecho parece abogar por la teoría del origen de novo de cáncer de tiroides en el conducto tirogloso.
La teoría del origen de novo viene apoyada por el hecho de que hasta en el 62% de los casos se ha encontrado tejido tiroideo en las piezas quirúrgicas2,21. Además, la sincronicidad con cáncer papilar en CTG y glándula tiroidea se puede explicar mejor por la multifocalidad que por los focos metastásicos. En pacientes con QCT intervenidos con tiroidectomía asociada, se ha encontrado carcinoma papilar tiroideo oculto entre un 11-27% de los casos. Sin embargo, son muchos los que han defendido la vía metastásica local del conducto para el cáncer papilar17,18,23.
Quienes están a favor de preservar la glándula se apoyan en el 95% de tasa de curación en el cáncer del conducto tirogloso (CCTG) y las potenciales complicaciones de la tiroidectomía, actitud hoy día menos defendible por los excelentes resultados exigibles a la cirugía tiroidea. Asimismo, se considera el largo período evolutivo del cáncer papilar de tiroides y la posibilidad de pérdida de seguimiento de estos pacientes. Hemos de considerar que en un 30% de los tiroides resecados existirá asociado carcinoma papilar de tiroides.
En general, podemos afirmar que para el cáncer papilar de tiroides en el QCT, la controversia actual es la misma que la existente en el tratamiento del cáncer papilar de tiroides: la disputa existente entre los defensores de la cirugía mínima y los de la tiroidectomía total.
Los pacientes no sometidos a tiroidectomía deben ser sometidos a dosis adecuadas de hormona tiroidea para la supresión de la TSH. La tiroglobulina puede ser utilizada de screening en estos casos. No obstante, el valor de la tiroglobulina en pacientes no tiroidectomizados permanece cuestionada. La presencia de la glándula tiroidea también dificulta el examen isotópico y posibles tratamientos posteriores ablativos con 131I.
Dado que generalmente no se diagnostica un cáncer hasta después de haber realizado la intervención de Sistrunk, la discusión se centra en la conveniencia de realizar una tiroidectomía total en un segundo tiempo inmediato o controlar estrechamente al paciente en su evolución.
El pronóstico suele ser bueno, siempre en función del tipo histológico y la presencia de metástasis ganglionares1,2,30.
La evaluación inicial de un paciente con QCT-carcinoma debe incluir estudios para confirmar el diagnóstico y localización de la glándula tiroidea, punción-aspiración con aguja fina (PAAF) de la masa central seguida de ultrasonografía. Si la PAAF es positiva para tejido tiroideo-cáncer de conducto tirogloso, se realiza TAC con contraste en lugar de ultrasonografía. Es de valor en la valoración tiroidea y el estado de los ganglios cervicales. El contraste yodado elimina la posibilidad de gammagrafía tiroidea por un período de 6-8 semanas. Esto es aceptable en el tratamiento del cáncer papilar de tiroides. El estudio ultrasonográfico cervical permite cubrir ambos objetivos sin las repercusiones de la irradiación.
En cuanto a la existencia de adenomegalias, sabemos, por la experiencia acumulada, que la afectación microscópica no tiene influencia en la supervivencia a largo plazo, que sí se encuentra influida por la afectación macroscópica.
Creemos que la tiroidectomía total debe ser el gesto quirúrgico a añadir al carcinoma folicular, mixto folicular-papilar y de células Hürthle.
Ante la sospecha de cáncer de conducto tirogloso se debe realizar una intervención de Sistrunk estándar y confirmación intraoperatoria. En caso de positividad, se realizará tiroidectomía total y linfadenectomía de acuerdo con los hallazgos operatorios. Debe ser seguido de terapia con yodo radiactivo. Sólo la intervención de Sistrunk debe ser limitada a pacientes de riesgo médico elevado con focos microscópicos de cáncer tiroideo en el conducto tirogloso y sin invasión de la pared del quiste ni evidencia de enfermedad metastásica. Esta actitud parece aumentar la probabilidad de diagnosticar preoperatoriamente la existencia de un cáncer en un QCT y mejora el potencial seguimiento a largo plazo de recidiva.
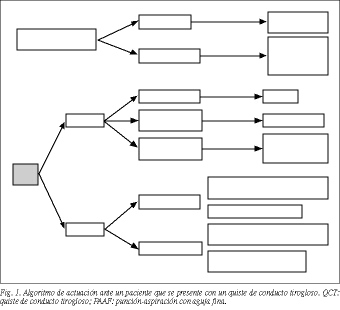
En la figura 1 presentamos un algoritmo de actuación actualizado ante un paciente que se presente con un quiste de conducto tirogloso a la luz de nuestros conocimientos actuales.
Esperemos que con estas pautas de actuación mejoremos la atención de los pacientes afectados de quiste de conducto tirogloso, evitando sorpresas evolutivas que puedan hacernos lamentar una primera actuación incorrecta.
Agradecimiento
Agradecemos la disposición y colaboración de todos aquellos hospitales que han remitido los datos que han permitido realizar el presente estudio. La amplitud del número de respuestas nos imposibilita la relación de los mismos.