El cáncer de mama es una enfermedad heterogénea cuya valoración pronóstica clásica se ha basado en parámetros clínicos e histopatológicos. La estadificación de los casos se ha fundamentado sobre todo en el tamaño tumoral y la afectación ganglionar. De todas formas, y aunque permiten la comparación de series y distintos tratamientos, estas clasificaciones morfológicas no terminan de aquilatar con suficiente especificidad el comportamiento biológico de los distintos tumores. La clasificación TNM permite agrupar a los pacientes en distintos estadios que representan diferentes probabilidades de recidiva y, por tanto, establecen un pronóstico y ayudan a indicar terapias adyuvantes al tratamiento quirúrgico1. Esto es especialmente cierto en los casos correspondientes a estadios muy precoces (0 o I) con recidivas en menos del 5% y en casos avanzados (III) con recidivas en torno al 80% a 5 años, y en los que puede estar más clara la indicación o no de quimioterapia y/o radioterapia adyuvante. Por desgracia, en los estadios intermedios la falta de indicadores pronósticos más específicos puede conllevar un infratratamiento o sobretratamiento, con la morbilidad asociada, sobre todo, en este último caso.
La aplicación de técnicas inmunohistoquímicas permite estudiar otras variables que pueden ayudar a ser más específicos en esta indicación. El índice de proliferación tu-moral, determinado por la expresión de moléculas como el MIB-1 (ki67), o la expresión de receptores hormonales o del receptor Her2neu por las células tumorales son otros factores con valor pronóstico y predictivo de la respuesta a una determinada terapia2-4.
Con los avances tecnológicos, los estudios de biología molecular con microarraysllegan a descifrar el código de expresión de determinados genes (genómica) o de proteínas reflejo de aquéllos (proteómica), y se ha podido relacionar este patrón de expresión con formas tumorales de diferente pronóstico. Mediante la técnica de microarrays se puede estudiar las diferencias en la expresión de genes en distintos tumores y compararlos con tejido normal. Basándose en las diferencias pronósticas observadas, se ha propuesto la existencia de subgrupos de tumores, que podrían tener un comportamiento distinto e incluso podrían ser subsidiarios de diferentes aproximaciones terapéuticas5,6. De este modo habría dos grandes grupos de cánceres de mama: aquellos con expresión de genes relacionados con los receptores hormonales (tipo luminal, que pueden subdividirse en luminal A y B en función del grado de expresión de estos genes y del p53) y otros que no expresan estos genes (tipo Her2neu, con sobreexpresión de Her2neu, y tipo basal, que no sobre-expresarían este gen y que tendrían sobreexpresión de p53 y EGFR1)7-9.
Estos estudios de biología molecular son costosos, y aunque presentan una prometedora proyección en su utilidad clínica futura, en la actualidad su aplicación clínica no es factible dados la complejidad y el coste de estas técnicas. Los estudios con inmunohistoquímica son técnicas más asequibles a la práctica clínica y, puesto que revelan la expresión de determinadas proteínas en las células tumorales, podrían considerarse un reflejo válido y aplicable de los estudios de biología molecular10. De hecho, se ha demostrado la utilidad de clasificar a las pacientes con cáncer de mama en función de la expresión y sobreexpresión de determinadas moléculas, fundamentalmente los receptores hormonales y el receptor Her2neu. Los tumores que expresan receptores hormonales (para estrógeno y/o progesterona) son tumores mejor diferenciados y con mejor pronóstico que los que sobreexpresan Her2neu o aquellos sin receptores hormonales ni Her2neu (triples negativos)11. Por otro lado, el uso de la determinación mediante inmunohistoquímica de la expresión de otras moléculas, como las citoqueratinas 5/6, la expresión de p53, los índices de proliferación, entre otros, permite distinguir subgrupos de peor pronóstico dentro de los triples negativos (subtipo basal)12-15.
En este trabajo se pretende determinar si 5 perfiles inmunohistoquímicos establecidos a partir de la expresión de receptores hormonales y de la sobreexpresión de Her2neu se asocian con variables clínicas, histopatológicas e inmunohistoquímicas de conocido valor pronóstico para el cáncer de mama.
Pacientes y métodoPacientes y muestras
Se estudiaron un total de 194 muestras de tumores correspondientes a carcinomas de mama en otras tantas pacientes. Los tumores correspondieron al tipo histológico del carcinoma ductal infiltrante, excluyéndose los diagnósticos de carcinoma lobulillar infiltrante, carcinoma ductal in situ o formas histológicas especiales. La media ± desviación estándar de edad de las pacientes fue 57,2 ± 13 (intervalo, 25-87) años.
El material utilizado fueron piezas quirúrgicas a partir de bloques de parafina, fijadas entre 12 y 24 h en formaldehído prediluido al 10% tamponado.
Inmunohistoquímica y su evaluación
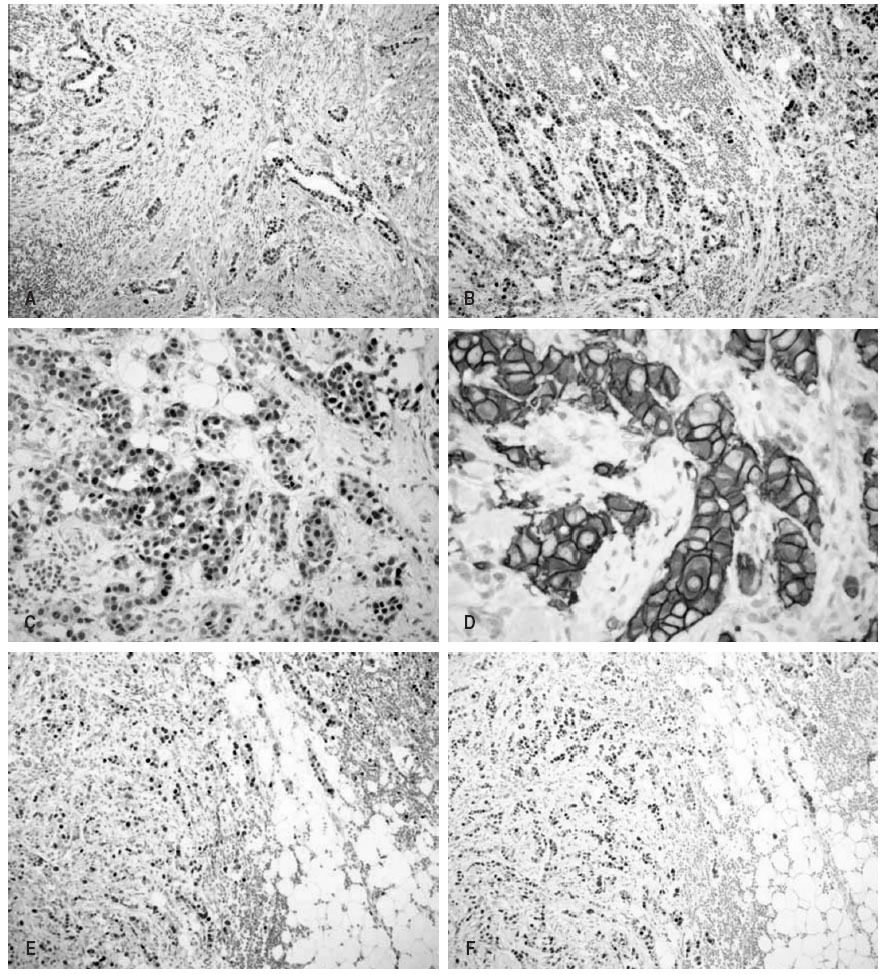
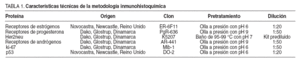
En todas las muestras se realizaron estudios inmunohistoquímicos, con los reactivos, clones de anticuerpos, sistemas de recuperación antigénica y diluciones que se detallan en la tabla 1. En todos los casos se realizó revelado con cromógeno (fig. 1) y se utilizaron como controles tejidos previamente comprobados con positividad para los marcadores utilizados.
Fig.1.Imágenes microscópicas correspondientes a resultados positivos con las tinciones inmunohistoquímicas.A:receptores estrogénicos (100).B:receptores progesterónicos (100).C:receptores androgénicos (200).D:receptores Her2neu (400x).E:expresión de ki67 (100).F:expresión de p53 (100).
TABLA 1. Características técnicas de la metodología inmunohistoquímica
Los mismos patólogos (J.S., J.B.) realizaron la valoración del resultado del estudio inmunohistoquímico, en todos los casos salvo para el Her2neu, mediante un método cuantitativo; se consideró positiva su expresión cuando se superaba el 10% de las células sobre 10 campos de gran aumento. En el caso concreto del Her2neu, la valoración fue semi-cuantitativa; se categorizó de 0 a +++, y se consideró positivo el caso de +++, y negativo, el de 0 o +; en los casos de ++, se realizó valoración mediante técnica FISH para determinar si era positivo o negativo. Esta técnica, para la determinación del grado de amplificación del oncogén ERBB2 (Her2neu) en los casos cuantificados como ++, se realizó mediante hibridación in situ con 2 sondas de ADN marcadas con fluoresceína. Las sondas utilizadas fueron CEP17 y LSI HER2. El resultado se obtiene tras el cálculo del cociente entre el número de señales de ambas sondas (HER/CEP) en un mínimo de 20 núcleos de células tumorales, valorado sucesivamente por 2 observadores (J.S., J.B.). El cociente HER/CEP inferior a 1,8 se interpretó como ausencia de amplificación de Her2neu.
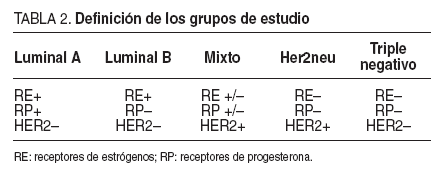
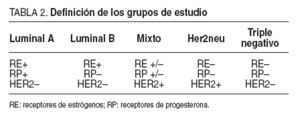
Para su clasificación en este trabajo se han definido los siguientes 5 grupos o perfiles inmunohistoquímicos, basados en la expresión de receptores hormonales (de estrógenos o progesterona) y/o sobreexpresión de receptores Her2neu, y que se resume en la tabla 2:
TABLA 2. Definición de los grupos de estudio
–El perfil denominado tipo luminal, que se define por la expresión de receptores hormonales (sean estrogénicos o progesterónicos) sin sobreexpresión de Her2neu. Este grupos se divide en dos subtipos dependiendo de que expresen (luminal A) o no (luminal B) receptores para progesterona.
–El perfil mixto, en el que hay tanto expresión de receptores hormonales (estrogénicos y/o progesterónicos) como sobreexpresión de Her2neu.
–El perfil tipo Her2neu, en el que no se expresan receptores hormonales, pero si hay una sobreexpresión del receptor Her2neu.
–El perfil tipo triple negativo, en el que no hay expresión de receptores hormonales ni sobreexpresión de Her2neu.
Variables clinicopatológicas e inmunohistoquímicas
En todos los casos se registraron variables clínicas y relacionadas con el diagnóstico (edad, edad de menarquia, menopausia, edad de la menopausia, antecedentes de gestaciones, número de gestaciones y edad de la primera, antecedente de lactancia, consumo de anticonceptivos o terapia hormonal y antecedentes familiares de primer grado para cáncer de mama y/u ovario), estadio de la clasificación TNM16, histopatológicos (tamaño tumoral, multifocalidad, diferenciación histológica, componente intraductal y su grado, invasión vascular y afectación de ganglios) e inmunohistoquímicos (expresión de receptores de andrógenos, índice de proliferación –Ki67–, expresión de p53).
Metodología estadística
Se compararon las variables entre los 3 grupos mediante una prueba de ANOVA para las variables cuantitativas y un análisis de tablas de contingencia con análisis de residuos y la prueba de la 2 para las cualitativas. Se consideró significativo un valor de p < 0,05 y un valor ajustado de residuos, para definir el sentido de la relación entre variables, de ±1,96.
ResultadosEn la serie se encontraron 134 (69%) de los 194 casos correspondientes a un inmunofenotipo luminal, de los que 98 (50,5%) fueron del grupo luminal A y 36 (18,6%), del luminal B; 29 (15,9%) casos fueron de inmunofenotipo triple negativo, en 18 (9,3%) se daba un inmunofenotipo de tipo mixto y en 13 (6,7%), del tipo Her2neu.
En 4 casos la valoración del Her2neu mostró ++, que en el estudio mediante la técnica de FISH fueron todos negativos, con número de copias de Her2neu menor de 4 y cociente entre número de copias Her2neu/número de centrómeros menor de 2 en todos los casos.
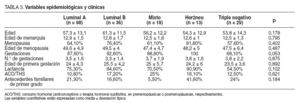
La relación entre los distintos grupos considerados y las variables clínico-epidemiológicas se muestran en la tabla 3. Sólo el hecho de no tener antecedentes de gestación mostró diferencias casi significativas entre ellos, concretamente con el inmunofenotipo triple negativo respecto a los otros grupos. No hubo diferencias en el resto de las variables clínicas o epidemiológicas consideradas.
TABLA 3. Variables epidemiológicas y clínicas
En relación con las variables histopatológicas de los tumores, hay que destacar la relación entre los inmunofenotipos triple negativo y Her2neu con formas histológicas peor diferenciadas (el 62 y el 60%, respectivamente) y del grupo luminal A con tumores bien diferenciados (p = 0,008). En este sentido, aunque no hay diferencias en la proporción de componente intraductal en cada perfil, sí que se encuentra que en todos los casos de los grupos triple negativo y Her2neu el carcinoma in situ es de alto grado, mientras que sólo el 50% de los casos del grupo luminal A presentan componente intraductal de alto grado (p = 0,008). No se encontraron diferencias entre los grupos en relación con el tamaño tumoral, su multicentricidad o la presencia de invasión vascular ni la afectación ganglionar (tabla 4).
Respecto a la afectación ganglionar, mientras que el inmunofenotipo luminal A sólo la presentaba en el 34,6% de los casos, los grupos luminal B y Her2neu presentaban una proporción significativamente mayor de casos con afectación ganglionar (el 66,6 y el 69,2%, respectivamente) (p = 0,001) (tabla 4).
TABLA 4. Variables histopatológicas
Las variables inmunohistoquímicas que se estudiaron (tabla 5) entre los grupos mostraron que los tumores del grupo luminal A tenían una expresión significativamente mayor de receptores androgénicos. La sobreexpresión del factor de proliferación celular (ki67) fue significativa-mente mayor en el grupo triple negativo (73,9%) y significativamente baja en el luminal A (26,3%) (p = 0,001). La expresión de p53 también fue mayor para los grupos Her2neu (55,5%) y triple negativo (60,8%) (p = 0,0005) respecto a los otros (tabla 5).
TABLA 5. Variables inmunohistoquímica
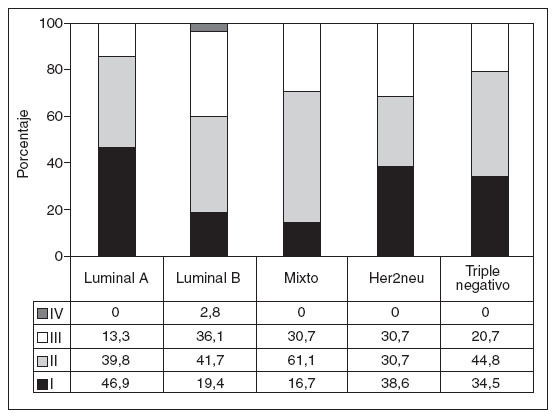
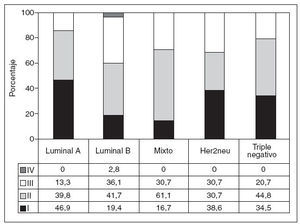
La distribución de casos según los estadios TNM en los distintos grupos definidos se presenta en la figura 2. Es de destacar la relación positiva significativa entre el mayor número de casos en estadio I y el grupo luminal A y la relación negativa entre este mismo grupo y los estadios avanzados (p = 0,041). De la misma forma, y con idéntico nivel de significación, el perfil luminal B se relaciona con menos casos en estadios precoces y con más casos en estadios avanzados, incluso en mayor grado que las formas que no expresan receptores hormonales (Her2neu y triple negativo).
Fig. 2. Distribución de los estadios TNM entre los inmunofenotipos considerados. Las cifras expresan porcentaje sobre el total de cada grupo.
DiscusiónLos perfiles inmunohistoquímicos utilizados en este trabajo están basados en las características de los tumores descritas mediante estudios con microarrays sobre cánceres de mama17-19 y en trabajos previos con técnicas de inmunohistoquímica20. La definición de los grupos, no obstante, depende de la expresión de determinadas proteínas por las células tumorales, y la finalidad es tratar de comprobar si las técnicas de inmunohistoquímica, mucho más sencillas de realizar e interpretar en la práctica diaria que las técnicas de biología molecular, pueden llegar a definir inmunofenotipos con diferencias en variables de interés pronóstico que sirvan como guía para diseñar estudios que permitan encontrar diferencias en la supervivencia global y libre de enfermedad e incluso que definan un valor predictivo de respuesta a tratamientos.
El primer paso, que pretende reflejar este trabajo, consistiría en determinar si hay diferencias entre los distintos inmunofenotipos definidos en relación con variables clínicas, histopatológicas e inmunohistoquímicas que tienen un conocido significado pronóstico, de tal forma que se puedan estratificar estos inmunofenotipos en relación con este pronóstico.
Los casos se han clasificado en función de la determinación de 3 pruebas inmunohistoquímicas de las que ya se conoce su importancia pronóstica e incluso predictiva, como son los receptores hormonales (estrogénicos y progesterónicos) y el Her2neu21,22. Su combinación nos ha llevado a catalogar los casos en los grupos definidos.
La proporción de casos en cada grupo se corresponde básicamente con la encontrada en la literatura mediante técnicas de microarrays,con una mayor frecuencia de inmunofenotipo luminal, que en la serie del Carolina Breast Cancer Study fue del 67%23 y en nuestra serie es del 69%. También el porcentaje de casos triples negativos (definido por la falta de expresión inmunohistoquímica de receptores estrogénicos, progesterónicos y Her2neu, sin tener en cuenta la de EGFR o citoqueratinas) concuerda con lo expresado en otras series (16,3%)14.
En las variables clínicas no encontramos diferencias significativas de interés entre los grupos. Si acaso, de forma anecdótica, sólo se encuentra que las pacientes con inmunofenotipo triple negativo, es decir, aquellas cuyos tumores no expresan receptores de ningún tipo de los considerados, presentaban una casi significativa menor tasa de gestaciones que los otros grupos.
Más interesante y de mayor importancia, a la hora de valorar la utilidad de estos criterios para clasificar el cáncer de mama desde un punto de vista pronóstico, es la relación que se encuentra entre los grupos triple negativo y Her2neu con las formas menos diferenciadas histológicamente14,24 y de la forma luminal A con las mejor diferenciadas. También, aunque no se encuentran diferencias en la cuantía de componente intraductal entre los diferentes grupos, en los casos con componente intraductal asociado, es significativa la presencia de tumor de alto grado en los grupos Her2neu y triple negativo.
No se encontraron diferencias entre los grupos en el tamaño tumoral o la invasión linfovascular, aunque encontramos que los grupos Her2neu y luminal B presentaban una significativa mayor proporción de casos con afectación ganglionar, lo que se refleja también al estudiar la proporción de casos con cáncer precoz o avanzado, según la clasificación TNM, entre los grupos. Aunque es conocido el peor pronóstico de los tumores que no expresan receptores, es llamativa la diferencia en la invasión ganglionar que se da en los casos que no expresan receptores progesterónicos pero sí de estrógenos que, al menos en nuestra serie, se asocia claramente con más estadios avanzados y menos estadios precoces. También es clara la asociación de la expresión del receptor Her2neu con la afectación ganglionar, incluso cuando se compara con grupos de fenotipo ba-sal definidos por microarrays24.
El peor comportamiento teórico de los tumores clasificados como triple negativo y Her2neu queda refrendado también por la relación de estos grupos con parámetros inmunohistoquímicos de mal pronóstico, como es el caso de un alto índice de proliferación celular25, en el caso del grupo triple negativo, o la expresión de p53 para ambos, aunque la comprobación de la utilidad pronóstica de esta clasificación inmunohistoquímica debe realizarse con un estudio de seguimiento a largo plazo con los casos presentados. De hecho, en nuestra serie, sin haberse utilizado como criterio de definición del grupo, encontramos una asociación significativa de la expresión de p53 con el inmunofenotipo triple negativo, como sucede en los trabajos realizados con microarrays8 e inmunohistoquímica14.Al igual que se ha visto en otras series2, y aunque sin diferencias estadísticamente significativas en nuestros casos, es de destacar que la tercera parte de los casos del grupo luminal B presentaban un índice de proliferación elevado, lo cual implica un factor de peor pronóstico respecto al otro subgrupo luminal y al grupo mixto.
En este trabajo se encuentran diferencias llamativas en un subgrupo concreto de tumores que expresan receptores hormonales estrogénicos únicamente, como es el caso del luminal B. Esto podría ser explicado desde el diseño de los grupos, al definir un grupo mixto con casos en que hay tanto receptores hormonales como Her2neu, que no “contaminarían” estadísticamente al grupo luminal puro y desprecia las diferencias que pudieran deberse a la expresión del receptor Her2neu. No considerar este grupo, definiendo como luminal a un tumor por el simple hecho de que exprese receptores hormonales e independientemente de que exprese Her2neu, podría pasar por alto estos hallazgos. Una explicación hipotética a la asociación que surge en este trabajo entre el grupo luminal B con una mayor afectación ganglionar y una mayor tasa de proliferación celular se basaría en que los receptores estrogénicos permiten un estímulo de la proliferación, mientras que la ausencia de receptores progesterónicos impediría la modulación de la diferenciación celular26-28, probablemente dotando a las células de características asociadas a un peor pronóstico clínico. Otra hipótesis, basada en el hecho de que determinados factores de crecimiento pueden ocasionar una disminución en la expresión de receptores de progesterona, es que el fenotipo luminal B sólo sea un epifenómeno que refleje la situación de tumores en los que se da una relación de hiperfuncionalidad entre los receptores estrogénicos y determinadas vías que incluyan estos factores de crecimiento y, en definitiva, inhiben la expresión de los receptores de progesterona29.
Desde el punto de vista de su aplicación clínica, además, es importante reseñar que el patrón dependiente de la expresión o no de receptores progesterónicos tendría también importancia como factor a la hora de considerar pautas terapéuticas hormonales concretas26,30-33.
De forma general, y en relación con esto último, hay que destacar que tan importante o más que la utilidad pronóstica de este tipo de clasificación es su valor predictivo. Esto es, los distintos inmunofenotipos responderían de forma distinta a distintas terapias. Así los grupos luminales con expresión de receptores serían subsidiarios de tratamientos hormonales (considerando las matizaciones a las que se hace referencia en el anterior párrafo), mientras que las pacientes del grupo Her2neu se beneficiarán de añadir terapia biológica con trastuzumab a la quimioterapia, y el inmunofenotipo triple negativo precisará quimioterapia. En este contexto, la asociación de la expresión de p53 con inmunofenotipos de alto riesgo podría definir subgrupos que se beneficiarían de quimioterapias de alta dosis34.
En relación con el tratamiento adyuvante del cáncer de mama, incluso se ha comprobado la influencia de la expresión inmunohistoquímica con la respuesta a terapias primarias o neoadyuvantes35.
Por todo lo anterior y ante la creciente introducción de nuevos fármacos, sobre todo hormonales, y terapias biológicas (anticuerpos dirigidos a dianas terapéuticas específicas), se hace imprescindible investigar y tener en cuenta este tipo de clasificaciones a la hora de valorar la respuesta a estos tratamientos, lo que deja abierta la línea de trabajo con las variables inmunohistoquímicas que, probablemente, permitan definir grupos concretos con mejor o peor respuesta a estas terapias.
En definitiva, los resultados obtenidos parecen confirmar que hay diferencias entre los inmunofenotipos considerados, de tal forma que la clasificación mediante estos criterios permitiría discernir formas con diferente pronóstico, aunque son necesarios estudios de seguimiento para confirmar este punto. Entre estas diferencias los subgrupos sin expresión de receptores hormonales, con sobreexpresión de Her2neu (grupo Her2neu) o sin ella (grupo triple negativo), presentan características asociadas a variables de peor pronóstico. También la falta de expresión de receptores progesterónicos, en los casos con receptores hormonales, parece asociarse a éstas.
Correspondencia: Dr. A. Piñero Madrona. Servicio de Cirugía General y del Aparato Digestivo I. Hospital Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. 30120 El Palmar. Murcia. España. Correo electrónico: antonio.pinero@carm.es; antonio.pinero@ono.com
Manuscrito recibido el 3-12-2007 y aceptado el 28-3-2008.