La denominada cirugía sin cicatrices visibles en el tratamiento del cáncer de mama incluye a un grupo de procedimientos quirúrgicos cuyo objetivo es doble: el control local del proceso oncológico y el mantenimiento de la imagen corporal de la mujer mediante la realización de incisiones que no sean visibles. Este artículo describe 4 vías de acceso para la cirugía sin cicatrices (periareolar, axilar, submamaria y torácica lateral) en diferentes contextos de la enfermedad oncológica mamaria. La aplicación de estas incisiones en el tratamiento conservador del cáncer de mama exige la realización de una disección subcutánea amplia sobre la localización tumoral y una remodelación local, con tejido mamario adyacente para no deformar el contorno mamario, así como el desplazamiento del pezón con su aréola, con lo que se evita modificar quirúrgicamente la mama contralateral para mantener la simetría entre ambas. En el ámbito de la mastectomía, se describe la utilización de incisiones que quedan ocultas para la realización de mastectomías que tratan de preservar la mayor cuantía de piel posible, junto con el pezón, así como para la disección, con ayuda endoscópica, del músculo dorsal ancho en la reconstrucción mamaria inmediata.
So-called “scarless” surgery in the treatment of breast cancer consists of a group of procedures with a double aim: local control of the oncological process and maintaining the body image of the woman by making incisions that will not be visible. This article describes four approach routes for scarless surgery (periareolar, axillary, submammary, lateral chest) in different contexts of the oncological breast disease. The application of these incisions in the conservative treatment of breast cancer requires making a wide subcutaneous dissection over the tumour location, and a local reconstruction with adjacent breast tissue, so as not to deform the breast contour, as well as moving the nipple with its areola, thus avoiding the surgical modification of the other breast to maintain symmetry between both. We describe the use of hidden incisions to perform mastectomies that try to conserve as much skin as possible, together with the nipple, as well the dissection, with the aid of an endoscope of the latissimus dorsi muscle, in the immediate breast reconstruction.
La cirugía sin cicatrices visibles (CSCV) es una nueva opción técnica en el tratamiento del cáncer de mama, cuyo objetivo final es la realización de resecciones oncológicas a través de incisiones imperceptibles a la visión de la paciente o a la percepción ajena. Este objetivo se alcanza mediante la planificación de incisiones que resultan imperceptibles en la mama o en sus proximidades y que permiten la extirpación del proceso tumoral con una seguridad oncológica idéntica a los procedimientos convencionales y, al mismo tiempo, con una mínima alteración en el contorno, el volumen y la forma de la mama original. Este nuevo planteamiento quirúrgico, que comparte los fundamentos oncológicos de la cirugía conservadora y radical del cáncer de mama (márgenes, extirpación glandular total, etc.), exige la previa evaluación del estadio ganglionar (biopsia del ganglio centinela y linfadenectomía axilar) así como técnicas quirúrgicas de remodelación y reconstrucción tras la exéresis tumoral, todo ello condicionado por la reducción de la vía de acceso al objetivo quirúrgico1. La remodelación local con tejido adyacente es una exigencia técnica que comparten la mayoría de estos procedimientos, con la que se procura evitar la deformidad secundaria a la cicatrización y a la irradiación del lecho quirúrgico.
Los 2 objetivos principales de la CSCV, conseguir el control local del tumor y, al mismo tiempo, un resultado final sin cicatrices perceptibles, deben situarse en el contexto de las exigencias oncológicas de la enfermedad con el objetivo de disminuir el impacto psicológico del cáncer de mama y reducir al mínimo la alteración de la imagen corporal de la mujer, en una zona tan sensible para ella, estética y emocionalmente. Con este planteamiento la mujer afrontará mejor el diagnóstico de cáncer de mama y sus tratamientos posteriores en los diferentes ámbitos de su dimensión humana (familiar, profesional, sexual, etc.), y evitará, en lo posible, los sentimientos de mutilación, baja estima, ausencia de feminidad o estigmatización social. La CSCV pretende, en último término, que la mujer con cáncer de mama se sienta mujer en la nueva situación personal originada por el tumor maligno.
IndicacionesLa CSCV engloba a un grupo de procedimientos técnicos que corresponden tanto a la cirugía conservadora de la mama como a la cirugía radical con reconstrucción inmediata. En la cirugía conservadora, este planteamiento comparte las indicaciones de las técnicas conservadoras, si bien limitadas por la localización anatómica del tumor y por el volumen de la resección. En lo que se refiere a la localización tumoral, su mejor indicación corresponde a los tumores situados en las inmediaciones de la reducida vía de acceso, o sea, los tumores periareolares, los situados en el cuadrante superoexterno (cola de Spencer, proximidades de la línea axilar anterior, etc.) o aquéllos ubicados en el polo inferior cercanos al surco submamario. Desde el punto de vista del volumen tumoral, la mejor indicación para esta vía de acceso son los tumores menores de 2cm (T1), especialmente T1a y T1b, ya que en estas circunstancias la remodelación puede realizarse mediante la movilización de colgajos dermoglandulares. Son especialmente interesantes para esta indicación los tumores no palpables diagnosticados en un programa de cribado que se manifiestan como masas o radiopacidades. Por el contrario, encontraremos la principal limitación en las mamas de escaso volumen, en donde el volumen extirpado es difícilmente remodelable con el tejido adyacente, así como los procesos multifocales que no permiten una resección “económica”.
La utilización de una vía de acceso sin cicatriz perceptible en las mujeres a las que se les realiza una mastectomía comparte indicaciones con los procedimientos que procuran preservar toda la piel posible junto con el pezón. En este sentido, la primera exigencia, desde el punto de vista oncológico, es la existencia de un plano anatómico, libre de enfermedad, entre la glándula y la piel, así como la ausencia de tumor en la cubierta cutánea, ya sea por afectación directa o por invasión carcinomatosa de los linfáticos dérmicos2,3. Con este criterio, el acceso quirúrgico sin cicatrices estaría contraindicado en las mastectomías por tumores cercanos a la piel, sin margen adecuado, desde el punto de vista oncológico, cuando existe afectación directa de la piel y cuando ésta presenta signos de inflamación y edema. Estas situaciones adversas pueden mejorar mediante tratamientos neoadyuvantes que dejen libre de invasión tumoral a la piel. Los tumores centrales merecen una mención especial, ya que su proximidad al complejo aréola-pezón (CAP) puede hacer necesaria la extirpación de este complejo, aunque en la mayoría de los casos podrá conservarse la aréola, no afectada por la tumoración4. Desde el punto de vista anatómico, la principal contraindicación son las mamas voluminosas y caídas, ya que en estas circunstancias la mejor opción será una skin-sparing mastectomy (MPP, ‘mastectomía con preservación de la piel’) del tipo iv, es decir, una técnica de reducción mamaria que impide la opción de una CSCV.
Planificación de un acceso quirúrgico sin cicatricesLa planificación de una incisión no visible para el acceso quirúrgico del cáncer de mama debe cumplir unos requisitos básicos, con el fin de mantener la seguridad oncológica y, simultáneamente, facilitar un resultado estético adecuado. Para esto, estas incisiones deben mantener la integridad del envoltorio mamario para evitar distorsiones en el contorno mamario y desplazamientos del CAP de modo especial tras la radioterapia. Si el acceso quirúrgico no modifica el contorno mamario ni moviliza el CAP, tendremos asegurada la simetría mamaria y, por tanto, la paciente no precisará una actuación quirúrgica en la otra mama con este objetivo. No obstante, y al igual que el resto de la cirugía conservadora, habrá que asumir una asimetría mamaria a medio plazo, secundaria a los tratamientos adyuvantes que provocarán la fijación de la mama intervenida, junto con la ptosis progresiva de la mama contralateral.
El segundo requerimiento técnico para un acceso sin cicatrices es la llamada cirugía de rescate, es decir, en la posibilidad de que el procedimiento inicial no haya sido exitoso y sea necesaria una mastectomía para el control local del proceso oncológico. Tradicionalmente se ha aconsejado la realización de incisiones que puedan quedar englobadas en la herida originada por la mastectomía con el fin de garantizar la exéresis de todos los trayectos quirúrgicos de la fallida intervención previa. En la actualidad, este criterio se ha visto modificado por el auge de los procedimientos que procuran preservar la mayor extensión de piel posible, en los que la MPP y la nipple-skin sparing mastectomy (MPPP, ‘mastectomía con preservación de la piel y el pezón’) son sus máximos exponentes. En este nuevo contexto, la planificación de una incisión no visible no sólo debe cumplir los criterios oncológico y estético, sino, además, un criterio anatómico que garantice una vascularización adecuada del envoltorio cutáneo para la técnica de preservación de la piel (MPP o MPPP), ya que de él dependerá el resultado de la reconstrucción inmediata5,6. En este sentido, cualquiera de las vías de acceso que describiremos a continuación garantiza la irrigación del envoltorio cutáneo de la mama, ya que no interfieren en la vascularización cutánea, especialmente la proveniente de la arteria mamaria interna.
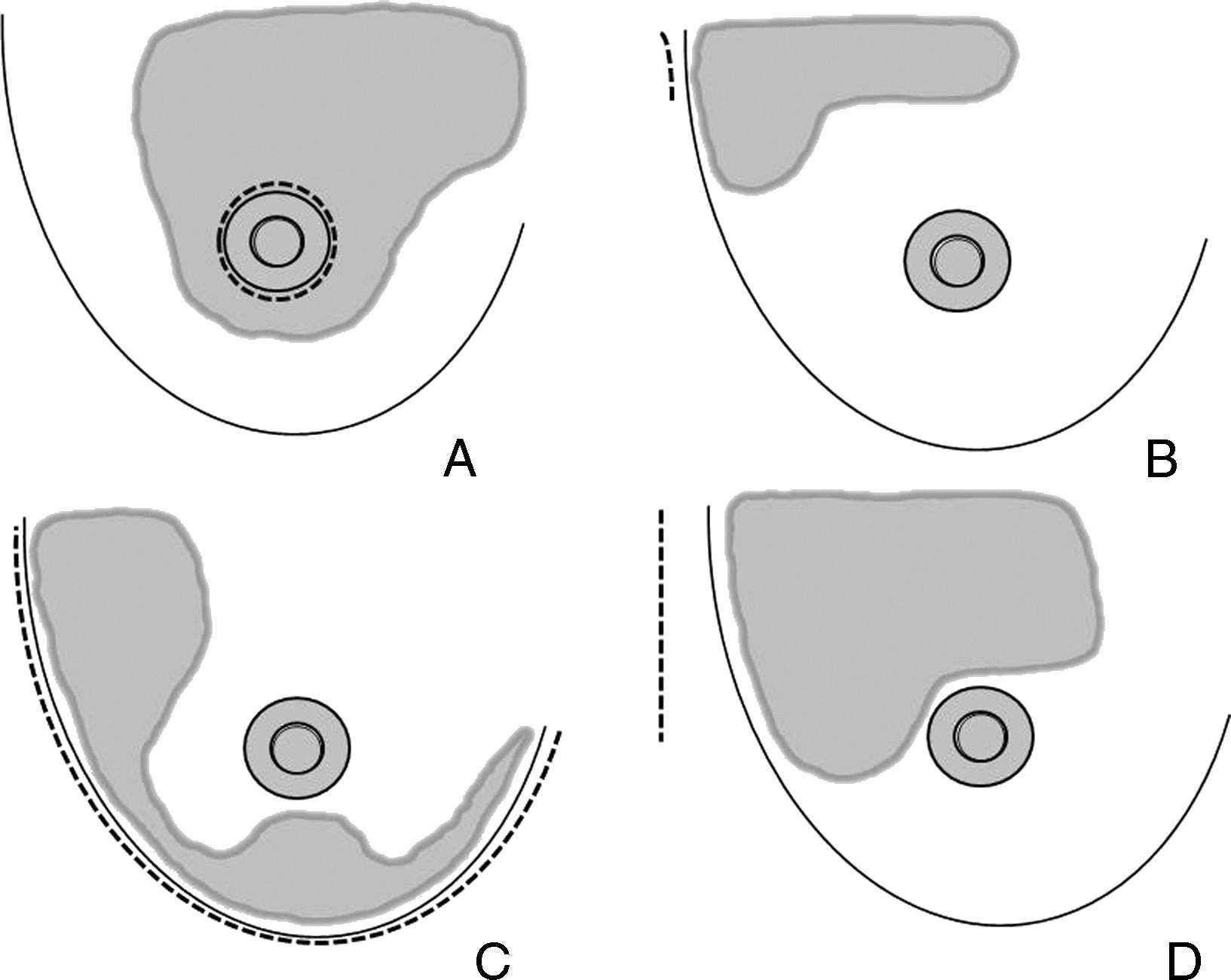
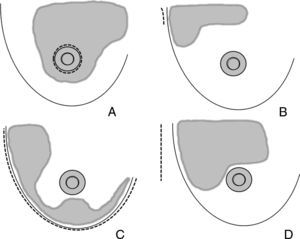
Finalmente, el requerimiento básico de cualquier vía de acceso no visible es que esta vía quede disimulada en los contornos anatómicos, al menos para la enferma. Existen 4 procedimientos básicos que cumplen estas expectativas: el acceso periareolar, el acceso axilar, el acceso inframamario y el acceso torácico lateral (ATL). La figura 1 expone las áreas de actuación de cada uno de estos abordajes.
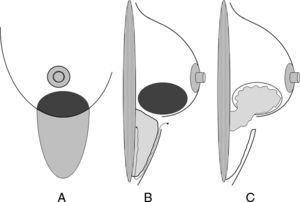
Áreas de actuación en las vías de acceso ocultas de la mama. Cirugía conservadora. A) La vía de acceso periareolar permite la extirpación de tumores situados en la proximidad de la aréola y el polo superior. Es especialmente útil para las lesiones situadas en las zonas visibles en el escote (cuadrante superointerno). B) La vía de acceso axilar está indicada para la extirpación de tumores en la cola de Spencer y el cuadrante superoexterno y la realización simultánea de una biopsia del ganglio centinela. C) Las tumoraciones situadas en la cercanía del surco submamario son candidatas de una vía de acceso a través de éste, especialmente las situadas en la región intercuadrantérea inferior, en donde puede utilizarse un colgajo adipofascial. D) El acceso torácico lateral es útil para resecciones amplias del cuadrante superoexterno y su posterior reconstrucción con el músculo dorsal ancho.
La vía de acceso periareolar (round-block) constituye el procedimiento más difundido con el propósito de conseguir un resultado estético adecuado, sobre todo en la enfermedad benigna de la mama. Esta vía de acceso permite la exéresis de lesiones próximas a la aréola, hasta una distancia de 2cm, aunque se pueden ampliar sus indicaciones mediante la creación de túneles en el tejido mamario dirigidos hacia la lesión. Su principal indicación son las lesiones situadas en el polo superior, ya que en esta área anatómica la exéresis del tejido no afecta, en la mayoría de los casos, al contorno mamario ni provoca desplazamientos del pezón con su aréola. Ésta es la razón de que sea posible utilizar, en el polo superior de la mama, la técnica del túnel para alcanzar lesiones alejadas del CAP como procedimiento idóneo para el acceso a tumores situados en regiones que son visibles en el escote femenino, como el cuadrante superointerno y la región intercuadrantérea superior7. Por el contrario, el polo inferior mamario no es una indicación idónea para esta vía de acceso, de modo especial las lesiones alejadas del CAP, ya que la realización de un túnel de acceso a la lesión se hace difícil por la ptosis mamaria y porque la cicatrización repercute sobre la convexidad de este polo y la rectifica, con lo que se deforma el contorno mamario.
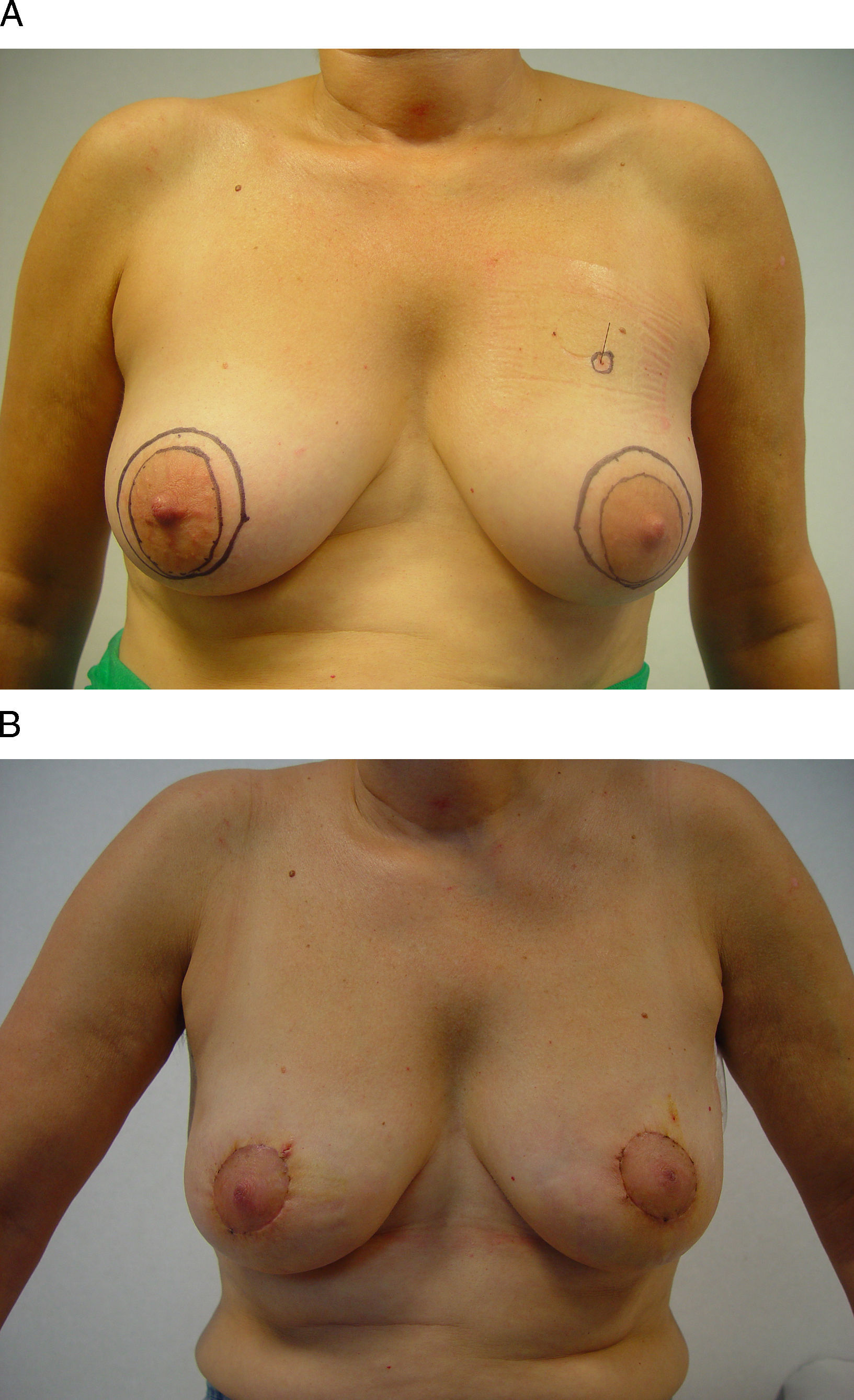
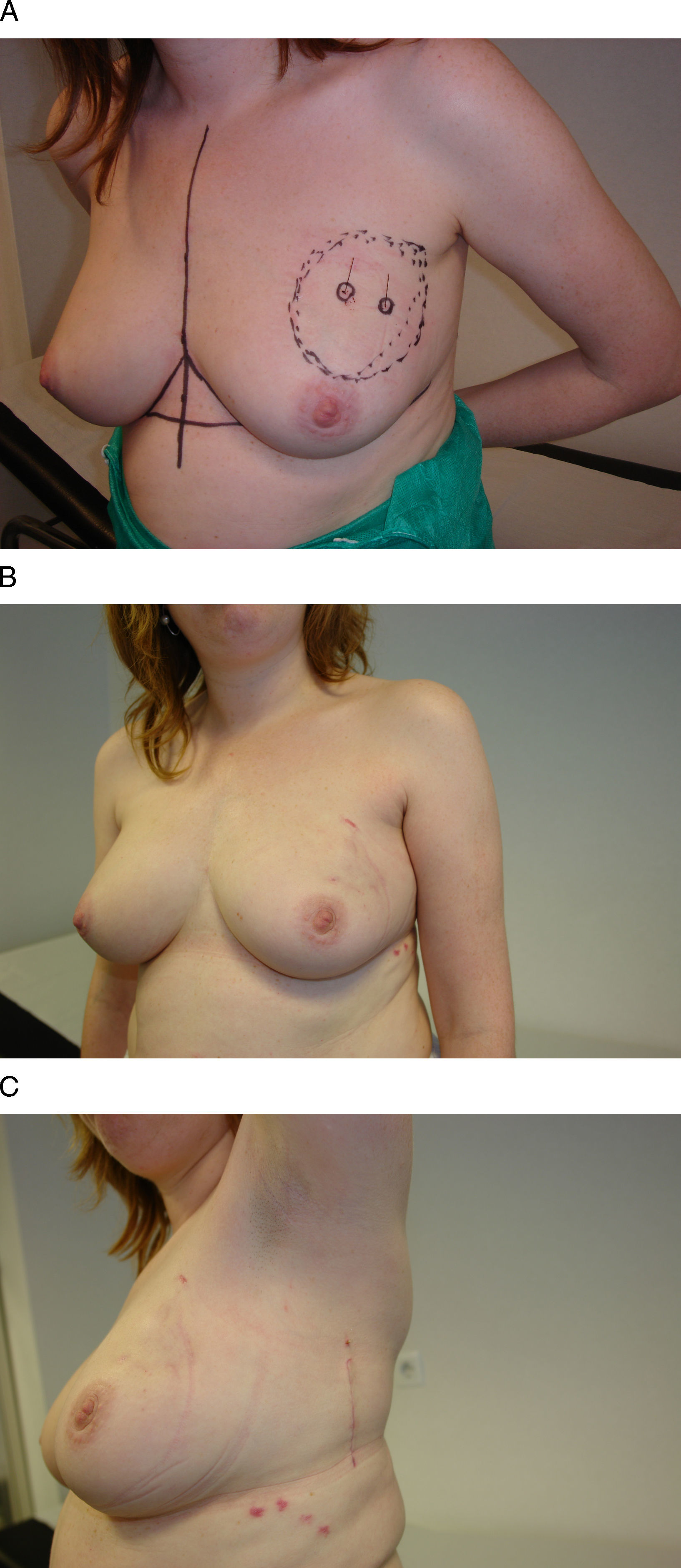
Este procedimiento hace posible, además, un despegamiento cutáneo extenso en el polo superior de la mama en aquellos casos en los que sea necesaria una remodelación de la mama a partir de la disección de colgajos dermoglandulares, especialmente las localizaciones alejadas del CAP situadas en los cuadrantes superointerno e intercuadrantéreo superior. El resultado final garantiza un volumen mamario y una localización del CAP similares a los que tenía antes de la operación, aunque con una disminución en la proyección mamaria. En aquellos casos en los que se considere necesaria una movilización del CAP, ésta podrá llevarse a cabo con facilidad mediante un segundo círculo descentrado hacia la posición a la que deseamos desplazar el CAP (fig. 2). En cualquiera de estas opciones, los drenajes pueden exteriorizarse a través del surco submamario para aminorar la visibilidad de las cicatrices.
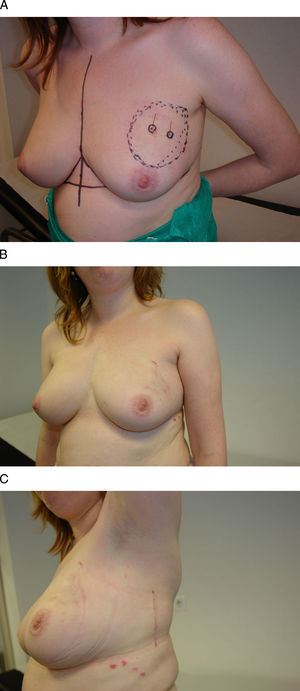
Vía de acceso periareolar o “round-block”. Esta mujer de 48 años presenta un carcinoma infiltrante en la unión de los cuadrantes superiores de la mama izquierda que se ha tratado con quimioterapia neoadyuvante. A) Tras su localización radioquirúrgica se ha planificado un acceso periareolar para evitar una cicatriz visible en el escote. B) Se ha descentrado el círculo externo con el fin de elevar la posición del CAP, por lo que ha sido necesaria una acción quirúrgica en la mama contralateral para igualar la altura de ambos pezones y aréolas.
Para evaluar el estadio ganglionar se realiza una segunda incisión a nivel axilar, ya sea para realizar una biopsia del ganglio centinela como para completar una linfadenectomía axilar. En los casos en los que se decida realizar una biopsia del ganglio centinela en la arteria mamaria interna debe intentarse su exéresis desde la vía de acceso periareolar mediante un despegamiento amplio de la cubierta cutánea del cuadrante superointerno y una cuidadosa disección de las ramas perforantes de la arteria mamaria interna. La alternativa a esta vía de acceso es una incisión paraesternal, visible en el escote.
Las principales consecuencias adversas del acceso periareolar son las cicatrices queloides, especialmente en razas vulnerables, como la negra, y la hipopigmentación de la aréola, que puede corregirse mediante tatuaje. Las alteraciones en la sensibilidad del CAP deben discutirse previamente con la paciente; para minimizar este déficit de sensibilidad, se debe intentar la conservación del pedículo interno, siempre que sea posible. La radioterapia postoperatoria puede inducir, a medio o a largo plazo, alteraciones en el resultado estético del CAP, como distorsiones en la aréola, muy patentes cuando no se ha realizado una remodelación del lecho tumoral, o bien desplazamientos de este complejo que pueden minimizarse mediante la planificación de un segundo círculo cuando se prevea una extirpación significativa del tejido próximo al centro mamario.
Acceso inframamarioEl surco inframamario constituye un acceso ideal para un procedimiento sin cicatrices, ya que en la mayoría de las mujeres la ptosis mamaria oculta la visibilidad de este surco. De acuerdo con la técnica quirúrgica por realizar, podemos diferenciar 3 procedimientos cuya puerta de entrada se sitúa en el surco inframamario.
- •
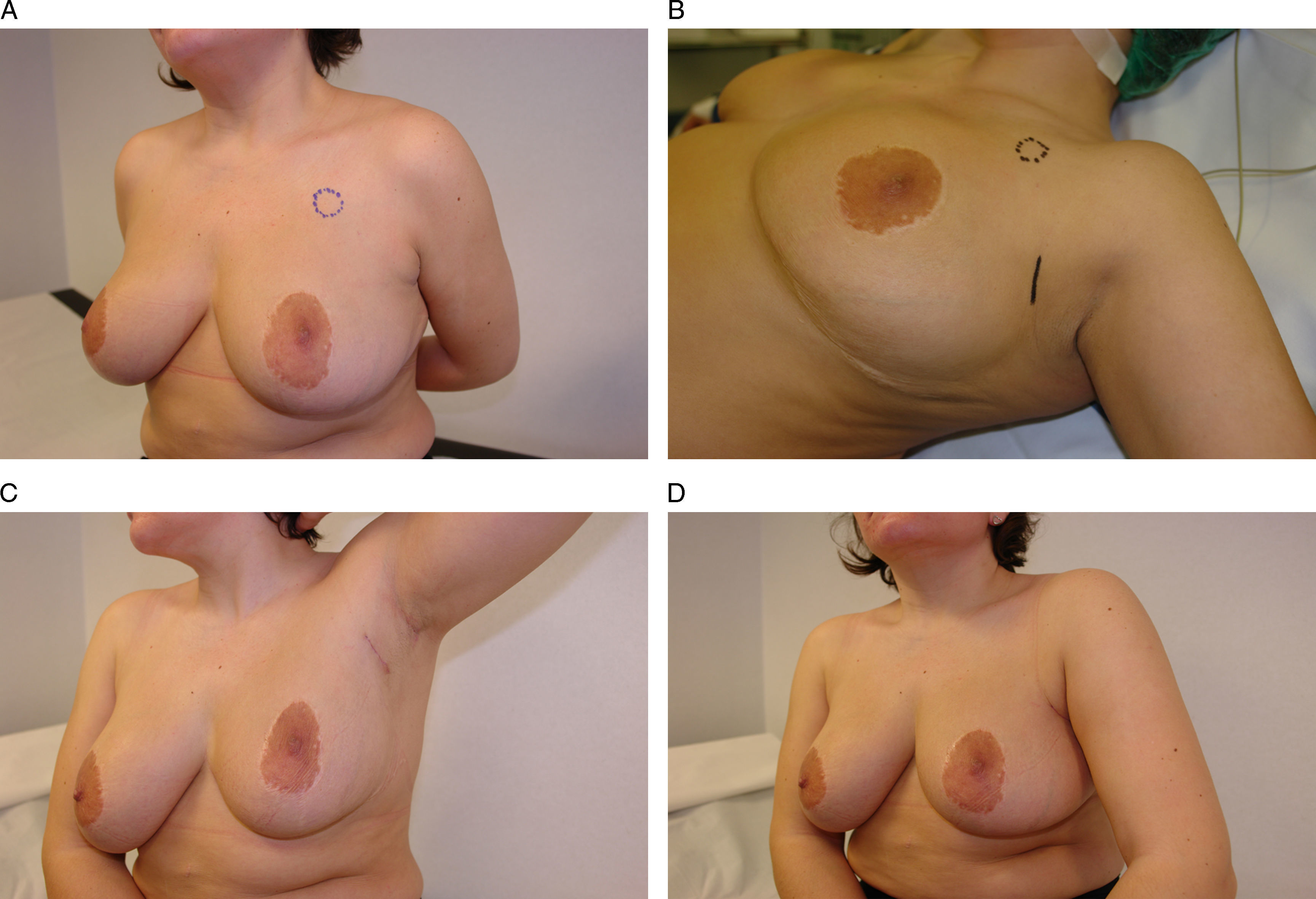
Tumorectomía y remodelación local con tejido mamario. La principal indicación de este procedimiento es el acceso a tumores próximos al surco inframamario cuyo tamaño (<5cm) permita la remodelación local mediante la disección de colgajos dermoglandulares. La principal limitación de este acceso es el impacto negativo que la remodelación local pueda provocar sobre el contorno del polo inferior, y que se verá tanto más alterado cuanto mayor sea el defecto y la movilización del tejido local. Por este motivo, las tumoraciones del cuadrante inferointerno son una mala indicación para esta vía de acceso por estar situadas en un cuadrante con escasos recursos para la remodelación local. Por el contario, la región intercuadrantérea externa constituye una localización idónea para el acceso a través del pliegue lateral del surco inframamario, ya que se dispone de abundante tejido mamario para la remodelación local (fig. 3). En cualquiera de los casos, un detalle técnico importante es que la disección desde el surco inframamario debe realizarse siempre en dirección a la mama, y evitar despegar el surco de su implantación en el tórax, ya que, en caso contrario, se desfigura su anatomía.
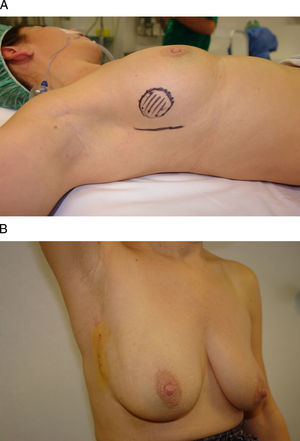
Figura 3.Vía de acceso inframamario. Esta mujer de 46 años presenta un carcinoma infiltrante en la unión de los cuadrantes externos de la mama derecha. A) Tras recibir quimioterapia neoadyuvante se planificó un acceso a través de la porción lateral del surco inframamario. B) El resultado final es una cicatriz lateral imperceptible a la visión frontal y una incisión oculta por el surco inframamario.
(0.29MB). - •
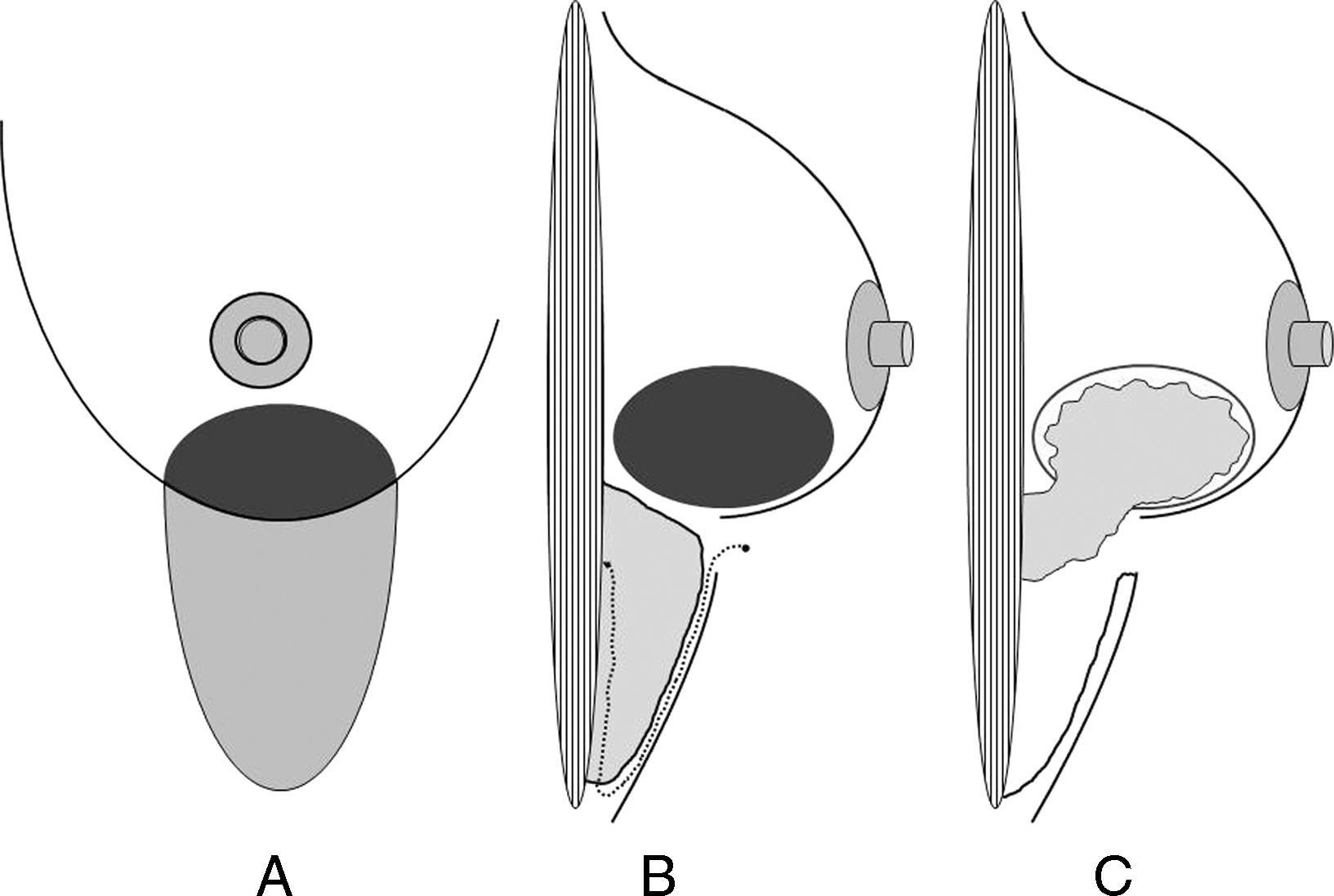
Tumorectomía y remodelación local con tejido extramamario. Recientemente, algunos autores japoneses8,9 han comunicado su experiencia en la utilización de colgajos adipofasciales inframamarios para la remodelación tras tumorectomías en el polo inferior mamario. Este procedimiento está indicado en tumores del polo inferior que se asientan en las mamas de pequeño tamaño, en las que no es posible la remodelación local con el tejido adyacente. El acceso en ambos procedimientos (tumorectomía y disección del colgajo) se realiza desde el surco inframamario. La confección del colgajo adipofascial exige un despegamiento subcutáneo de un área inframamaria con un volumen superior (>30%) al volumen del defecto con el fin de compensar la atrofia que se producirá en el colgajo con el paso del tiempo (fig. 4). Finalmente, se despega la porción grasa y fascial de su adherencia a la pared torácica para su movilización cefálica y se mantiene el colgajo adherido en el surco inframamario. Tras movilizarlo hacia el defecto mamario, se sutura el borde inferior de la herida quirúrgica con el fin de reproducir nuevamente el surco inframamario original.
Figura 4.Confección de un colgajo adipofascial. A) La realización de un colgajo adipofascial se inicia con la planificación del área de despegamiento inframamario a la altura de la lesión mamaria. B) Posteriormente se realiza el tallado del colgajo adipofascial y se despega de la cubierta cutánea y de la pared torácica respetando su adherencia en el surco submamario de donde recibirá su irrigación. C) Finalmente, se traslada este colgajo a su nuevo alojamiento en el polo inferior de la mama para ocupar el defecto originado por la resección oncológica.
(0.1MB). - •
MPPP. Este procedimiento puede realizarse a través del surco inframamario con importantes ventajas para la paciente: deja una cicatriz invisible, no interrumpe el flujo vascular cutáneo proveniente de las arterias laterales (axila), mediales (mamaria interna) y superiores, y permite reforzar el nuevo surco submamario y mejorar el resultado estético final10. La preservación del pezón da un aspecto natural a la mama y superior al proporcionado con el injerto libre de CAP; además, le confiere a la mama una mayor entidad, ya que la mujer la identifica como propia, tanto en su imagen corporal como en sus sensaciones (recuperación de la sensibilidad).
La indicación de este acceso dependerá de las características anatómicas de la mama y del proceso oncológico. Desde el punto de vista anatómico, este acceso está indicado en las mamas de pequeño y mediano tamaño (copa A-B), en las que la distancia entre el surco inframamario y el límite del polo superior no supere los 18–20cm11,12. Esta limitación se relaciona con la dificultad en la disección del polo superior, la más alejada de la puerta de entrada, y con la necesidad de que esta distancia no rebase la longitud de los separadores. Desde el punto de vista oncológico deben descartarse los tumores centrales de la mama, los mayores de 3cm y aquéllos en donde exista invasión linfática y vascular. En estos casos puede ser oportuno un tratamiento neoadyuvante con quimioterapia con el fin de reducir la masa tumoral. Las mujeres fumadoras y obesas deben informarse del incremento de complicaciones locales relacionadas con la necrosis cutánea y la infección, sin que ello sea una contraindicación absoluta para el procedimiento.
La realización de una MPPP a través del surco inframamario debe garantizar 2 aspectos: la viabilidad vascular y oncológica del CAP y la viabilidad vascular del envoltorio cutáneo. La viabilidad del CAP precisa una disección cuidadosa del tejido retroareolar para dejar una mínima porción detrás de éste. Una vez extirpada la pieza quirúrgica se puede evertir esta zona a través de la herida quirúrgica con el fin de limpiar la mayor cantidad posible del tejido13. En este momento la viabilidad vascular del CAP dependerá de la microvascularización proveniente de los vasos dérmicos de la aréola distribuidos en anillos concéntricos al pezón. Respecto a la seguridad oncológica, la práctica de una MPPP exige la realización de una resonancia magnética preoperatoria para identificar la relación del tumor con el CAP y descartar su afectación. Durante la intervención es aconsejable la realización de una biopsia intraoperatoria del tejido retroareolar para descartar la afectación neoplásica del pezón que, en caso de producirse, requerirá su extirpación para su conversión a una MPP y aréola. Finalmente, la viabilidad vascular del envoltorio cutáneo dependerá de la permeabilidad de las perforantes de la arteria mamaria interna y del dorsal ancho, lo que nos exige su preservación durante la disección de la pieza quirúrgica.
La seguridad oncológica de este procedimiento se ha incrementado en la actualidad a causa de varios factores. El primero, una mayor especialización de los cirujanos en las técnicas quirúrgicas del cáncer de mama que permite una disección más precisa de los colgajos cutáneos (<2mm) y una optimización de la resección en las localizaciones más complejas, como el cuadrante superoexterno y la axila o aquéllas más alejadas de la puerta de entrada, lugares en donde clásicamente se han producido las recidivas en esta técnica. Un segundo factor ha sido el diagnóstico temprano de la enfermedad que ha permitido el acceso a tumores cada vez más pequeños que pueden ser fácilmente controlables con una mastectomía. A ello debemos añadir la realización de tratamientos neoadyuvantes que, como la quimioterapia, producen una disminución significativa del tamaño del tumor o la práctica de radioterapia intraoperatoria en el CAP que mejora significativamente el riesgo de recaída en esta localización14,15. Finalmente, la introducción de la resonancia magnética en el estudio preoperatorio permite identificar los tumores con afectación del CAP para excluir la preservación del pezón y optar por una MPP del tipo i16. En este sentido, el carcinoma ductal in situ constituye el tipo clínico más conflictivo para la MPPP, ya que su multicentricidad y la imposibilidad de un tratamiento neoadyuvante condicionan un porcentaje no desdeñable de afectación del tejido retroareolar.
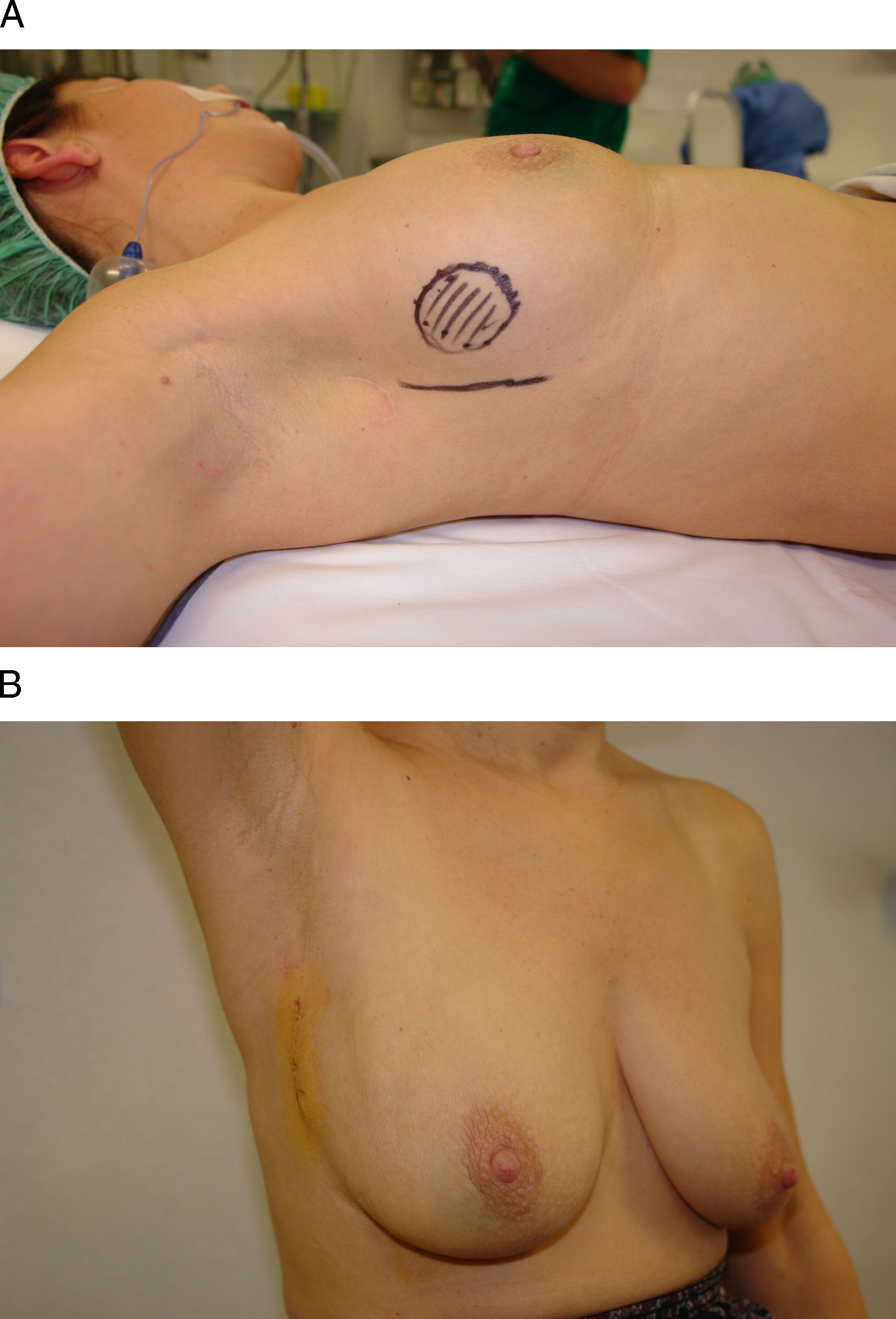
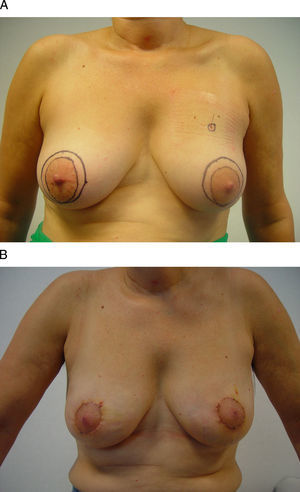
Vía de acceso axilarEl acceso axilar es el procedimiento menos intensivo en el tratamiento conservador del cáncer de mama, ya que permite la extirpación tumoral y la evaluación del estadio ganglionar a través de una mínima incisión en la línea axilar anterior17 (fig. 5). Su principal indicación la constituyen las tumoraciones ubicadas en la cola de Spencer y en el cuadrante superoexterno, si bien algunos autores también han utilizado esta vía de acceso para la extirpación de lesiones en cuadrantes mediales e inferiores con la ayuda de material endoscópico o una segunda incisión periareolar18–20. Su principal limitación técnica es la distancia respecto a la incisión axilar, ya que su ejecución no sólo precisa la creación de un túnel hasta la tumoración, sino, además, un despegamiento cutáneo local para facilitar tanto la extirpación como la remodelación. La afectación cutánea y la multifocalidad constituyen otras limitaciones para este acceso.
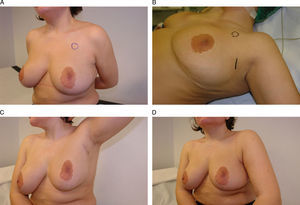
Vía de acceso axilar. A) Esta mujer de 42 años se ha diagnosticado de un carcinoma infiltrante en la región infraclavicular izquierda. B) Para su extirpación se planificó un abordaje axilar a partir de una incisión sobre un pliegue cutáneo en la línea axilar anterior. C y D) El resultado final es una mínima incisión en la axila sólo visible con el brazo en abducción.
La ejecución técnica de este procedimiento de acceso es sencilla. Tras una incisión sobre el borde posterior del pectoral mayor, se progresa subcutáneamente hacia la tumoración, guiados por la palpación o por un método que permita localizar las lesiones no palpables (isótopo, arpón, etc.). Una vez alcanzada la tumoración, se realiza un despegamiento amplio del área para abordar la extirpación y el marcaje de sus bordes. Finalmente, se diseñan y se diseccionan en el tejido adyacente los colgajos dermoglandulares necesarios para el cierre del defecto, para ello se coloca a la paciente en posición sentada con el fin de detectar posibles retracciones en el contorno mamario.
La evaluación del estadio ganglionar puede realizarse a través de la misma incisión, especialmente cuando se planifica una biopsia del ganglio centinela, ya que su ejecución será sencilla a través de una incisión axilar amplia y próxima al área de captación isotópica. Si fuese necesaria la realización de una linfadenectomía axilar, ésta podrá llevarse a cabo mediante la ampliación de la incisión inicial en forma de “U”, y hace coincidir su rama posterior con el borde lateral del dorsal ancho a fin de ocultarla en el hueco axilar tras la apertura de los drenajes de aspiración.
Acceso torácico lateralSe trata de un procedimiento que debemos situar en el contexto de la reconstrucción parcial o total de la mama, ya que nos permite disponer no sólo de una puerta de entrada para la extirpación local o total de la mama, sino, además, de un acceso al músculo dorsal ancho para su disección y movilización anterior. Esta vía de acceso puede utilizarse como puerta de entrada única o en combinación con otras incisiones (periareolar e inframamaria) para completar adecuadamente la extirpación mamaria. Su utilización como puerta de entrada única se centra en la realización de resecciones parciales de la mama en el cuadrante superoexterno y su reconstrucción con el cuerpo muscular del dorsal ancho21,22. En estos casos se trata de tumoraciones extensas con afectación multifocal que no pueden abordarse mediante una remodelación con tejido mamario adyacente (fig. 6). Por el contrario, debemos situar la asociación a otras incisiones no visibles en los casos en los que la propuesta técnica es mastectomía y reconstrucción inmediata; de este modo, puede combinarse este acceso lateral con una incisión en el surco submamario para la realización de una MPPP y su reconstrucción inmediata con un implante recubierto con el músculo dorsal ancho. En este caso se suturará el borde inferior del colgajo al surco submamario, con lo que se mantiene el concepto y la práctica de CSCV. Una segunda opción es la asociación del ATL a una incisión periareolar para optimizar la resección en los cuadrantes internos. En la mayoría de estos casos será necesaria la extirpación del CAP, ya sea para su reimplantación posterior o bien para el cierre del defecto central mediante una sutura en bolsa de tabaco.
Acceso torácico lateral. Esta mujer de 35 años se diagnosticó de un carcinoma infiltrante multifocal en el cuadrante superoexterno de la mama izquierda. A) Tras el tratamiento neoadyuvante se planificó una resección del área afectada por el tumor, previamente marcada con arpones, y se procedió a su extirpación a través de una incisión lateral que, al mismo tiempo, posibilitó la disección del músculo dorsal ancho para la reconstrucción parcial del defecto. B y C) El resultado final es una mama sin deformidades y una incisión lateral oculta a la visión frontal.
El ATL ofrece dificultades para evaluar el estadio ganglionar de la axila, especialmente para la realización de una linfadenectomía, ya que su localización a la altura del surco inframamario impide una visión adecuada de la vena axilar. No obstante, puede realizarse una biopsia del ganglio centinela mediante la creación de un túnel, guiado por el marcador isotópico, hacia las inmediaciones del músculo pectoral menor. Desde el punto de vista técnico, el ATL consiste en la planificación de una incisión longitudinal de 10cm en la línea axilar posterior sobre el borde anterior del músculo dorsal ancho, tal como ha descrito previamente en nuestro país Güemes et al23. Desde aquí, y con ayuda de material endoscópico, puede realizarse la disección del cuerpo del dorsal ancho y liberarlo, inicialmente, del tejido subcutáneo para, posteriormente, despegarlo de su adherencia a la pared torácica. Finalmente, se efectúa la sección del cuerpo muscular lo más distalmente posible para liberar el músculo y así poder rotarlo hacia su nueva localización en la mama.
ConclusionesEn conclusión, la CSCV constituye un nuevo horizonte en el tratamiento quirúrgico del cáncer de mama, cuya finalidad es garantizar el control oncológico de la enfermedad y mejorar la imagen corporal de la mujer. Estos procedimientos son compatibles y complementarios a la mayoría de las técnicas de conservación, remodelación y reconstrucción mamaria; por esto, es importante su difusión y conocimiento en el ámbito quirúrgico, ya que la mayoría de los cirujanos estarán capacitados para su realización. Sólo la universalización de estos procedimientos podrá garantizar las mejores oportunidades a nuestras pacientes.