En la población mundial, el cáncer gástrico es el segundo tumor maligno más frecuente. Se diagnostica en fases avanzadas en más del 65% de los casos y presenta metástasis linfática hasta en el 85% de los pacientes1. La resección quirúrgica R0 es el único tratamiento potencialmente curativo, aunque sólo consigue supervivencias globales a los 5 años en torno al 30%1.
En los últimos años se ha evaluado el papel de la radioquimioterapia postoperatoria y de la quimioterapia perioperatoria dentro del tratamiento multimodal del cáncer gástrico y, aunque sólo muestran modestos aumentos en la supervivencia, se están asumiendo como estándares2. Estos estudios presentan algunos sesgos que han sido subrayados en la literatura, así como complicaciones que no deben ser infravaloradas y que obligan a una mejor selección de los pacientes que pueden realmente beneficiarse de estas opciones terapéuticas3,4.
En octubre de 2006, una mujer de 61 años, sin antecedentes personales de interés, acudió a Urgencias por melenas y vómitos en poso de café. Refería un cuadro constitucional de 2 meses de evolución con pérdida de 2-3kg de peso. La analítica evidenció una hemoglobina de 10g/dl, y la endoscopia digestiva alta identificó una masa exofítica, ulcerada y estenosante yuxtapilórica, cuya biopsia reveló un adenocarcinoma. El estudio de extensión mediante tomografía computarizada (TC) mostró un engrosamiento de la pared del antro gástrico sin metástasis a distancia ni adenopatías de tamaño patológico. No se realizó eco-endoscopia por no disponer de esta exploración. Se realizó una laparotomía exploradora que permitió localizar la tumoración yuxtapilórica y otra lesión en incisura gástrica que no había sido identificada previamente en la endoscopia y cuya biopsia intraoperatoria confirmó el diagnóstico de adenocarcinoma. Se realizó una gastrectomía subtotal con linfadenectomía D1-β y reconstrucción tipo Billroth II. No hubo complicaciones postoperatorias. El estudio histopatológico diagnosticó un adenocarcinoma úlcero-infiltrante yuxtapilórico de 2cm de tamaño, de tipo intestinal, bien diferenciado, y que infiltraba el 50% de la capa muscular (pT2). La segunda lesión era un adenocarcinoma úlcero-infiltrante de 2,5cm de tamaño, tipo enteroide, poco diferenciado, que afectaba la serosa (pT3) (fig. 1). Se aislaron 34 ganglios linfáticos sin metástasis. Se administró radioquimioterapia adyuvante con 5 ciclos de 5-fluorouracilo (5-FU) y leucovorin con radioterapia concomitante (4.500 cGy divididos en 180 cGy al día, 5 días a la semana durante 5 semanas, aplicados sobre el lecho tumoral, ganglios linfáticos regionales y sobrepasando en 2cm los márgenes proximal y distal de resección) entre el 2.° y el 3.° ciclo (esquema Macdonald)2. El tratamiento adyuvante comenzó un mes después de la intervención quirúrgica.
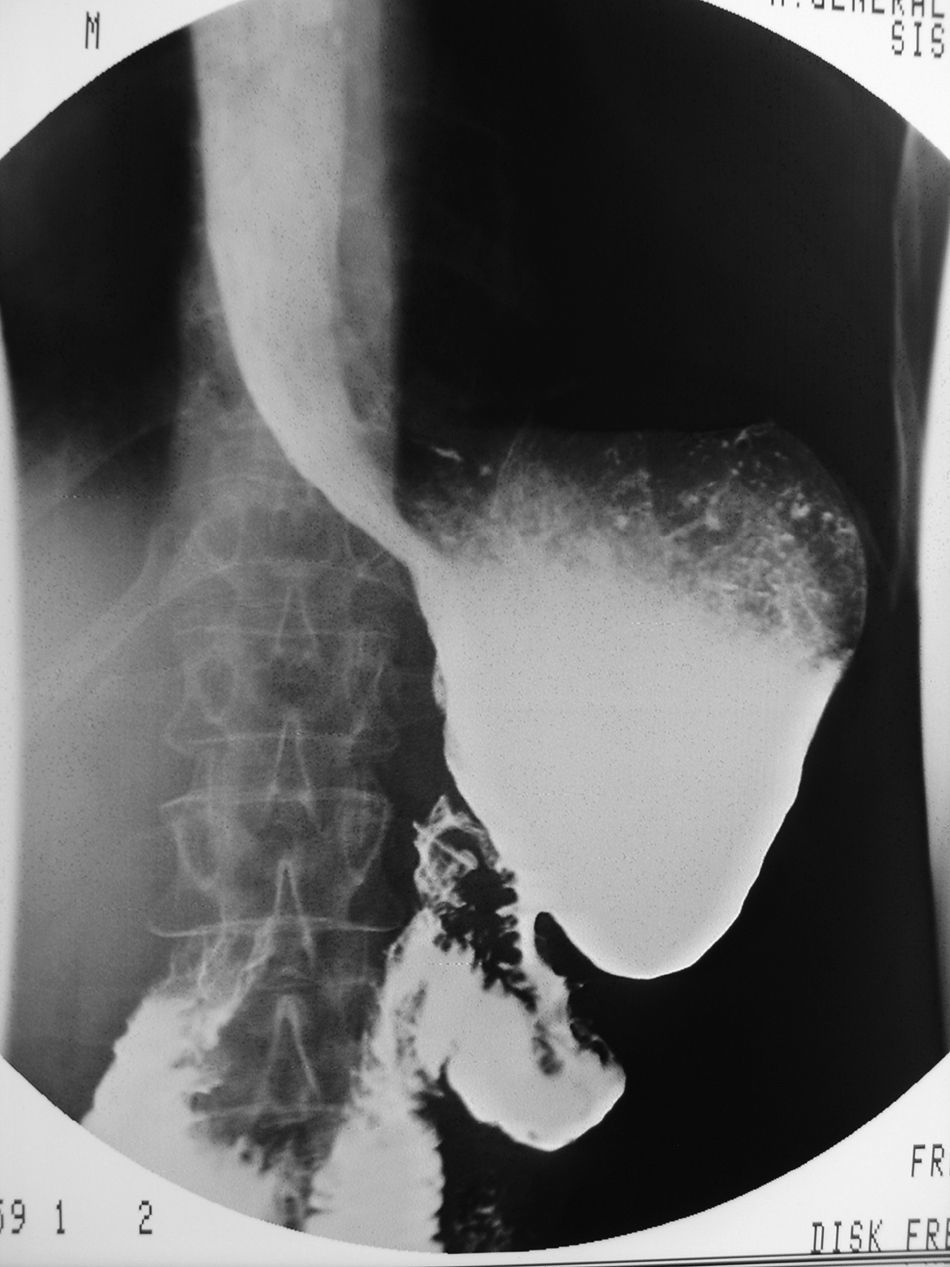
En marzo de 2007, la paciente comenzó con dolor epigástrico post-prandial, vómitos de repetición y pérdida de peso. La endoscopia digestiva alta detectó una úlcera anastomótica con biopsias negativas para malignidad que se trató con inhibidores de la bomba de protones y sucralfato. Un estudio baritado mostró una estenosis de la anastomosis (fig. 1). La paciente no mejoró de su sintomatología e incluso empezó a referir esteatorrea que se controló con Kreon®, por lo que en diciembre de 2007 se reintervino, objetivándose fibrosis y edema en la parte distal del remanente gástrico, cerca de la anastomosis gastroyeyunal. Se realizó una resección parcial del muñón gástrico yuxtaanastomótico y se reconstruyó con un asa intestinal en Y de Roux. No hubo complicaciones postoperatorias. El estudio histopatológico de la pieza quirúrgica reveló fibrosis y edema sin signos de malignidad. Tres años y medio después de la resección tumoral, la paciente sigue controles clínicos periódicos con TC y marcadores tumorales (CEA, CA19.9 y CA 125) que no han mostrado signos de recidiva. No refiere síntomas digestivos y ha aumentado de peso progresivamente, pero está en tratamiento sustitutivo con enzimas pancreáticas que han controlado eficazmente la esteatorrea.
El esquema adyuvante de Macdonald está considerado el tratamiento de elección en la gran mayoría de pacientes con carcinoma gástrico en EE.UU. Esta recomendación proviene de los resultados de un ensayo en el que se incluyeron pacientes desde estadios IB hasta IVM0. El beneficio sobre la supervivencia de los pacientes tratados con radioquimioterapia adyuvante fue de carácter global, sin que pudiera demostrarse por estadios2. Asimismo, la calidad metodológica de este estudio ha sido cuestionada ante la existencia de algunos defectos, como la realización de una cirugía insuficiente en la mayoría de los pacientes, que comprometen su validez interna y externa3.
La incidencia de cáncer gástrico sincrónico múltiple está entre 4–15%4. Nuestra paciente fue considerada de mal pronóstico por presentar dos tumores sincrónicos, si bien se ha observado que el pronóstico en estos casos viene determinado por el tumor con TNM más desfavorable4. La indicación del esquema Macdonald en tumores N0 con suficientes ganglios analizados, como ocurre en el caso que presentamos, es controvertida. Así, se ha propugnado que este tratamiento no debe sustituir a la realización de una linfadenectomía insuficiente5,6, aunque algún estudio también sugiere que puede ser beneficioso incluso cuando se realiza una linfadenectomía D27. Finalmente, algunos oncólogos radioterapeutas son reticentes a aplicarlo por su elevada toxicidad (33% de toxicidad gastrointestinal aguda), fundamentalmente a consecuencia del amplio volumen de irradiación y prefieren reservarlo para pacientes con factores de mal pronóstico (pT3-T4, pN2-N3, rotura capsular o resección incompleta)8.
Aparte de la toxicidad aguda, la radioterapia, potenciado su efecto por la quimioterapia, puede provocar una lesión crónica de los tejidos causada por el daño oxidativo secundario a la liberación de radicales libres. La lesión se inicia con una endoarteritis obliterante que progresa a isquemia intestinal, fibrosis, ulceración y estenosis)7,9. La aparición de úlceras gastroyeyunales por reflujo alcalino es conocida, sin embargo la coexistencia en nuestra paciente de fibrosis, ulceración y estenosis además de la esteatorrea aparecida tras la fase de adyuvancia y controlada con enzimas pancreáticas sugieren un efecto tóxico de la radioquimioterapia10.
La radioquimioterapia adyuvante puede ser la causa de complicaciones graves que en ocasiones requieren una intervención quirúrgica, lo que debe ser tenido en cuenta a la hora de elegir esta opción terapéutica. La indicación del esquema Macdonald debe ser valorada cuidadosamente en pacientes con tumores N0 con suficientes ganglios analizados.