Las heridas del pie diabético secundarias a amputación son complejas y de difícil tratamiento. Actualmente, la curación asistida por presión negativa (CAPNE) es ampliamente utilizada para el tratamiento de diversos tipos de heridas. Sin embargo, en la literatura médica hay escasas pruebas científicas sólidas sobre la aplicación de este tipo de curación en heridas del pie diabético amputado. El objetivo de este estudio es comparar la efectividad de la CAPNE con la de la curación convencional en heridas del pie diabético secundarias a amputación.
Pacientes y métodoEnsayo clínico aleatorio. Sujetos mayores de 18 años, diabéticos de tipo II, con herida por amputación del pie, asignados a curación con CAPNE (grupo A) o a curación convencional (grupo B). La variable respuesta fue el tiempo en alcanzar el 90% de granulación. Se estimó un tamaño de muestra de 11 pacientes por grupo. La CAPNE se preparó con una espuma de éster de poliuretano, sonda Nelaton n.o 16, apósito transparente adhesivo y aspiración central a 100mmHg. La herida se curó cada 48 a 72h y se evaluó semanalmente. Se utilizó estadística descriptiva y analítica.
ResultadosVeinticuatro sujetos con un promedio de edad de 61,8 ± 9,0 años (79% varones), 12 sujetos en cada grupo. El tiempo promedio para alcanzar el 90% de granulación fue significativamente menor en el grupo A (18,8 ± 6 días frente a 32,3 ± 14 días), p=0,007.
ConclusiónLa CAPNE reduce en un 40% el tiempo de granulación de la herida en el pie diabético amputado comparado con el de la curación convencional.
Foot amputation wounds in patients with diabetes are complex and treatment is often difficult. At the moment negative pressure wound therapy (NPWT) is widely used for the treatment of several types of wounds. Nevertheless, the clinical evidence to support the application of this dressing in foot amputation wounds in patients with diabetes is scarce. The aim of this study was to evaluate the efficacy of NPWT compared with standard wound dressing to treat diabetic foot amputation wounds.
Patients and methodRandomised controlled trial. Diabetic patients aged 18 years or older with a foot amputation wound were assigned to treatment with NPWT (A group) or standard wound dressing (B group). Primary efficacy end point was time in reaching 90% of wound granulation. A size of sample of 11 patients per group was used. NPWT was prepared with a polyurethane ether foam dressing, a Nelaton catheter, a transparent adhesive drape and continuous negative pressure of 100mmHg. The wound was treated every 48–72h and evaluated weekly. Descriptive and analytical statistics were used.
ResultsThere were 24 patients, with a mean age of 61.8±9 years (79% men), 12 in each group. The average time to reach 90% of granulation was lower in A group (18.8±6 days versus 32.3±13.7 days), a statistically significant difference (P=0.007).
ConclusionNPWT reduces the granulation time of diabetic foot amputation wounds by 40%, compared with the standard wound dressing.
Se estima que la diabetes mellitus afectará a cerca de 366 millones de personas para el año 20301,2,3. Entre un 12 y un 25% de los sujetos diabéticos desarrollará una úlcera en el pie durante su vida4,6,7,8; ésta es una de las complicaciones que mayor incapacidad genera en estos pacientes4,5. Su prevalencia es de un 12%9 y frecuentemente se acompaña de infecciones de distinta magnitud, tiene una evolución tórpida y el acontecimiento final en el 7% de los casos es la amputación10. Las heridas resultantes de estas amputaciones son grandes, profundas11,12 y requieren un cuidado local intensivo, con lenta cicatrización e incapacidad prolongada13. A su vez, el retraso en la cicatrización de las heridas del pie diabético se relaciona con infección en el tejido óseo o en partes blandas, lo que complica el pronóstico y el tratamiento de la lesión14.
Como consecuencia, se han desarrollado y se han perfeccionado técnicas de curación (hidrocoloides en gel, ungüentos tópicos con factores de crecimiento y compuestos de desbridamiento enzimático, cámara hiperbárica, cultivos sustitutos de piel, etc.), pero muchos de estos tratamientos se asocian a un mayor gasto económico y en algunas situaciones se están usando sin pruebas científicas demostradas15. Dentro de estos nuevos tratamientos aparece la aplicación de presión negativa sobre la herida16, que es un método no invasivo de curación que consiste en ubicar una esponja de poros amplios en la herida o en la cavidad, con una presión subatmosférica localizada y controlada para promover la curación. En la actualidad, la curación asistida por presión negativa (CAPNE) se acepta y se utiliza en todo el mundo para el cuidado y la curación de todo tipo de heridas17,18,19,20,21,22,23,24,25. Sin embargo, en la literatura médica hay escasas pruebas sólidas sobre la aplicación de este tipo de curación en heridas del pie diabético amputado26. El objetivo de este estudio es comparar la efectividad de la CAPNE con la de la curación convencional en relación con el tiempo de granulación en heridas de amputaciones parciales abiertas del pie en sujetos diabéticos.
Pacientes y métodoEnsayo clínico conducido en el Servicio de Cirugía Vascular del Hospital Dipreca de Santiago de Chile (de agosto de 2006 a julio de 2007). Este estudio cumple con los principios de la declaración de Helsinski y el Comité de Ética de este hospital lo aprobó. A todos los pacientes se les informó verbalmente y por escrito de las técnicas de curación que se les iba a realizar, sus beneficios y sus posibles complicaciones.
DefinicionesPerfusión adecuada del pie. Presencia de uno o más de los siguientes criterios: registro de volumen de pulso transmetatarsiano (RVPT) adecuado27,28,29 (altura de onda de pulso superior o igual a 5mm, presión sistólica superior o igual a 50mmHg e índice de tobillo/brazo superior o igual a 0,5), pulso pedio o tibial posterior presentes o revascularización previa exitosa30.
Tiempo de granulación. Tiempo en días que demoró la herida en alcanzar el 90% de granulación, sin tejido necrótico, exposición ósea o de tendones y sin signos locales de infección. En el caso de que la herida no alcanzara el 90% de granulación, se midió el tiempo en que demoró en cerrar completamente por segunda intención.
Dolor. Medido con una escala visual análoga31,32. Se lo consideró como secundario al tratamiento con un valor mayor a 5, dentro de las primeras 6 h de aplicado el tratamiento y que no cedió con la administración de analgésicos tradicionales.
Hemorragia. Necesidad de hemostasia con una ligadura o revisión en quirófano.
Infección. Se determinó de acuerdo con normas internacionales33.
Apósito saturado. La saturación de un apósito se refiere a la capacidad que éste tiene de absorber el exudado de una herida. Se evaluó macroscópicamente esta saturación y se determinó si el apósito secundario se encontraba manchado o mojado mayor o menor al 50%.
Profundidad de las heridas. Para caracterizar las heridas se utilizó el sistema de clasificación de heridas en sujetos diabéticos de la Universidad de Texas34.
Efectos adversos. Se valoró dolor, hemorragia e infección.
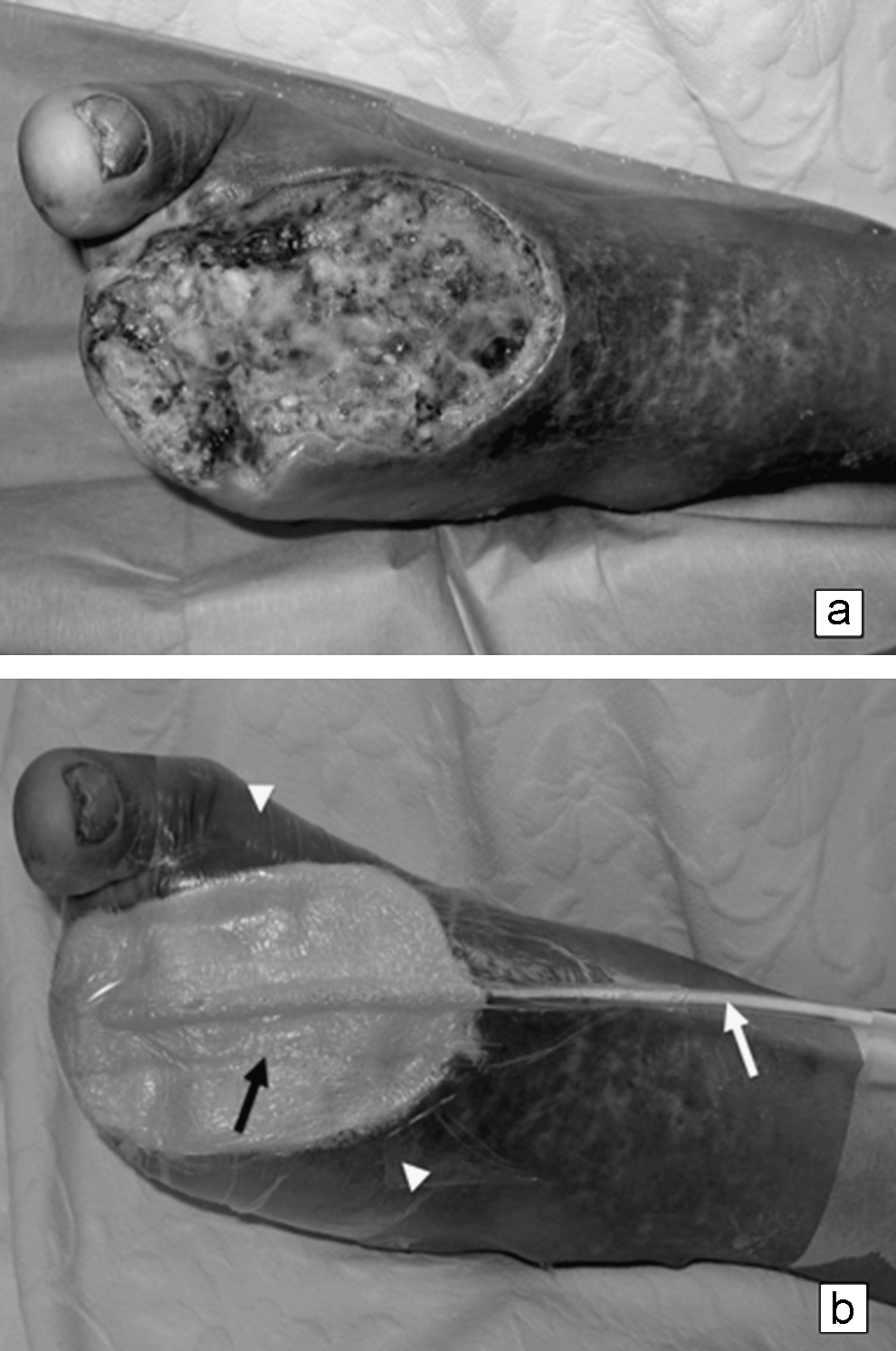
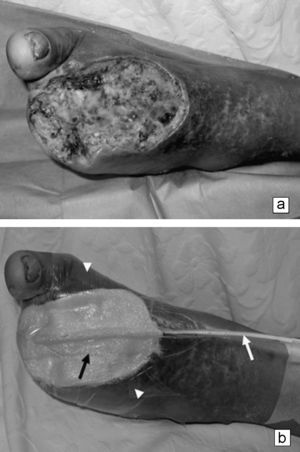
Sujetos mayores de 18 años, diabéticos de tipo II, con una herida por amputación transmetatarsiana de 2 o más dedos contiguos o del primer dedo del pie (figura 1a) por causa infecciosa o vascular resuelta, perfusión adecuada de la extremidad afectada y que hubieran aceptado participar en el estudio. Se excluyó del estudio a sujetos con artropatía de Charcot activa, hiperglucemia no controlada (hemoglobina glucosilada [HbA1C] superior al 12%), tratamiento esteroidal, inmunosupresor o quimioterapia, desnutrición grave (albúmina inferior a 2,1mg/dl)7,35,36,37,38 y tratamiento con factores de crecimiento o con oxígeno hiperbárico en los últimos 30 días.
Figura 1. a) Pie con amputación parcial. b) Esquema del sistema de curación asistido por presión negativa en un pie con amputación parcial. Flecha negra: esponja. Flecha blanca: sonda Nelaton n.o 16. Punta de flecha blanca: apósito transparente impermeable adhesivo.
Para calcular el tamaño de la muestra, fue necesario realizar previamente un estudio piloto (sujetos a los que se les realizó CAPNE frente a curación convencional) debido a que la información existente sobre lesiones secundarias a amputación en el pie diabético sólo se refiere a la proporción de heridas cicatrizadas en un período determinado de tiempo como variable resultado26 y no al promedio de días en alcanzar el 90% de granulación, como lo establece el presente estudio. Al utilizar un intervalo de confianza (α) del 95%, un poder del 80% y una diferencia entre los grupos de 14 días en el tiempo promedio necesario para alcanzar el 90% de granulación, el tamaño de la muestra requerido fue de 11 pacientes por grupo.
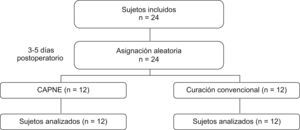
Los sujetos se asignaron de forma aleatoria a curación con CAPNE (grupo A) o a curación convencional (grupo B) entre el tercer y el quinto día posterior a la cirugía (para evitar que la herida estuviera con hemorragia o infección activa). Los cirujanos vasculares de este Servicio realizaron todas las amputaciones para asegurar una técnica quirúrgica estándar. La secuencia aleatoria se elaboró a través de un programa computacional. Se confeccionaron sobres cerrados con un número de identificación arbitrario y en cuyo interior se encontraba la asignación al tratamiento previamente determinada, la que se mantuvo oculta hasta el final del estudio.
Una enfermera capacitada y entrenada en la aplicación de cada tipo de curación realizó los tratamientos. Dadas las diferencias físicas entre los tratamientos, no fue posible enmascarar al paciente ni al equipo tratante luego de la asignación aleatoria.
Los pacientes asignados al grupo A recibieron un tratamiento consistente en una cobertura de la herida con una esponja de éster de poliuretano con poros amplios (400–600μm) y un tubo de drenaje (Nelaton n.o 16) fenestrado, ubicado entre la esponja y un apósito transparente impermeable adhesivo dispuesto como sello sobre todo este sistema (figura 1b). El sistema se conectó a aspiración central y se mantuvo a una presión subatmosférica continua de 100mmHg hasta la siguiente curación39.
Los pacientes del grupo B recibieron un tratamiento de acuerdo con la saturación del apósito secundario. Si este último presentaba una saturación inferior al 50%, la herida era cubierta con hidrocoloide en gel, tul (gasa tejida porosa impregnada con emulsión de petrolato) y apósito. Si por el contrario, presentaba una saturación superior al 50%, la herida se cubría con alginato y apósito. Los pacientes de ambos grupos recibieron una curación previa a la asignada, de acuerdo con las guías clínicas del Ministerio de Salud de Chile (duchoterapia, suero fisiológico por arrastre y desbridamiento)40.
La herida se curó cada 48 a 72h y se evaluó semanalmente con una fotografía digital. La fotografía se cuadriculó y se analizó cuadro por cuadro para determinar la fracción de tejido granulado de cada cuadro. El porcentaje total de granulación de la herida resultó del promedio de todas las fracciones de todos los cuadros de la imagen. Un grupo independiente del equipo investigador y enmascarado al tratamiento asignado realizó la valoración del porcentaje de granulación.
Análisis estadísticoEl análisis estadístico se realizó con intención por tratar y enmascarado al tratamiento asignado. Para el análisis estadístico se utilizó el software SPSS versión 13.0. Además de la estadística descriptiva, como distribuciones de frecuencia, medidas de tendencia central y de dispersión, se empleó estadística analítica. Se comprobó normalidad de las variables a través del test de Shapiro-Wilks, se utilizó el test de la t de Student para muestras independientes y la prueba de χ2 según el tipo de variable. Se utilizó el test no paramétrico de Kruskal-Wallis para muestras independientes en el caso que no hubiera normalidad. Se utilizaron curvas de probabilidad acumulada para comparar las tasas de curación de cada grupo (método de Kaplan-Meier) y posteriormente el test de log-rank. Se aplicó regresión lineal múltiple para la variable respuesta principal y regresión logística para la proporción de amputaciones y de aseo.
ResultadosSe seleccionó a 24 sujetos (12 por grupo). El promedio de edad global fue de 61,8 ± 9 años (42–85 años). Diecinueve pacientes (79%) correspondían al sexo masculino. El peso promedio fue de 78,1 ± 12kg. La talla y el índice de masa corporal promedio de la muestra fueron de 169,2 ± 8cm y de 27,3 ± 4, respectivamente. Trece sujetos (54%) se clasificaron como que nunca habían consumido tabaco, 14 sujetos (58%) con perfil lipídico normal y 11 sujetos (46%) como hipertensos controlados con un solo fármaco. Dos sujetos tenían antecedentes de insuficiencia renal terminal en hemodiálisis (uno en cada grupo) y ninguno presentó tratamiento anticoagulante oral. La creatinina promedio fue de 1,9 ± 3mg/dl. La albúmina y la HbA1C promedio fueron de 3,36 ± 0,4mg/dl y de 9,6 ± 2%, respectivamente.
En el RVPT la presión sistólica media fue de 140,6 ± 73mmHg, el índice de tobillo/brazo de 1,10 ± 0,6 y la altura de la onda de pulso de 14,1 ± 5mm. Veintitrés sujetos (96%) se clasificaron como grado II en profundidad de acuerdo con la clasificación de Texas y un sujeto se clasificó como grado III. En 5 sujetos (21%) se realizó revascularización de la extremidad afectada antes de la asignación aleatorizada. En el 50% de los participantes se realizó una amputación transmetatarsiana del pie. No hubo diferencias estadísticamente significativas entre las variables biodemográficas y las variables clínicas de los grupos (tabla 1).
Tabla 1. Características clínicas y biodemográficas de la población en estudio
| Grupo A (n=12) | Grupo B (n=12) | p | |
| Edad a (años) | 61,5 ± 10 | 62,1 ± 8 | 0,878 b |
| Sexo, n (%) | 1,000 c | ||
| Femenino | 2 (16,7) | 3 (25,0) | |
| Masculino | 10 (83,3) | 9 (75,0) | |
| Peso a (kg) | 80,8 ± 9 | 75,5 ± 14 | 0,298 b |
| Talla a (cm) | 168,0 ± 8 | 169,6 ± 6 | 0,774 b |
| IMC a | 28,1 ± 4 | 26,6 ± 4 | 0,113 b |
| Tabaquismo, n (%) | 0,688 b | ||
| Nunca | 7 (58,3) | 6 (50,0) | |
| Detenido > 1 año | 2 (16,7) | 3 (25,0) | |
| Detenido< 1 año | 1 (8,3) | 0 (0,0) | |
| Activo | 2 (16,7) | 3 (25,0) | |
| Dislipidemia, n (%) | 0,574 b | ||
| Perfil normal | 7 (58,3) | 7 (58,3) | |
| Control con dieta | 0 (0,0) | 1 (8,3) | |
| Requiere fármacos | 5 (41,7) | 4 (33,4) | |
| Hipertensión arterial, n (%) | 0,662 b | ||
| Diastólica<90 mmHg | 4 (33,3) | 6 (50,0) | |
| Control con un fármaco | 6 (50,0) | 5 (41,7) | |
| Control con 2 o más fármacos | 2 (16,7) | 1 (8,3) | |
| Creatinina a (mg/dl) | 2,1 ± 3 | 1,6 ± 2 | 0,639 b |
| Albúmina a (gr/dl) | 3,36 ± 0,5 | 3,57 ± 0,5 | 0,784 b |
| HbA1C a (%) | 9,5 ± 2 | 9,7 ± 2 | 0,535 b |
| Registro de volumen de pulso a | |||
| Transmetatarsiano (mmHg) | 126,9 ± 81 | 154,3 ± 66 | 0,502 b |
| Índice de tobillo y brazo | 1,05 ± 0,5 | 1,16 ± 0,6 | 0,735 b |
| Altura onda (mm) | 15,9 ± 6 | 12,4 ± 4 | 0,231 b |
| Revascularización c , n (%) | 3 (25,0) | 2 (16,7) | 1,000 c |
| Tipo de amputación c , n (%) | 1,000 c | ||
| Sólo primer dedo del pie | 3 (25,0) | 3 (25,0) | |
| Dos o más dedos del pie | 3 (25,0) | 3 (25,0) | |
| TMT del pie | 6 (50,0) | 6 (50,0) | |
| Lado de la amputación, n (%) | 1000 c | ||
| Izquierdo | 5 (41,7) | 4 (33,3) | |
| Derecho | 7 (58,3) | 8 (66,7) |
HbA1C: hemoglobina glucosilada; IMC: índice de masa corporal; TMT: tarsometatarsiano.
a Media ± desviación estándar.
b Prueba de la χ2.
c Test exacto de Fisher.
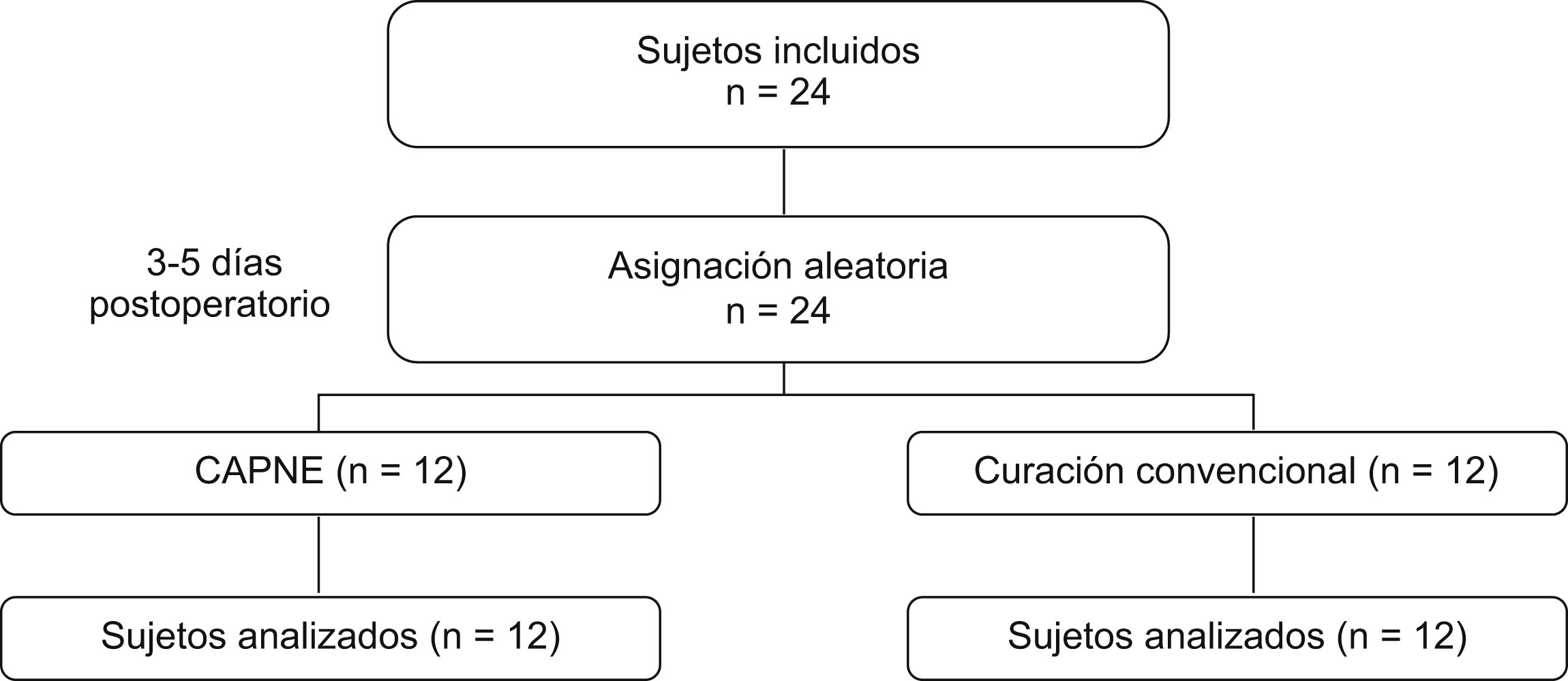
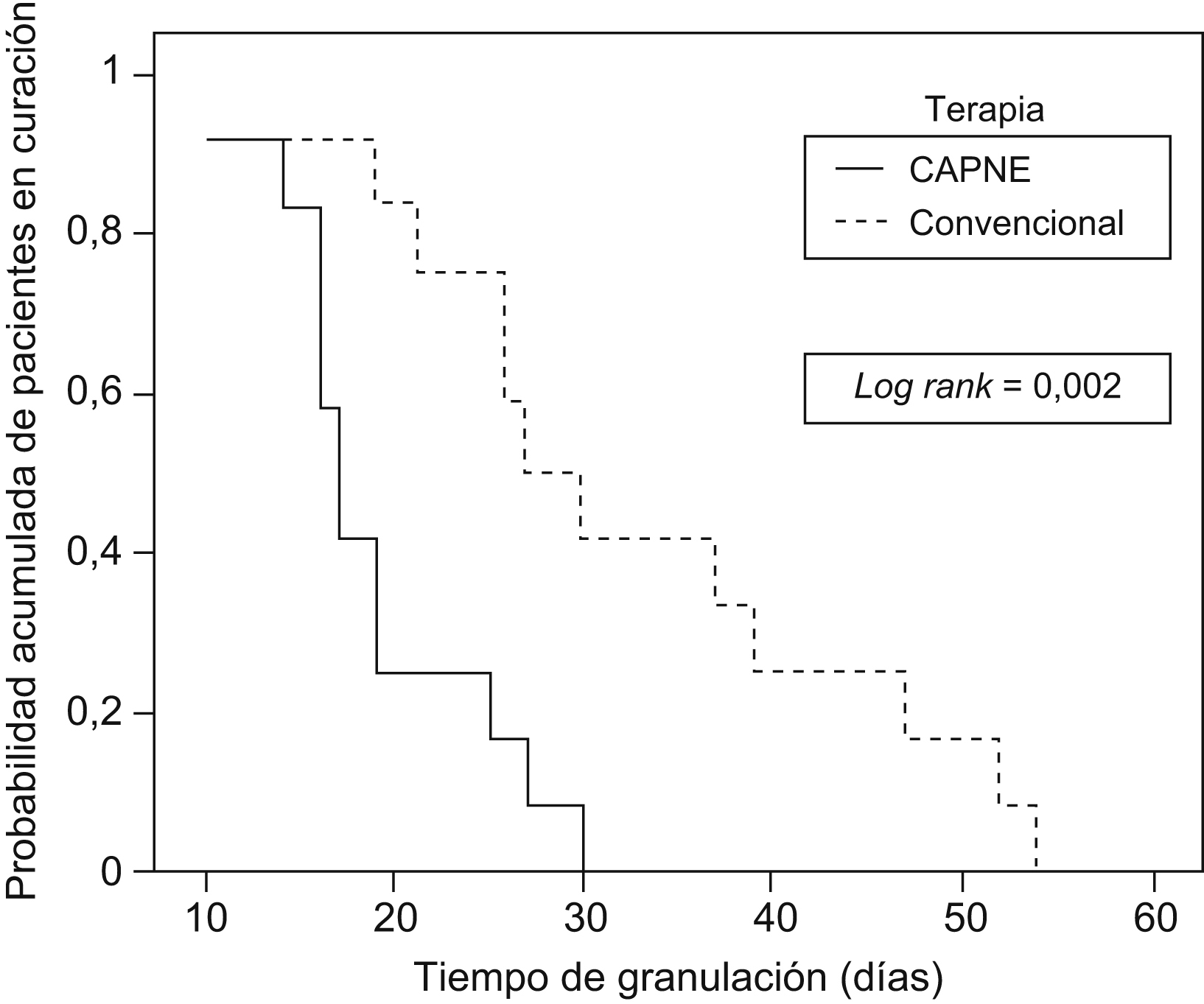
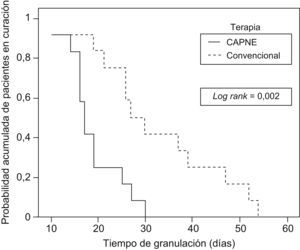
Durante el seguimiento, 23 sujetos (96%) alcanzaron la granulación sobre el 90%. Un sólo caso del grupo B no alcanzó el 90% de granulación y se consideró el tiempo en que cerró completamente la herida. No hubo pérdidas ni interrupción del tratamiento en ningún grupo (figura 2). El tiempo promedio de granulación global fue de 25,6 ± 12 días. Al comparar ambos grupos de estudio, el tiempo promedio de granulación fue menor en el grupo A (18,8 ± 6 días frente a 32,3 ± 14 días), diferencia estadísticamente significativa (p=0,007). Las curvas de probabilidad acumulada para los tiempos de granulación según el grupo (figura 3) presentaron diferencias estadísticamente significativas (test de log-rank=0,002).
Figura 2. Diagrama de flujo de los participantes.
Figura 3. Curvas de probabilidad acumulada para los tiempos de granulación según el grupo.
Un sólo sujeto del grupo A presentó hemorragia, mientras que en el grupo B hubo un sujeto que presentó dolor y otro presentó infección. No hubo reamputaciones, aseos ni mortalidad en esta serie.
DiscusiónEl presente estudio mide como variable resultado el tiempo en alcanzar el 90% de granulación en heridas de amputaciones parciales abiertas del pie en sujetos diabéticos. Los resultados demuestran que la CAPNE es más efectiva que la curación convencional en el tratamiento de estas heridas debido a que reduce significativamente el tiempo de granulación hasta en un 40%. Por otra parte, la CAPNE parece ser tan segura como la curación convencional en relación con los efectos adversos, las reamputaciones y los aseos quirúrgicos.
En la actualidad, el concepto de mantener un ambiente húmedo para favorecer la cicatrización de las heridas es ampliamente conocido y aceptado31,32,41. Pero al parecer, no basta sólo con mantener húmeda la herida, se requieren otros elementos que intervienen y que favorecen el proceso de la curación, por lo que han aparecido varios agentes farmacológicos activos más complejos2 así como otros tratamientos para el cuidado de las heridas42, pero muchos de éstos se asocian a mayor gasto económico y a aplicaciones con pruebas científicas inciertas15. La CAPNE se inserta dentro de estos tratamientos y estas tecnologías emergentes como respuesta a la necesidad de curar heridas crónicas o de difícil cicatrización16. A diferencia de los otros tratamientos, la CAPNE ha tenido mundialmente una aceptación y una utilización cada vez más frecuente para el cuidado y la curación de todo tipo de heridas17,18,19,20,21,22,23,24,25.
La explicación del éxito en la utilización de la CAPNE se encuentra en el trabajo de Argenta y Morykwas18, que postularon que esta nueva técnica de curación retira el exceso de líquido intersticial, aumenta la angiogénesis, disminuye la colonización bacteriana y aumenta la formación de tejido de granulación como respuesta al estímulo de las fuerzas mecánicas ejercidas por la presión negativa transmitida a través de la esponja. Otros autores han confirmado estos conceptos43,44. Además, hace mucho tiempo se ha postulado que si el exceso de líquido no es adecuadamente eliminado de la herida después de una operación, sus componentes pueden actuar como impedimentos físicos y químicos para la cicatrización de la herida43.
Una de las limitaciones de este trabajo es el hecho de tratar a los pacientes en régimen hospitalizado, ya que este dispositivo obtiene la presión negativa desde la aspiración central. Esto posiblemente hace que se prolongue la estadía en el hospital. Sin embargo, a diferencia de otros trabajos que utilizan un dispositivo fabricado industrialmente para proveer el sistema de aspiración negativa15,17,26,43, en este trabajo se utilizan elementos que se encuentran a la mano en cualquier hospital comunitario y con lo que se cumplen con los estándares y las exigencias de funcionalidad45. Aunque no se realiza un estudio de costos, los elementos utilizados en este estudio claramente son de menor precio que el uso de un dispositivo industrial. Si se sabe que además hay estudios de la relación entre costo y efectividad a favor del sistema aspirativo46,47, parece atractivo utilizar la CAPNE en este tipo de pacientes.
El único trabajo comparable con el presente es el de Armstrong y Lavery26 que, aunque presenta un gran número de pacientes, tiene algunas carencias en su metodología, como no presentar una pregunta de investigación claramente definida ni justificar el cálculo del tamaño de la muestra o clarificar si la secuencia de aleatorización se mantuvo oculta hasta el final del estudio. Por otra parte, el trabajo de Armstrong y Lavery establece la variable resultado como proporción de heridas cicatrizadas en un período determinado de tiempo. Utilizar el tiempo en alcanzar el 90% de granulación como variable respuesta, además de acortar el tiempo de estudio, permitiría ofrecer al paciente otros métodos de cierre de la herida. Hay datos que demuestran que la CAPNE puede ser un tratamiento alternativo para el cierre primario por segunda intención o para el cierre secundario con otras técnicas al preparar un lecho granulatorio adecuado26. En este estudio se injertó a casi todos los pacientes con amputación transmetatarsiana del pie que recibieron CAPNE, lo que acortó el tiempo de cierre de la herida. Esto abre una alternativa de tratamiento en pacientes seleccionados.
En suma, estos resultados demuestran que la CAPNE es un tratamiento efectivo y seguro para la curación de heridas de amputaciones parciales del pie en sujetos diabéticos. El tratamiento con CAPNE permite alcanzar el 90% de granulación de la herida en un tiempo más corto y con escasas complicaciones cuando se la compara con la curación convencional. Futuros trabajos deberían incluir estudios de la relación entre costo y efectividad así como de calidad de vida.