Introducción
La duodenopancreatectomía cefálica (DPC) es la única opción potencialmente curativa para tratar el adenocarcinoma (ADC) de cabeza de páncreas. La tasa de mortalidad postoperatoria varía entre un 0 y un 8% en series recientes y la supervivencia a 5 años varía del 7 al 12%1. Los resultados son peores cuando la resección es incompleta o los márgenes quirúrgicos son positivos, y no ofrece ventajas frente a un procedimiento paliativo2. En un intento de conseguir un margen quirúrgico negativo puede estar indicado resecar la vena porta (VP), la vena mesentérica superior (VMS) o la confluencia venosa portomesentérica superior (CVP-MS). En casos seleccionados, este procedimiento no aumenta la morbimortalidad postoperatoria y ofrece la misma supervivencia que la DPC sin resección venosa, siempre que los márgenes quirúrgicos estén libres de tumor3-5.
Presentamos un caso de ADC de cabeza de páncreas intervenido en nuestro hospital que infiltraba la CVP-MS. Se practicó una DPC de Whipple con resección venosa porto-mesentérica superior (RVP-MS) y reconstrucción vascular con vena yugular interna autóloga. Comentamos los aspectos técnicos más relevantes.
Caso clínico
Intervenimos a un varón de 58 años de neoplasia de cabeza de páncreas. La tomografía computarizada (TC) objetivaba una tumoración sólida de cabeza de páncreas de 6 cm de diámetro que incluía la VMS sin trombosarla y respetaba la arteria mesentérica superior (AMS); la vía biliar estaba dilatada, las adenopatías periaórticas y pericava estaban agrandadas, y el cuerpo y la cola del páncreas eran de aspecto normal. Se realizó un drenaje biliar externo percutáneo preoperatorio e intervenimos al paciente mediante una laparotomía media. Se movilizó el ángulo hepático del colon, se realizó una maniobra de Kocher amplia y se abrió la transcavidad de los epiplones. Se encontró una tumoración de cabeza de páncreas que retraía la VMS por debajo del uncinado, con adenopatías locorregionales y pancreatitis crónica en el cuerpo y la cola. La biopsia intraoperatoria de la tumoración pancreática informó de ADC, mientras que las adenopatías periaórticas y pericavas estaban libres de tumor.
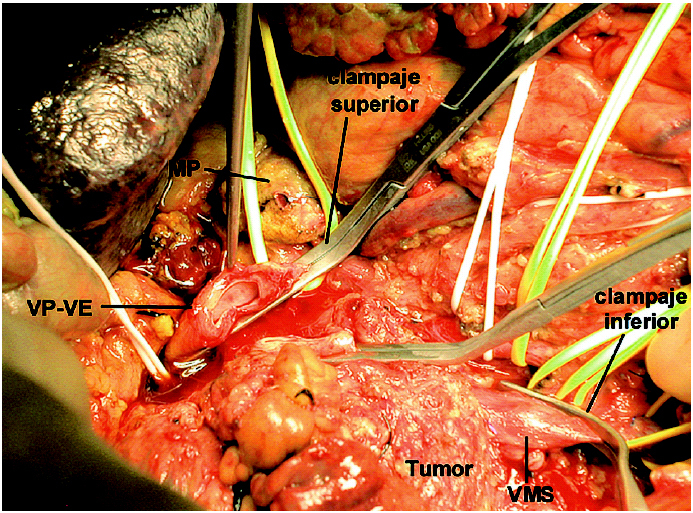
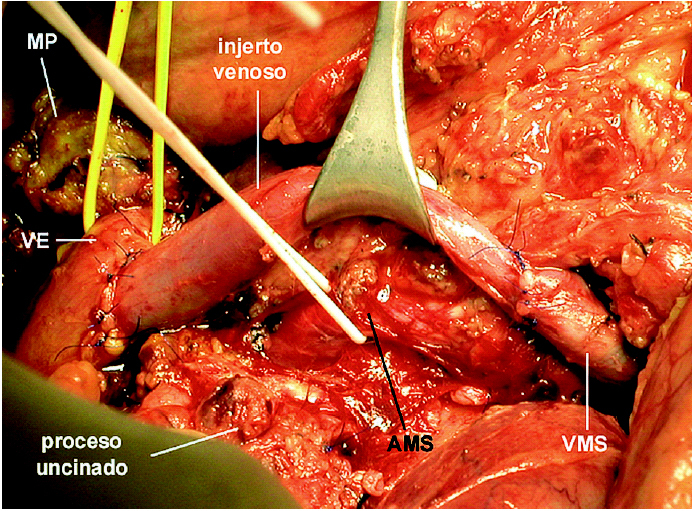
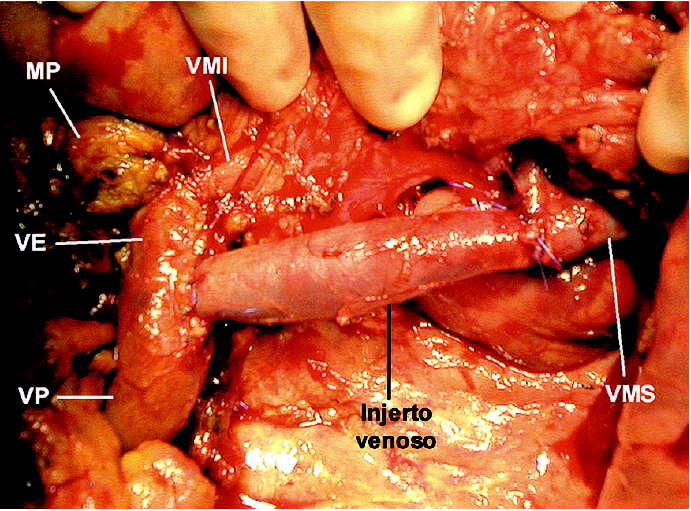
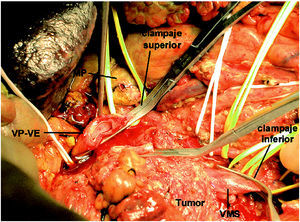
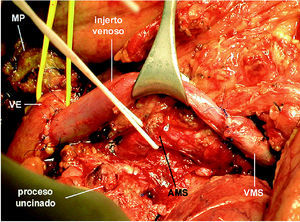
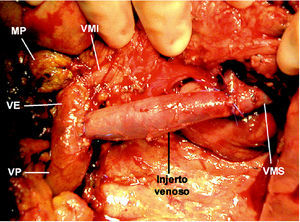
Se realizó una cuidadosa disección del hilio hepático, referenciando la VP supraduodenal, vena esplénica (VE) y VMS. Se comprobó la ausencia de afectación de la arteria mesentérica superior (AMS) disecándola por encima de la vena renal izquierda, en un trayecto de 2 cm, y en la raíz de mesenterio, al lado de la VMS. Con el dedo se comprobó la posibilidad de liberación de la AMS en el resto del trayecto retropancreático. Se seccionó el estómago y se inició la liberación del asa fija. Dada la ausencia de plano de clivaje preportal tuvo que disecarse y seccionarse el cuello del páncreas a la izquierda de la VP, sobre la VE. Posteriormente, se extrajo un injerto de vena yugular interna izquierda de 8 cm de longitud mediante un abordaje laterocervical izquierdo. El injerto venoso se conservó en un bote estéril con solución de preservación (Collins) a 4 grados. Se cerró la incisión cervical y posteriormente se procedió a realizar el clampaje venoso. El clamp inferior se colocó en la VMS por debajo de la desembocadura de la vena ileocecal. El clamp superior se colocó tangencial a la VP conservando la unión con la VE. Se seccionaron la VP y la VMS, y se cerraron los cabos venosos de la pieza con suturas continuas de Prolene para evitar la hemorragia por retorno (fig.1). Se colocó el injerto venoso en el campo operatorio y se efectuaron las suturas venosas con Prolene 5/0 siguiendo los mismos principios del trasplante hepático. La cara posterior se suturó con una continua y la cara anterior con puntos sueltos. El anudado de la sutura posterior con la anterior se efectuó después de haber retirado ordenadamente los clamps para purgar el aire y respetar el factor de crecimiento. El tiempo de clampaje fue de 45 min. Una vez restablecido el flujo portal, se completó la disección de la AMS (fig. 2) y la liberación del proceso uncinado, rechazando el injerto venoso con un separador, hasta resecar completamente la pieza (fig. 3). Posteriormente, se completó la linfadenectomía preaorticocava y del pedículo hepático. La intervención duró 12 h y se transfundieron 2 concentrados de hematíes. Durante el postoperatorio el paciente presentó diarrea acuosa, atribuible a la disección de la AMS, que se controló eficazmente con loperamida. El paciente fue dado de alta al 18.o día de la intervención. Mediante eco-Doppler se comprobó la permeabilidad del eje venoso portomesentérico. El informe anatomopatológico de la pieza de resección informó de ADC ductal indiferenciado de cabeza de páncreas, de 6,5 cm, con extensa infiltración vascular y perineural, y afectación de los ganglios peripancreáticos (2/16). Los márgenes quirúrgicos estaban libres de tumor.
Fig. 1. Control vascular de la confluencia venosa porto-espleno-mesentérica. El clamp superior se coloca tangencial para respetar la desembocadura de la VE en la VP. VP-VE: confluencia de la vena porta con la vena esplénica. VMS: vena mesentérica superior; MP: muñón pancreático.
Fig. 2. Revascularización inmediata con injerto de vena yugular. El injerto acorta el tiempo de clampaje y facilita la disección posterior de la AMS y del uncinado. AMS: arteria mesentérica superior; VE: vena esplénica; VMS: vena mesentérica superior; MP: muñón pancreático.
Fig. 3. Campo operatorio tras resecar la pieza. VP: vena porta; VE: vena esplénica; VMS: vena mesentérica superior; VMI: vena mesentérica inferior; MP: muñón pancreático.
Discusión
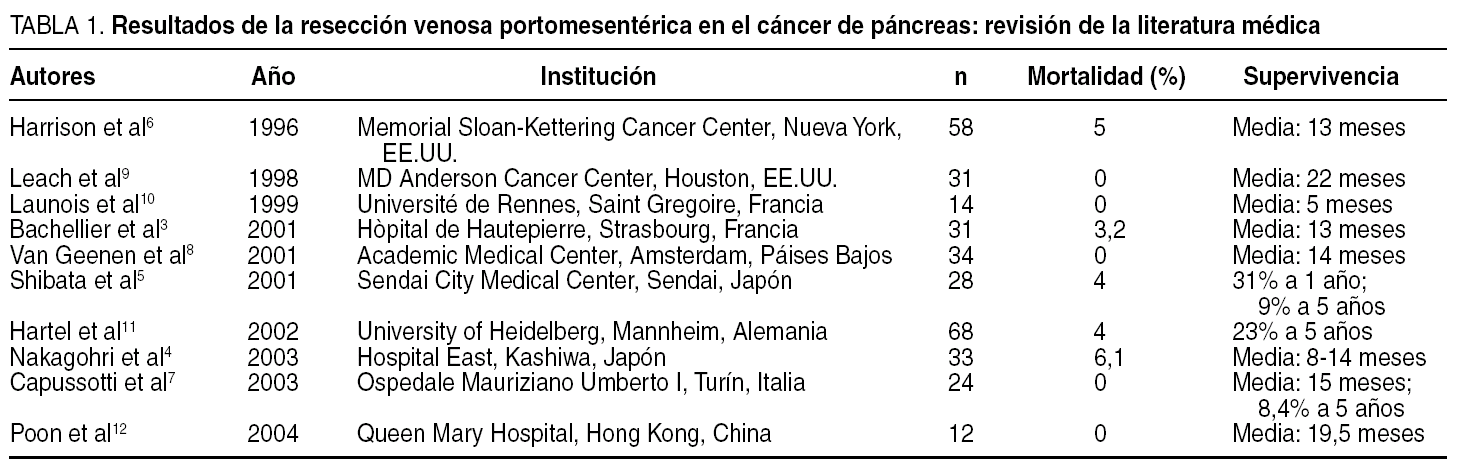
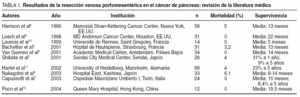
La invasión tumoral de la VP o de la VMS es un hecho frecuente en pacientes con ADC de cabeza de páncreas debido a la estrecha relación anatómica entre la cabeza pancreática y el sistema portal. En el pasado constituía una contraindicación para la resección, ya que se consideraba que la enfermedad estaba localmente avanzada; el pronóstico era peor y el riesgo operatorio, mayor. En la década de los noventa centros con un gran volumen de pacientes empezaron a realizar DPC combinadas RVP-MS con una morbimortalidad y una supervivencia a largo plazo similares a las de la resección pancreática sin resección venosa, aunque con un tiempo operatorio y unas necesidades transfusionales mayores2,5-7. La tasa de DPC por ADC de páncreas que requieren RVP-MS varía ampliamente, dependiendo de la filosofía quirúrgica de cada centro, con una incidencia del 3 al 41% en las series occidentales y del 58 al 88% en las series orientales5,7,8. En la tabla 1 se detallan los resultados de algunas series de RVP-MS publicadas en los últimos años.
Los equipos quirúrgicos que realizan RVP-MS contraindican este procedimiento si hay trombosis completa de la VP o la VMS con venas colaterales, invasión de la AMS o del tronco celíaco o si hay afectación extrapancreática, ganglionar periaórtica o a distancia, debido a la alta mortalidad operatoria y al peor pronóstico. En este sentido, la valoración preoperatoria con TC helicoidal o resonancia magnética puede evitar una laparotomía innecesaria2,5,9. La estenosis unilateral o bilateral de la VP-MS no contraindica la resección. Durante la laparotomía es difícil de distinguir entre infiltración tumoral de la vena y adherencias desmoplásticas inflamatorias. De hecho, un 18-50% de las resecciones venosas no tiene afectación tumoral en el estudio histológico6,7. Antes de realizar la RVP-MS debe de comprobarse la ausencia de invasión tumoral de la AMS, disecando la arteria por encima de la vena renal izquierda y en el proceso uncinado, y también deben de biopsiarse las adenopatías periaortocavas.
Según el grado de afectación tumoral, la reconstrucción venosa puede realizarse mediante sutura lateral, anastomosis venosa término-terminal o mediante la interposición de un injerto2,4-9. La sutura lateral es el procedimiento más simple pero su principal inconveniente es que es estenosante y conlleva riesgo de trombosis; por ello, algunos autores asocian un parche con vena safena interna9. La anastomosis término-terminal sin injerto es la más utilizada en la literatura y es factible de realizar si no se resecan más de 3-5 cm de vena5. La interposición del injerto puede llevarse a cabo con vena autóloga (yugular interna o ilíaca externa)2,9,10, vena criopreservada proveniente de donante (VMS o ilíaca)10 o prótesis (PTFE anillado o Dacron)8,10,11.
Hay dos factores que pueden causar morbilidad postoperatoria en la RVP-MS y que están condicionados por la técnica de reconstrucción venosa empleada. Por un lado, el tiempo de clampaje venoso, que determina el grado de congestión venosa esplácnica y, por otro, la preservación o no de la VE. La duración del clampaje es mayor si la sutura venosa se realiza después de extraída la pieza. Aunque no es una práctica habitual, Bachellier et al3 efectúan clampaje simultáneo de la AMS cuando piensan que la reconstrucción venosa no puede llevarse a cabo antes de 60 min, o realizan un shunt portosistémico si aparece congestión venosa durante el clampaje. Algunos autores5,12 ligan y seccionan la VE para liberar completamente la AMS, colocando los clamps venosos justo antes de extraer la pieza, minimizando así el tiempo de clampaje. En caso de ligar la VE se aconseja asociar una esplenectomía que evite la aparición de hipertensión portal segmentaria izquierda que aumentaría el riesgo de hemorragia, tanto en la línea de transección pancreática como en la mucosa gástrica (gastropatía hipertensiva)2,13. Sin embargo, otros autores nunca asocian la esplenectomía5,10,12. Aunque la ligadura de la VE es un gesto quirúrgico simple, creemos que es recomendable preservarla o reimplantarla siempre que sea posible para preservar el flujo portal3,13.
La anastomosis término-terminal presenta varios inconvenientes, ya que obliga a ligar la VE para movilizar correctamente la raíz del mesenterio y para liberar adecuadamente la AMS; si la anastomosis se efectúa antes de finalizar la disección del proceso uncinado el campo quirúrgico es más dificultoso; si la anastomosis se realiza después de la resección, el tiempo de clampaje venoso mesentérico es mayor2,6,9. En nuestra opinión, el injerto no presenta estos inconvenientes ya que permite restablecer fácilmente el retorno venoso antes de completar la DPC, y minimiza el tiempo de clampaje. Para ello, hay que disecar al máximo la VP, la VE y la VMS, y debe de extraerse el injerto antes de efectuar el clampaje. Mediante una sección tangencial es posible mantener unida la VE con la VP (fig. 1) o con la VMS, dependiendo de la localización del tumor en el eje venoso portomesentérico. La disección de la AMS y del proceso uncinado puede completarse fácilmente después de finalizar la reconstrucción venosa y sin tener que sacrificar la VE.
Aunque la vena yugular interna tenga un calibre algo mayor que la VP o VMS, no hemos tenido problemas de trombosis venosa y pensamos que es un buen sustituto venoso por ser técnicamente simple su extracción y por no alargar el tiempo quirúrgico más de 30 min. La obtención de vena ilíaca obligaría a ampliar la incisión abdominal y estaría gravada con un edema de miembro inferior secundario. Aunque la prótesis vascular es un sustituto venoso de fácil obtención, creemos que podría dar problemas en caso de aparecer una infección intraabdominal en el postoperatorio.
El tratamiento quirúrgico del ADC de cabeza de páncreas debería realizarlo un equipo quirúrgico especializado en cirugía hepatobiliopancreática que seleccione los casos y que sea capaz de asumir resecciones y reconstrucciones vasculares portomesentéricas con una morbimortalidad mínima. De no ser así, la afectación de la vena por el tumor será una limitación técnica que contraindicará la resección y que privará al paciente de su mejor opción terapéutica.
Correspondencia: Dr. G. Manzanet Andrés.
Plaza San Pascual, 15. 12540 Vila-real. Castellón. España.
Correo electrónico: manzanet_ger@gva.es
Manuscrito recibido el 14-2-2005 y aceptado el 21-6-2005.