Introducción. Durante el síndrome de respuesta inflamatoria sistémica, la célula endotelial expresa en su membrana moléculas de adhesión, favoreciendo la acción lesiva local de los leucocitos polimorfonucleares de neutrófilos. En este trabajo estudiamos el efecto que ejerce la administración de interleucina 1ß murina sobre la expresión de la molécula de adhesión intercelular (ICAM-1) soluble tras una agresión endotóxica.
Material y métodos. Se han dividido 72 ratones de la cepa CBA/H en tres grupos de 24: grupo 1 (simulado); grupo 2 (control, el shock endotóxico se provocó mediante la inyección de lipopolisacárido de membrana bacteriana de Escherichia coli serotipo 055:B5 a dosis de 125 mg/kg); grupo 3 (tratado con interleucina 1ß murina a dosis de 80 ng/ratón 24 h antes del lipopolisacárido de membrana). Se han determinado, mediante la técnica de ELISA, las concentraciones séricas de ICAM-1 soluble a las 1, 2, 4 y 24 h de inyectar el lipopolisacárido.
Resultados. El tratamiento con interleucina 1ß provocó un significativo descenso de las concentraciones séricas de ICAM-1 soluble a las 4 y 24 h tras la agresión endotóxica respecto al grupo control.
Conclusiones. La administración de interleucina 1ß disminuye las concentraciones séricas de ICAM-1 soluble, que aparecen elevadas tras una agresión endotóxica experimental.
Introduction. During systemic inflammatory response syndrome (SIRS), the endothelial cell expresses membrane adhesion molecules favoring the local polymorphonuclear (PMN) cell-mediated damage. In this report, we study the effect of the administration of murine interleukin 1ß (IL-1ß) on the expression of intercellular adhesion molecule-1 (ICAMs-1) following endotoxic shock.
Material and methods. Seventy-two CBA/H mice were divided into 3 groups of 24 each: group 1, sham; group 2, controls in which endotoxic shock was provoked by Escherichia coli lipopolysaccharide (LPS, serotype 055:B5) at a dose of 125 mg/kg body weight; and group 3, mice treated with murine IL-1 at a dose of 80 ng/mouse 24 hours before LPS. Serum ICAMs-1 levels were determined by ELISA 1, 2, 4 and 24 hours after injection of LPS.
Results. Treatment with IL-1ß produced a significant decrease in the serum ICAMs-1 levels 4 and 24 hours after endotoxic shock when compared with the control group.
Conclusions. The administration of IL-1ß reduces the serum levels of ICAMs-1 after the increase provoked by experimental endotoxic shock.
Introducción
El síndrome de disfunción orgánica múltiple (MODS) puede definirse como la alteración de la función orgánica de los pacientes en estado crítico provocada por diferentes etiologías, que se manifiesta clínicamente por el deterioro de la función de uno, dos o más órganos, y cuyo índice de mortalidad hoy día es muy elevado1. Este síndrome es la consecuencia clínica de una respuesta inflamatoria generalizada del hospedador ante distintos tipos de agresión, que actualmente se conoce como síndrome de la respuesta inflamatoria sistémica (SIRS)1. Esta respuesta está condicionada por la activación en cadena de múltiples mediadores endógenos, entre los que destacan los macrófagos, las células de la serie blanca y el sistema de citocinas2. El resultado final de la actuación de estos mediadores es una lesión endotelial provocada, entre otros, por el fenómeno de marginación leucocitaria. Este fenómeno se debe a la síntesis en el endotelio de moléculas de adhesión, las cuales comienzan a expresarse a las pocas horas de provocada la agresión, sobre las que se adhieren los leucocitos polimorfonucleares neutrófilos (PMN) y linfocitos3. En estudios previos hemos observado cómo el pretratamiento experimental con dosis subletales de interleucina 1ß (IL-1ß) 24 h antes de provocar una agresión con lipopolisacárido de membrana bacteriana (LPS) provoca, entre otros efectos, un aumento tanto del número de leucocitos circulantes como del índice CD4/CD84, fenómeno que podría estar mediado por una disminución de la marginación de estas células hacia el endotelio, consecuencia de la menor expresión de moléculas de adhesión inducida por el tratamiento. El objeto de este estudio es comprobar si, efectivamente, la administración de IL-1ß en las condiciones citadas provoca una disminución de la expresión de la molécula de adhesión intercelular (ICAM-1) soluble.
Material y métodos
Material biológico
Se han utilizado ratones endogámicos hembras de la cepa CBA/H con una edad comprendida entre 10 y 12 semanas y peso entre 19 y 21 g. Los animales se criaron en el animalario de la Unidad de Cirugía Experimental del Hospital Virgen de las Nieves de Granada, donde permanecieron en un medioambiente controlado con un ciclo luz-oscuridad de 12 h y una temperatura media de 20 °C, teniendo libre acceso a la comida y al agua hasta finalizada la experiencia.
Modelo experimental de shock endotóxico
El shock endotóxico se provocó mediante la inyección intraperitoneal de lipopolisacárido de membrana bacteriana (LPS) de Escherichia coli serotipo 055:B5 (Sigma Chemical Company), a dosis de 125 mg/kg de peso. Esta dosis se administró disuelta en 0,1 ml de tampón fosfato salino con un pH de 7,4.
IL-1ß recombinante murina
La IL-1ß recombinante murina (Genzyme Immunobiologicals) fue administrada por vía intraperitoneal a dosis de 80 ng por ratón, disuelta en 0,1 ml de tampón fosfato salino con un pH de 7,4 a las 24 h previas a la inyección del LPS.
Protocolo experimental
Se distribuyeron 72 ratones de manera aleatoria en tres grupos de 24 cada uno.
1. Grupo 1: grupo simulado al que se administraron 2 dosis de 0,1 ml de tampón fosfato salino con un pH de 7,4 (código P-3818, Sigma Chemical Company) por vía intraperitoneal; la segunda dosis se administró 24 h después de la primera.
2. Grupo 2: grupo control, en el que se provocó un shock endotóxico mediante la administración de 125 mg/kg de LPS de Escherichia coli serotipo 055:B5 por vía intraperitoneal. De igual modo se inyectaron 0,1 ml de tampón fosfato salino con un pH de 7,4 por la misma vía 24 h antes del LPS.
3. Grupo 3: grupo tratado con IL-1ß recombinante murina, la cual se administró por vía intraperitoneal a dosis de 80 ng por ratón 24 h antes de inyectar el LPS.
Determinación de ICAM-1 soluble
En 6 ratones de cada grupo se determinaron, a las 1, 2, 4 y 24 h de inyectado el LPS, las concentraciones séricas de ICAM-1 soluble. Las muestras de sangre se obtuvieron mediante laparotomía, previa anestesia del animal con 50 mg/kg de peso de pentobarbital sódico y 5 mg/kg de peso de ketamina, ambos por vía intraperitoneal. Se puncionó la vena cava con jeringa de insulina, obteniéndose sangre venosa hasta la muerte del animal por exanguinación. Las muestras se recolectaron en tubos estériles con separadores del suero modelo Vacutainer Brand SST (referencia 367784, Becton Dickinson), centrifugándose a 3.000 rpm durante 15 min a una temperatura de 4 °C en una centrífuga refrigerada. Se alicuotaron 100 µl del suero obtenido en tubos Eppendorff, que se congelaron inmediatamente a 80 °C y se almacenaron en estas condiciones hasta su posterior análisis. Las concentraciones de ICAM-1 soluble en suero de ratón, a las distintas horas de inducido el shock endotóxico experimental, se midieron mediante la técnica de ELISA utilizando el paquete comercial Mouse ELISA ICAM-1 (CD54) (código EM-ICAM1 Endogen), previa dilución de las muestras a una proporción de 1:100. La lectura se efectuó en un lector de ELISA automático y programable (SLT Lab Instruments A-5082) con filtro de 450 nm, siendo las absorbancias resultantes directamente proporcionales a las concentraciones en µg/ml de ICAM-1 soluble presentes en las muestras.
El principio del ensayo de la técnica de ELISA empleada en este estudio es un enzimoinmunoanálisis de fase sólida en el que se emplea el principio del sándwich de múltiple anticuerpo. Este método usa anticuerpos monoclonales anti-CD54 al tamente purificados (anticuerpos de captura), absorbidos de manera no covalente sobre los pocillos de la placa de microtitulación. Los anticuerpos inmovilizados capturan específicamente las moléculas ICAM-1 soluble presentes en las muestras colocadas en cada pocillo. Después de lavar la placa para eliminar el material no ligado, la molécula ICAM-1 soluble capturada es detectada por un anticuerpo anti-CD54 biotinilado (anticuerpo de detección), que se liga a la ICAM-1 soluble capturada. Seguidamente, se añade una enzima (peroxidasa) conjugada con avidina o estreptoavidina, que se liga con biotina a los inmunocomplejos capturados en la placa. La adición de una solución que contiene un sustrato cromógeno inicia un cambio de coloración catalizado por la enzima, el cual se detiene por acidificación. El grado de color resultante es medido por espectrofotometría utilizando un lector de placa de ELISA y a una densidad óptica apropiada.
Análisis estadístico
Las concentraciones séricas de ICAM-1 soluble se presentan como media ± desviación estándar de la media, y aplicamos un análisis de la variancia de una vía usando la prueba de Newman-Keuls para comparar estos valores entre los distintos grupos y a las distintas horas, considerando significativa una p < 0,05.
Resultados
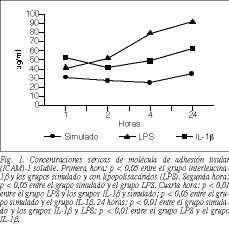
En la primera hora posterior a la agresión endotóxica se observó un aumento en las concentraciones séricas de ICAM-1 soluble en el grupo tratado con IL-1ß con respecto a los grupos simulado y control. En la segunda hora, éstas siguieron aumentando en el grupo control en comparación con el grupo simulado, sin que se apreciaran diferencias entre estos dos últimos con el grupo tratado. En la cuarta hora los valores de ICAM-1 soluble se elevaron todavía más en el grupo LPS, siendo este aumento significativamente mayor que en los otros dos grupos. A su vez, en el grupo tratado con IL-1ß las concentraciones de ICAM-1 soluble fueron mayores que en el grupo simulado. Por último, a las 24 h se observó cómo en el grupo LPS continuaron aumentando los valores de ICAM-1 soluble, siendo significativamente mayores con respecto a los grupos simulado y tratado con IL-1ß. Entre estos dos últimos grupos también se apreció que las concentraciones séricas de ICAM-1 soluble fueron mayores en el grupo tratado en comparación con el grupo simulado (tabla 1 y fig. 1).
Discusión
El MODS es la consecuencia clínica de un proceso sistémico mediado por factores circulantes endógenos que desencadenan una reacción inflamatoria generalizada, conocida como SIRS, como respuesta del propio huésped ante distintos tipos de agresiones, durante la cual se produce la activación de múltiples células inflamatorias efectoras como macrófagos, leucocitos y linfocitos2. Merece especial atención el papel que ejercen las células endoteliales en la fisiopatología de la respuesta inflamatoria. El endotelio vascular es el primer blanco de distintos mediadores inflamatorios, y uno de los pasos más importantes en el desarrollo del MODS está representado por la adherencia sobre el mismo de las células blancas sanguíneas1,3.
En las fases iniciales del SIRS, el macrófago estimulado libera grandes cantidades de citocinas, como la interleucina 1 (IL-1), el factor de necrosis tumoral (TNF) y la interleucina 6 (IL-6)2,3. Entre otros efectos sistémicos, estos mediadores ac túan sobre la célula endotelial, provocando un cambio en su fenotipo a través de la expresión en la misma de moléculas de adhesión, como la molécula de adhesión intercelular (ICAM-1)3. La ICAM-1 media la adherencia sostenida de neutrófilos a las células endoteliales5, fenómeno conocido como marginación leucocitaria, disminuyendo por tanto el número total de PMN circulantes en el torrente circulatorio. Los PMN adheridos provocan una lesión del endotelio a través de la liberación de enzimas proteolíticas y radicales libres de oxígeno, cuya consecuencia biológica final es la disfunción y el fracaso del órgano afectado3. En estudios experimentales previos se ha comprobado que el pretratamiento con IL-1ß 24 h antes de provocar una agresión endotóxica causa una modulación de la respuesta del huésped ante la agresión. Así, este tratamiento evita la elevación durante las primeras horas posteriores a la inyección de LPS, de las concentraciones séricas de IL-1, TNF e IL-66,7. Igualmente, hemos observado cómo la IL-1ß causa, a las 24 h de producido el shock séptico, un aumento en el número de leucocitos circulantes en sangre total al compararlo con el grupo no tratado4. Creemos que dicho efecto pudiera deberse a una disminución de la expresión, entre otras moléculas de adhesión, de la ICAM-1. Esta molécula comienza a ser detectada a las 2 h, y alcanza su máxima expresión a las 4 h de provo cado el estado séptico con LPS8. La síntesis y expresión de ICAM-1 continúa aumentando, consiguiendo concentraciones estables de expresión cerca de las 24 h posteriores a la agresión9. La expresión sobre las membranas de las células endoteliales de esta molécula es estimulada directamente por el LPS, así como por el TNF, la IL-1 y la IL-6 producidas por células inmunológicas activadas durante las primeras horas tras la agresión endotóxica1. La acumulación de neutrófilos y el edema que se observan en los tejidos durante la respuesta inflamatoria se atribuyen al efecto de la endotoxina sobre las células endoteliales, que inducen a su vez la producción de citocinas y éstas, en consecuencia, una sobreproducción de moléculas de adhesión1,3,10. Este proceso provoca la migración y redistribución de los leucocitos hacia los distintos órganos, favoreciendo la acción lesiva sobre los mismos y disminuyendo el número total de estas células en sangre periférica3,8,11. Estas observaciones apoyan el hecho de que la lesión endotelial que se observa en el MODS está asociada con la síntesis y expresión de las moléculas de adhesión, y que la transmigración de neutrófilos a través del endotelio desde la luz vascular al espacio extravascular depende de la existencia de éstas3. Al mismo tiempo que la molécula ICAM-1 se expresa en la membrana endotelial, puede ser liberada al torrente circulatorio en respuesta a la activación celular por degradación proteolítica secundaria a la lesión en el endotelio y, por tanto, el incremento de la fracción soluble en sangre de esta molécula (ICAM-1 soluble) se correlaciona proporcionalmente con el aumento de su expresión en las membranas celulares12. Se sugiere que esta liberación de ICAM-1 por parte de los tejidos lesionados podría tener un efecto de reclutamiento de otras células hacia el foco de lesión, con lo que se potenciaría la respuesta inflamatoria12.
En este estudio hemos comprobado cómo el pretratamiento con IL-1ß produce una disminución de las concentraciones séricas de ICAM-1 en las horas posteriores a la provocación de un estado séptico experimental. La disminución de la expresión de esta molécula explicaría el aumento del número de leucocitos circulantes en estas condiciones de sepsis experimental que hemos observado en experiencias previas4. Dicho efecto pare ce ser debido a la acción protectora que las dosis subletales de IL-1ß ejercen durante las primeras horas posteriores a la inyección del LPS, evitando el ascenso de IL-1, TNF e IL-66,7. Con ello se suprimiría, en parte, el efecto estimulador que estas citocinas tienen sobre la célula endotelial, inhibiendo la expresión sobre sus membranas de ICAM-1 y, por tanto, la adherencia sobre las mismas de los PMN. De esta forma se evitaría el efecto lesivo de estas células sobre el endotelio. Hemos comprobado cómo este tratamiento disminuye las concentraciones de mieloperoxidasa (enzima específica de los PMN)13 y de productos derivados de la peroxidación lipídica (malondialdehí do)14 tisulares, indicadores cuantitativos del grado de infiltración leucocitaria y de lesión celular, respectivamente, tras una agresión endotóxica en distintos órganos de ratones posterior a la inyección de LPS. Este hecho estaría en consonancia con una menor adhesión de PMN sobre el endotelio al expresar éste menos ICAM-1, con lo que se mitigaría el efecto lesivo de estas células, y todo ello inducido por la IL-1ß previamente inyectada.
En la práctica clínica, las moléculas de adhesión solubles se han descrito como marcadores de la inflamación en alteraciones inflamatorias agudas y crónicas15, así como indicadores de activación y daño endotelial16, y su determinación parece ser útil en la cuantificación de la magnitud de la lesión tisular en la respuesta inflamatoria12. En enfermos con sepsis severa y en aquellos con desarrollo de síndrome de disfunción orgánica múltiple, las concentraciones de ICAM-1 soluble se elevan tempranamente. Pueden incluso servir como marcadores para el diagnóstico temprano del fracaso orgánico y del pronóstico en pacientes con síndrome de disfunción orgánica múltiple12,16, así como indicador primario de sepsis clínica o bacteremia en neonatos17. Se han estudiado las concentraciones en plasma de ICAM-1 en pacientes con sepsis, sepsis severa y shock séptico, siendo marcadamente elevadas en pacientes con sepsis fatal (1.793 ng/ml), mientras que en aquellos que sobrevivieron fueron significativamente más bajas (786 ng/ml). Las concentraciones plasmáticas de ICAM-1 soluble superiores a 1.000 ng/ml se han asociado con una elevada tasa de mortalidad18. En pacientes con shock séptico se han descrito concentraciones plasmáticas de ICAM-1 soluble muy aumentadas, que se han incrementado significativamente durante los primeros 3-5 días de la enfermedad19,20.
A la vista de los resultados obtenidos en este estudio, podemos afirmar que el tratamiento experimental con IL-1ß provoca una disminución en la expresión de la molécula de adhesión ICAM-1 soluble tras una agresión endotóxica, siendo probablemente éste uno de los mecanismos por los cuales este tratamiento ejerce su acción protectora frente a una agresión endotóxica, al evitar los efectos lesivos que tienen sobre el endotelio los PMN adheridos sobre el mismo, disminuyendo de esta forma la lesión celular y, por generalización, la disfunción orgánica.