La claudicación intermitente, estación evolutiva intermedia de la enfermedad arterial periférica, se ha considerado tradicionalmente como un estadio benigno, atendiendo al hecho exclusivo de la clínica de dolor que se produce durante la marcha.
En este artículo pretendemos llamar la atención sobre las posibles consecuencias asociadas al dolor isquémico y el consiguiente estrés oxidativo desencadenado por su «sombra», el fenómeno isquemia/reperfusión. Durante el mismo se produce deficiente manejo del calcio y aparición incontrolada de radicales libres de oxígeno, con daño mitocondrial y aumento del fenómeno inflamatorio que podría estar asociado a una progresión acelerada de la arteriosclerosis sistémica con aumento del riesgo cardiovascular, directamente proporcional a la disminución del índice tobillo/brazo.
Ante estos acontecimientos, proponemos una nueva clasificación integradora de las actuales de Fontaine y Rutherford, que considera las posibles consecuencias sistémicas expuestas y sirva para modificar nuestro manejo tradicional de la enfermedad arterial periférica.
Clasically, intermittent claudication, an intermediate stage in peripheral arterial disease, has been considered as a benign condition when considering only the muscular pain on walking.
In this paper our aim is to attract attention about the effects linked to ischemic pain and the oxidative injury resulting from episodes of ischemia/reperfusion. Throughout this process alterations in calcium homeostasis as well as uncontrolled generation of reactive oxygen species, in association with the mitochondrial dysfunction and inflammatory phenomena, could lead to accelerate atherosclerosis, with an increased cardiovascular risk stated by means of a reduced ankle-brachial index.
Taking this idea into account we propose a possible new classification for the management of the peripheral arterial disease, combining the Fontaine and Rutherford classifications and thinking about the described systemic effects in order to change the traditional management of peripheral arterial disease.
Son bien conocidas las clasificaciones de R. Fontaine (4 grados) y R.B. Rutherford (6 grados)1,2 acerca de la enfermedad arterial periférica (EAP). La claudicación intermitente es el estadio o grado ii (a y b), de la primera y los grados 2, 3 y 4 de la segunda, según sea la distancia de claudicación recorrida leve, moderada o grave, y en estas graduaciones nos seguimos basando todos los profesionales para estadificar la gravedad del proceso.
Pero esta visión de la enfermedad, poniendo únicamente el foco de atención en la distancia recorrida libre de dolor por el paciente claudicante, es acorde con la antigua concepción segmentaria y evolutiva de la arteriosclerosis en general y de la EAP en particular, pero puede que se esté quedando obsoleta, al considerar exclusivamente el síntoma dolor, sin reparar en su causa, ni en el fenómeno isquemia/reperfusión (F I/R), con el que siempre va asociado.
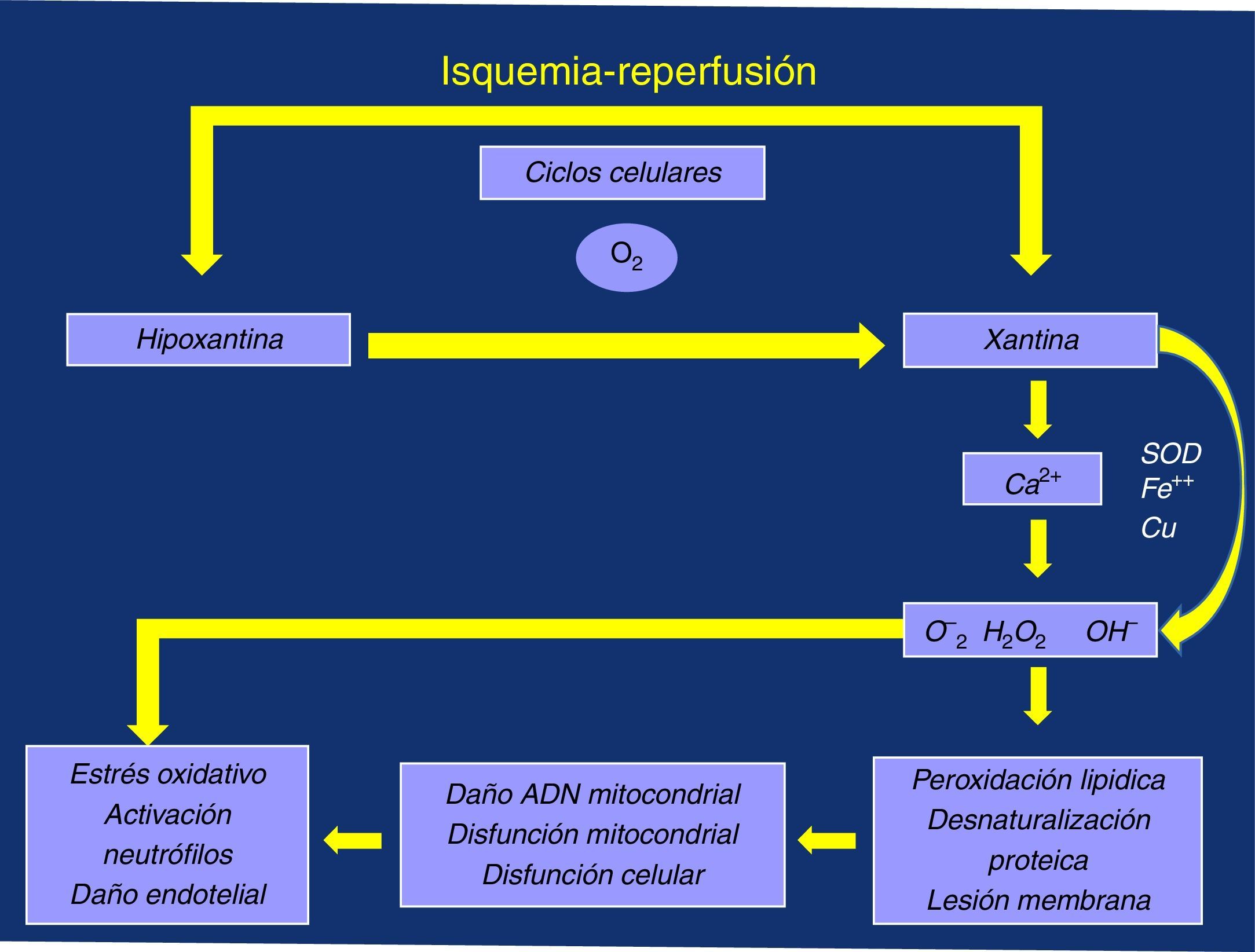
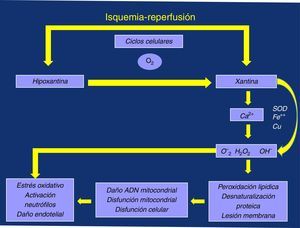
Pudiera suceder que nos estemos fijando en algo poco trascendente, aunque sea muy limitante para la vida activa de quien lo padece, cual es el dolor isquémico y la distancia de claudicación asociada y no le demos la importancia necesaria a las posibles consecuencias asociadas al estrés oxidativo desencadenado por su «sombra», el F I/R, por el deficiente manejo del ión calcio (Ca2+), y la producción de radicales libres de oxígeno (RLO), con daño de las membranas mitocondriales y celulares, y la consiguiente respuesta inflamatoria local y sistémica, ligada a la activación de los neutrófilos y a la disfunción (daño) endotelial3–5 (fig. 1).
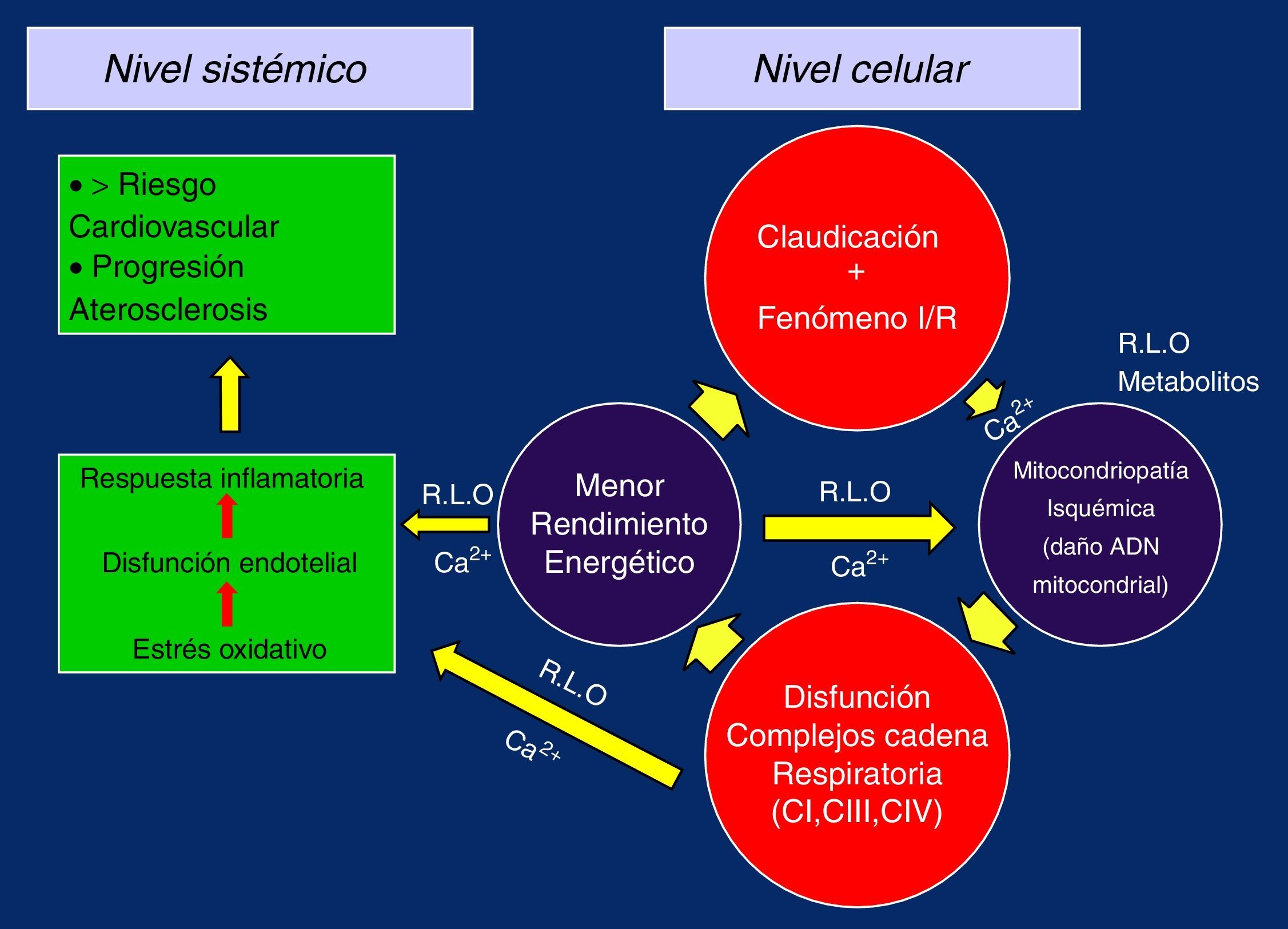
Claudicación, fenómeno isquemia/reperfusión, cambios hemodinámicosEl F I/R se presenta cada vez que el claudicante debe aflojar, por dolor, el ritmo de la marcha y/o detenerse; son muchas veces cada día y miles cada año. No es razonable pensar que el riesgo cardiovascular, que está fuera de toda duda aumentado en el claudicante, sin enfermedad arteriosclerosa asociada, coronaria o cerebrovascular, sea debido al dolor muscular en la pantorrilla afectada, por ejemplo, o a una casualidad, parece al menos tan plausible pensar que puede haber otros fenómenos asociados a la fisiopatología del dolor que pudieran explicarlo.
El F I/R que se produce en las masas musculares, transitoriamente isquémicas del claudicante, podría poner en marcha el proceso de estrés oxidativo, de modo semejante a lo originalmente descrito de forma experimental en el miocardio por Jennings et al.6.
La existencia de daño celular masivo a consecuencia del F I/R en el miocardio, fue descrita como la paradoja del calcio por Zimmerman et al.7, observando el daño de membrana con necrosis masiva en los cardiomiocitos de rata, tras la administración de solución cardiopléjica sin Ca2+, seguido de reperfusión con solución salina con calcio en concentración fisiológica.
El conocimiento de los complejos mecanismos fisiopatológicos subyacentes a la arteriosclerosis y a su manifestación como claudicación intermitente en la EAP es esencial para tener una visión de conjunto del proceso y en su caso plantear nuevas estrategias de prevención y tratamiento8.
El flujo arterial dependiente de la presión sistémica y de la resistencia vascular es capaz de adaptarse a las necesidades del ejercicio muscular por disminución de las resistencias periféricas, en ausencia de estenosis. Cuando aparecen estenosis en el circuito, la ley de Poisseuille nos recuerda que intervienen entre otros factores el radio (a la cuarta potencia), la longitud de la misma y la viscosidad sanguínea. El radio es el factor primordial para determinar la reducción de la presión, ya que una estenosis transversal del 50% multiplica por 16 la resistencia. La longitud de la lesión tiene escaso significado, en cambio 2 estenosis no críticas una a continuación de otra sí tienen efecto sobre el flujo9,10
Se conoce como estenosis arterial crítica aquella en la que disminuye el flujo distal, pero este concepto relaciona la estenosis con la velocidad del paso y la caída del flujo distal a la misma. Esto significa que una estenosis arterial puede no ser crítica en reposo y serlo durante el ejercicio. En reposo la velocidad de flujo en la arteria femoral se cifra entre 10 y 20cm/seg11. Sin embargo al caminar, la velocidad de flujo aumenta fácilmente hasta los 150cm/seg.
La claudicación y las variaciones de flujo en la enfermedad arterial periféricaEn el estadio de claudicación intermitente no aparece ningún síntoma de isquemia en reposo, ello es debido a que la perfusión tisular distal a la lesión es suficiente para subvenir a las necesidades metabólicas; pero con el ejercicio, por las necesidades de incrementar el flujo por caída de las resistencias periféricas, se produce linealmente hasta alcanzar un flujo mantenido en meseta, durante el cual se origina un consumo de oxígeno que se va retrasando a pesar de todas las posibles compensaciones metabólicas puestas en marcha, como serían aquellos incrementos de la extracción muscular de oxígeno (aumento de enzimas oxidativas, aumento de acilcarnitina de cadena corta, hasta la producción no oxidativa [anaeróbica] de trifosfato de adenosina); asimismo, al interrumpir el ejercicio, la fase hiperhémica es más prolongada en estos pacientes que en los sanos8,12–15. Aunque la situación hemodinámica es determinante en el estado circulatorio del claudicante, no hay una correlación lineal entre el descenso del índice tobillo/brazo (I T/B) y la distancia recorrida libre de claudicación, o al menos la relación es inconstante16, por lo que es probable que puedan estar involucrados otros factores. Otros autores valoran los I T/B durante el reposo y después del ejercicio, anotando cuidadosamente la distancia inicial libre de dolor y la distancia de claudicación hasta que el mismo obliga a detenerse, observando que los datos no siempre se correlacionan con los I T/B, por lo que describen un modelo de regresión que incluye otros parámetros17.
Por otra parte, en otro estudio aleatorizado18 se constató que a pesar de aumentar al triple la distancia de claudicación en el grupo de entrenamiento sobre el grupo control, el flujo muscular medido con xenón 133 en ambos grupos no mostró ninguna mejoría, lo que demuestra que el flujo no es el único determinante de la función muscular en este tipo de pacientes.
Fenómeno isquemia/reperfusión, fallo metabólico: Ca2+ y radicales libres de oxígenoLa isquemia muscular que ocurre durante la marcha del claudicante y la posterior reperfusión que aparece durante el descanso transitorio obligado por el dolor (I/R), posiblemente debe producir sobre el sarcolema afectado unas consecuencias similares a las que ocurren a nivel del miocardio6.
La perfusión inadecuada disminuye el metabolismo aerobio llevando a una depleción inicial de las reservas energéticas (fosfocreatina), con eventual disminución en la producción de trifosfato de adenosina. Estas pérdidas se intentan compensar a través del metabolismo anaerobio, con producción de ácido láctico y RLO, con el consiguiente estrés oxidativo y daño celular. Daños que continúan en la fase de reperfusión, durante el reposo, cuando se restaura el suministro de oxígeno y nutrientes19.
Como el rendimiento anaerobio es menor, la disminución del conjunto adenina-nucleótidos conduce a una serie de fallos metabólicos en cadena: depleción y falta de sustrato para la producción de trifosfato de adenosina; colapso del potencial de membrana mitocondrial, con daño de la misma y apertura del poro transitorio de permeabilidad de membrana mitocondrial (mPTP), con dificultad para el manejo del Ca2+; acumulación de productos intermedios del metabolismo anaerobio, incluyendo ácido láctico y RLO, lo que conlleva la inhibición de varias vías metabólicas, acumulación y sobrecarga de este ión con todas sus dañinas consecuencias19.
El papel del mPTP es clave porque puede permitir una lesión por reperfusión letal. La membrana interna de la mitocondria es relativamente impermeable en condiciones normales, el poro permanece cerrado durante la fase de isquemia, mientras se pueda mantener el potencial de membrana, sin embargo se puede producir su apertura durante la reperfusión, por incapacidad metabólica para mantener dicho potencial, con intoxicación por Ca2+ y explosión de RLO, lo que lleva al daño mitocondrial y celular19,20.
La regulación endotelial principalmente mediada por el óxido nítrico es uno de esos factores, que puede verse gravemente alterado por la aparición y efectos indeseables del anión superóxido y otros radicales libres que aparecen durante el F I/R de la marcha del claudicante, con el consiguiente estrés oxidativo21, y como consecuencia de su funcionamiento alterado favorecer la aparición de la respuesta inflamatoria sistémica a través de los mediadores inflamatorios, la activación de las plaquetas y la migración de linfocitos y monocitos.
Las concentraciones plasmáticas de malondialdehido, que es un marcador de formación de RLO, son altas en reposo en la EAP y aumentan todavía más con el ejercicio22. Intentando estudiar mejor los efectos de este estrés oxidativo, se han analizado los efectos de la marcha forzada en un grupo de claudicantes estudiando la oxidación de la antipirina por los RLO, a través de la aparición de sus metabolitos. Tanto durante la marcha como durante la posterior reperfusión, los 2 productos derivados de la antipirina, consecuencia de la oxidación por los RLO aumentan significativamente en plasma. Estos metabolitos son más precisos para medir el efecto oxidativo que cuando se mide a través del test del malondialdehido, el cual por su inestabilidad bioquímica puede dar lugar a falsos positivos de aparición de peroxidación lipídica23.
Cuando analizamos la oxigenación local del tejido muscular isquémico por medio de la espectroscopia infrarroja14, colocando una sonda sobre el músculo gemelo y con pacientes isquémicos y sanos, sobre cinta rodante de máximo esfuerzo, se observa que la desaturación es más rápida en los sanos y también se recuperan mucho antes, mientras en los claudicantes es algo más lenta, pero sobre todo el tiempo de recuperación es significativamente más prolongado. Estos cambios metabólicos pueden explicarse porque la función mitocondrial en los claudicantes estaría disminuida, produciéndose una forma de miopatía que alteraría la respuesta al ejercicio.
Lesión oxidativa, disfunción y daño mitocondrialCuando se mide la respiración mitocondrial de manera basal y tras la estimulación del ciclo de Krebs con sustratos y ADP, podemos observar en los pacientes con EAP, en comparación con los sanos, el decrecimiento del consumo de oxígeno en las miofibrillas del músculo esquelético, apuntando a que un defecto de la cadena de transporte electrónico (CTE) sea el origen de la disfunción mitocondrial24.
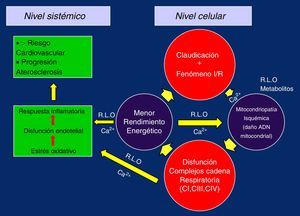
Analizando en los pacientes claudicantes de forma separada los complejos de la CTE para estudiar su función y así poder evaluar sus posibles defectos, tanto a través de la respirometría «in vitro», como su actividad enzimática por espectrometría, podemos observar que en los complejos CI,CIII y CIV son los lugares donde mayor cantidad de RLO se generan, midiéndose una función disminuida de la respiración mitocondrial del 17; 30 y 17%, así como una menor actividad enzimática del 22; 15 y 32%, respectivamente. Estos hallazgos son particularmente importantes para cuantificar de forma clara la disfunción mitocondrial producida por la isquemia25 y muestran la conexión lógica entre los defectos de la CTE, el compromiso de la respiración mitocondrial, la disminución de producción de energía oxidativa en el músculo esquelético y el bajo rendimiento para el ejercicio en los pacientes con EAP26.
Pero también el papel de los RLO sigue en permanente discusión, porque las sustancias antioxidantes que los deberían neutralizar no han conseguido validar sus propiedades en diferentes ensayos clínicos que se han realizado para evitar sus efectos a nivel clínico en cuanto a protección sobre el estrés oxidativo y la progresión de la arteriosclerosis sistémica. Hasta ahora no se ha publicado ningún ensayo consistente en el que se demuestren beneficios con las distintas terapias antioxidantes27.
No obstante, si contemplamos en conjunto la pérdida del potencial de membrana mitocondrial, la aparición del poro (mPTP), la incapacidad para mantener los niveles adecuados de Ca2+ intracelular, que es el resultado de la acción coordinada de una serie de diferentes sistemas de transporte localizadas en las membranas plasmáticas y membranas de diferentes organelas celulares, así como de su unión a diversas proteínas citosólicas28, unido al escape de RLO no tamponados en los complejos CI, CIII y CIV de la CTE, es lógico pensar que el primer lugar donde se pueden producir alteraciones es en la propia cadena de transporte, empeorando progresivamente su función, así como en los propios contenidos de la mitocondria28,29. Curiosamente el CII no resulta afectado en estos estudios separados, posiblemente porque este complejo se codifica íntegramente a través del ADN del núcleo celular, mientras que el ADNmt controla parcialmente el resto de los complejos, a través de la codificación de 13 de sus proteínas30.
Este daño en el ADNmt puede ser el mecanismo responsable de los defectos específicos encontrados en esos complejos, por ser este ADN particularmente vulnerable al daño oxidativo, con un promedio de mutación 10 veces mayor que el producido en el genoma de la célula muscular31. Esta hipótesis ha cobrado fuerza desde que otros trabajos han demostrado un daño 17 veces mayor en el ADNmt mediado por el sustrato específico de la deleción 4977-bp, respecto del grupo control32.
De esta manera, al replicarse defectuosamente los complejos de la CTE se cerraría el círculo vicioso del daño isquemia/reperfusión, perpetuándose el fallo y dando paso a la presencia de la miopatía mitocondrial isquémica propia del claudicante, en la que la pérdida del potencial de membrana y los problemas en el manejo del Ca2+ por el menor rendimiento energético sería el desencadenante, poniéndose en marcha el estrés oxidativo, disfunción endotelial y respuesta inflamatoria global, con progresión de la arteriosclerosis generalizada a nivel sistémico y aumento del riesgo cardiovascular5,19,26,28,32 (fig. 2).
Alteraciones de la estructura y función muscular en la enfermedad arterial periféricaLos pacientes con EAP presentan anomalías histológicas en sus músculos esqueléticos.
En las biopsias musculares se observan cambios profundos tanto en la morfología como en el número de reclutamiento de las distintas miofibrillas de contracción lenta de tipo i, así como en las de los 2 subtipos a y b de las de tipo ii, que son de actividad más enérgica y rápida. Estas últimas, que en condiciones normales contienen menos mitocondrias y se fatigan antes, estarían disminuidas, asociándose a debilidad muscular; también se constata por electrofisiología presencia de axonopatía distal, que afecta a las fibras nerviosas de todos los tamaños33,34.
En los pacientes claudicantes, como consecuencia de la limitación de su actividad al caminar, ocurre un mayor sedentarismo, por lo que el número y actividad mitocondrial deberían estar disminuidas, pero, por el contrario, varios estudios muestran un aumento del número de mitocondrias26,35; este aumento de la expresión mitocondrial puede ser consecuencia directa y proporcional al grado de isquemia de la extremidad, lo que podría reflejar en cierto modo la gravedad e intensidad de la isquemia.
Es cierto que un aumento de la masa mitocondrial puede mejorar la extracción de oxígeno para cumplir sus funciones metabólicas en presencia de isquemia y establecerse como mecanismo compensador. Pero de manera interesante el aumento de la expresión mitocondrial está asociado también a enfermedades degenerativas de la CTE y esto permite establecer un vínculo mecanicista y funcional con la miopatía mitocondrial isquémica ya descrita24,35.
Alteraciones sistémicasLa claudicación intermitente se asocia a alteraciones hemorreológicas de la sangre con mayor viscosidad, por un aumento de la concentración plasmática del fibrinógeno, del recambio de fibrina, del factor von Willebrand y del inhibidor del activador del plasminógeno; asimismo la deformabilidad de los eritrocitos es menor, por lo que el paso a través de la microcirculación se ve dificultada36.
También se ha demostrado que el ejercicio en los claudicantes está asociado a una excesiva producción de trombina, tanto en el grupo de fumadores, como no fumadores, respecto al grupo control37.
Los efectos ocultos que se producen en el organismo como consecuencia del estrés oxidativo durante la marcha de los claudicantes son todavía más numerosos, pudiendo demostrarse la presencia de microalbuminuria, indicador de aumento de la permeabilidad del glomérulo renal, un fenómeno encuadrado en el contexto de un incremento generalizado de la permeabilidad vascular38. De todas maneras la microalbuminuria en otras ocasiones no aparece durante la marcha, pero sí aparece la enzima NAG en proporciones estadísticamente significativas, con perfil de marcador más grave, en estados más avanzados de isquemia crítica, con grave riesgo de provocar disfunción renal39.
Otro efecto a distancia que merece ser señalado es el aumento de la permeabilidad intestinal durante la marcha de los pacientes claudicantes (caminando en cinta rodante 200m al 12% de pendiente), hecho que se demuestra por el test de lactulosa-manitol. Este incremento en la permeabilidad intestinal era conocido como consecuencia del F I/R, tras el pinzamiento aórtico, tanto en modelos animales como en clínica humana, pero tras este estudio queda demostrado que como consecuencia del F I/R, la permeabilidad intestinal aumenta significativamente durante la marcha y disminuye, hasta casi desaparecer, tras la revascularización exitosa de estos pacientes40.
Claudicación intermitente, índice tobillo/brazo y riesgo cardiovascularEs bien conocida la aparente benignidad de la claudicación, atendiendo a su evolución dentro de las clasificaciones actuales de la EAP. En los miembros inferiores, solo un 25% tiende a empeorar a un ritmo del 7-9% anual y posteriormente al 2-3% anual.
El riesgo de pérdida de miembro se estima en el estudio Framinghan en un 2%, pero estudios más recientes sobre un horizonte de 5 años lo cifran entre un 1-3%, por lo que es lógico en este aspecto considerarla como una enfermedad benigna.
Sin embargo, esta misma claudicación podemos considerarla como una enfermedad de muy mal pronóstico a la luz de sus complicaciones sistémicas. La supervivencia de los claudicantes es mucho menor que la de la población general, su mortalidad a los 5, 10 y 15 años es del 30, 50 y 70%, respectivamente. El riesgo de mortalidad es 2,5 veces mayor respecto a los grupos control, siendo todavía mucho peor el subgrupo más avanzado de isquemia crítica (3-4 veces mayor), con cifras de mortalidad del 20% para el primer año, del 50% a los 5 años y del 90% a los 10 años41. Podemos establecer una clara estratificación entre los estadios de la EAP y el I T/B; correspondiendo el estadio i (asintomático) a índices≥0,9; el estadio ii (claudicación intermitente), se mueve entre un I T/B de 0,9-0,5; siendo más corta la distancia de claudicación cuanto más desciende el índice, aunque no existe una correlación lineal entre distancia de claudicación medida sobre cinta rodante e I T/B16.
Por otra parte el I T/B se ha revelado como el marcador más potente de riesgo cardiovascular. En las mujeres mayores, un I T/B<0,9 aumenta entre 3 y 8 veces el riesgo de mortalidad cardiovascular y entre 2 y 5 veces el riesgo de fallecimiento por todas las causas cuando se compara con un I T/B>0,942. Los pacientes con enfermedad coronaria más extensa y con mayor prevalencia de enfermedad multivaso son aquellos con un I T/B más patológico43.
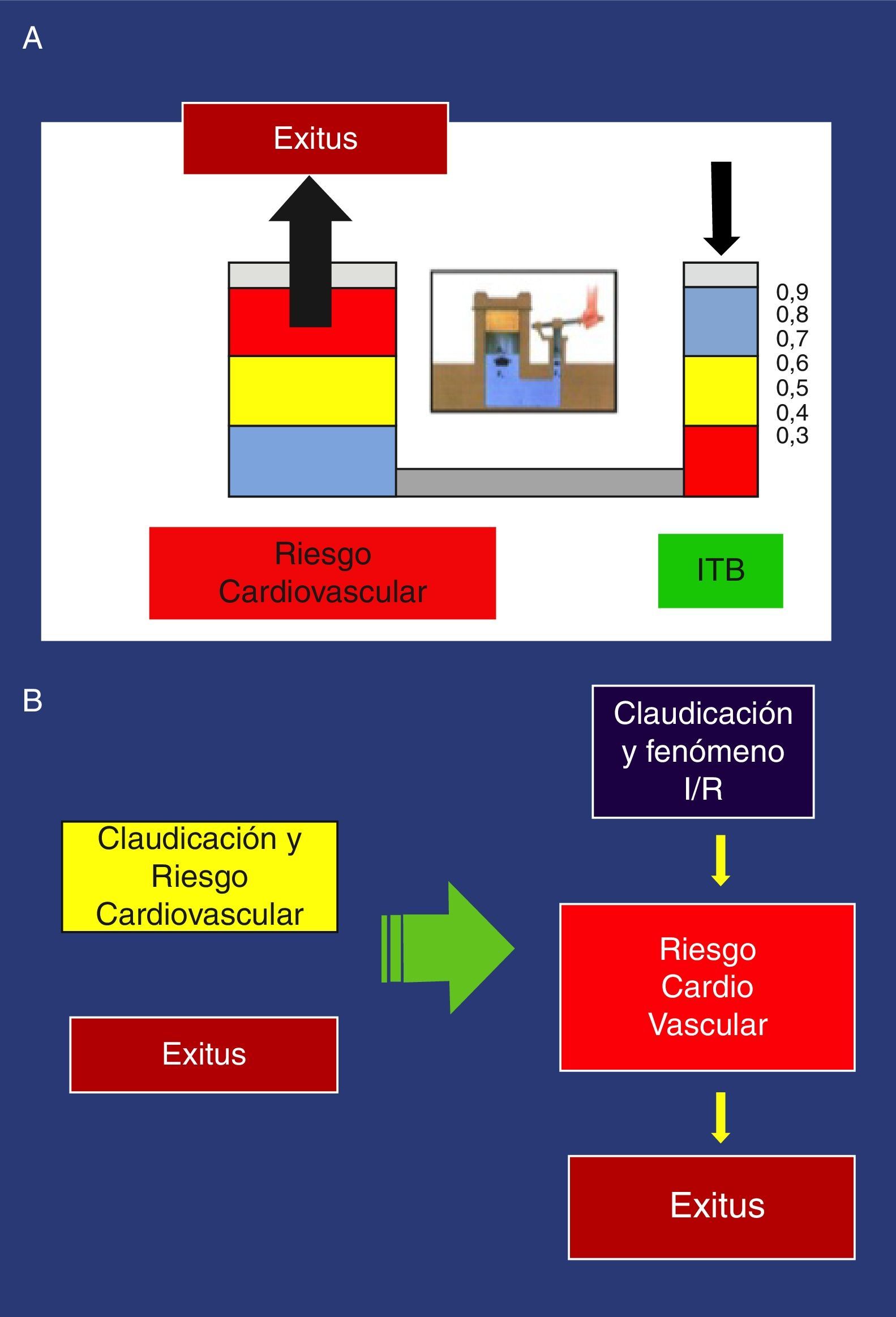
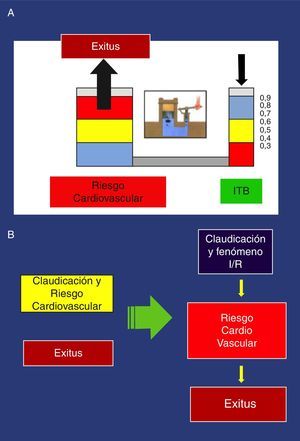
Estos hallazgos se han confirmado en múltiples estudios, de manera que un I T/B<0,9 se asocia con aproximadamente el doble de mortalidad total a los 10 años por causas cardiovasculares, siendo mucho más grave el pronóstico vital por aumento del riesgo cardiovascular cuanto más desciende el I T/B44. Podemos poner el ejemplo del principio de Pascal aplicado a la prensa hidráulica, para recordar esta asociación (fig. 3).
A: Ejemplo del principio de Pascal, aplicado a la asociación Índice tobillo/brazo y aumento del riesgo cardiovascular. B: Nueva orientación de la claudicación: Izquierda: visión tradicional, relación no causal del>de riesgo cardiovascular. Derecha: nueva orientación: relación causal.
Con la visión tradicional de la claudicación, obviando la fisiopatología, se ignora por completo las posibles consecuencias del F I/R, únicamente atiende a la distancia recorrida, expresada subjetivamente por la distancia de claudicación libre de dolor; con esta nueva visión, además de la distancia, se atiende al F I/R y su posible relación con el aumento del riesgo cardiovascular del claudicante. Cuanto más intenso sea este, más riesgo (fig. 3).
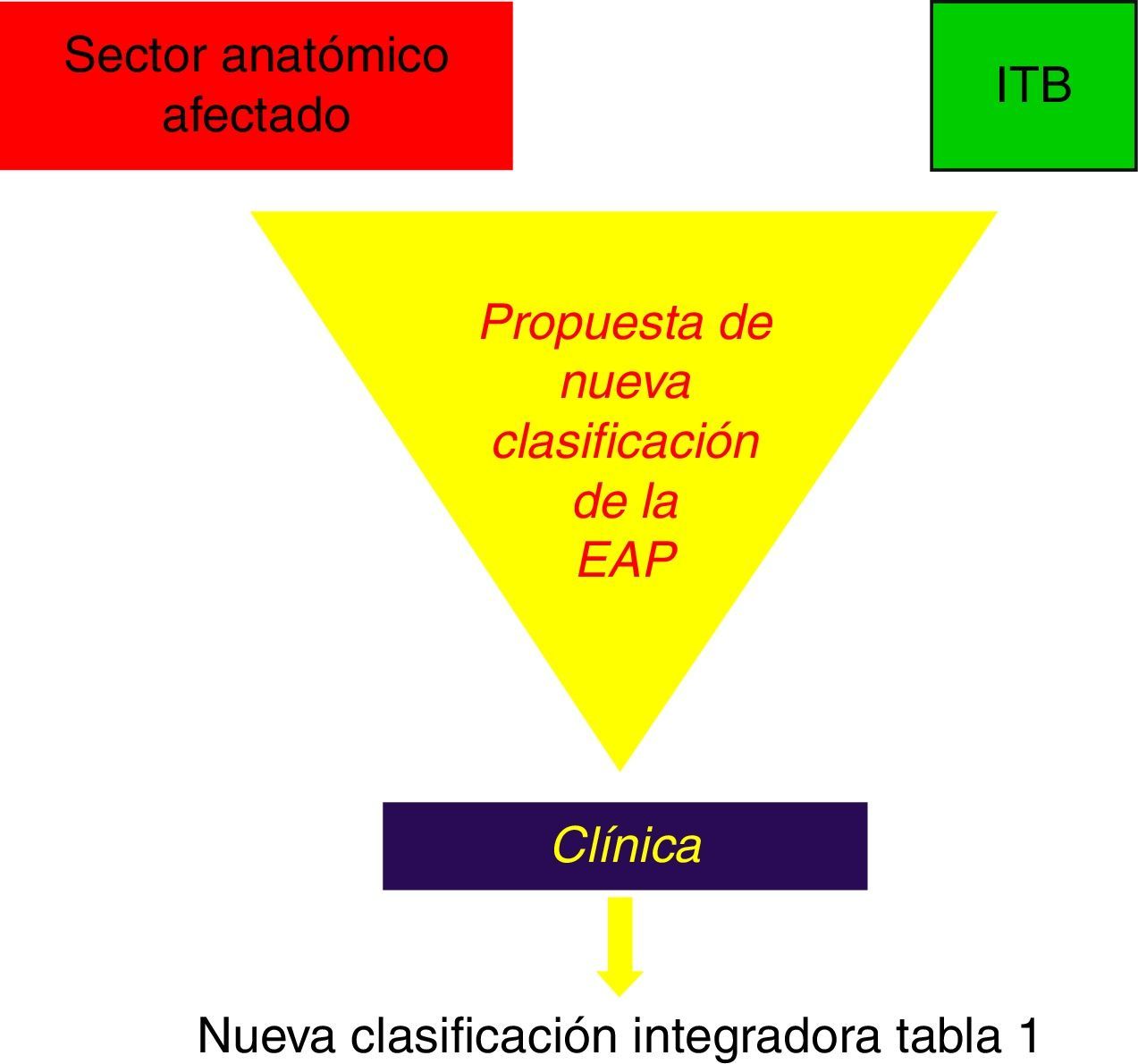
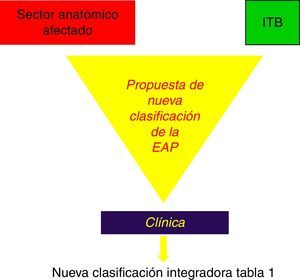
A la luz de estos acontecimientos, planteamos la conveniencia de acordar una nueva clasificación de la EAP, que integrando las actuales de Fontaine y Rutherford1,2 contemple no solo la clínica de claudicación, que es subjetiva y variable incluso en el mismo día, sino las posibles consecuencias metabólicas del F I/R, expresado tanto por las masas musculares que entran en isquemia en los sectores topográficos afectados, por las lesiones estenosantes u obstructivas recogidas por la clasificación TASC II41, como por la intensidad de la misma expresada por el I T/B44,45 (fig. 4).
No deben tener la misma repercusión metabólica a largo plazo por la magnitud del F I/R que generan, una lesión obstructiva del tronco tibioperoneo que un síndrome de Leriche. Las 2 lesiones pueden tener una expresión clínica de claudicación moderada a 150m, encuadrándose ambas como G.IIb de Fontaine y 2 de Rutherford; pero debemos convenir que las posibles repercusiones ligadas al daño isquemia/reperfusión, como son:>el estrés oxidativo,>la disfunción endotelial y>de la respuesta inflamatoria sistémica, no deben ser comparables.
Nuestra propuesta mantiene 6 grados (grado 0 asintomático), que integran 3 apartados que deben combinarse (tabla 1):
- a.
la extensión lesional del sector anatómico afectado (clasificación TASC II).
- b.
la expresión hemodinámica (I T/B).
- c.
la clínica del paciente (Fontaine y Rutherford modificadas), en 5 estadios.
Nueva clasificación integradora
| Grado 0 | Asintomático: Lesiones estenosantes de cualquier sector | I T/B>0,9 |
| Grado 1 | Lesiones TASC A y B (sector aorto-iliaco) | I T/B:>0,7 |
| Grado 2 | Lesiones TASC C (sector aorto-iliaco) | I T/B: 0,7-0,5 |
| Grado 3 | Lesiones TASC D (sector aorto-iliaco) | I T/B:<0,5 |
| Grado 4 | Lesiones TASC A y B (sector fémoro-poplíteo) | I T/B:>0,7 |
| Grado 5 | Lesiones TASC C | I T/B: 0,7-0,5 |
| Grado 6 | Lesiones TASC D | I T/B:<0,5 |
Clínica:
a.- Claudicación leve:>300m; b.- claudicación moderada: 100-300m; c.- claudicación severa:<100m; d: parestesias-dolor de reposo; e: lesión tisular.
Nota: La nueva clasificación asocia un grado numérico y una letra del apartado clínica: p. ej.: Grado 3d; Grado 5b.
De esta manera un grado 5b, p. ej., es un paciente con lesiones estenosantes u obstructivas de más de 15cm del sector fémoro-poplíteo de un miembro (TASC C); I T/B entre 0,7, y 0,5; y una distancia de claudicación moderada a 200m.
La consideración en la nueva clasificación de las posibles consecuencias provocadas por el F I/R, sobre las masas musculares isquémicas (miopatía mitocondrial isquémica), que ponen en marcha el estrés oxidativo, disfunción endotelial y respuesta inflamatoria sistémica, con posible progresión generalizada de la arteriosclerosis y aumento del riesgo cardiovascular5,19,26,28. sería clave para orientar de manera integral las recomendaciones de tratamiento a estos pacientes y así, posiblemente, poder disminuir a medio plazo el riesgo cardiovascular tan elevado que actualmente presentan41–45.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.