Introducción
Privar de flujo sanguíneo a un órgano (isquemia) y luego restablecerlo (reperfusión) causa un daño que se denomina lesión por isquemia-reperfusión (LIR). Las lesiones producidas durante la fase de isquemia se relacionan, sobre todo, con la privación de oxígeno que reduce los fenómenos respiratorios celulares y puede llegar a causar, en pocos minutos, lesiones irreversibles en órganos vitales tales como el corazón, el cerebro, los riñones o el hígado. La reperfusión significa la nueva entrada de oxígeno, que genera una respuesta inflamatoria que no sólo daña el órgano sometido a isquemia (respuesta local), sino también órganos distantes (respuesta sistémica)1-9. En el ámbito de la cirugía hepática, la LIR queda bien patente en 2 situaciones: a) a temperatura corporal (normotermia) durante las resecciones hepáticas, cuando se realiza la oclusión vascular del pedículo (maniobra de Pringle), y b) a baja temperatura, durante el proceso de obtención, almacenamiento y posterior implante de un injerto hepático en el ámbito del trasplante. El problema clínico es que la LIR conlleva una morbimortalidad significativa en ambas situaciones10-13.
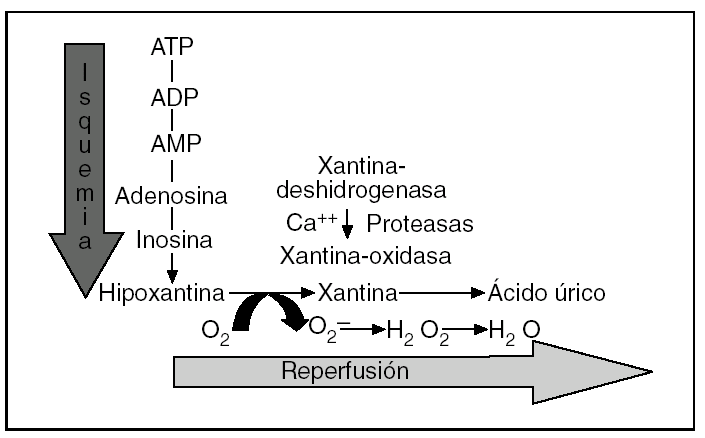
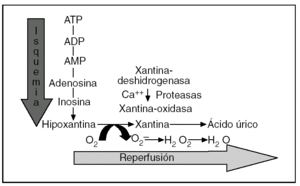
La fisiopatología de la LIR es compleja, pero hay una serie de hechos bien establecidos1-9. En condiciones de isquemia prolongada se produce un catabolismo del adenosintrifosfato (ATP) que lleva a la acumulación de hipoxantina y se generan, inmediatamente después de la reperfusión, especies reactivas de oxígeno (ERO) a través del sistema xantina-oxidasa14,15 (fig. 1). Por otra parte, en esta fase también está bien demostrada una disminución de la fosforilación oxidativa y de la actividad de las bombas de membrana dependientes del ATP, con la consiguiente entrada de calcio, sodio y agua en el interior de la célula, situación que hace a las células especialmente vulnerables a cualquier agresión16-19. Además, se ha podido constatar la aparición de moléculas proinflamatorias (moléculas de adhesión de leucocitos, citocinas, endotelina, tromboxano A2, etc.) y la supresión o inactivación de moléculas protectoras (óxido nítrico, prostaciclina, etc.)1-9. En resumen, la isquemia conduce a un estado proinflamatorio que aumenta la vulnerabilidad del tejido durante la reperfusión y puede llevar a la necrosis celular o la apoptosis.
Fig. 1. Representación esquemática del catabolismo del adenosintrifosfato (ATP) durante la fase de isquemia y de la producción de especies reactivas de oxígeno por el sistema xantina-oxidasa en la fase precoz de la reperfusión. ADP: adenosindifosfato; AMP: adenosinmonofosfato.
A pesar de que se conoce la existencia de la LIR desde hace más de 40 años y de los reiterados esfuerzos para reducir su impacto, los logros obtenidos han sido más bien escasos. Se ha aplicado diversas estrategias terapéuticas, unas basadas en la administración de fármacos (corticoides, antioxidantes, anticuerpos anticitocinas, proteínas recombinantes), otras en la aplicación de técnicas de terapia génica20-22, algunas quirúrgicas23 y, finalmente, otras basadas en el llamado de "shock térmico"24. De todas ellas, la que ha demostrado tener unos efectos más beneficiosos y una clara utilidad clínica es una estrategia quirúrgica: el preacondicionamiento isquémico (PI).
El preacondicionamiento isquémico
El PI es un fenómeno que fue descrito por primera vez en 1986 por Murry et al25 en el corazón. En síntesis, el PI consiste en la aplicación de episodios de isquemia-reperfusión breves y repetitivos, antes de una isquemia-reperfusión prolongada. Con posterioridad se constató que la protección obtenida contra la LIR con el PI en el corazón era aplicable a otros órganos con funcionalidad muy diversa, como el músculo estriado26, el cerebro27, el intestino28, los pulmones29, los riñones30 y el hígado23,31-33. En cualquier caso, la tolerancia a la LIR inducida por el PI es específica para cada órgano y cada especie animal. Es decir, para cada uno de ellos, el número de ciclos de isquemia-reperfusión y su duración varían9. Así pues, mientras que en el miocardio se consigue la protección tras varios ciclos de isquemia-reperfusión25, en el hígado se obtiene tras aplicar un único ciclo de 10 min de isquemia seguido de 10 min de reperfusión, sin que la adición de nuevos períodos de isquemia-reperfusión proporcione más protección34.
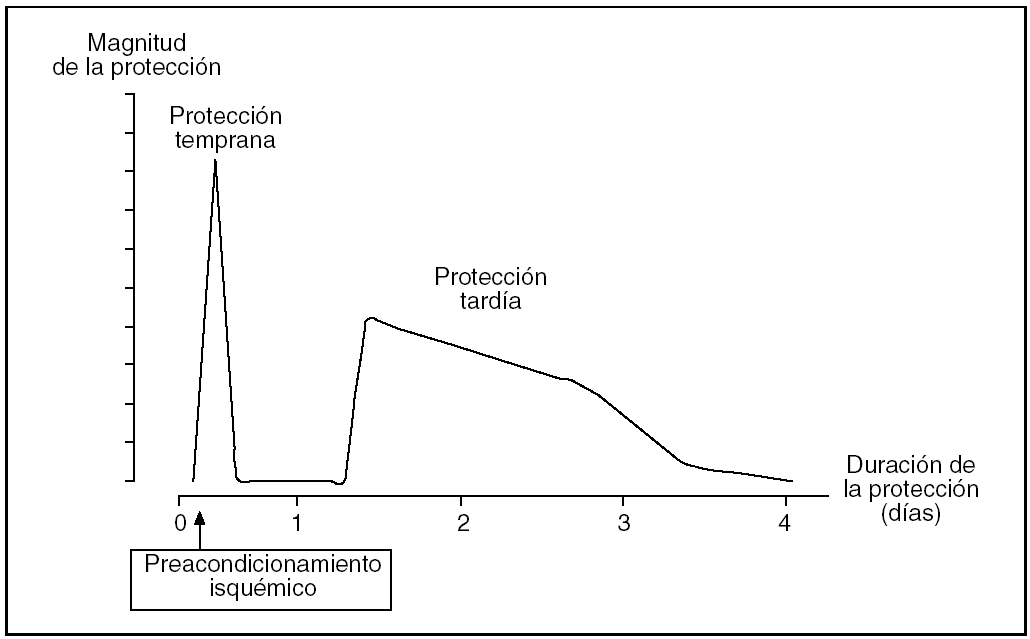
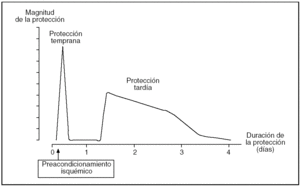
De forma clásica se ha descrito que el PI ofrece una protección inicial a las 2-3 h de la reperfusión y otra tardía a las 12-24 h, que dura de 2 a 3 días (fig. 2). Pese a que en el hígado el comportamiento es similar, la ventana de protección tardía no está completamente definida.
Fig. 2. Representación esquemática de la magnitud y la duración las 2 fases de protección que confiere el preacondicionamiento isquémico.
Mecanismos moleculares del preacondicionamiento isquémico
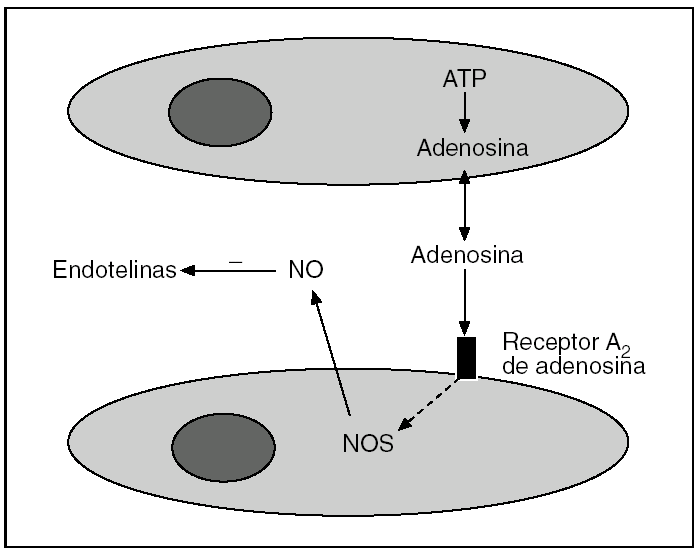
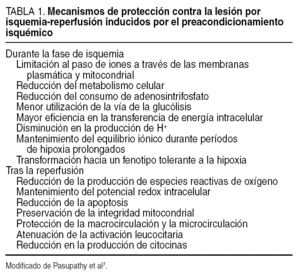
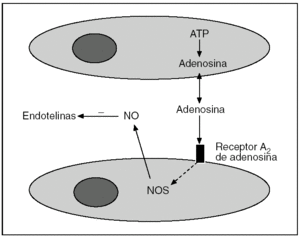
Los mecanismos por los que el PI confiere protección contra la LIR son motivo de investigación en la actualidad1-9 (tabla 1). Se postula que se trataría de una secuencia rápida de acontecimientos en la que una señal desencadenaría un mensaje intracelular y la posterior amplificación de los mecanismos encaminados a la protección35. En el eje de esta secuencia aparecerían el NO y la adenosina como moléculas fundamentales (fig. 3), para luego promover la activación de múltiples señales celulares.
Fig. 3. Representación esquemática de la generación de NO y su efecto inhibidor de las endotelinas. ATP: adenosintrifosfato; NOS: óxido nítrico sintetasa.
Papel del óxido nítrico
Los trastornos de la microcirculación y la ausencia de perfusión sinusoidal son dos hechos bien documentados que contribuyen a la LIR. Aunque la lesión del endotelio y los episodios de coagulación intravascular pueden reducir e incluso bloquear el flujo sanguíneo, el factor determinante es la liberación de potentes sustancias vasoconstrictoras, entre las que destacan las endotelinas36-39. Varios estudios muestran que en la fase de isquemia se producen cantidades insuficientes de NO para contrarrestar de forma efectiva la presencia de estos elementos vasoconstrictores durante la reperfusión40-42.
A los pocos minutos de realizar el PI en el hígado, se libera adenosina al espacio extracelular43. La adenosina activa la forma constitutiva endotelial de la enzima (eNOS)32,44 y aparece el NO, tanto en situaciones de isquemia normotérmica34,43,45,46 como de la hipotermia relacionada con el trasplante hepático47-50. En esta situación se ha comprobado una mejoría en la oxigenación tisular y en la microcirculación del hígado44. Por otra parte, el PI también se ha mostrado eficaz para inhibir la producción de las endotelinas, hecho que también ayuda a la mejoría de la microcirculación32.
Que no se haya detectado la forma inducible de la enzima (iNOS) en estas circunstancias y que no se demuestre su presencia hasta varias horas después parecen indicar que la iNOS podría participar en la fase tardía del PI, situación que puede adquirir especial relevancia en el trasplante hepático51.
Papel de la adenosina
Tal como se ha comentado, la generación de NO en el PI se produce por la liberación de adenosina (fig. 3). Hoy se sabe que esta adenosina activa sólo los receptores de adenosina A243,52. Este hecho se puso de manifiesto cuando se demostró que los efectos protectores del PI desaparecían al administrar antagonistas selectivos de los receptores de adenosina A2, mientras se mantenían cuando se administraba antagonistas de los receptores de adenosina A143. La ventana de efectividad del PI está determinada por 2 factores: una concentración de adenosina lo suficientemente grande para inducir la generación de NO mediante la activación de los receptores de adenosina A2, junto con una baja concentración de xantina para evitar sus efectos perjudiciales45.
Vías de señalización molecular
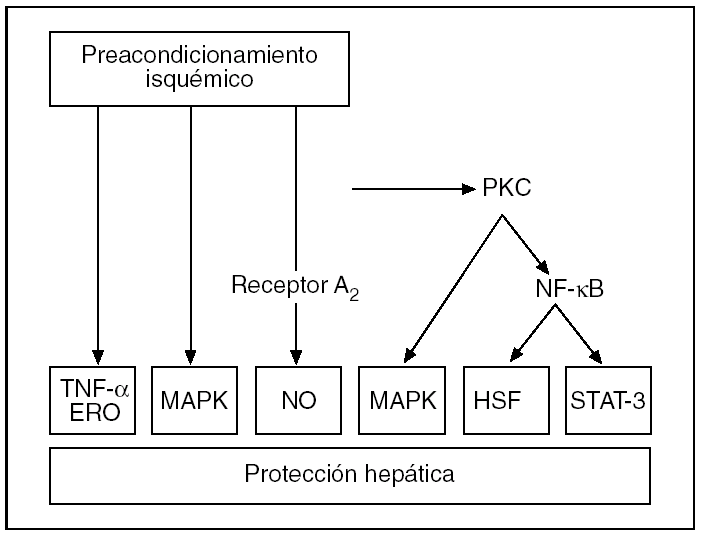
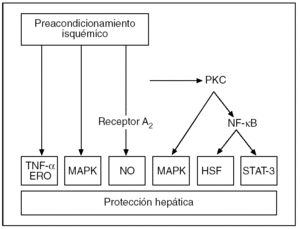
La activación de los receptores de adenosina A243 estimula la actividad de varias cinasas intracelulares, tales como la proteincinasa C (PKC), la proteincinasa de activación mitogénica (MAPK) y su variante MAPK p383,53,54 (fig. 4). Este hecho se ha demostrado recientemente en modelos de PI hepático54 y se ha podido establecer que de su activación depende la fosforilación de moléculas efectoras como las tirosincinasas55 y las MAPK, incluida la MAPK p383,53. Todo ello conlleva un aumento de la tolerancia de los hepatocitos y las células endoteliales a la lesión isquémica.
Fig. 4. Representación esquemática de las vías de señalización por las que el preacondicionamiento isquémico confiere protección contra la lesión por isquemia-reperfusión hepática. ERD: especies reactivas de oxígeno; HSF: factores de transcripción de choque térmico; MAPK: proteincinasa de activación mitogénica; NF-κB: factor de necrosis kappa B; PKC: proteincinasa de activación mitogénica; STAT-3: activador de la transcripción 3.
Tras la activación de la PKC, se puede inducir otros factores de transcripción, como el factor de necrosis kappa B (NF-κB), que serían la causa principal de los efectos protectores de la fase tardía del PI56,57..Estos factores de transcripción modulan la expresión de determinados genes y dan lugar a la síntesis de proteínas como las del shock térmico (HSP) que se han propuesto como causa del efecto protector del PI31. En el hígado, el PI se asocia a la síntesis de varias formas inducibles de HSP: la HSP70, HSP72 y HSP73 y de la hemooxigenasa (HO-1/HSP32)31,58,59. La inducción de las HSP reduce la unión nuclear de factores de transcripción proinflamatorios e incrementa la capacidad antioxidante de las células60,61. De este modo se contribuye a la disminución de la formación de factor de necrosis tumoral alfa (TNF-α) y la atenuación de la respuesta inflamatoria en los hígados preacondicionados62,63. También se ha propuesto que el PI podría disminuir la transcripción de genes, como los c-fos y c-jun, implicados en el desarrollo de la LIR hepática, y que la activación del NF-κB podría inducir inducir la activación del traductor de señales y activador de la transcripción 3 (STAT-3), implicado en la hepatoprotección y la proliferación celular31,53,57,64-67.
El papel del NF-κB en los beneficios del PI es contradictorio. Mientras Funaki et al68 demuestran que los efectos del PI están relacionados con la inhibición de la activación del NF-κB, otros autores señalan lo contrario, es decir, defienden que se deben a su activación15,56. Una explicación a este hecho aparentemente contradictorio es la utilización de diferentes modelos experimentales que pueden llevar a conclusiones contradictorias.
Además de todas estas vías de señalización celular, algunos trabajos recientes indican que el PI puede inducir la liberación de una pequeña cantidad de ERO69 y de TNF-α70 que también podrían contribuir a su efecto protector.
Influencia en el estrés oxidativo
El PI es una estrategia muy efectiva para prevenir el estrés oxidativo que la LIR conlleva, tanto en condiciones normotérmicas71,72 como en el trasplante hepático47,48. En ambos casos, su acción incide en el sistema xantina-oxidasa (XOD)/xantina-deshidrogenasa (XDH), que es, sin duda, la fuente principal de ERO que se generan en el proceso de isquemia-reperfusión hepática. Así pues, por una parte limita la acumulación de xantina y, por otra, reduce la conversión de la XDH a XOD durante la isquemia48,71. Su efecto protector contra el daño inducido por las ERO probablemente sea más efectivo que el de otras terapias farmacológicas basadas en la administración de antioxidantes, cuyas dosis para que sean realmente efectivas pueden presentar efectos colaterales adversos20.
También se ha propuesto que el PI ejerce una acción protectora adicional preservando el estado redox mitocondrial73. En este sentido, la combinación del PI con la administración de fármacos antioxidantes que actúen directamente en la mitocondria podría ofrecer nuevas posibilidades terapéuticas para preservar el hígado de la LIR.
Preservación del metabolismo energético
El PI preserva el metabolismo energético durante la isquemia74 reduciendo el consumo de ATP y la acumulación de lactato. Este efecto está mediado por un aumento de la actividad de la MAPK que ocurre durante el PI y es independiente del NO75.
Acumulación de neutrófilos y alteraciones de la microcirculación
La capacidad del PI para modular la acumulación de neutrófilos y las alteraciones de la microcirculación ha sido puesta de manifiesto por varios autores46,73,76,77, tanto en el ámbito de la isquemia normotérmica73,77,78 como de la hipotermia54,55. Se ha propuesto que el PI actuaría mediante la liberación de NO, cuyo efecto vasodilatador inhibiría la vasoconstricción inducida por las células estrelladas y los mediadores inflamatorios32,46,74.
Aunque numerosos estudios demuestran el efecto beneficioso del PI en la acumulación de neutrófilos después de la isquemia-reperfusión hepática46,73,76,77, los mecanismos por los que el PI modula las interacciones entre los leucocitos hepáticos y las células endoteliales están todavía por definir. Datos experimentales en modelos de isquemia normotérmica apuntan a que el PI reduce la capacidad adhesiva de los leucocitos en los sinusoides y las vénulas postsinusoidales76,79,80. Sin embargo, hay evidencia de que la expresión de las moléculas de adhesión no se modifican en el hígado después del PI68,81. Algunos autores han señalado que la gravedad de la lesión vascular que se produce tras la reperfusión eliminaría o al menos reduciría de forma considerable la función barrera del endotelio sinusoidal y que, de esta forma, los neutrófilos accederían libremente al hepatocito4. Aun así, se podría especular con que el PI reduce la acumulación de neutrófilos al preservar en algún grado la integridad del endotelio. Es evidente que en este apartado se necesita de estudios más profundos que permitan aclarar los mecanismos por los que el PI reduce la acumulación de neutrófilos tras la LIR, sobre todo para diseñar nuevas estrategias terapéuticas.
Protección tardía en órganos extrahepáticos
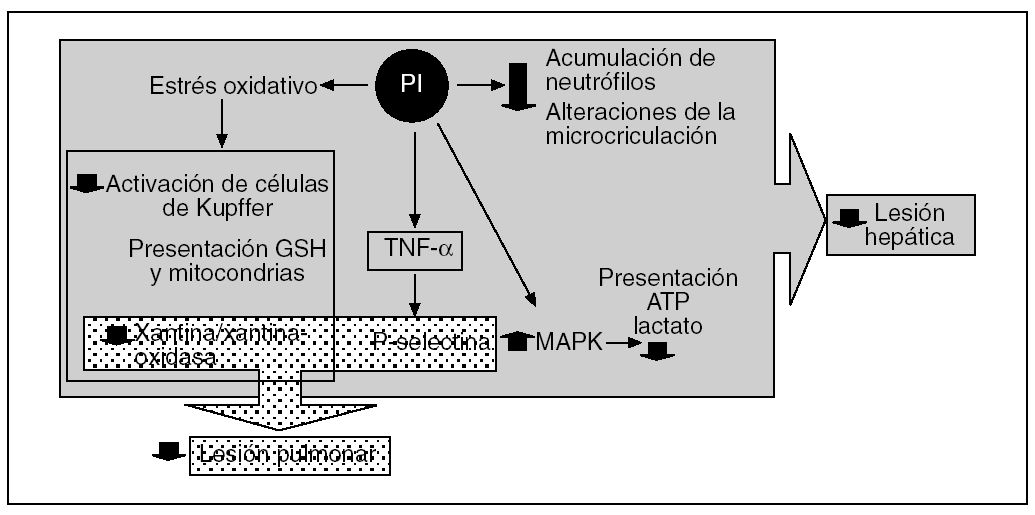
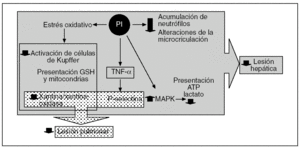
Los efectos beneficiosos del PI no se limitan sólo al hígado, ya que se ha demostrado que también reduce la LIR en órganos extrahepáticos como el pulmón47,48,81-83. Esta protección remota que ocurre tanto en modelos experimentales de isquemia normotérmica81,82 como de trasplante hepático47,48 se debe a que el NO producido durante el período de PI inhibe la producción, a partir de las células de Kupffer, del TNF-α43,81. Ello conlleva una disminución de la concentración de esta citocina proinflamatoria en el torrente sanguíneo y una menor inflamación pulmonar, que conlleva una reducción de la expresión de P-selectina y de la adhesión e infiltración de neutrófilos81. En el efecto protector del PI en los pulmones también se debe tener en cuenta la modulación que se ejerce en el sistema xantina/XOD al prevenir la generación de ERO48,71 (fig. 5).
Fig. 5. Representación esquemática de los efectos del preacondicionamiento isquémico en la lesión por isquemia-reperfusión hepática y pulmonar. ATP: adenosintrifosfato; MARK: proteincinasa de activación mitogénica; TNF-α: factor de necrosis tumoral alfa.
De forma paradójica, algunos autores han observado que la administración de TNF-α en pequeñas dosis simula los efectos del PI70,84, lo que indica que, en pequeñas concentraciones, el TNF-α podría mediar algunos de los efectos del PI.
El preacondicionamiento isquémico y la esteatosis
El depósito de grasa en el citoplasma de los hepatocitos es un hecho común en la población occidental. La cirugía hepática, tanto en situaciones de normotermia (resección) como de hipotermia (trasplante), en los órganos con grados de esteatosis importantes va seguida de elevadas tasas de morbimortalidad85. Varios estudios han demostrado que el PI reduce la vulnerabilidad del hígado esteatósico a la LIR86,87. El PI, por una parte, preserva el metabolismo energético en los hígados esteatósicos y, por otra, a través de la generación de NO, aumenta la tolerancia del hígado esteatósico a la LIR, pues reduce el estrés oxidativo y la acumulación de neutrófilos86,87, las alteraciones en la microcirculación88, estimula la actividad de varias cinasas intracelulares89 y modula la liberación de citocinas, tales como la interleucina (IL) 10 y la IL-1β90. A diferencia de lo que ocurre en el hígado normal, el TNF-α no parece estar implicado en los mecanismos de protección del PI.
Del mismo modo, el PI también ha demostrado su utilidad en modelos experimentales de trasplante ortotópico de hígado con injerto esteatósico47, pues protege al injerto vulnerable al LIR. La modulación del sistema xantina/XOD redujo el fallo hepático y pulmonar relacionado con el trasplante. Estos resultados marcan nuevas expectativas en la aplicación del PI como una estrategia quirúrgica idónea para el aprovechamiento de injertos "subóptimos", como los hígados grasos, que actualmente se descarta para trasplante.
Implicaciones clínicas del preacondicionamiento isquémico
En este contexto, no es de extrañar que el PI haya surgido como una buena estrategia quirúrgica para reducir la LIR, y en los últimos años se ha publicado algunos trabajos de revisión2,6,7. A Clavien et al91 les cabe el honor de ser los primeros autores que demostraron la utilidad del PI en una serie de 24 pacientes sometidos a hepatectomía91. En los pacientes a los que se aplicó el PI (10 min de isquemia, seguido de 10 min de reperfusión) antes de la oclusión hepática, se observó una disminución significativa de la concentración plasmática de ALT en comparación con el grupo de pacientes no preacondicionados. También se observó una marcada reducción de la muerte celular por apoptosis de las células endoteliales hepáticas91. Tres años más tarde, en 2003, ese mismo grupo de investigación realizó un estudio más extenso que confirmó que la protección inducida por el PI fue mayor en pacientes con edad menor de 60 años y en hígados que presentaban una esteatosis superior al 25%92. Un aspecto importante es que no se observaron diferencias en la morbimortalidad entre el grupo sometido a PI y el que no92.
Otros trabajos posteriores han confirmado la utilidad del PI en las resecciones hepáticas. Chouker et al93 han puesto de manifiesto que, en las condiciones empleadas por Clavien et al21,22, el PI mejora además la estabilidad hemodinámica tras la reperfusión. Esos mismos autores, en otro estudio, han demostrado que el PI reduce la activación de neutrófilos asociada a la maniobra de Pringle94. Los beneficios del PI también se conservan cuando son precisos tiempos de isquemia prolongados (superiores a los 30 min)95 o cuando se aplica en hígados cirróticos96.
En el ámbito del trasplante se tiene pocos datos, pero todos ellos apuntan en sentido positivo. Koneru et al97 realizaron un pequeño estudio prospectivo y aleatorizado para demostrar la eficacia y la seguridad del PI. Azoulay et al98, en un estudio con algunas limitaciones, concluyeron que el PI aumenta la tolerancia del injerto a la isquemia, aunque tiene efectos adversos en la recuperación de la función hepática (fallo primario del injerto). El trabajo de Jassem et al99 demuestra que el PI reduce el daño hepatocelular, la producción de lactatos y la estancia en cuidados intensivos, sobre todo porque disminuye las complicaciones respiratorias. Todas estas aportaciones concluyen que se precisa de más estudios prospectivos y aleatorizados para obtener una respuesta definitiva. Probablemente el estudio definitivo sea una tesis doctoral muy reciente de un grupo español, que demuestra que el PI, además de atenuar la LIR por reducción de la lesión endotelial y hepatocitaria o el grado de apoptosis, tiene claras ventajas clínicas como una reducción en el índice de fallor primario del injerto y, por ende, la necesidad de retrasplante urgente, y en la tasa de reintervenciones por hemorragia intraabdominal100.
También es reciente el interés acerca del posible papel del PI en la regeneración hepática. El hígado es el único órgano capaz de regenerarse y conseguir una función hepática similar a la inicial después de una resección, que en la mayoría de las ocasiones se realiza en condiciones de isquemia-reperfusión (oclusión continua o intermitente del hilio vascular). En ese contexto no es de extrañar que, dados los resultados obtenidos hasta ahora con el PI como mecanismo de prevención de la LIR, haya surgido la hipótesis de su posible efecto beneficioso también en la fase de regeneración. Hoy se sabe que la regeneración hepática está controlada por una compleja interrelación del metabolismo celular, las citocinas y los factores de crecimiento101, elementos todos ellos modulados por el PI. Así, por una parte, varios trabajos han demostrado que la LIR reduce la síntesis de ADN y la capacidad de recuperar el peso del órgano después de una hepatectomía102-105, pero, por otra, las experiencias con el PI han sido contradictorias. Mientras algunos trabajos indican su posible efecto beneficioso106, otros lo ponen en duda107.
Conclusiones
Los datos experimentales y la experiencia clínica inicial hacen suponer que el PI es un estrategia útil para mejorar la tolerancia del hígado a la LIR, lo que permitiría ampliar las indicaciones de resección hepática y aumentar el número de órganos que se puede trasplantar, en especial los considerados subóptimos por su grado de esteatosis. Sin embargo, todavía hay algunas lagunas en el conocimiento de su mecanismo de acción y determinados aspectos clínicos, por lo que todavía son necesarios más estudios, clínicos y experimentales, que permitan aclarar estos aspectos confusos.
Este trabajo está financiado por las ayudas 03/02 (Redes temáticas de Investigación Cooperativa de Centros), 03/1174 y 04/1794 (Fondo de Investigaciones Sanitarias).
Correspondencia: Dr. L. Grande.
Servicio de Cirugía. Hospital del Mar.
Pg. Marítim, 25-29. 08003 Barcelona. España.
Correo electrónico: lgrande@imas.imim.es
Manuscrito recibido el 29-6-2006 y aceptado el 7-7-2006.