Introducción
La historia del trasplante de islotes pancreáticos (TIP) ha ido escribiéndose de manera intermitente a medida que se superaban los numerosos problemas para su aplicación clínica real. Estos problemas siempre han surgido conforme se trataba de llevar a cabo el procedimiento en humanos, sin que muchas veces fuesen previsibles. Este hecho, junto a la lenta progresión de sus resultados, confiere al TIP un carácter de eterno aspirante a convertirse en la opción principal para los pacientes insulinopénicos, rodeado de un halo de incertidumbre y una sensación de promesa incumplida.
Gran parte de estos problemas están hoy en el camino hacia su resolución, en gran parte por un mejor conocimiento de la fisiopatología de los fenómenos de rechazo, los avances en la obtención y la preservación y una cuidada selección de los receptores.
El TIP se ha demostrado eficaz en situaciones clínicas diferentes de la diabetes mellitus (DM), como el autotrasplante tras pancreatectomía total1, si bien el TIP es un procedimiento aplicable fundamentalmente a pacientes con DM1.
Hoy los esfuerzos para mejorar los resultados del TIP son cada vez mayores, si bien cada vez se ven involucradas más áreas de conocimiento médico. En el presente artículo se trata de exponer las principales novedades en la realización del TIP, así como explicar las diversas áreas estratégicas implicadas y los problemas pendientes de cada una de ellas.
El trasplante de islotes pancreáticos como opción terapéutica
La terapia intensiva con insulina es el tratamiento más empleado en la DM; sin embargo, su eficacia para prevenir las complicaciones a largo plazo no ha sido demostrada hasta hace relativamente pocos años y cuenta con la contrapartida de ocasionar cuadros de hipoglucemia severa2. Frente a esta posibilidad terapéutica, rápidamente surgió la idea de llevar a cabo una reposición más fisiológica de la insulina a través de la recuperación de islotes de Langerhans mediante trasplante. En el momento actual es posible afirmar que los islotes pancreáticos trasplantados pueden por sí mismos tanto restablecer el control metabólico perdido como prevenir las complicaciones derivadas de la hiperglucemia mantenida. Frente al trasplante de páncreas tiene como ventajas ser una técnica mínimamente invasiva, con escasísima morbilidad y prácticamente nula mortalidad, y un coste económico previsiblemente menor.
Las indicaciones para el TIP son, según la declaración de la American Diabetes Association, en principio, las mismas que para el trasplante de páncreas sólido2, tanto aislado (historia de frecuentes complicaciones metabólicas agudas; problemas clínicos o emocionales con la insulina exógena, fracaso del tratamiento médico) como en los casos en que se realiza junto con un trasplante renal (indicación preexistente de trasplante renal, y riesgo quirúrgico no excesivo).
Sin embargo, en la práctica, el TIP se está llevando a cabo en un determinado grupo de pacientes diabéticos, de modo que las "indicaciones oficiosas" son:
1. DM1 de más de 5 años evolución.
2. Mal control glucémico.
3. Péptido C < 0,48 ng/ml.
4. Hipoglucemias severas.
5. Diabetes "lábil".
6. Que no haya contraindicación para el trasplante y la inmunosupresión.
Tanto la labilidad como las hipoglucemias severas inadvertidas constituyen las principales indicaciones para plantear un TIP a un paciente diabético3. Estas dos circunstancias son las que mejor se corrigen con el TIP y, probablemente, las que más contribuyen a mejorar la calidad de vida de los pacientes trasplantados. Se define como labilidad la presencia de valores erráticos en la concentración de glucosa plasmática que llegan a interferir con las actividades de la vida diaria. Para su cuantificación se ha ideado un índice de labilidad que refleja la cuantía y el número de las variaciones en la glucemia a lo largo de una semana. De este modo, un diabético regularmente controlado presenta valores cercanos a 220 mmol2/h/semana, y se eleva por encima de 450 en pacientes con labilidad.
Siempre es conveniente considerar que el TIP puede mejorar algunas de las complicaciones a largo plazo de la DM; no obstante, que las haya puede influir en su efectividad. La presencia de retinopatía severa, aunque no es una contraindicación en sí misma, puede empeorar transitoriamente en las primeras semanas postrasplante. La cardiopatía isquémica, que puede ser contraindicación para llevar a cabo un trasplante de órgano sólido por el alto riesgo quirúrgico, no es impedimento para realizar un TIP siempre que esté estabilizada y se suspenda la antiagregación una semana antes. La nefrotoxicidad de algunos de los inmunosupresores debe hacer diseñar un régimen farmacológico específico para los receptores con la función renal ya dañada. Asimismo, una gastroparesia por disautonomía puede condicionar la asimilación de los inmunosupresores, en especial si hay vómitos o ralentización evidente del tránsito.
Objetivos. Definición de éxito en el trasplante de islotes pancreáticos
Durante muchos años, el objetivo principal del TIP fue prevenir las complicaciones de la DM a largo plazo, y la independencia de la insulina era prácticamente anecdótica. Hoy podemos afirmar que el correcto funcionamiento de los islotes trasplantados es la norma y que lo anecdótico es la independencia de la insulina con una única infusión de islotes.
Es difícil definir exactamente qué se entiende como éxito en el TIP4. En primer lugar, el candidato ideal para el TIP universalmente aceptado es aquel que tiene episodios recurrentes de hipoglucemia con clínica inespecífica (reconocimiento tardío de los síntomas) y un mal control metabólico. En nuestro contexto, esta situación se conoce como diabetes lábil. Los primeros dos problemas son mejorables con insulinoterapia intensiva, pero las cifras de glucohemoglobina empeoran a la larga, con lo que el control metabólico es peor.
Todo depende de los criterios de excelencia que se quiera emplear. Si se considera éxito la independencia de la insulina junto con valores para la glucemia preprandial y posprandial normales, ausencia de hipoglucemias, mejora en el reconocimiento de los síntomas y cifras de glucohemoglobina permanentemente en rangos normales, el TIP está todavía lejos de alcanzarlo... como lo están el trasplante de órgano sólido y la propia insulinoterapia intensiva.
Si consideramos éxito la normalización de las cifras de glucohemoglobina, la reducción del número de episodios de hipoglucemia y el reconocimiento rápido de sus síntomas, junto con una mejor calidad de vida, el TIP lo ha alcanzado. De hecho, para algunos expertos es ya la opción por excelencia en el tratamiento de la DM1 en combinación con antidiabéticos orales, que contribuirían a un control metabólico apropiado a largo plazo5.
Resultados del trasplante de islotes pancreáticos
El principal inconveniente de la inmunosupresión sobre los islotes ha sido fundamentalmente los efectos diabetógenos de la mayoría de los fármacos empleados. Esto explica en parte los malos resultados en cuanto a independencia de la insulina, a pesar del relativamente elevado porcentaje de función insular. Según datos del Islet Transplant Registry internacional (ITR), entre 1990 y 1997 los resultados en trasplantes de islotes asociados a trasplante renal consiguieron función insular (péptido C > 0,5 ng/ml) durante períodos > 30 días en el 68% de los casos, e independencia de la insulina en el 14%. A pesar de estos resultados aparentemente desalentadores, cada vez estaba más claro que el trasplante de islotes puede beneficiar a los pacientes diabéticos. La funcionalidad parcial del injerto tras el trasplante era capaz de normalizar el metabolismo de lípidos y proteínas en estos pacientes6, se dedujo entonces la gran importancia de los islotes para el control metabólico sistémico, ya que su recuperación podría reducir el impacto de las complicaciones tardías de la diabetes. Es así que en 2000 el grupo de Edmonton, liderado por James Shapiro, publica el estudio que cambiaría las perspectivas del trasplante de islotes al conseguir tasas de insulinoindependencia superiores al 70% tras 2 años de seguimiento empleando un protocolo sin esteroides, basado en el uso de sirolimus (rapamicina) y tacrolimus (FK-506) a bajas dosis, junto con anticuerpos monoclonales contra el receptor de interleucina 2, con infusión casi inmediata de islotes procedentes de 2 o más donantes para conseguir un número de islotes óptimo7. Los escasos efectos indeseables de los nuevos protocolos de inmunosupresión hacen factible el trasplante de islotes en pacientes en fases "precoces" de la enfermedad, cuando no han aparecido complicaciones microvasculares.
Hoy en día los resultados son cada vez más esperanzadores, y se establecen casi como obligatorios resultados que se aproximen al 95% de injertos funcionantes y un 80% de insulinoindependencias mantenidas más allá de los primeros 2 años. De hecho, ya se están poniendo en marcha estudios comparativos entre el TIP y la insulinoterapia intensiva8 con vistas a establecer la verdadera valía de este procedimiento para establecerlo como primera alternativa terapéutica en la DM1.
Resultados post-Edmonton
La generalización del uso del Protocolo de Edmonton no ha conseguido terminar con los problemas del TIP, en parte porque los resultados en su aplicación dependen en gran medida de la experiencia del centro. Una de las series más largas publicadas hasta la fecha recoge 30 casos de TIP9, en los que las cifras de glucohemoglobina fueron sensiblemente más bajas (6,1%), las tasas de insulinoindependencia a los 2 años superaron el 70% y más del 85% de los pacientes dejaron de sufrir episodios de hipoglucemia. Sin embargo, también se reflejaron las diversas complicaciones asociadas: hemorragia pospunción, trombosis portal parcial, hematomas subglissonianos, transaminitis temporal, hipercolesterolemia, elevación de la creatinina y proteinuria si ya había insuficiencia renal, sin mortalidad ni complicaciones infecciosas asociadas. Es necesario recalcar que, aunque variadas, estas complicaciones se registraron de modo aislado (salvo la hemorragia pospunción).
En España se han llevado a cabo al menos 11 TIP. Los 8 primeros fueron llevados a cabo por el grupo del Hospital Clínico de Madrid durante la época previa al Protocolo de Edmonton, con resultados superponibles a los publicados por otros grupos (Miami) en aquellas fechas. Es decir, no se alcanzó insulinoindependencia pero sí mejoró claramente el control metabólico del 62,5% de los receptores. Más tarde fue en el Hospital Carlos Haya donde se llevaron a cabo 2 implantes más. Para éstos se recibieron más de 30 páncreas, de los que 19 fueron viables y únicamente 4, óptimos para el aislamiento. Los 2 pacientes experimentaron un aumento en los niveles de péptido C significativo, así como descenso de los valores de glucohemoglobina, por debajo del 7%, sin experimentar episodios de hipoglucemia inadvertida. Aunque no se logró la insulinoindependencia, las dosis de insulina exógena descendieron muy notablemente hasta hacerse ocasionales en uno de los receptores10,11.
Al igual que con la vía transparietohepática en los años noventa, nuestro país ha sido pionero en la introducción de la vía transyugular para la canalización portal12 por parte del grupo del Hospital Clínic de Barcelona.
En el mundo, el TIP es al día de hoy una realidad clínica, si bien tiene que superar todavía importantes problemas. Los resultados reales del TIP nos indican que todavía hay muchos aspectos que mejorar. Tomando como ejemplo los correspondientes al grupo de Edmonton, a los 5 años, la tasa de insulinoindependencia pasa de un 70 a un 10%; el 80% de los pacientes necesitan más de un páncreas, y se emplean infusiones de 12.000 EqI/kg, de media. Más del 80% de los receptores tienen péptido C detectable a los 5 años, con una tasa media de glucohemoglobina del 6,4%. No se ha observado un aumento de la tasa de resistencia a la insulina, mejorando notablemente el control de la glucemia, ya que ningún paciente trasplantado ha vuelto a tener episodios de hipoglucemia severa. La morbilidad total asociada al procedimiento es del 15% (hemorragias por la punción hepática y trombosis portales parciales), y es nula la mortalidad. Sí se ha observado un incremento en el uso de antihipertensivos y estatinas, ya que el control de la presión arterial y el perfil lipídico no mejoraron sustancialmente13. En el grupo de Miami, que emplea por lo general islotes cultivados, los resultados han sido algo mejores, con un 88% de insulinoindependencias iniciales, que se mantuvieron sin necesidad de nuevas infusiones de islotes en el 43% del total de los casos durante 3 años14.
Recientemente han sido publicados los resultados del primer ensayo multicéntrico utilizando el Protocolo de Edmonton16. En él han participado 9 instituciones y se eligió a 36 pacientes de entre 2.000 candidatos. Los resultados iniciales reflejaron que el 72% de los implantes fueron funcionantes y se alcanzó insulinoindependencia en el 44% de los casos. Tras más de 2 años de seguimiento, el 67% de los TIP mantiene su funcionalidad y la tasa de insulinoindependencia baja hasta el 17% (muy en relación con las cifras previas de autoanticuerpos). En todos los pacientes con implante funcionante desaparecieron los episodios de hipoglucemia severa, así como mejoró claramente el perfil metabólico. Es necesario señalar que ese estudio se ha llevado a cabo utilizando la pauta de inmunosupresión descrita en 2000 por Shapiro et al, sin introducir las nuevas técnicas de preservación y aislamiento ni los protocolos de preacondicionamiento inmunológico que han contribuido notablemente a mejorar los resultados del TIP.
De cara al futuro, el trasplante de islotes debe comenzar a ser evaluado mediante estudios controlados4. Si bien tanto las continuas mejoras en el tratamiento médico (que dificultan el uso de datos clínicos pasados) como la imposibilidad de aleatorización suponen inconvenientes metodológicos importantes. Como propone Robertson, el prototipo de estudio para la evaluación del TIP como tratamiento de la DM1 sería del tipo caso-control, siendo los controles los pacientes que pueden ser receptores pero que no aceptan el tratamiento. Los subgrupos podrían distribuirse en función de las complicaciones surgidas del procedimiento a corto y largo plazo así como en función del tipo de trasplante (TIP o TIP + riñón).
Normativa vigente en España
Actualmente son varios los grupos interesados en realizar TIP clínico en España, sin embargo hay múltiples dificultades logísticas que impiden el pleno desarrollo de un verdadero programa de TIP en nuestro país.
En la actualidad existen 3 directivas de la Unión Europea (2001/20 CE, 2003/63 CE y 2004/23 CE) por las que se regula la "terapia celular somática" en las que quedaría encuadrado el TIP al considerarse a éste, de un modo cuestionable, como terapia celular. De este modo, el TIP adquiere la consideración de "medicamento", por lo que es necesario poner en marcha un ensayo clínico con la conformidad de la Agencia Española del Medicamento y cumplir unos estándares de calidad muy elevados (normas GMP) en lo que a equipamiento y personal se refiere16.
Por la necesaria coordinación en la realización de las distintas modalidades de trasplante pancreático y renal, por iniciativa de la ONT se constituyó a finales de 2004 un grupo de trabajo que elaboró un primer documento de consenso52 en el que se acordó limitar el número de centros que procesen islotes, de acuerdo con su experiencia, actividad mínima anual y número de habitantes (1 centro por cada 8-10 millones de habitantes). Sin embargo, la decisión del número de centros que llevarán a cabo implantes lo decidirá cada comunidad autónoma. Además, la opción del TIP queda restringida a los páncreas donados que no se vaya a destinar a trasplante de órgano sólido.
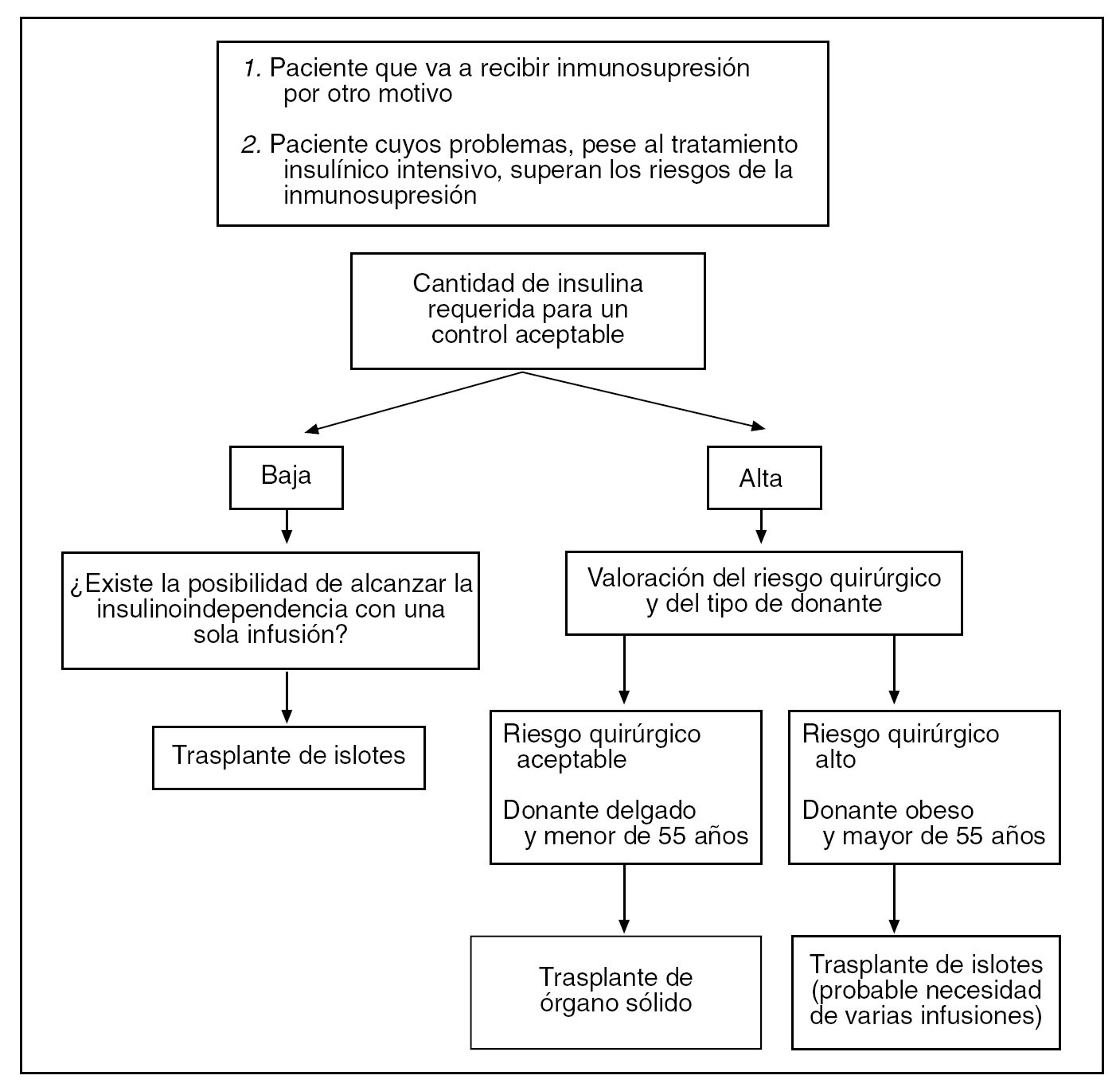
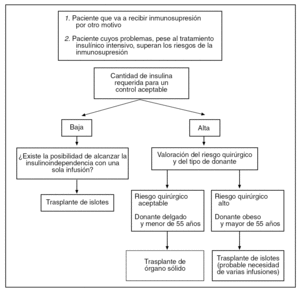
¿Cómo decidir en qué tipo de trasplante emplear el páncreas donado?17 (fig. 1)
Fig. 1. Insuficiencia pancreática exocrina. Adaptado de Kandaswamy et al17.
No está muy lejano el momento en que un coordinador de trasplantes se plantee qué petición realizar para un paciente con insuficiencia pancreática endocrina de su lista de espera. La evidente escasez de donantes hace imperiosa la ya citada priorización. Sin embargo, los constantes avances en el TIP van haciendo reconsiderar la manera de asignar los páncreas donados a cada receptor en función de una serie de características bien definidas que hacen presuponer que un páncreas ofrecerá un mejor rendimiento en un TIP o en un trasplante de páncreas sólido. Curiosamente, dichas características son casi complementarias. El páncreas que es óptimo para el TIP es probablemente una mala opción para órgano sólido.
Así, el primer factor a tener en cuenta es la necesidad de insulina. Es bien conocido que los requerimientos de insulina exógena corresponden a la "producción de la masa total de islotes" que necesita el receptor para controlarse. Así, en pacientes con una necesidad de insulina menor, el trasplante de islotes (que ofrece un número de islotes total inferior) podría ser la opción. Por otro lado, los donantes obesos aportan más islotes por páncreas, sin embargo surgen más complicaciones quirúrgicas al emplear esta fuente de células beta. Los páncreas obtenidos de donantes mayores de 55 años tienen muchas veces un número de islotes aceptable, si bien su vascularización macroscópica y microscópica es peor, con lo que serían más adecuados para el TIP.
Es evidente que en pacientes cuyo riesgo quirúrgico sea muy elevado es preferible emplear el TIP, ya que el número de complicaciones asociadas al procedimiento es significativamente menor.
Finalmente, la escasez de órganos hace imperioso evitar el uso de varios páncreas para un mismo receptor siempre que sea posible; por eso es cada vez más frecuente en países anglosajones que se prefiera destinar islotes para primeras infusiones en candidatos ideales que en segundas infusiones en pacientes con grandes requerimientos insulínicos.
Trasplante de islotes pancreáticos y prevención de las complicaciones de la diabetes mellitus a largo plazo
La prevención, estabilización y en algunos casos reversión de las complicaciones derivadas tanto de la afección microvascular como macrovascular en la DM es uno de los objetivos primordiales del TIP. En la actualidad constituye una de sus principales ventajas ya que, en definitiva, mejora la esperanza de vida de los receptores.
Cuando el TIP es funcionante, los valores de glucohemoglobina se estabilizan en el rango normal o inmediatamente por encima del límite de la normalidad. Esta estabilización no es más que un reflejo de un mejor control metabólico.
En series recientemente publicadas el TIP ha demostrado mejorar las complicaciones de la diabetes a largo plazo. En el caso de la retinopatía, la gran mayoría de los pacientes logra estabilizarla con mejoría en un pequeño porcentaje de ellos, si bien se ha descrito un empeoramento inicial en algunos de los pacientes; los resultados son más discretos para la neuropatía periférica, donde aproximadamente la mitad de los receptores experimentan una mejoría clínica evidente18; no obstante, sí que se han comunicados resultados más alentadores en lo que a la disautonomía se refiere19.
Al comparar a pacientes con trasplante renal aislado con aquellos que además recibieron un TIP funcionante, se observa una mejora en parámetros de la función cardiovascular como la fracción de eyección, alteraciones electrocardiográficas o en el transporte iónico de membrana20. En ese mismo grupo de pacientes fue mayor la supervivencia total y disminuyeron las muertes por enfermedad cardiovascular. Es más, se tiene constancia de que el TIP mejora los cambios histológicos de la afección macrovascular, así como aumenta la liberación local de vasodilatadores y disminuye la de agentes protrombóticos21.
La evaluación del TIP en cuanto al desarrollo de complicaciones agudas es también favorable en la mayoría de las series; mejoran el número de hipoglucemias y el índice de labilidad y disminuye el número de ingresos13. De modo aislado se ha indicado una mejoría en el reconocimiento de los episodios de hipoglucemias, si bien este hecho debe ser interpretado con precaución todavía.
Con el paso del tiempo, el seguimiento a largo plazo de los pacientes trasplantados indicará el valor real del TIP en cuanto a la aparición de complicaciones derivadas de la evolución de la DM, pero además deberá demostrar si es capaz de evitar que se desarrollen, pues cada vez más se trasplantan islotes a pacientes sin complicaciones establecidas.
Problemas actuales/persistentes
La generalización del TIP todavía debe superar tres problemas: la desproporción entre el número de posibles receptores y el número de donantes, el número de islotes viables obtenidos de cada páncreas donado y la superación de los problemas inmunitarios.
Escasez de donantes. Nuevas fuentes de islotes
Para poder competir realmente con el trasplante de órgano sólido, el TIP debe conseguir obtener insulinoindependencias con infusiones procedentes de un solo donante. Para ello la selección de donantes y receptores, las mejoras en la obtención de islotes y una cuidadosa selección de la inmunosupresión han de ser los principales factores que tener en cuenta.
Evidentemente, una vez que el número de islotes obtenido de un solo donante sea óptimo habitualmente, será necesario aumentar el número de donantes. Para ello deberán optimizarse dos fuentes hasta ahora poco empleadas: donantes a corazón parado y donantes vivos.
Donantes a corazón parado
La experiencia en el TIP utilizando donantes en parada es muy escasa. Si bien el primer grupo en estudiar las características de los islotes procedentes de donantes en parada fue el de la Universidad de Leicester (Reino Unido) en 200022, la primera experiencia clínica se llevó a cabo en Philadelphia en 200323. En el estudio británico se demostró que tanto la cantidad de islotes como su función son equiparables entre aquellos que proceden de donantes en asistolia y los que proceden de donantes en muerte cerebral. Además el tiempo de isquemia caliente, determinante en los resultados de otros trasplantes a corazón parado, no tuvo influencia en la cantidad de islotes aislados. El grupo estadounidense comparó islotes procedentes de donantes en parada y donantes en muerte encefálica con características similares. El procedimiento para el aislamiento fue el mismo, obteniéndose un número de islotes muy similar. La respuesta funcional de los islotes procedentes de donantes en asistolia fue óptima. Trasplantando islotes tanto de donantes en parada como convencionales se restableció la normoglucemia en ratas diabéticas no obesas. Finalmente se llevó a cabo un trasplante en humanos, con resultados excelentes, ya que se obtuvo insulinoindependencia de varios meses de duración.
La experiencia clínica se amplió en 2005 con los 5 trasplantes llevados a cabo por el grupo de la Universidad de Kioto24. Con las variaciones al método habitual señaladas en la introducción de este trabajo, se disminuyeron los episodios de hipoglucemia y los requerimientos de insulina, y se mejoró el control glucémico en todos los pacientes.
Trasplante de islotes pancreáticos empleando donantes vivos
Uno de los dilemas que se le plantearán en un futuro inmediato al cirujano será la idoneidad de emplear donantes vivos para obtener islotes. A medida que el procedimiento va siendo más popular, crece el número de familiares de pacientes diabéticos, en especial padres, que se ofrecen como donantes. La posibilidad actual de realizar pancreatectomías distales (zona además con mayor densidad de islotes)25 mediante laparoscopia hace que ésta sea una opción viable con bastante menor morbilidad que, por ejemplo, en el trasplante hepático de donante vivo y con una tolerancia inmunológica previsiblemente mayor por tratarse muchas veces de donantes emparentados. A estas ventajas se añade el hecho de que el aislamiento de los islotes sería inmediato y se minimizaría el efecto de la isquemia26.
Esta opción está siendo desarrollada con gran fuerza en países con restricciones a la hora de emplear algunos tipos de donantes como Japón. Hasta ahora se ha llevado a cabo con éxito un TIP de donante viva que era la madre de la receptora. Se consiguió insulinoindependencia duradera en la receptora sin morbilidad añadida para la donante27,28.
Autotrasplante
Uno de los campos en los que cada vez se discute menos el papel del TIP es la reconstitución de la función endocrina tras pancreatectomías en el contexto de pancreatitis crónicas. La pancreatitis crónica acarrea no sólo una disfunción exocrina progresiva, sino además una insuficiencia insular que desemboca en insulinodependencia a largo plazo. Las diversas opciones quirúrgicas (operaciones derivativas y resecciones) ofrecen a menudo resultados tanto irregulares como desalentadores. Las intervenciones derivativas (Partington-Roschelle, Puestow) suelen conseguir un mejor control del dolor; sin embargo, las pancreatectomías además eliminan el tejido inflamado y a menudo fibrótico y pueden ofrecer la posibilidad de recuperar los islotes del propio paciente29.
Aunque el TIP en este caso no restablece la función exocrina y requiere de más masa insular de la que en un principio se pensó; ha demostrado que, en combinación con la pancreatectomía, puede reducir el dolor, disminuir el uso de analgésicos y mejorar el control glucémico incluso con funciones parciales30-32. Por otro lado, la práctica del TIP tras pancreatectomías por neoplasia está comenzando a aceptarse. En la mayoría de las series se trata de neoplasias benignas (quísticas, endocrinas, neuroendocrinas...) y de nuevo se comprueba que el perfil glucémico mejora incluso con funciones parciales33. Al comparar los resultados del autotrasplante en pancreatitis crónicas y tumores benignos, los resultados tanto en el aislamiento como en la función posterior de los islotes son mejores en el grupo de pancreatectomizados por tumores benignos34.
El autotrasplante de islotes en el contexto de neoplasias malignas se reduce a experiencias muy aisladas y su idoneidad es muy cuestionable. Se ha comunicado su realización tras fístulas post-Whipple35 no controlables o tras pancreatectomía total36. En el segundo caso la función insular fue muy buena e incluso se comprobó que la resección fue R0 y que los islotes aislados no portaban la mutación de K-ras observada en el tumor. Sin embargo, el paciente murió a los 2,5 años debido a una recidiva "local" sin metástasis hepáticas.
Identificación del mejor donante. Criterios de estandarización
Diversas variables han sido identificadas como factores determinantes en el rendimiento final del aislamiento de los islotes y del trasplante en sí. Clásicamente, la edad del donante, el tiempo de isquemia fría, el índice de masa corporal y el equipo extractor han sido algunos de los más citados37,38.
Tales factores han sido tenidos en cuenta para las diferentes guías clínicas de cada país. En el Documento de Consenso sobre el trasplante de páncreas e islotes de la ONT39, se señalan como condiciones ideales una edad comprendida entre 15 y 50 años, ausencia de pancreatitis, etilismo o diabetes, estabilidad hemodinámica previa relativa, IMC < 22, enzimas hepáticas, creatinina, amilasa y lipasa por debajo del doble de los valores normales y tiempo de isquemia total previa al aislamiento < 8 h.
Sin embargo, son muchos más los factores que pueden influir tanto en el rendimiento del aislamiento como en el resultado final del trasplante40. Así, en una reciente publicación41 el grupo de Edmonton ha señalado como principales variables para un rendimiento óptimo: edad comprendida entre 35 y 55 años, accidente cerebrovascular como causa de la muerte, tiempo de isquemia fría < 8 h y > 3, IMC entre 25 y 29,9, equipo extractor perteneciente a la misma institución que procesa el páncreas, estancia hospitalaria previa del donante < 4 días, amilasa > 200 UI/l y lipasa > 100 UI/l, bajas dosis de agentes vasopresores (dopamina 15 μg/kg/min, noradrenalina 20 μg/min y vasopresina 2 UI/h), normoglucemia y ausencia de insulinoterapia intensiva, ausencia de problemas sociales previos e historial médico sin reseña de hipertensión arterial, alcoholismo, transfusiones sanguíneas masivas, insuficiencia cardíaca o respiratoria terminal. De acuerdo con estos criterios, la Universidad de Alberta ha confeccionado un sistema de puntuación para cada donante. Lejos de haber reducido el número de páncreas a aislar, la aplicación de unos criterios selectivos condujo a tasas de aislamientos excelentes más altas, en parte porque se puede prever necesidades o problemas no habituales al manejar un páncreas que ya se sabe no óptimo. No sólo eso, la observación de este sistema permitió recuperar muchos páncreas que en condiciones habituales se habría desechado.
Por otra parte, es frecuente que en muchos trasplantes sea el cirujano quien, con la mera inspección del órgano, decida si se prosigue con la extracción. En el TIP esta situación se extiende al equipo de procesamiento, que además ha de valorar otras características macroscópicas del páncreas antes de iniciar la obtención de los islotes. Así, tanto los grupos de Miami como de Edmonton coinciden en observar 7 características del órgano aislado:
1. Consistencia del tejido: se prefieren páncreas firmes, aunque no fibrosos. Un tejido excesivamente blando puede indicar autodigestión, excesiva isquemia caliente o degranulación en curso. De hecho, en el caso de los donantes jóvenes, es su excesiva firmeza (debido a un mayor componente exocrino) su principal problema, si bien en estudios experimentales han servido como fuente para conseguir insulinoindependencias con una sola infusión sin que se haya esclarecido firmemente la causa.
2. Grasa: el concepto fatty pancreas como fuente de aislamientos excelentes es conocido desde hace tiempo42. La mayor cantidad de grasa peripancreática parece ejercer un efecto protector para minimizar el impacto del aislamiento.
3. Tamaño: hay que evitar páncreas tanto pequeños o muy pequeños como excesivamente grandes.
4 y 5. Calidad en la extracción y daños durante ella: la presencia de lesiones del conducto de Wirsung o la cápsula pancreática disminuye las posibilidades de un aislamiento exitoso, así como fallos en el enfriamiento o la descontaminación.
6. Empaquetado y traslado excelentes.
7. Calidad del líquido escurrido tras eliminar las soluciones de preservación: este punto es de especial interés, ya que, si al retirar las soluciones de preservación (Winsconsin o bien solución de doble capa) se aprecia débito sanguinolento, el aislamiento se verá afectado negativamente, pues la sangre dificulta la acción de la enzima liberasa.
Mejoras en la preservación. Método de la doble capa
El método de la doble capa (two-layer method) fue introducido por Tanioka et al43,44 ya que previamente había demostrado mejorar la viabilidad del tejido pancreático en trasplantes segmentarios en perros45. Consiste en la creación de un sandwich de soluciones de preservación en el que quedaría incluido el páncreas extraído. Una capa de solución de la Universidad de Winsconsin (UW) aporta principios inmediatos y iones y otra de perfluorocarbono actúa como donante de oxígeno46. Dado que la densidad del perfluorocarbono es mucho mayor, éste queda en el fondo de la preparación. De este modo el páncreas quedaría "flotando" sobre el donante de oxígeno, pero hundido en la solución de Winsconsin. Este método ha aportado grandes mejoras en el rendimiento y la calidad a la hora de obtener islotes, y se ha generalizado su uso.
La principal ventaja que aporta este método es que permite alargar el tiempo límite de isquemia fría para la obtención de un número de islotes adecuado en comparación con las soluciones tradicionales (UW) de 8-10 h hasta casi 1647. Además minimiza el daño producido por la isquemia caliente, por lo que es de gran utilidad en casos de donación a corazón parado48,49. Su uso mejora la funcionalidad y el número de islotes obtenidos en modelos experimentales50 como en humanos51-53. Gracias a estas ventajas se han llevado a cabo aislamientos a distancia con tiempos de isquemia prolongados sin repercusión clínica en el TIP54. El método no tiene efectos negativos para los islotes y permite incluso doblar el número de islotes obtenidos de donantes marginales55.
Si bien parece claro que el aporte de oxígeno mejora la viabilidad de los islotes, no está claro el verdadero mecanismo de acción del método de las dos capas, ya que una reoxigenación masiva tras un período de isquemia prolongado podría resultar perjudicial. En ese sentido se ha señalado la preservación de las células ductales50 y un bloqueo de la activación de la apoptosis por la vía mitocondrial56 como mecanismos contribuyentes. El método de la doble capa no es fácil de reproducir y requiere una infraestructura que no siempre está disponible en el momento de la extracción, principalmente cuando ésta se lleva a cabo a distancia; por eso se está estudiando la posibilidad de simplificarlo eliminando la capa de UW57,58. Del mismo modo, también se está tratando de mejorar su rendimiento añadiendo inhibidores de la tripsina (Pefabloc) en el momento del aislamiento59,60.
Aislamiento
Para llevarlo a cabo, es necesario aislar únicamente el componente endocrino del páncreas donado, minimizando la cantidad de tejido exocrino y de soporte en la solución final que será infundida al receptor. La eliminación del tejido no endocrino mejora principalmente la inmunogenicidad del implante. Conforme éste es más intenso y prolongado, la pureza es mayor; sin embargo, las consecuencias para los islotes no siempre son buenas. Por así decirlo, el aislamiento permite llevar a cabo el TIP, pero es además uno de sus limitantes.
Es un proceso complejo, que puede durar más de 6 h y requiere una infraestructura importante y una alta especialización de los profesionales encargados. Obtener islotes tanto humanos como de otras especies para experimentación es relativamente fácil; hacerlo para un trasplante, no. Son numerosos los detalles a los que debe prestarse atención y el éxito final puede ser cuestión únicamente de pequeños matices.
Cada vez se cuestiona más la necesidad de llevar a cabo aislamientos exhaustivos. El aislamiento supone la pérdida del 30% de los islotes en los mejores casos y los expone a un ambiente químico muy desfavorable, además de un continuo traumatismo, ya que incluye una parte puramente mecánica. Las consecuencias suelen traducirse en la pérdida de islotes inmediatamente tras el implante.
La tendencia actual es reducirlo al mínimo, especialmente en el caso del autotrasplante y cuando donante y receptor sean familiares, como ocurre en el donante vivo.
Uno de los factores que se ha señalado como determinante en el éxito del aislamiento de los islotes es la solución enzimática empleada. Desde que en 1997 fuese introducida, la enzima liberasa ha conseguido mejorar la pureza de los aislamientos en detrimento del biocatalizador anteriormente empleado: colagenasa. Ambos principios tienen como objetivo eliminar el máximo de tejido no endocrino y así permitir la liberación de los islotes. Sin embargo, la extrema variabilidad entre los diferentes lotes de colagenasa, así como la casi constante contaminación con lipopolisacárido bacteriano, hizo necesario buscar una alternativa. En ese sentido la liberasa surgió como una combinación de proteasas de gran potencia y especificidad además de gran pureza. Son muy numerosos los estudios que demuestran la superioridad de la liberasa tanto en el número de islotes obtenidos como en su viabilidad y función. De hecho, uno de los pilares del Protocolo de Edmonton fue una detallada atención al proceso de aislamiento en todos sus pasos, incluyendo liberasa en todos los trasplantes. Desgraciadamente, algunos de los problemas observados con la colagenasa se repiten con esta enzima, ya que también hay diferencias entre lotes e incluso dentro del mismo lote, que acaban por afectar al resultado del aislamiento, especialmente la presencia de la isoforma Ib de la colagenasa61. Por otra parte, debe minimizarse el contenido final de enzima en el extracto de islotes purificados, ya que su presencia en la preparación final tendría graves efectos en el receptor, hecho que ya se ha observado en roedores62. La realización de un aislamiento enzimático a la carta, es decir, variando los tiempos de exposición a las enzimas en función de la calidad del páncreas, ha permitido mejorar mucho el rendimiento, del mismo modo que se han recuperado páncreas a priori subóptimos con muy buenos resultados63.
En un aislamiento intenso se reduce el componente exocrino e intersticial al mínimo, y la gran mayoría de las células se eliminan de los ductos pancreáticos. Las células ductales pancreáticas han sido consideradas "células madre facultativas", y al ser células epiteliales, tienen como marcador inmunohistoquímico la citoqueratina 19. Secretan numerosos factores de crecimiento y de ellas se han obtenido tanto células beta como islotes enteros64,65. Se ha conseguido obtener islotes humanos funcionantes tanto de islotes fetales humanos y de rata como de islotes adultos. Paradójicamente, los páncreas humanos de los que es más fácil obtener células ductales que den lugar a islotes que ya in vivo sean funcionantes son los de donantes jóvenes, clásicamente considerados malos candidatos para ser donantes66.
Criterios de calidad después del aislamiento
El aislamiento de islotes es un proceso largo, complejo y costoso que en gran medida depende de la experiencia del equipo de biólogos moleculares. En nuestro país ésta es limitada, ya que son pocos los grupos que hayan realizado aislamientos habitualmente y menos todavía los que lo han hecho para un trasplante clínico. En manos de los mejores grupos, aproximadamente un 40-45% de los páncreas extraídos terminan siendo aislados satisfactoriamente.
No existen unos criterios internacionalmente aceptados para considerar exitoso un aislamiento, si bien la mayoría de los grupos emplean los criterios que utiliza el grupo de Edmonton dictaminados conjuntamente por el Clinical Islet Isolation Lab y Health Canada. Tales criterios son: un mínimo de 4.000 EqI/kg de peso del receptor, viabilidad > 70%, cifras de endotoxina < 5 U/kg de peso del receptor y un volumen total < 5 ml.
Viabilidad. Predicción de la función de los islotes trasplantados
Si bien los criterios de calidad se van estableciendo y generalizando, aunque éstos se cumplan, no siempre es fácil predecir si los islotes aislados van a tener una función óptima tras su infusión. Evidentemente, no es posible predecir la magnitud de la respuesta humoral inmediata ni la intensidad de la respuesta celular inmunitaria a largo plazo, pero cada vez hay más parámetros que correlacionan variables obtenidas durante el cultivo pretrasplante con el resultado clínico.
Dado que el TIP es un trasplante "dependiente de la masa", el número de islotes obtenidos en el aislamiento siempre ha sido crucial para asegurar un resultado aceptable. Dada la irregularidad de los islotes humanos, cosa que no ocurre en otras especies, por ejemplo, roedores, no se indica el número aproximado de islotes, sino el número de agregados celulares cuyo diámetro total correspondería al de un islote medio, es el concepto llamado equivalente de islote.
El primer método empleado para comprobar la viabilidad de los islotes es el examen directo con el microscopio. Evidentemente es una prueba en extremo dependiente del observador, pero que en caso de expertos tiene un gran valor. Un error habitual es atribuir excelentes cualidades a islotes intensamente teñidos con ditizona, ya que contienen gran número de gránulos de secreción; en muchos casos se trata de islotes con una gran sobrecarga funcional previa a su muerte que no liberan su producción de manera adecuada.
En segundo lugar estaría la respuesta a estímulos insulinosecretores como es el aumento de potasio, glucosa o ADP en el medio. La captación de tintes como el azul triptán por los restos de células ductales también es un indicador habitual de la viabilidad insular.
En muchos grupos de trabajo, el trasplante de un extracto de los islotes a ratones diabéticos desprovistos de respuesta inmunitaria adaptativa es un criterio de viabilidad cuando dicho extracto consigue revertir la DM en el ratón receptor.
Sin embargo, el análisis tanto del porcentaje de células beta (que ya se ha correlacionado con el resultado final del trasplante67) como de estructuras subcelulares va cobrando importancia. Aunque en numerosos estudios experimentales se analizan parámetros bioquímicos como el balance energético (cociente ADP/ATP)68 o el estado oxidativo de los islotes, son la inmunohistoquímica y la inmunofluorescencia las técnicas empleadas de modo habitual. El diacetato de fluoresceína y las tinciones de unión específica al ADN de las células insulares señalan como parámetros de viabilidad alteraciones en la membrana celular69. A su vez, estas técnicas van siendo superadas por nuevas propuestas como la LSC (laser scanning cytometry), que también es capaz de valorar células que se encuentran en apoptosis70. Conforme todas estas técnicas vayan siendo validadas como indicadores fiables del futuro funcional de los islotes trasplantados y aumente su disponibilidad y eficiencia, comenzarán a ser herramientas de uso generalizado en la mayoría de los trasplantes de células y tejidos.
Cultivo
Durante los primeros años de la aplicación clínica del TIP, el cultivo supuso una de las opciones principales para mejorar el rendimiento de los islotes. La posibilidad de neutralizar los efectos del proceso de extracción y aislamiento regularizando la función insular es su principal aportación. Con el paso del tiempo, se han ido identificando algunas de las características que pueden convertir este paso en una maniobra incluso perjudicial. De ahí que hoy se insista en la necesidad de eliminar cualquier resto de material no humano. Este hecho es de especial relevancia, ya que durante años se emplearon medios de cultivo en los que aparecían tanto albúmina como suero fetal bovinos.
El cultivo permite mejorar las condiciones pretrasplante ya que, desde la previsible manipulación genética, las sustancias disponibles para mejorarlas son cada vez más. Así, los antioxidantes, los antiapoptóticos, los antiinflamatorios o la propia inmunosupresión han sido añadidos a los medios habituales, con lo que han mejorado la viabilidad y la función de los islotes71. En relación con este hecho, llama la atención que los intentos de mejorar la capacidad de neovascularización añadiendo factores de crecimiento han sido satisfactorios al emplear fundamentalmente metaloproteasas, en detrimento del factor de crecimiento vascular derivado del endotelio (VEGF)72.
Sin embargo, en la nueva era del TIP el aislamiento se realiza casi de inmediato y se trata de trasplantar en el mínimo tiempo posible, sobre todo en caso de donantes emparentados. Esto puede destinar al cultivo pretrasplante casos en los que se prevea que los islotes puedan sufrir las consecuencias de la obtención (donante en parada, isquemia caliente prolongada) o en los casos en que el lugar del aislamiento esté a distancia del centro donde se implanten.
Criopreservación
La posibilidad de congelar los islotes una vez obtenidos para poder realizar el trasplante en un momento o lugar óptimos hizo que su aplicación fuese motivo de numerosos estudios en la primera fase del TIP. Actualmente, las series de TIP en humanos no suelen incluir en sus protocolos la criopreservación, ya que cada vez se da más valor al acortamiento de los tiempos durante el proceso. Sin embargo, la criopreservación permite reunir islotes de varios donantes para una única infusión masiva, cuantificar el número de islotes obtenidos, evaluar su viabilidad y asegurar su esterilidad e incluso disminuir su sensibilidad a los mediadores proinflamatorios73.
El principal problema achacado a la criopreservación ha sido desde hace tiempo la escasa repercusión en la inmunogenicidad y la disminución en la viabilidad y la respuesta funcional de los islotes. Este hecho es particularmente frecuente en islotes de gran tamaño, probablemente debido a que la muerte del islote comienza tras la isquemia de las células centrales (más alejadas de la vascularización periférica en islotes grandes)74. En concordancia con este hecho, la criopreservación (también llamada preacondicionamiento térmico) mejora la viabilidad y la función de islotes de diámetros menores75.
En la actualidad se estudia diversas opciones que hagan de la criopreservación un método más seguro al reducir su impacto en los islotes. En ese sentido, el bloqueo de señales proapoptóticas como la cinasa activada por mitógenos p3876, la inclusión de células ductales77 o la adición de extractos proteínicos anticongelantes que evitan la formación de microcristales, similares a los hallados en peces polares78, han mostrado mejoras en los resultados experimentales de este procedimiento.
Complicaciones
Una de las ventajas aducidas por los partidarios del TIP frente al trasplante de órgano sólido es la baja morbimortalidad del procedimiento. Gran parte de esas posibles complicaciones se deben al abordaje transparietohepático, ya que en grandes series de TIP que incluyen infusión durante una laparotomía en el caso de un trasplante simultáneo de riñón, éstas fueron extremadamente raras79.
Tras casi 2 décadas de experiencia clínica, las complicaciones asociadas a la infusión intraportal de islotes son bien conocidas y cada vez menos frecuentes, y además su resolución en la inmensa mayoría de los casos es con tratamiento conservador80. Entre las más citadas se encuentran la hemorragia en el lugar de punción al emplear la vía transparietohepática y la trombosis portal81. En el primer caso puede asociarse o no a hemoperitoneo o hematoma subcapsular. En el caso de los fenómenos trombóticos portales, la frecuencia es menor de la esperable, pues la infusión de islotes suele elevar la presión en la vena hasta los 13-21 mmHg; suelen ser parciales y se aprecian de manera significativamente mayor en receptores con alteraciones de la coagulación no conocidas previamente82. Del mismo modo, se resuelven con anticoagulantes orales de modo habitual.
Durante las primeras semanas tras el TIP también se ha observado en la mayoría de los pacientes una elevación de las transaminasas (alaninaminotransferasa) que suele ser asintomática y no se correlaciona ni con daño hepático funcional ni con complicaciones postrasplante, como la trombosis portal o el hematoma intrahepático83.
Hasta la fecha, series en centros con gran experiencia como el de Miami no han observado muertes, enfermedad injerto contra huésped, infecciones severas por citomegalovirus o enfermedad linfoproliferativa postrasplante con las pautas de inmunosupresión post-Edmonton84.
Idoneidad del hígado como lugar del implante. Microhemodinámica del trasplante de islotes pancreáticos
El TIP se ha llevado a cabo empleando diversas localizaciones para alojar el injerto (hígado, bazo, cápsula renal, testículo, cerebro, cavidad peritoneal, epiplón, etc.). De todas ellas es el hígado la opción universal. Si bien hay quien se cuestiona su idoneidad. La infusión de material en el flujo portal trae consigo el riesgo de complicaciones trombóticas, si bien su frecuencia con repercusión clínica tras TIP es anecdótica. Otros riesgos son el sangrado y el desarrollo ulterior de hipertensión portal.
Los islotes ubicados en los sinusoides hepáticos están virtualmente expuestos a todas las sustancias absorbidas a través del intestino, incluidas toxinas y fármacos; funcionalmente, los islotes trasplantados responden mal a la hipoglucemia, sin embargo, se ha demostrado que poseen un número suficiente de células beta y que éstas responden correctamente ante estímulos para la liberación de glucagón85-88.
En el TIP no hay un aporte directo de sangre oxigenada mediante una red vascular definida. Los islotes quedan alojados en radicales venosos de segundo y tercer orden, así como sinusoides. Durante los primeros 10 días, el implante sólo recibe aporte sanguíneo portal89 y no dispone de una neorred capilar propia hasta pasadas 2 semanas90, este fenómeno hace que la angiogénesis post-TIP sea crucial para el éxito, ya que la saturación de oxígeno en la porta raras veces supera el 85%. La angiogénesis es en extremo dependiente de la producción de VEGF en las primeras 24 h91, cuando tienen un papel primordial las células endoteliales del hígado receptor. La rapamicina se ha relacionado experimentalmente con una inhibición de la angiogénesis post-TIP, así como inhibición de la nesidioneogénesis a partir de las células madre de los ductos pancreáticos92-94. Este hallazgo es contradictorio con los resultados clínicos del TIP empleando este fármaco como inmunosupresor.
Dos fenómenos en esta fase son determinantes del éxito o fracaso del TIP: la hipoxia y la respuesta inflamatoria sistémica.
La hipoxia prolongada en islotes trasplantados puede durar hasta 9 meses después del implante sin que se pueda establecer la causa ya que, en teoría, la nueva red capilar estaría ya desarrollada. Del mismo modo, se postula que tal hipoxia mantenida, junto con la localización central de las células beta, tiene un efecto negativo en la secreción insulínica95. Otros autores defienden que precisamente ese microambiente hipóxico hace que los fenómenos de repercusión postrasplante sean menores, así como los fenómenos inflamatorios y oxidativos.
La llegada de los islotes a modo de émbolo convierte a los sinusoides en protrombóticos, con dos agentes principales: células de Kuppfer y la hipoxia generada en el endotelio receptor por el émbolo de islotes. Ambos son capaces de favorecer la producción local de tromboplastina, factor VII y factor activador de las plaquetas (PAF)96,97. La hipoxia sinusoidal tras la infusión ha sido relacionada con una mayor producción local de factor X98.
El papel de los hepatocitos en el fallo primario tras el TIP ha llegado a ser considerado como el más importante, incluso por encima de los macrófagos residentes en los islotes o las células de Kupffer. La razón estriba en que la generación de estrés oxidativo procedente de los hepatocitos en presencia de mediadores proinflamatorios e islotes es 30 veces mayor que la observada en condiciones normales99. Esta respuesta está, sin embargo, en contraposición con la teoría del efecto beneficioso que tendría la presencia de islotes en la proximidad de los hepatocitos debido al efecto hepatotrópico de la insulina100; sin embargo, el aumento de las concentraciones portales de insulina observados tras el TIP se ha correlacionado en modelos experimentales con efectos negativos: esteatohepatitis y depósito perivascular de glucógeno101.
Rechazo en el trasplante de islotes pancreáticos
El principal problema que limita actualmente la generalización del trasplante de islotes en clínica humana es el inmunológico, causa del fracaso primario/rechazo de los islotes trasplantados.
Como en cualquier trasplante, el TIP es objeto de reconocimiento y rechazo por parte del organismo receptor. En este caso, una de las mayores dificultades reside en identificar cuál es la causa de ese rechazo. Parece lógico pensar que la persistencia de la autoinmunidad contra los islotes típica de la DM1 es uno de los factores a tener en cuenta. Tanto es así que en modelos de trasplante de órgano sólido singénico, incluso en gemelos idénticos humanos se observa este fenómeno102. Y, en contraposición, el éxito del autotrasplante puso de manifiesto que, además de la autoinmunidad y la alorreactividad típica de cualquier trasplante, existían otras barreras inmunológicas103.
Desde el punto de vista inmunológico, el trasplante de islotes se diferencia del trasplante de órgano sólido (revestido por endotelio vascular) por presentar dos tipos de rechazo: por un lado, el rechazo clásico, específico, mediado fundamentalmente por la inmunidad adaptativa, predominantemente celular. Y, por otro, un rechazo mediado por la respuesta inmunitaria inespecífica o innata, que además es precoz. En el segundo tipo (relativamente frecuente) han sido implicados un escaso número de islotes trasplantados, factores técnicos que reduzcan la viabilidad de los islotes, tales como isquemia fría o caliente, etc., pero hoy parece claro que la principal causa es una respuesta inflamatoria no específica. Hasta hace poco no ha sido posible justificar la necesidad de varias infusiones para conseguir insulinoindependencias después del TIP7,104. Independientemente de la pérdida de islotes durante el período de aislamiento, hoy se sabe que la mayoría de las pérdidas de islotes se producen tras el implante105-107. Los diferentes modelos experimentales, fundamentalmente con trasplantes singénicos y modelos experimentales sin células T activadas, han puesto de manifiesto que la pérdida de islotes se debe a mecanismos inflamatorios inespecíficos y que más del 60% de los islotes trasplantados desarrolla apoptosis en los primeros 3 días postimplante108-110. Aunque los mecanismos de transducción que median la respuesta celular a estas condiciones de estrés no son totalmente conocidos, cada vez más parece haber un consenso generalizado atribuyendo un papel importante a las citocinas como mediadores directos de la muerte de las células beta. Las citocinas proinflamatorias como interleucina 1 (IL-1), factor de necrosis tumoral alfa (TNFa) o interferón gamma (IFNg), así como óxido nítrico y otros radicales libres por los macrófagos, pueden inducir tanto apoptosis como necrosis; la apoptosis es la forma predominante en islotes humanos111. Para ello emplean la unión y activación de receptores específicos como la reducción en la expresión de la variante antiapoptótica del gen Bcl-2112. Las "señales de supervivencia celular" previenen la activación de la apoptosis, en parte, inhibiendo a la subfamilia proapoptótica de Bcl-2 a nivel postraduccional. Otros fenómenos observados son cambios en la actividad de cinasas y/o fosfatasas113, activación de factores de transcripción inactivos en citosol como el factor nuclear kappa B (NF-kB y STAT-1114,115. Actualmente se cree que las citocinas podrían inducir directamente la muerte de las células beta o contribuir a la muerte celular por regulación de la expresión de factores de sobra conocidos como implicados en la apoptosis como Fas. Conceptualmente, la pérdida precoz de islotes tras el implante es el producto de una suma multifactorial en la que la respuesta inflamatoria inespecífica es el factor más importante. Se unen a ésta un número inadecuado de islotes y una mala vascularización durante las primeras horas tras el TIP. La recurrencia de los fenómenos autoinmunitarios, la toxicidad de los inmunosupresores y el rechazo mediado por células o clásico no formarían parte de ella.
Es conocida la sensibilidad de los islotes a la liberación de productos proinflamatorios procedentes de los macrófagos ya existentes en los islotes que se trasplantan y en los del propio receptor. Esto es, los islotes sufren las consecuencias de la activación de la respuesta inflamatoria inespecífica tanto del microambiente en el que quedan alojados tras el implante como de algunos de sus componentes.
Inmunosupresión en el trasplante de islotes pancreáticos
Debido a la complejidad de los diferentes mecanismos del rechazo en el TIP, el avance en la prevención es una de las líneas de investigación principales en este campo.
Si bien es ya un hecho universalmente aceptado que la inmunosupresión propia del trasplante renal no sólo no es efectiva, sino que es perjudicial para los islotes pancreáticos, algunos de los fármacos empleados habitualmente en trasplantes de órgano sólido siguen empleándose, especialmente los inhibidores de la calcineurina. Tanto que al día de hoy el Protocolo de Edmonton es la pauta más empleada y mejor conocida. Aunque la combinación de rapamicina y sirolimus es especialmente interesante, ya que parece haber cierta sinergia que permite emplear dosis bajas (quizá por compartir receptor citosólico FKBP-12), es la rapamicina la que tiene más posibilidades de que se deje de emplearla116. Tanto por sus efectos negativos a medio plazo en el implante como por ser causa de gran parte de los efectos secundarios menores, así como del empeoramiento del perfil lipídico y función renal observada en algunos pacientes, se plantea la opción de sustituirla por otros agentes en desarrollo como el everolimus.
El empleo de tacrolimus sigue siendo controvertido, ya que, además de ser un fármaco diabetógeno, no están claros los mecanismos por los que ejercería su acción protectora. En este sentido, nuestro grupo ha realizado diversos experimentos in vitro con islotes humanos en los que el FK-506 ha tenido un efecto bloqueante de los fenómenos asociados al rechazo primario al neutralizar el estrés oxidativo, la producción de novo de mediadores proinflamatorios y la activación de la apoptosis, aumentando el contenido de insulina de los islotes117. Estos resultados estarían en consonancia con la creciente evidencia del efecto antioxidante y antiinflamatorio inespecífico observado en el tacrolimus dependiente tanto de la dosis como del tejido. Es por esto que el papel beneficioso del tacrolimus podría producirse en los primeros días postinfusión, y se podría retirarlo o sustituirlo por fármacos con mejor perfil glucémico a largo plazo. De las opciones actualmente en estudio, tanto las combinaciones de everolimus con dosis mínimas de ciclosporina como la sustitución progresiva del tacrolimus por micofenolato mofetil han sido probadas con buenos resultados118,119. Finalmente, principios activos como el FTY-720, análogo del tacrolimus con muy baja toxicidad, serán las opciones a emplear en un futuro muy próximo120.
Sin embargo, la principal novedad desde la introducción del Protocolo de Emonton ha sido el empleo de inmunosupresión previa a la infusión. El preacondicionamiento inmunológico, junto con el método de preservación en doble capa, ha permitido alcanzar los mejores resultados hasta la fecha en el TIP118. Gracias a este régimen se han podido alcanzar insulinoindependencias duraderas empleando infusiones de un solo donante, pero además con una cantidad de islotes marginal (alrededor de 7.200 EqI). La pauta de inmunosupresión empleada previamente al trasplante incluyó antagonistas de la respuesta inmunitaria celular (globulina antitimocítica y daclizumab) y además un antagonista de los receptores del TNFa, etanercept, de tal manera que quedaban en gran medida prevenidos los fenómenos de respuesta inflamatoria inespecífica observados en la disfunción primaria en las primeras horas postimplante.
Otro de los objetivos para conseguir una tolerancia duradera del implante es la respuesta linfocítica. Para minimizarla se están desarrollando dos vías fundamentales: la depleción previa al trasplante y el bloqueo de las señales coestimuladoras de su activación.
La depleción linfocítica con globulina antitimocítica y anticuerpos monoclonales anti-CD3 se ha empleado ya en humanos con buenos resultados, incluso insulinoindependencias con un solo donante121. Por otra parte, el bloqueo de las señales coestimuladoras se presentaba como una de las opciones más prometedoras. El empleo de anticuerpos monoclonales contra marcadores de membrana de los linfocitos T como CD154 o moléculas como CTLA4-Ig, bloqueador de CD28, tuvo resultados muy interesantes en modelos experimentales con primates. Sin embargo, estos resultados no se han podido extrapolar a trasplantes en humanos, ya que se han observado graves complicaciones tromboembólicas asociadas al uso de estos principios activos122.
Para terminar, la interrupción directa de los fenómenos inflamatorios y proapoptóticos asociados a la fisiopatología del rechazo primario se postula como el siguiente paso para alcanzar tolerancias duraderas.
En la actualidad hay resultados in vitro bastante interesantes utilizando diversos agentes antiinflamatorios en islotes humanos y murinos, que llegan a contrarrestar la liberación masiva de citocinas observada en la disfunción primaria del TIP. En ese sentido se han utilizado desde antagonistas de IL-1 (IL-1ra), ácido acetilsalicílico, 17-b-estradiol o lisofilina123.
La interrupción de las señales apoptóticas será con seguridad uno de los pilares fundamentales en las futuras pautas de inmunoterapia en el TIP. Hasta el momento, la promoción de la expresión de moléculas antiapoptóticas (Bcl-2, Bcl-XL) por diversos métodos (incluyendo la transfección) ha mostrado excelentes resultados en modelos animales. La introducción de agentes inhibidores de la vía mitocondrial de la apoptosis y en especial de la caspasa-3 mejora el rendimiento en la obtención de islotes, así como su función, en roedores, pero no ha mostrado efectos beneficiosos en mamíferos más grandes como los cerdos124,125. Aunque la interrupción de las señales apoptóticas puede ser útil en el TIP, no hay que olvidar que su bloqueo masivo podría tener efectos inesperados al alterar la dinámica de replicación celular, que permitiría incluso proliferaciones anómalas. De hecho, la activación del gen promotor de Bcl-2 es una de las alteraciones citogenéticas características de neoplasias como la leucemia mieloide crónica.
Evolución futura del trasplante de islotes pancreáticos clínico126
El TIP es un proceso complejo y largo que puede durar días, por eso es absolutamente necesario prestar atención a múltiples detalles que en la mayoría de los casos competen a partes de grandes equipos multidisciplinarios. Uno de los errores más comunes en el pasado fue la incomunicación entre equipos extractores, biólogos moleculares y los responsables del seguimiento del paciente o de la inmunosupresión127.
Son múltiples los procesos implicados y, desgraciadamente, no se van resolviendo los problemas a la misma velocidad en cada uno de ellos. Además, las mejoras en un campo no sólo no se acompañan de la resolución de otros problemas, sino que pueden repercutir negativamente en el resultado final. Por ejemplo, los nuevos objetivos en la inmunosupresión, como son el bloqueo de las señales coestimuladoras o la apoptosis, pueden mejorar la supervivencia del injerto inicialmente, pero supondrían un impedimento a la tolerancia, ya que son mecanismos implicados en el reconocimiento de los islotes como propios. Por otro lado, la mejoría en el aislamiento tanto en su faceta enzimática como puramente mecánica puede aumentar la pureza de los islotes, si bien constituye un estímulo capaz de desencadenar el rechazo primario. Y del mismo modo, un mejor método de cultivo que consiga elevar la viabilidad pretrasplante puede constituir un estímulo antigénico potente capaz de activar el mismo proceso.
Así, para algunos autores como Ricordi, el TIP evolucionará de manera secuencial en "cuatro eras". En el momento actual, se trata de aminorar la influencia de todos los factores que llevan a la pérdida de islotes antes y después del trasplante: desde la selección del donante al rechazo primario, pasando por todos los factores que determinan un aislamiento exitoso. Además, es en esta fase cuando se trata de controlar los principales eventos relacionados con la respuesta inmunitaria tanto innata como adaptativa. En la segunda fase se conseguirá mejorar la cantidad de islotes obtenidos así como su viabilidad, junto con la obtención de tolerancia significativamente mayor para el injerto. En una tercera fase la consecución de una tolerancia habitual y duradera será un hecho y la mayoría de las mejoras irán encaminadas a mejorar la disponibilidad y viabilidad de los islotes aislados para así alcanzar resultados óptimos con poca cantidad de islotes, incluso el empleo de otras fuentes de órganos como los donantes en parada, donantes vivos o incluso se podrá emplear un solo donante para varios receptores. Finalmente, en la cuarta era la obtención de células productoras de insulina del propio paciente, así como la reversión de los fenómenos autoinmunitarios, hará que el propio TIP, ya en su fase de procedimiento efectivo y habitual, quede superado por nuevas opciones terapéuticas.
Correspondencia:
Dr. J.M. Balibrea del Castillo.
Ctra. del Plantío, 19. 28220 Majadahonda. Madrid. España.
Correo electrónico: jose_balibrea@yahoo.es
Manuscrito recibido el 30-10-2006 y aceptado el 5-2-2007.