Introducción
Hay variadas líneas de investigación sobre el cáncer. Muchas de ellas se basan en la búsqueda de nuevos tratamientos. Otras, no menos importantes, intentan averiguar por qué, a diferencia de bastantes tumores hematológicos como las leucemias y los linfomas, la mayoría de los tumores sólidos no pueden ser curados con quimioterapia.
Sin duda, las causas de que una célula tumoral sea resistente a la quimioterapia son muchas y de variada naturaleza. El motivo del presente trabajo es el estudio de una de estas posibles causas, en concreto, el de la expresión de proteínas relacionadas con la resistencia a múltiples fármacos en pacientes con cáncer de pulmón.
La resistencia a la quimioterapia, independientemente de los mecanismos que la produzcan, puede ser innata o adquirida. La resistencia innata sería la que presenta un tumor sin contacto previo con los fármacos, mientras que la adquirida sería la que aparece tras el contacto con uno o varios de ellos1. Hay dos características tumorales que parecen determinar la resistencia a la quimioterapia: la cinética de crecimiento2 y, en estrecha relación con ésta, la aparición de mutaciones espontáneas3.
Muchos tumores, incluidos los de pulmón, al ser tratados con quimioterapia siguen aparentemente las reglas enunciadas por Skipper et al4 y Goldie y Goldman3. La mayor parte de los pacientes con cáncer de pulmón no de célula pequeña no responde al tratamiento quimioterápico desde el principio5, es decir, presenta resistencia intrínseca o innata.
No hay una definición claramente establecida sobre lo que se considera un tumor "resistente" a nivel clínico. Algunos autores6 consideran apropiado emplear criterios de valoración de respuesta a la quimioterapia, como los de la OMS7, y clasifican como sensibles a los tumores con respuesta completa, y resistentes o parcialmente resistentes a los demás. Dado que, hasta el momento, no se ha identificado ningún mecanismo que por sí solo confiera resistencia a todos los fármacos conocidos1,8, es muy probable que esta resistencia sea de causa multifactorial.
Clasificar las múltiples causas que pueden originar resistencia a la quimioterapia es difícil1,4,8. El objetivo principal del tratamiento quimioterápico es conseguir la muerte de la célula tumoral. Para ello es necesario conseguir que la mayor cantidad de fármaco activo posible llegue a su diana molecular, en el interior de la célula. Cualquier circunstancia que se interponga o dificulte este objetivo puede ser causa de resistencia. Tomando como base la publicación de Lehnert en 19964, podríamos clasificar los factores causantes de resistencia en extracelulares e intracelulares9.
La reducción de la acumulación intracelular de los fármacos es uno de los mecanismos más frecuentes de resistencia a los antineoplásicos. Esto puede producirse por su expulsión a través de la membrana celular10-13, por secuestro en las vesículas citoplasmáticas6, por variaciones en el transporte entre el núcleo y el citoplasma o por alteración en el metabolismo intracelular del fármaco14.
Las alteraciones de la topoisomerasa II son un ejemplo de cómo una variación en la diana molecular de los fármacos puede ser causante de resistencia a múltiples fármacos. La resistencia ligada a estas enzimas ha sido ampliamente estudiada de manera experimental1,12,15.
La célula tumoral puede defenderse de los efectos de la quimioterapia, incluso después de que el medicamento haya alcanzado su objetivo y causado un daño importante4. Dos alteraciones celulares destacan a este nivel, un aumento en la capacidad de reparación del ADN12 y, lo que parece más importante, el fallo en la muerte celular programada o apoptosis9.
La historia de las proteínas causantes de resistencia a múltiples fármacos o MDR-proteínas se inicia en 1973, con el descubrimiento por Keld Dano16 de la expulsión activa de daunomicina en células tumorales resistentes. Pgp es una glucoproteína de membrana con un peso molecular de 170 kD; por este motivo se la llama también proteína P-17017. Pgp actúa como una bomba de expulsión ATP-dependiente, reduciendo la acumulación intracelular de varias sustancias. Mrp es en realidad una familia de varios transportadores celulares. Las Mrp se localizan en la membrana plasmática formando parte, como la Pgp, de los transportadores ABC, pero también en el retículo endoplasmático, de lo que se infiere que puedan actuar tanto en la expulsión de fármacos fuera de la célula como en el secuestro intracelular de estas en vesículas citoplasmáticas13,18. Las Mrp son capaces de transportar aniones orgánicos y fármacos neutros, conjugados o no, con sustancias como el glutatión, los glucuronatos y los sulfatos. Se cree que algunos sistemas de expulsión de conjugados de glutatión (GS-X pumps) pueden ser proteínas de la familia Mrp19. Éste es el caso de los "GS-X pumas" que expulsan metotrexato (anión orgánico), los cuales se han relacionado con Mrp1, Mrp2, Mrp3 Mrp4, Mrp5, Mrp620. Por este mismo sistema, también podrían estar relacionadas con la expulsión de toxinas naturales, sales de metales pesados como el arsénico y con la resistencia a pequeñas moléculas como el cisplatino5,21. Lrp es una proteína de 110 kD descubierta a partir de una línea celular de cáncer de pulmón con MDR no ligada a Pgp23. El gen que la codifica se localiza en el cromosoma 16, cercano al de Mrp. Se la conoce también como MVP (major vault protein) porque constituye el componente proteínico mayor de unas organelas celulares llamadas vaults24. Los vaults, de descripción relativamente reciente25, son ribonucleoproteínas con una compleja estructura en forma de barril. Los vaults tienen una composición y una estructura casi idénticas en especies filogenéticamente tan alejadas como las amebas y los humanos, lo que parece indicar que su función es esencial para las células eucariotas.
Objetivos
Los objetivos del presente trabajo son los siguientes:
1. Determinar mediante estudio inmunohistoquímico la expresión de las proteínas Pgp, Mrp1 y Lrp (MDR-proteínas) en muestras tumorales de pacientes afectados de cáncer de pulmón.
2. Determinar la relación entre la expresión individual de cada MDR-proteínas y las siguientes variables clinicopatológicas: edad, sexo, tipo histológico, grado histológico, estadio tumoral, supervivencia y respuesta al tratamiento quimioterápico.
Material y métodos
El presente estudio se ha realizado en muestras de tejido tumoral de pacientes diagnosticados y/o tratados de cáncer de pulmón en el Hospital Donostia de San Sebastián entre abril de 1995 y junio de 1997.
Obtención y conservación de muestras
1. Muestras quirúrgicas: durante el acto quirúrgico se tomaban dos muestras de la zona tumoral que se introducían en criotubos y se almacenaban en una cubeta portátil de nitrógeno líquido hasta su procesamiento.
2. Muestras broncoscópicas: se tomaba una muestra que era tratada del mismo modo que las piezas quirúrgicas.
Se recogieron 147 muestras tumorales procedentes de 143 pacientes. De éstas, 35 eran broncoscópicas y 112 quirúrgicas. Resultaron válidas para el estudio 101 muestras correspondientes a 99 pacientes (tabla1). En 2 pacientes se dispuso de una muestra broncoscópica y una quirúrgica, optándose por procesar únicamente la quirúrgica. Por último, el estudio se realizó en 99 muestras de 99 pacientes, 6 de ellas broncoscópicas (que mostaron material suficiente para el estudio; además, luego no fueron intervenidos por ser 3 de ellos T3N1M1 y otros 3 resultaban inoperables por su condición general) y 93 quirúrgicas (tabla 2).
Estudio inmunohistoquímico de las muestras tumorales
Las muestras tumorales criocongeladas fueron sometidas a análisis inmunohistoquímico para la detección de las 3 MDR-proteínas, Pgp, Mrp1 y Lrp. Para ello se utilizó la técnica comercial de estreptavidina-biotina (LSAB de Dako), junto con anticuerpos monoclonales no comerciales procedentes de un laboratorio de investigación universitario (Universidad Libre de Amsterdam).
Reactivos utilizados
Anticuerpos monoclonales:
MRPr1 reconoce la proteína Mrp1.
MRPm6 reconoce la proteína Mrp1.
LRP-56 reconoce la proteína Lrp.
JSB-1 reconoce la proteína Pgp.
Sistema de visualización LSAB y kits de diamonobenzidina (Dako).
Acetona.
Suero bovino.
PBS (tampón fosfato salino).
Descripción de los anticuerpos monoclonales (AcMo)
1. AcMo MRPr1: IgG isotipo 2a de rata, obtenido a partir de una proteína de fusión bacteriana de Mrp1 que contenía un segmento de 168 aminoácidos en la mitad aminoproximal de la proteína. Se produce a partir de células híbridas resultantes de la fusión entre células linfáticas de rata inmunizada y células SP2/O de mieloma de ratón.
2. MRPr1 reacciona con epítopo de Mrp1. No presenta reacción cruzada con los productos de los genes humanos MDR1 y MDR3.
3. AcMo MRPm6: IgG isotipo 1 de ratón, obtenido a partir de una proteína de fusión bacteriana de Mrp1 que contenía un segmento de 170 aminoácidos en el extremo carboxiterminal y parte del dominio de unión carboxiproximal de la proteína. MRPm6 reacciona con un epítopo interno de Mrp1. Se produce a partir de células híbridas resultantes de la fusión entre células linfáticas de ratón inmunizado y células SP2/O de mieloma de ratón. No presenta reacción cruzada con los productos de los genes humanos MDR1 y MDR3.
4. AcMo LRP-56: IgG isotipo 2b. Reacciona con un epítopo interno de Lrp. Se produce a partir de células híbridas resultantes de la fusión entre células linfáticas de ratón inmunizado y células SP2/O de mieloma de ratón.
5. AcMo JSB1: IgG isotipo 1. Reacciona con un epítopo citoplasmático de Pgp. Se produce a partir de células híbridas resultantes de la fusión entre células linfáticas de ratón inmunizado y células SP2/O de mieloma de ratón.
Descripción de la técnica
1. De cada muestra tumoral crioalmacenada se realizan en el criostato 5 cortes de 4? (C-1, C-2, C-3, C-4 y control negativo) que se dejan secar a temperatura ambiente.
2. Se sumergen durante 15 min en acetona y se dejan secar.
3. Incubación en suero bovino durante 15 min.
4. Incubación directa con el anticuerpo monoclonal correspondiente durante 1 h, diluido en suero bovino y PBS a partes iguales, con cada uno de los cortes, a excepción del corte control negativo.
5. Lavado en PBS.
6. Avidina durante 30 min.
7. Lavado en PBS.
8. Streptavidina durante 30 min.
9. Lavado en PBS.
10. Incubación DAB durante 7 min.
11. Lavado PBS.
12. Contrastar con hematoxilina de Harrys durante 1 min.
13. Lavado en agua.
14. Virar en agua amoniacal.
15. Deshidratar y montar.
Todas las incubaciones se realizaron en cámara húmeda y a temperatura ambiente.
Se empleó tejido normal de colon como control positivo, el cual presenta alta expresión de estas proteínas. El quinto corte histológico de cada muestra tumoral se utilizó como control negativo y fue sometido a todo el proceso técnico a excepción de la incubación con el anticuerpo primario (cuarto paso). Como control negativo se utilizó un antisuero inespecífico tipo IgG de ratón.
Variables del estudio
Variable dependiente: expresión de MDR-proteínas
Se cuantificó la proporción de células que reaccionaban con el AcMo. Se consideró como positiva cuando un 10% o más de las células de la preparación expresaba la proteína. El estudio de la expresión de MDR-proteínas y su relación con las diferentes variables clinicopatológicas se realizó de dos formas:
1. Individual o independiente: analizamos la expresión de cada proteína por separado, sin tener en cuenta si se expresaba sola o asociada con las otras.
2. Simultáneo: analizamos la expresión conjunta de MDR-proteínas en los pacientes desde diferentes puntos de vista:
Expresión positiva fente a expresión negativa: con independencia del número o el tipo de proteína expresada.
Número de proteínas expresadas simultáneamente con independencia del tipo: ninguna, 1, 2 o 3.
Número y tipo de MDR-proteínas expresadas simultáneamente: ninguna, Pgp, Mrp1, Lrp, Pgp + Lrp, Mrp1 + Pgp, Mrp1 + Lrp, y las 3 a la vez.
Variables independientes
Las variables independientes consideradas en el estudio fueron la edad y el sexo.
Tipo histológico. Las muestras fueron clasificadas mediante examen en microscopio óptico tras tinción con hematoxilina y eosina (HE), siguiendo los criterios de la OMS (Ref) en los siguintes tipos histológicos: carcinomas escamosos, adenocarcinomas, carcinomas indiferenciados de célula grande, carcinomas indiferenciados de célula pequeña y otros.
Grado de diferenciación histológica. Se determinó el grado histológico de las muestras por tinción con HE y examen al microscopio óptico. Fue la zona más indiferenciada de la muestra la que marcó el grado, que fue clasificado en uno de los siguientes grupos: bien diferenciado, moderadamente diferenciado, pobremente diferenciado.
Estadio tumoral. Se estableció por el sistema TNM, según la clasificación de la UICC 1997 (Ref). Se utilizó el estadio clínico en aquellos casos no tratados quirúrgicamente y el estadio patológico en los que sí lo fueron.
Variables clinicopatológicas (variables independientes)
Examen anatomopatológico. A partir del estudio histoquímico de las muestras criocongeladas, mediante examen en microscopio óptico tras tinción con HE, se comprobó la presencia de tumor y se determinaron las siguientes variables: tipo histológico y grado de diferenciación histológica.
Revisión de historiales clínicos. De los historiales clínicos de los pacientes se recogieron los datos correspondientes a las siguientes variables: edad, sexo, estadio tumoral, intervalo libre de enfermedad, supervivencia y respuesta al tratamiento quimioterápico. Para concretar los tres últimos se realizaron revisiones periódicas, la última en marzo de 2004. Para determinar la supervivencia fue necesario el contacto telefónico en varios casos y en otros se consultó el registro de mortalidad del País Vasco, aunque no se incluyó en el presente trabajo.
Resultados
Variables clinicopatológicas
La edad media de los 99 pacientes fue de 64 ± 10,2 años. La serie se compone de 85 varones y 14 mujeres, con una media de edad de 64 ± 9,7 años para los varones y de 61 ± 13 años para las mujeres. Presentaban tumores con histología no célula pequeña, 93 pacientes (49 carcinomas escamosos, 37 adenocarcinomas y 7 carcinomas indiferenciados de célula grande), 3 carcinomas indiferenciados de célula pequeña y 3 con otras histologías (1 carcinoma con diferenciación neuroendocrina, 1 carcinoma sin más especificación y 1 tumor carcinoide). Con respecto al grado de diferenciación histológica, en 20 casos fue bien diferenciado, en 35 moderadamente diferenciado, en 43 pobremente diferenciado, y en 1 paciente no pudo especificarse el grado. Por estadios, los 99 pacientes se agruparon de la siguiente forma: estadio I, 45 casos (Ia 14, Ib 31); estadio II, 23 casos (IIA 0, IIB 23); estadio III, 22 casos (IIIA 15, IIIB 7), y estadio IV, 9 casos.
Expresión de MDR-proteínas
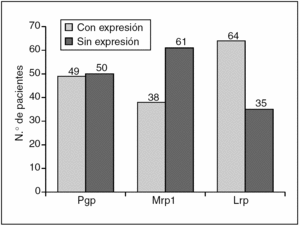
En el análisis de la expresión independiente de cada MDR-proteína, los resultados fueron los siguientes (figs. 1 y 2):
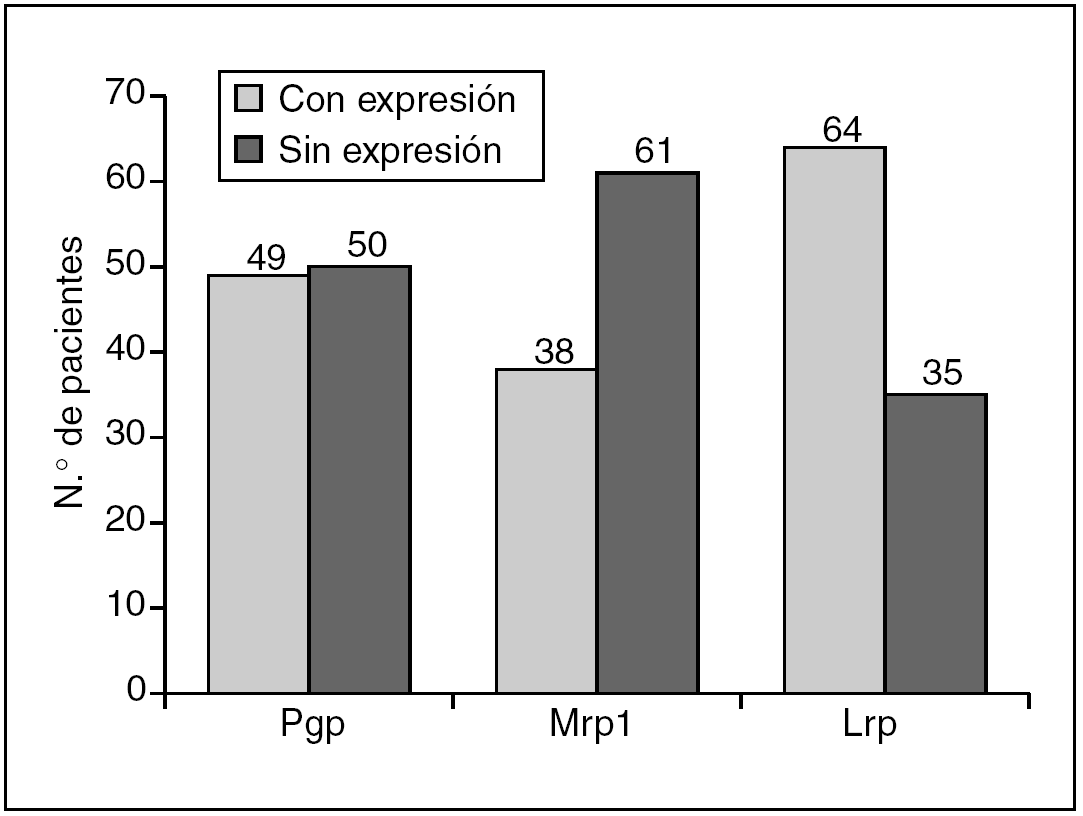
Fig. 1. Expresión de MDR-proteínas en los 99 pacientes de la serie.
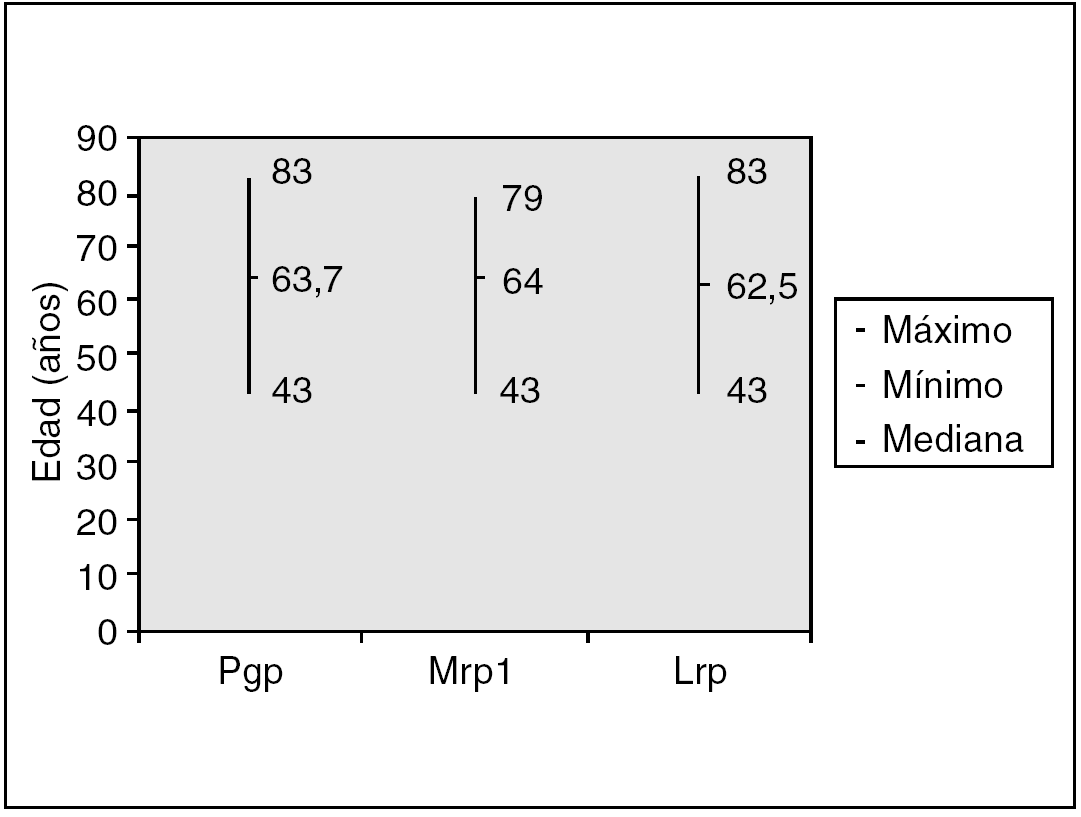
Fig. 2. Valores medios de MDR-proteínas y edad.
Pgp: sin expresión 50 pacientes (50,5%); con expresión 49 pacientes (49,5%).
Mrp1: sin expresión 61 pacientes (61,6%), con expresión 38 pacientes (38,4%).
Lrp: sin expresión 35 pacientes (35,4%), con expresión 64 pacientes (64,6%).
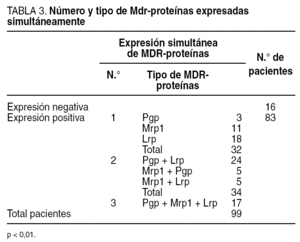
Con respecto a Mrp1, 30 de los 38 pacientes que la expresaban presentaron positividad para los dos anticuerpos monoclonales empleados, mientras que 8 (4 para cada AcMo) fueron positivos sólo a uno de ellos. Un total de 83 de los 99 pacientes expresaba alguna MDR-proteína y 16 no expresaba ninguna. La distribución fue la siguiente:
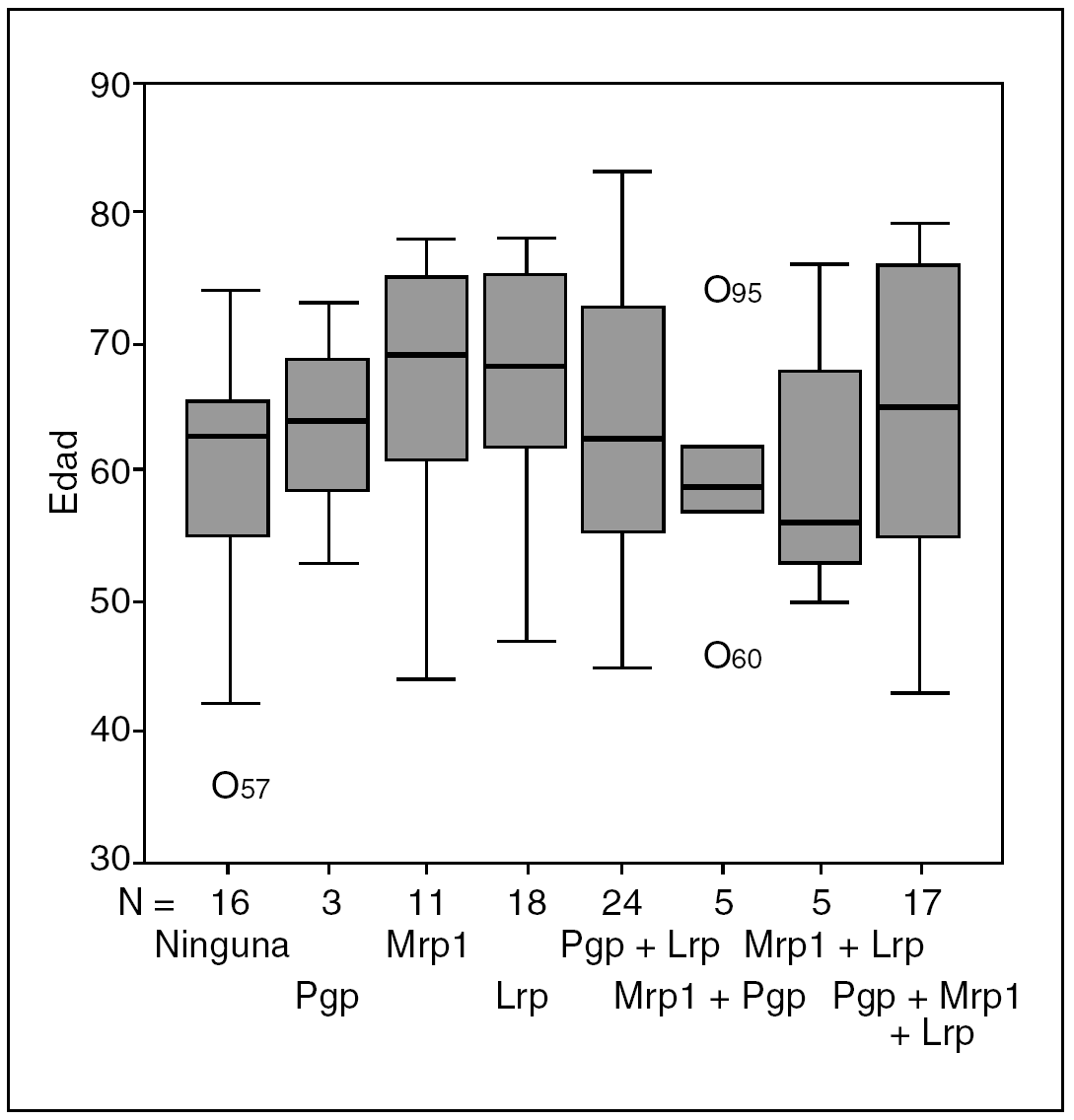
Sin expresión de proteínas: no expresaban ninguna proteína, 16 casos.
Expresión de 1 proteína: expresaban una sola proteína, 32 casos: 3 Pgp, 11 Mrp1 y 18 Lrp = 0.
Expresión de 2 proteínas: expresaban 2 proteínas, 34 casos: 24 Pgp y Lrp, 5 Mrp1 y Pgp, 5 Mrp1 y Lrp=0.
Expresión de las 3 proteínas: expresaban las tres proteínas, 17 casos (tabla 3).
Expresión de MDR-proteínas y su relación con las variables clinicopatológicas
Edad
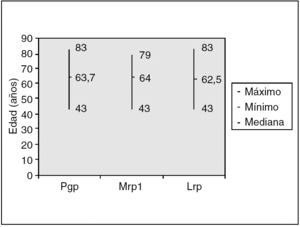
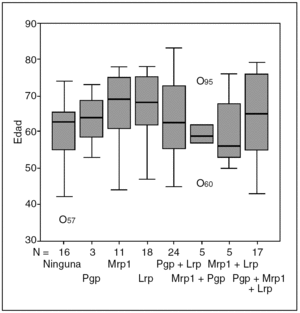
En el análisis de la expresión independiente de cada MDR-proteína, con respecto a la edad, los resultados fueron los siguientes (fig. 3):
Fig. 3. Valores medios ± DE ((desviación estándar) por edades.
Pgp: la media de edad de los pacientes con expresión de Pgp fue de 63,7 ± 10,5 años (rango, 43-83) y la de los pacientes sin expresión de 64,4 a 78 ± 10 años (rango, 36 a 78 ± 10).
Mrp1: la media de edad de los pacientes con expresión de Mrp1 fue de 64 ± 10,6 años (rango, 43-79) y la de los pacientes sin expresión de 64,1 ± 10 (rango, 36-83).
Lrp: la media de edad de los pacientes con expresión de Lrp fue de 64,9 ± 10,2 años (rango, 43-83) y la de los pacientes sin expresión de 62,5 ± 10,2 (rango, 36-78).
No hemos detectado relación significativa entre la edad y la expresión de Pgp (p = 0,74), Mrp1 (p = 0,95) o Lrp (p = 0,26).
Sexo
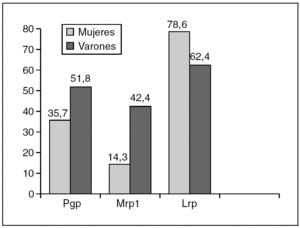
En el análisis de la expresión independiente de cada MDR-proteína con respecto al sexo, los resultados fueron los siguientes (fig. 4):
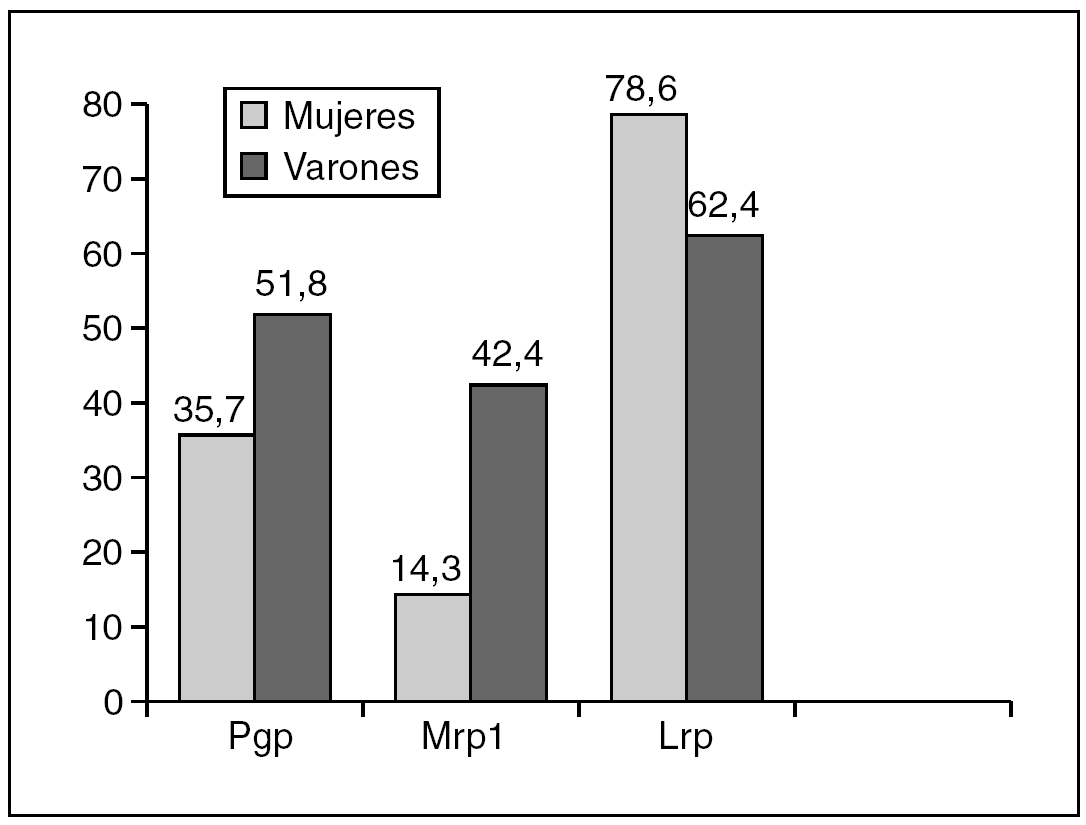
Fig. 4. Porcentaje de expresión de cada MDR-proteína en relación con el sexo. Diferencias significativas para Mpr1 (p = 0,045).
Pgp: expresaban Pgp 5 (35,7%) de las 14 mujeres y 44 (51,8%) de los 85 varones.
Mrp1: expresaban Mrp1 2 (14,3%) de las 14 mujeres y 36 (42,4%) de los 85 varones.
Lrp: expresaban Lrp 11 (78,6%) de las 14 mujeres y 53 (62,4%) de los 85 varones.
Hemos encontrado diferencias significativas entre los dos sexos en la expresión individual de Mrp1 (p = 0,045), pero no de Pgp (p = 0,26) o Lrp (p = 0,24).
Al estudiar la expresión simultánea de MDR-proteínas, los resultados fueron los siguientes:
Sin expresión de proteínas: no expresaban ninguna proteína 3 (21,4%) de las 14 mujeres y 13 (15,3%) de los 85 varones.
Expresión de 1 proteína: de las 14 mujeres, 5 (35,7%) expresaban sólo 1 proteína, Lrp = 0. De los 85 varones, 27 (31,8%) expresaban 1 proteína: 3 Pgp, 11 Mrp1 y 13 Lrp = 0.
Expresión de 2 proteínas: de las 14 mujeres, 5 (35,7%) expresaban 2 proteínas: 4 Pgp y Lrp, 1 Mrp1 y Lrp = 0. De los 85 varones, 29 (34,1%) expresaban 2 proteínas: 20 Pgp y Lrp, 5 Mrp1 y Pgp, 4 Mrp1 y Lrp = 0.
Expresión de las 3 proteínas: de las 14 mujeres, 1 (7,1%) expresaba las 3 proteínas. De los 85 varones, las expresaban 16 (18,8%).
No detectamos diferencias significativas entre sexos, tanto al analizar por el número (p = 0,72) como por el tipo (p = 0,39) de proteínas expresadas de forma simultánea.
Histología
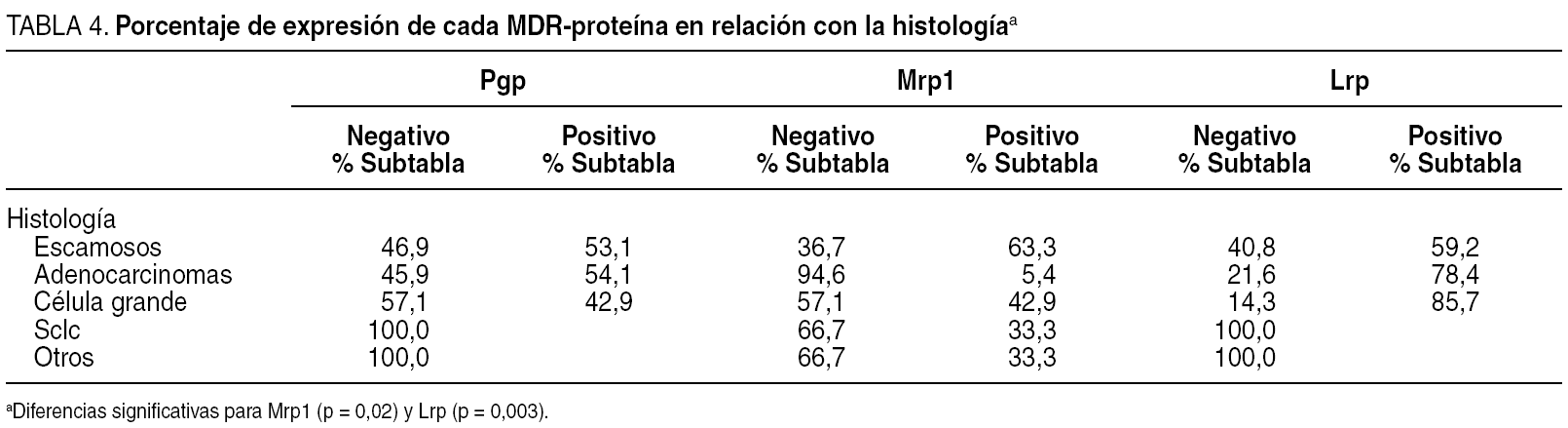
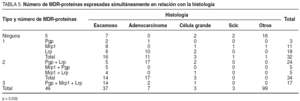
En el análisis de la expresión independiente de cada MDR-proteína con respecto a la histología, los resultados fueron los siguientes (tablas 4 y 5):
Pgp: de los 49 carcinomas escamosos, expresaban Pgp 26 (53,1%), de los 37 adenocarcinomas lo hacían 20 (54,1%), de los 7 carcinomas indiferenciados de célula grande, 3 (42,9%), de los 3 carcinomas indiferenciados de célula pequeña, ninguno (0%) y de los 3 casos con otras histologías, ninguno (0%).
Mrp1: de los 49 carcinomas escamosos, expresaban Mrp1 31 (63,3%), de los 37 adenocarcinomas lo hacían 2 (5,4%), de los 7 carcinomas indiferenciados de célula grande, 3 (42,9%), de los 3 carcinomas indiferenciados de célula pequeña, 1 (33,3%) y de los 3 casos con otras histologías, 1, el caso definido como carcinoma sin más especificación (33,3%).
Lrp: de los 49 carcinomas escamosos, expresaban Lrp 29 (59,2%), de los 37 adenocarcinomas lo hacían 29 (78,4%), de los 7 carcinomas indiferenciados de célula grande 6 (85,7%), de los 3 carcinomas indiferenciados de célula pequeña ninguno (0%) y de los 3 casos con otras histologías ninguno (0%).
Hemos encontrado diferencias significativas entre los diferentes tipos histológicos con respecto a la expresión individual de Mrp1 (p = 0,000) o Lrp (p = 0,003), pero no de Pgp (p = 0,16).
Al estudiar la expresión simultánea de MDR-proteínas, encontramos que expresaban alguna proteína el 100% (7/7) de los carcinomas indiferenciados de célula grande, el 90% (44/49) de los carcinomas escamosos, el 81% (31/37) de los adenocarcinomas, 1 de los 3 carcinomas indiferenciados de célula pequeña y el caso del carcinoma sin más especificación; la distribución fue la siguiente:
Sin expresión de proteínas: de los 49 carcinomas escamosos, no expresaban ninguna proteína 5 (10,2%), de los 37 adenocarcinomas 7 (18,9%), de los 7 carcinomas indiferenciados de célula grande ninguno (0%), de los 3 carcinomas indiferenciados de célula pequeña 2 (66,6%) y de los 3 casos con otras histologías 2, el carcinoma con diferenciación neuroendocrina y el tumor carcinoide (66,6%).
Expresión de 1 sola proteína: de los 49 carcinomas escamosos expresaban una sola proteína 16 (32,7%): 2 Pgp, 8 Mrp1, 6 Lrp = 0. De los 37 adenocarcinomas 11 (29,7%): 1 Pgp, 10 Lrp = 0. De los 7 carcinomas indiferenciados de célula grande 3 (42,9%): 1 Mrp1, 2 Lrp = 0. De los 3 carcinomas indiferenciados de célula pequeña 1 (33,3%): Mrp1. De los 3 casos con otras histologías 1, el caso definido como carcinoma sin más especificación (33,3%): Mrp1.
Expresión de 2 proteínas: de los 49 carcinomas escamosos expresaban dos proteínas 14 (28,6%): 5 Pgp y Lrp, 5 Mrp1 y Pgp, 4 Mrp1 y Lrp = 0. De los 37 adenocarcinomas 17 (45,9%): 17 Pgp y Lrp = 0. De los 7 carcinomas indiferenciados de célula grande 3 (42,9%): 2 Pgp y Lrp, 1 Mrp1 y Lrp = 0. De los 3 carcinomas indiferenciados de célula pequeña ninguno (0%). De los 3 casos con otras histologías ninguno (0%).
Expresión de las 3 proteínas: de los 49 carcinomas escamosos expresaban las 3 proteínas 14 (28,6%). De los 37 adenocarcinomas 2 (5,4%). De los 7 carcinomas indiferenciados de célula grande 1 (14,3%). De los 3 carcinomas indiferenciados de célula pequeña ninguno (0%). De los 3 casos con otras histologías ninguno (0%).
Al realizar el análisis de la expresión simultánea de MDR-proteínas también detectamos diferencias significativas entre los diferentes tipos histológicos, tanto para el número (p = 0,02) como para el tipo (p = 0,002) de MDR-proteínas expresadas simultáneamente.
Grado de diferenciación
En el análisis de la expresión independiente de cada MDR-proteína con respecto al grado de diferenciación, los resultados fueron los siguientes:
Pgp: de de los 20 tumores bien diferenciados expresaban Pgp 13 (65%), de los 35 moderadamente diferenciados 16 (45,7%), y de los 43 pobremente diferenciados 20 (46,5%).
Mrp1: de de los 20 tumores bien diferenciados expresaban Mrp1 10 (50%), de los 35 moderadamente diferenciados 11 (31,4%) y de los 43 pobremente diferenciados 16 (37,2%).
Lrp: de los 20 tumores bien diferenciados expresaban Lrp 14 (70%), de los 35 moderadamente diferenciados 25 (71,4%), y de los 43 pobremente diferenciados 25 (58,1%).
No hemos encontrado diferencias significativas entre los diferentes grados histológicos con respecto a la expresión individual de Pgp (p = 0,35), Mrp1 (p = 0,32), o Lrp (p = 0,31).
En el análisis de la expresión simultánea de MDR-proteínas, encontramos que expresaban alguna de éstas el 90% (18/20) de los tumores bien diferenciados, el 82,9% (29/35) de los moderadamente diferenciados, y el 81,4% (35/43) de los pobremente diferenciados; la distribución fue la siguiente:
Sin expresión de proteínas: de los 20 tumores bien diferenciados no expresaban ninguna proteína 2 (10%), de los 35 moderadamente diferenciados 6 (17,1%), y de los 43 pobremente diferenciados 8 (18,6%).
Expresión de 1 proteína: de los 20 tumores bien diferenciados expresaban 1 sola proteína 5 (25%), de los 35 moderadamente diferenciados 10 (28,6%), y de los 43 pobremente diferenciados 16 (37,2%).
Expresión de 2 proteínas: de los 20 tumores bien diferenciados expresaban 2 proteínas 7 (35%): 5 Pgp y Lrp, 2 Mrp1 y Pgp = 0. De los 35 moderadamente diferenciados 15 (42,9%): 11 Pgp y Lrp, 1 Mrp1 y Pgp, 3 Mrp1 y Lrp = 0. De los 43 pobremente diferenciados 12 (27,9%): 8 Pgp y Lrp, 2 Mrp1 y Pgp, 2 Mrp1 y Lrp = 0.
Expresión de las 3 proteínas: de los 20 tumores bien diferenciados expresaban las 3 proteínas 6 (30%), de los 35 moderadamente diferenciados 4 (11,4%), y de los 43 pobremente diferenciados 7 (16,3%).
Tampoco detectamos diferencias significativas entre los diferentes grados histológicos, tanto para el número (p = 0,59) como para el tipo (p = 0,51) de MDR-proteínas expresadas simultáneamente.
Estadio
En el análisis de la expresión independiente de cada MDR-proteína con respecto al estadio, los resultados fueron los siguientes:
Pgp: de los 45 estadios I expresaban Pgp 25 (55,6%), de los 23 estadios II 9 (39,1%), de los 22 estadios III 12 (54,5%), y de los 9 estadios IV 3 (33,3%).
Mrp1: de los 45 estadios I expresaban Mrp1 17 (37,8%), de los 23 estadios II 8 (34,8%), de los 22 estadios III 9 (40,9%), y de los 9 estadios IV 4 (44,4%).
Lrp: de los 45 estadios I expresaban Lrp 26 (57,8%), de los 23 estadios II 17 (73,9%), de los 22 estadios III 17 (77,3%), y de los 9 estadios IV 4 (44,4%).
No hemos encontrado diferencias significativas entre los diferentes estadios con respecto a la expresión individual de Pgp (p = 0,42), Mrp1 (p = 0,95) o Lrp (p = 0,17).
Al realizar el análisis de la expresión simultánea de MDR-proteínas encontramos que expresaba alguna de éstas el 77,8% (35/45) de los tumores en estadio I, el 91,3% (21/23) de los estadios II, el 90,9% (20/22) de los estadios III y el 77,8% (7/9) de los tumores en estadio IV; la distribución fue la siguiente:
Sin expresión de proteínas: de los 45 tumores en estadio I no expresaban ninguna proteína 10 (22,2%), de los 23 en estadio II 2 (8,7%), de los 22 en estadio III 2 (9,1%), y de los 9 en estadio IV 2 (22,2%).
Expresión de 1 sola proteína: de los 45 tumores en estadio I expresaban 1 sola proteína 11 (24,4%): 1 Pgp, 5 Mrp1 y 5 Lrp = 0. De los 23 en estadio II 11 (47,8%): 2 Pgp, 1 Mrp1 y 8 Lrp = 0. De los 22 en estadio III 6 (27,3%): 2 Mrp1 y 4 Lrp = 0. De los 9 en estadio IV 4 (44,4%): 3 Mrp1 y 1 Lrp = 0.
Expresión de 2 proteínas: de los 45 tumores en estadio I expresaban 2 proteínas 15 (33,3%): 12 Pgp y Lrp, 3 Mrp1 y Pgp = 0. De los 23 en estadio II 7 (30,4%): 3 Pgp y Lrp, 1 Mrp1 y Pgp, y 3 Mrp1 y Lrp = 0. De los 22 en estadio III 10 (45,5%): 7 Pgp y Lrp, 1 Mrp1 y Pgp, y 2 Mrp1 y Lrp = 0. De los 9 en estadio IV 2 (22,2%): 2 Pgp y Lrp = 0.
Expresión de las 3 proteínas: de los 45 tumores en estadio I expresaban las 3 proteínas 9 (20%), de los 23 en estadio II 3 (13,0%), de los 22 en estadio III 4 (18,2%), y de los 9 en estadio IV 1 (11,1%).
Tampoco detectamos diferencias significativas entre los diferentes estadios tumorales, tanto para el número (p = 0,55) como para el tipo (p = 0,21) de MDR-proteínas expresadas simultáneamente.
Análisis de la asociacion entre MDR-proteínas
Hemos estudiado la tendencia de las MDR-proteínas a expresarse en solitario o asociadas a las otras, con los siguientes resultados:
Pgp: de los 49 casos en que se expresó esta proteína, en 3 (6%) lo hizo sola, y en 46 (93%) asociada: con Lrp en 24, con Mrp1 en 5 y en 17 con Lrp y Mrp1 a la vez.
Mrp1: de los 38 casos en que se expresó esta proteína, en 11 (29%) lo hizo sola, y en 27 (71%) asociada: con Pgp en 5, con Lrp en 5 y en 17 con Pgp y Lrp a la vez.
Lrp: de los 64 casos en que se expresó esta proteína, en 18 (28%) lo hace sola, y en 46 (72%) asociada: con Pgp en 24, con Mrp1 en 5 y en 17 con Pgp y Mrp1 a la vez.
La tendencia de Pgp y Lrp a expresarse asociadas ha resultado muy significativa (p = 0,000); no ocurrió lo mismo para la asociación Pgp y Mrp1 (p = 0,18) o Mrp1 y Lrp (p = 0,26).
Discusión
El cáncer de pulmón, por su frecuencia y elevada mortalidad, constituye un importante problema sanitario. A pesar de que es posible prevenirlo incidiendo sobre el hábito tabáquico, los datos epidemiológicos actuales no auguran un futuro muy esperanzador, al menos a medio plazo. Su incidencia a nivel mundial aumenta continuamente a expensas de los países industrializados y, sobre todo, de los que están camino de ello26.
Con los tratamientos actuales sólo tienen opción de curación los pacientes diagnosticados en los estadios iniciales de la enfermedad27, pero la falta de un método eficaz de diagnóstico precoz hace que la mayoría de pacientes se presente con la enfermedad avanzada. Además, la incidencia de recidivas tras un tratamiento, en teoría radical, es elevada27. Por estos motivos, la mayoría de los pacientes con cáncer de pulmón es candidata ha recibir tratamiento quimioterápico en algún momento evolutivo de su enfermedad. Desafortunadamente, los resultados de la quimioterapia son en la actualidad muy modestos: paliación de síntomas y un discreto aumento de supervivencia.
Los procesos genéticos y bioquímicos que condicionan la aparición de un fenotipo celular resistente a la quimioterapia han sido objeto de intenso estudio en los últimos años28. Esto ha conducido a la identificación de varios mecanismos celulares fundamentales y ha permitido el diseño de estrategias para intentar vencer la resistencia a la quimioterapia. Algunas de estas estrategias han sido o están siendo testadas en el ámbito clínico.
Los cultivos celulares han sido fundamentales en el desarrollo de los conocimientos en quimiorresistencia. La selección de líneas celulares resistentes a partir de la exposición de los cultivos a los fármacos antineoplásicos ha permitido identificar mecanismos de resistencia moleculares28. Los xenoinjertos tumorales en modelos animales y el estudio de muestras neoplásicas de pacientes han confirmado la presencia de muchos de estos mecanismos in vivo29, indicando que pueden estar implicados procesos similiares en la resistencia a la quimioterapia en la práctica clínica diaria.
Un destacado mecanismo de resistencia a los fármacos en las células cancerosas es la reducción de la concentración intracelular de éstas en su diana celular. Hay al menos dos estrategias celulares capaces de producir esta situación. El más obvio de estos mecanismos es el que reduce la concentración intracelular del fármaco mediante una disminución de su captación y/o un aumento de su excreción. Un segundo mecanismo podría ser el de una redistribución intracelular del fármaco, de forma que, aunque su concentración intracelular total no varía, la cantidad disponible en su zona de acción es menor. Hasta la actualidad, la mayoría de los mecanismos asociados con la reducción de la concentración o con una redistribución intracelular del fármaco se han relacionado con proteínas transportadoras de membrana, como Pgp y Mrp1, y con otra de más reciente descubrimiento y mecanismo de acción menos conocido, llamada Lrp. En cultivos celulares la expresión de estas proteínas se relaciona directamente con la resistencia a un gran número de quimioterápicos, por lo que también se las conoce como proteínas relacionadas con la resistencia a múltiples fármacos o MDR-proteínas.
En la actualidad no hay datos concluyentes sobre si la expresión de estas proteínas puede estar implicada en la resistencia a la quimioterapia del cáncer de pulmón. La resistencia a la quimioterapia de los enfermos con cáncer de pulmón es un hecho evidente en la práctica clínica diaria. De forma intrínseca o adquirida, esta resistencia afecta a variados agentes antineoplásicos, por lo que presumiblemente se deba a múltiples factores.
El primer paso para averiguar si los mecanismos causantes de resistencia a múltiples fármacos in vitro están implicados en los malos resultados de la quimioterapia en el cáncer de pulmón sería demostrar la presencia de alguno o varios de estos mecanismos en los pacientes con dicho tumor. Dada la frecuencia de esta neoplasia, cualquier mejora en la eficacia del tratamiento, por pequeña que fuese, podría beneficiar a miles de personas. La resistencia a la quimioterapia es uno de los principales obstáculos que es necesario superar para mejorar esta eficacia.
Nuestro estudio tenía como primer objetivo determinar la expresión de 3 MDR-proteínas en el cáncer de pulmón. Los resultados de nuestro estudio confirman la presencia de MDR-proteínas en el cáncer de pulmón. La proteína más expresada fue Lrp, con positividad en el 64% de los pacientes, seguida de Pgp en el 49% y Mrp1 en el 38%. Estos resultados son parecidos a los que se exponen en la bibliografía. Los trabajos iniciales sobre MDR-proteínas en cáncer de pulmón estudiaban la expresión de Pgp y se realizaron hace ya algunos años. Estos primeros estudios, salvo el publicado por Radosevich et al30 en 1989, detectaron una baja expresión de esta proteína, por lo que durante algunos años se aceptó como establecido que Pgp no se expresaba en el cáncer de pulmón y, por tanto, no podía influir en el mal resultado de la quimioterapia. Posteriores estudios han demostrado una mayor expresión de Pgp que, por inmunohistoquímica, se sitúa en un 35-52%. Sobre muestras congeladas, Beer et al27 y Scagliotti et al31 encontraron una expresión del 35 y el 41%, respectivamente, en pacientes con carcinomas de pulmón no célula pequeña. Nosotros hemos encontrado un 49% de expresión de Pgp, un 51% si consideramos sólo los casos de carcinoma no célula pequeña, resultado parecido al publicado por estos autores y que confirma la presencia de una expresión relevante de Pgp en estos tumores.
El abanico de resultados publicados para Mrp1 es más amplio y se sitúa entre el 38 y el 88%, pero ninguno de los trabajos con un número considerable de casos emplea material congelado. El resultado de nuestro estudio se sitúa en un nivel bajo para esta proteína, del 38%, al igual que el de Sugawara et al32.
La proteína con mayor expresión ha sido Lrp, con el 64% de casos. Los trabajos inmunohistoquímicos que incluyen mayor número de pacientes se realizaron en muestras conservadas en parafina, y la expresión de Lrp fue del 45, 57 y 59%, respectivamente. Un estudio sobre tejido congelado, pero con 36 pacientes, detectó nada menos que un 86% de expresión.
Un aspecto importante de nuestro estudio que lo diferencia de la mayoría de los publicados es la determinación de la expresión simultánea de las 3 MDR-proteínas en un mismo paciente. La presumible presencia e interacción de diferentes mecanismos de resistencia en vivo justifican esta importancia. Estudiada la muestra desde este punto de vista, encontramos que el 83% de los pacientes expresaba proteínas, con el 32% expresando 1, el 34% expresando 2 y el 17% expresando las 3. Es decir, el 51% de los pacientes expresaba más de 1 proteína.
Hay pocas publicaciones que hagan referencia a la simultaneidad de expresión de estas 3 MDR-proteínas en cáncer de pulmón. Zhou et al33, en 30 pacientes con NSCLC, encuentran que alrededor de un 40% expresa a la vez Pgp, Mrp1 y Lrp, un porcentaje superior al 17% obtenido por nosotros, pero estos autores emplean muestras conservadas en parafina y el número de casos es menor. En este estudio, aunque los autores no hacen mención expresa de ello, también es Lrp la proteína más expresada, con un 87% de casos. Nuestro estudio detecta una tendencia muy significativa de Pgp y Lrp a expresarse asociadas (el 41% de casos). Nuestro resultado es similar al obtenido por Volm et al34, que en 87 pacientes refieren un 32% de expresión simultánea de Pgp y Lrp.
Otros mecanismos de resistencia, como las alteraciones en la glutatión S-transferasa-¼ o las mutaciones de la p53, se han detectado a la vez que algunas MDR-proteínas en cáncer de pulmón. Éste es el caso de la glutatión S-transferasa-¼ con Pgp y Lrp, o de una p53 mutada con Mrp1 y Pgp. Esta tendencia a la asociación entre diferentes mecanismos de resistencia puede deberse a la presencia de factores comunes de regulación.
Con respecto al grado de diferenciación histológico, aunque sin alcanzar la significación, sí hemos notado que la expresión de cualquiera de las proteínas tiende a ser mayor en los tumores bien diferenciados que en los pobremente diferenciados: 13/20 (65%) frente a 20/43 (46,5%) para Pgp, 10/20 (50%) frente a 16/43 (37,2%) para Mrp1, y 14/20 (70%) frente a 25/43 (58,1%) para Lrp. Algunos autores encontraron que esta disminución de la expresión conforme el tumor se desdiferencia era significativa.
Es en relación con la histología donde se han publicado los resultados más discrepantes. Algunos estudios detectan una menor expresión de MDR-proteínas en los carcinomas indiferenciados de célula pequeña que en los de célula no pequeña, pero otros no. Los pocos estudios de los revisados, que incluyen a más de 30 pacientes con carcinomas indiferenciados de célula pequeña, revelan una expresión de Pgp que oscila entre el 12% para Segawa et al35 y el 26% de Hsia et al36. Para Mrp1, la expresión oscila menos, entre un 31 y un 34% publicado por Hsia et al36. En cuanto a Lrp, los estudios son escasos y poco valorables, y según el método de detección empleado varían del 0% de expresión hasta el 100% de Oguri et al37. Nosotros dispusimos de sólo 3 casos de carcinoma indiferenciado de célula pequeña, un número muy reducido para extraer conclusiones válidas. Detectamos expresión sólo en 1 caso (33,3%) y éste lo fue únicamente para Mrp1, sólo con el AcMo Mrpm6 y en límite inferior de lo considerado positivo (el 10% de células teñidas en la preparación).
Varios autores no encuentran relación entre los diferentes subtipos histológicos de carcinomas no célula pequeña y la expresión de Pgp, Mrp1 o Lrp. En cambio, algunos describen una preferencial expresión de Pgp y fundamentalmente Mrp1 en carcinomas escamosos frente a adenocarcinomas, mientras otros encuentran precisamente lo contrario. Nosotros encontramos diferencias significativas en la expresión de Lrp y Mrp1 entre los diferentes tipos histológicos. Las más llamativas se observan en la expresión de Mrp1, la cual es muy baja en adenocarcinomas frente a carcinomas indiferenciados de célula grande y escamosos, con porcentajes del 5,4, 42,9 y 63,3%, respectivamente. En la menor expresión de Mrp1 en adenocarcinomas coincidimos con algunos autores. En cambio, Lrp se expresa menos en los carcinomas escamosos que en adenocarcinomas y carcinomas indiferenciados de célula grande (el 59,2, el 78,4 y el 85,7%, respectivamente), con lo que discrepamos aunque sólo parcialmente con alguna publicación que encontraba mayor expresión de Lrp en adenocarcinomas y carcinomas escamosos que en indiferenciados de célula grande, y por lo que sus autores sugerían una relación entre Lrp y la diferenciación histológica tumoral. No encontramos diferencias en la expresión de Pgp.
Para los tipos histológicos más frecuentes, la proporción de pacientes que expresan alguna o varias proteínas en nuestro estudio es similar, con un 90% para los carcinomas escamosos, un 81% para los adenocarcinomas y un 100% para los carcinomas indiferenciados de célula grande. Pero entre ellos difieren significativamente en el tipo y el número de proteínas que expresan. Los porcentajes de pacientes con carcinomas escamosos que expresan 1, 2 o las 3 proteínas a la vez son similares: 32,7% (16/49), 28,6% (14/49) y 28,6% (14/49), respectivamente. En cambio, en adenocarcinomas e indiferenciados de célula grande es mucho menos frecuente encontrar a pacientes que expresen las 3 proteínas de manera simultánea: 5,4% (2/37) y 14,3% (1/7), respectivamente. Esto está sobre todo relacionado con la baja expresión de Mrp1 en los adenocarcinomas. Por este motivo, 14 de los 17 casos que expresan simultáneamente las 3 proteínas son carcinomas escamosos. Los adenocarcinomas expresan con frecuencia y de forma simultánea Pgp y Lrp (17 de 37 casos, 45,9%) y también Lrp sola (10 de 37 casos, 27%). En los carcinomas escamosos, Pgp y Lrp aparecen juntas sólo en 5 de los 49 casos (10,2%), y Lrp sólo en 6 casos (12,2%). Los 7 carcinomas indiferenciados de célula grande no tienen predilección por expresar simultáneamente ninguna combinación de proteínas.
Hemos estudiado la tendencia de las MDR-proteínas a expresarse asociadas o no entre ellas y, en caso de asociarse, con cuál. Todas se presentan con más frecuencia asociadas a otras que solas. Cabe destacar la relación entre Pgp y Lrp. Pgp se expresa en 44 casos y, de éstos, lo hace asociada en 41 (93%), en todos ellos con Lrp (41 de 44 casos). La proporción de casos con expresión de Lrp que se asocian a Pgp es del 64% (41/64). Esta tendencia de Pgp y Lrp a expresarse juntas alcanza la significación estadística.
Hemos detectado alguna diferencia con respecto al sexo. En nuestro estudio, las mujeres expresan menos Mrp1 que los varones. Esto puede deberse a que 9 de las 14 mujeres presentaban adenocarcinomas, tipo histológico que ha resultado expresar muy poco esta proteína. Ninguno de los trabajos revisados que hacen referencia al sexo ha encontrado relación entre éste y la expresión de MDR-proteínas, pero sólo 1 de ellos estudiaba en concreto Mrp1. No encontramos diferencias entre sexos para Pgp y Lrp, ni tampoco en cuanto al número de proteínas expresadas de manera simultánea.
El aspecto más importante del estudio de las MDR-proteínas en el cáncer es, lógicamente, su implicación en la respuesta a la quimioterapia. Mientras que en algunos tipos de tumores hematológicos esta implicación está claramente establecida, en tumores sólidos los datos son muy variados y poco concluyentes a este respecto29. Hasta la fecha, en cáncer de pulmón, al contrario de lo que ocurre en otro tipo de neoplasias, fundamentalmente las hematológicas, como hemos indicado, no se puede excluir ni afirmar tal implicación. Nuestro análisis ulterior de estos datos se dirigirá hacia la determinación del valor pronóstico de éstos en relación con la respuesta quimioterápica y la supervivencia38,39. Esperamos que en un plazo razonable podamos aportar dichos datos.
Conclusiones
De los resultados del presente estudio podemos concluir que:
1. El cáncer de pulmón expresa con frecuencia MDR-proteínas.
2. De las 3 MDR-proteínas estudiadas, Pgp Mrp1 y Lrp, es Lrp la más frecuentemente expresada.
3. Los adenocarcinomas expresan menos Mrp1 que el resto de los tipos histológicos.
4. Los carcinomas escamosos expresan menos Lrp que los adenocarcinomas y carcinomas indiferenciados de célula grande.
5. Una proporción importante de pacientes expresa de forma simultánea más de una MDR-proteína.
6. Los carcinomas escamosos son los que con más frecuencia expresan Pgp, Mrp1 y Lrp de forma simultánea.
7. Pgp se expresa fundamentalmente asociada a Lrp.
Correspondencia: Dr. M. Echenique-Elizondo.
Facultad de Medicina. UD San Sebastián. Universidad del País Vasco.
P.o Dr. Begiristain, 105. 20014 San Sebastián. España.
Correo electrónico: gepecelm@sc.ehu.es
Manuscrito recibido el 21-6-2005 y aceptado el 8-7-2005.