La dehiscencia de la anastomosis cervical tras esofagectomía sigue siendo una complicación frecuente y grave que precisa de un diagnóstico precoz y un tratamiento apropiado. El objetivo de este estudio ha sido describir nuestra experiencia con esta complicación.
Pacientes y métodosEstudio retrospectivo (2003-2011) de una serie consecutiva de 77 pacientes con anastomosis esofagogástrica cervical, de los cuales 18 (23,3%) presentaron una dehiscencia anastomótica. Las fístulas se clasificaron en 4 tipos según la presentación clínica, los datos radiológicos (esofagograma/tomografía computarizada), los hallazgos en las reoperaciones y, desde el año 2010, la exploración endoscópica. La fístula tipo i corresponde a una fuga subclínica, la tipo ii presenta síntomas a nivel cervical, la tipo iii se asocia con manifestaciones clínicas respiratorias secundarias a una colección pleural o mediastínica y la tipo iv, con un cuadro sistémico secundario a una necrosis de la plastia.
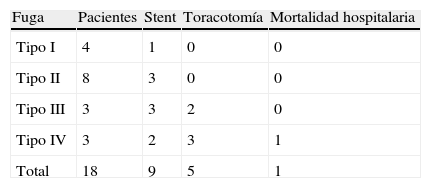
ResultadosEn 4 pacientes (22,2%) la fístula se clasificó como tipo i, en 8 (44,4%) como tipo ii, en 3 (16,6%) como tipo iii y en otros 3 (16,6%) como tipo iv. Ocho pacientes fueron tratados de forma conservadora, en 9 se utilizó una prótesis autoexpansible, 5 requirieron toracotomía y un paciente (tipo iv) falleció. Los pacientes con fuga presentaron una mayor morbilidad (61 frente a 30%; p=0,019) y una estancia hospitalaria más larga (mediana de 28,5 vs.14 días; p=0,009) en comparación con aquellos pacientes que no la desarrollaron.
ConclusionesCasi la cuarta parte de las anastomosis esofagogástricas cervicales presenta algún tipo de fuga anastomótica. Aunque la mayoría puede ser tratada de forma conservadora o endoscópicamente, su aparición está gravada con una elevada morbimortalidad.
Cervical anastomotic leaks after esophagectomy are still a frequent and severe complication that needs an early diagnosis and an appropriate treatment. The aim of this study was to describe our experience with the management of this complication.
Patients and methodsRetrospective study (2003-2011) of a consecutive series of 77 patients with a cervical esophagogastric anastomosis, 18 of them (23.3%) presenting a leak. Fistulae were classified into 4 groups depending on clinical presentation, radiology (esophagogram or CT), surgical findings (in case of re-operation) and, since 2010, endoscopic examination. Type i leaks were an asymptomatic or radiographic leak, type ii had local signs limited to the neck, type iii was associated with respiratory symptoms due to a pleural or mediastinal collection, and type iv with a systemic disorder secondary to gastric necrosis.
ResultsFour patients (22.2%) were classified as type i, 8 (44.4%) as type ii, 3 (16.6%) as type iii, and 3 (16.6%) as type iv. Eight patients were managed conservatively; in 9 a self-expanding stent was used, 5 required a thoracotomy, and one of them (type iv) died. Leaks were related to a higher associated morbidity (61 versus 30%; P=.019) and a longer hospital stay (median of 28.5 vs 14 days; P=.009).
ConclusionsAlmost one quarter of cervical esophagogastric anastomoses present some kind of anastomotic leak. Although most of them can be treated conservatively or by endoscopy, they are associated with an increase in morbidity and mortality.
Definimos la fuga anastomótica como la pérdida de continuidad y posterior extravasación del contenido intraluminal a su través. Por tratarse de anastomosis esofágicas, incluimos también en este apartado las necrosis de la plastia gástrica, donde una fuga puede ser su manifestación tardía.
La incidencia de fuga anastomótica a nivel cervical postesofagectomía varía ampliamente en la literatura, con un rango que varía en centros de referencia entre el 10 y el 25%1,2. Su aparición se asocia a un incremento significativo de la morbilidad perioperatoria, estenosis tardía3 y una mortalidad entre 3 y 10%4,5.
Se han aducido múltiples factores que influyen en el desarrollo de una dehiscencia anastomótica, tales como el estado nutricional y las comorbilidades del paciente, la tensión de la anastomosis, el grado de isquemia y fragilidad de los tejidos, su localización (cuello o tórax) y la terapia neoadyuvante, siendo los principales aquellos que están relacionados con la alteración de la perfusión de oxígeno1,5–9.
La fuga se presenta de diferentes formas y la gravedad para el paciente estará definida principalmente por la localización de la fuga, su extensión, la viabilidad de la plastia gástrica, el tiempo transcurrido hasta el tratamiento y la repercusión sistémica. La identificación precoz y el tratamiento adecuado permiten reducir la morbimortalidad4.
El objetivo de este estudio ha sido analizar, en nuestra experiencia, el diagnóstico y el tratamiento de una serie de pacientes con fugas en las anastomosis cervicales.
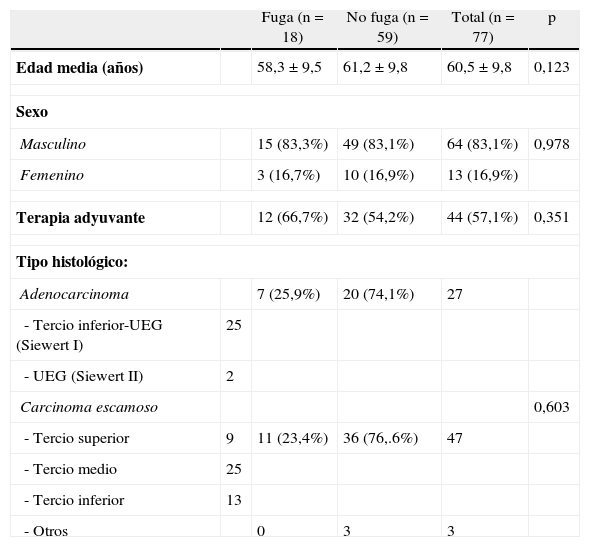
Pacientes y métodosEntre los años 2003 y 2011, 112 pacientes con neoplasias de esófago fueron intervenidos en la Sección de Cirugía Esófago-Gástrica del Hospital Universitario Donostia de San Sebastián por el mismo equipo quirúrgico. Se realiza un estudio retrospectivo, de corte longitudinal, incluyendo a los 77 pacientes a los que se les practicó una esofagectomía con anastomosis esofagogástrica cervical. Presentaron fuga anastomótica 18 pacientes, que han sido el objeto de nuestro estudio. La tabla 1 muestra los datos demográficos de estos pacientes, así como el tipo histológico y localización de los tumores intervenidos.
Datos demográficos
| Fuga (n=18) | No fuga (n=59) | Total (n=77) | p | ||
| Edad media (años) | 58,3±9,5 | 61,2±9,8 | 60,5±9,8 | 0,123 | |
| Sexo | |||||
| Masculino | 15 (83,3%) | 49 (83,1%) | 64 (83,1%) | 0,978 | |
| Femenino | 3 (16,7%) | 10 (16,9%) | 13 (16,9%) | ||
| Terapia adyuvante | 12 (66,7%) | 32 (54,2%) | 44 (57,1%) | 0,351 | |
| Tipo histológico: | |||||
| Adenocarcinoma | 7 (25,9%) | 20 (74,1%) | 27 | ||
| - Tercio inferior-UEG (Siewert I) | 25 | ||||
| - UEG (Siewert II) | 2 | ||||
| Carcinoma escamoso | 0,603 | ||||
| - Tercio superior | 9 | 11 (23,4%) | 36 (76,.6%) | 47 | |
| - Tercio medio | 25 | ||||
| - Tercio inferior | 13 | ||||
| - Otros | 0 | 3 | 3 | ||
UEG: unión esofagogástrica.
Se utilizaron técnicas mínimamente invasivas en 73 de los 77 pacientes. En 65 pacientes se realizó una esofagectomía en 3 campos y en 12 pacientes se recurrió a una esofagectomía transhiatal. La técnica en 3 campos se inicia por vía toracoscópica; hasta 2007 se realizaba en decúbito lateral izquierdo y posteriormente en decúbito prono, mediante 3 trocares (2 de 10mm y uno de 5mm), procediéndose a la evaluación de la resecabilidad, sección del cayado de la vena ácigos y disección del esófago en bloque. A continuación, por vía laparoscópica, se realiza la movilización y tubulización gástrica a expensas de curvatura mayor mediante endograpadoras lineales de carga azul (3,5mm), dejando una plastia de unos 4-5cm de ancho.
La técnica transhiatal por vía laparoscópica reproduce el procedimiento clásico descrito por Orringer10. En ambos casos, la pieza quirúrgica se extrae a través de una cervicotomía lateral izquierda y se realiza la anastomosis esofagogástrica. Como criterio general, si la plastia llega holgadamente al cuello se realiza una anastomosis semimecánica latero-lateral tipo Collard11 (49 casos) o semimecánica latero-lateral tipo Orringer10 (9 casos). Si la plastia no tiene suficiente holgura, se realiza una anastomosis manual término-terminal (19 casos) en un plano, con puntos sueltos de material reabsorbible.
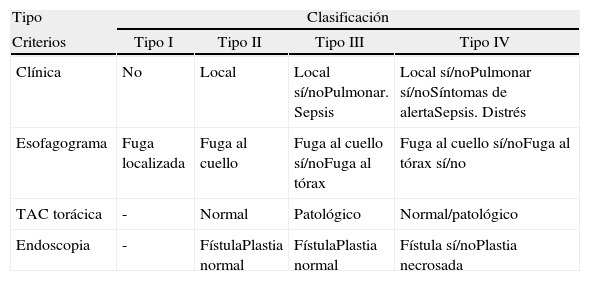
Diagnóstico y clasificación de las fugas anastomóticasHabitualmente, realizamos un estudio radiológico con contraste el sexto día postoperatorio. En caso de mala evolución clínica y sospecha de complicaciones se solicita una tomografía computarizada (TC) con contraste y, desde el año 2010, una endoscopia. Con la introducción de la endoscopia, hemos adoptado una clasificación basada en criterios clínicos (afectación local o sistémica), radiológicos (forma de extensión de la fístula) y endoscópicos (tamaño de dehiscencia y afectación de la gástrica), inspirada en una serie de artículos publicados recientemente1,4,12 (tabla 2). Ateniéndonos a esta clasificación y aunque la endoscopia en la serie histórica no fue utilizada sistemáticamente hasta el año 2010, los pacientes que presentaron fuga anastomótica fueron clasificados con los anteriores criterios a partir de sus principales características clínicas, datos radiológicos y por los hallazgos quirúrgicos en el caso de reintervenciones.
Clasificación de las fugas anastomóticas cervicales
| Tipo | Clasificación | |||
| Criterios | Tipo I | Tipo II | Tipo III | Tipo IV |
| Clínica | No | Local | Local sí/noPulmonar. Sepsis | Local sí/noPulmonar sí/noSíntomas de alertaSepsis. Distrés |
| Esofagograma | Fuga localizada | Fuga al cuello | Fuga al cuello sí/noFuga al tórax | Fuga al cuello sí/noFuga al tórax sí/no |
| TAC torácica | - | Normal | Patológico | Normal/patológico |
| Endoscopia | - | FístulaPlastia normal | FístulaPlastia normal | Fístula sí/noPlastia necrosada |
Las complicaciones asociadas a las fugas en relación con aquellos que no las presentaron se clasificaron según los criterios propuestos por Clavien para las complicaciones quirúrgicas13,14, que consideran conjuntamente el nivel de gravedad y el tipo de actuación requerida.
En caso de indicación de colocación de un stent como tratamiento de las fugas anastomóticas, el Servicio de Radiología intervencionista ha utilizado la prótesis autoexpansible tipo SX-ELLA Esophageal HV de Biomed® (Hradec Králové, República Checa), que es irreabsorbible, recubierta y metálica de 20mm de diámetro, con una longitud que varía entre 85 y 135mm. La prótesis se retira por vía endoscópica al cabo de 6 a 8 semanas.
Análisis estadísticoLas variables continuas fueron expresadas como medianas con rango intercuartil (percentil 25-75). Se empleó la prueba t de Student para comparar las distribuciones de datos continuos y la prueba de chi-cuadrado para comparar las variables cualitativas. El análisis estadístico se realizó con el Statistical Package for Social Science 17.0 (SPSS, Inc., Chicago, IL, EE. UU.).
ResultadosDieciocho (23,3%) de los 77 pacientes con anastomosis esofagogástricas a nivel cervical desarrollaron una dehiscencia, que según la clasificación propuesta previamente fueron divididas en los siguientes tipos:
- -
Tipo I: 4 pacientes (22,2%). Fueron detectadas en el esofagograma de control que se realizó al sexto día postoperatorio. Ninguno de los pacientes presentaba clínica asociada.
- -
Tipo II: 8 pacientes (44,4%). Presentaron tan solo síntomas locales en la herida cervical alrededor de la primera semana del periodo postoperatorio y la fístula drenó al exterior, ya fuera de forma espontánea o tras apertura de la herida quirúrgica.
- -
Tipo III: 3 pacientes (16,6%). Afectación sistémica que apareció entre el sexto y decimotercer día postoperatorio. La expansión de la fuga hacia el tórax produjo un gran compromiso respiratorio en estos pacientes.
- -
Tipo IV: 3 pacientes (16,6%). Estos pacientes presentaron un grave deterioro sistémico e inestabilidad hemodinámica. En 2 pacientes la necrosis de la plastia se descubrió durante la toracotomía y en uno de ellos, por endoscopia.
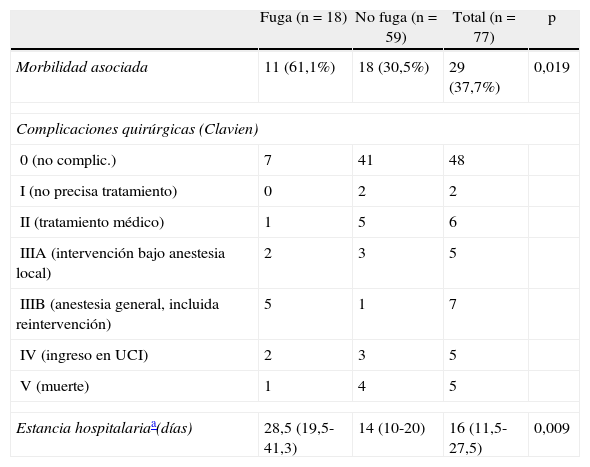
La tabla 3 muestra la morbilidad asociada, la estancia hospitalaria y la complejidad de las complicaciones quirúrgicas según la clasificación de Clavien modificada13,14 en los pacientes con fuga y sin fuga anastomótica. La morbilidad asociada, entendiendo como tal «otras complicaciones sin incluir la fuga», fue cuantitativamente mayor y con significación estadística entre los pacientes con fuga, al igual que la mediana de la estancia hospitalaria. Cualitativamente, utilizando la clasificación modificada de Clavien, el nivel de gravedad de las complicaciones fue similar en ambos grupos. Aunque los enfermos con fuga requirieron más procedimientos intervencionistas, los pacientes sin fuga presentaron mayor mortalidad.
Curso postoperatorio de los pacientes intervenidos
| Fuga (n=18) | No fuga (n=59) | Total (n=77) | p | |
| Morbilidad asociada | 11 (61,1%) | 18 (30,5%) | 29 (37,7%) | 0,019 |
| Complicaciones quirúrgicas (Clavien) | ||||
| 0 (no complic.) | 7 | 41 | 48 | |
| I (no precisa tratamiento) | 0 | 2 | 2 | |
| II (tratamiento médico) | 1 | 5 | 6 | |
| IIIA (intervención bajo anestesia local) | 2 | 3 | 5 | |
| IIIB (anestesia general, incluida reintervención) | 5 | 1 | 7 | |
| IV (ingreso en UCI) | 2 | 3 | 5 | |
| V (muerte) | 1 | 4 | 5 | |
| Estancia hospitalariaa(días) | 28,5 (19,5-41,3) | 14 (10-20) | 16 (11,5-27,5) | 0,009 |
Respecto a los tipos de anastomosis, las fugas ocurrieron en 9 de 49 anastomosis semimecánicas latero-laterales (18,4%) realizadas según la técnica de Collard, en 4 de 9 (44,4%) anastomosis semimecánicas realizadas según la técnica de Orringer y en 5 de 19 anastomosis manuales (26,3%).
Las fugas tipo i fueron tratadas de forma conservadora mediante observación, excepto en un caso, que se resolvió con la colocación de un stent (tabla 4). Todos los pacientes evolucionaron favorablemente.
De los 8 pacientes con fuga tipo ii, 5 fueron tratados de manera conservadora y a 3 se les colocó un stent. La indicación del stent, una vez tratada localmente la herida del cuello, se estableció con criterios muy subjetivos, dependiendo fundamentalmente del débito de la fuga y del tiempo de resolución de la fístula. La evolución hospitalaria de estos pacientes fue satisfactoria y, en el momento del alta hospitalaria, todos seguían alimentación oral.
A los 3 pacientes con fuga tipo iii se les colocó un stent, si bien 2 de ellos precisaron, además, una toracotomía para el drenaje adecuado del tórax. Los 3 pacientes evolucionaron favorablemente.
En los 2 primeros pacientes, anteriores al año 2010, con fuga tipo iv, se intentó inicialmente controlar la dehiscencia de la anastomosis mediante la colocación de un stent. Sin embargo, en ambos empeoró la sintomatología y se produjo un deterioro del estado general por lo que fueron reintervenidos, confirmándose en la toracotomía la necrosis de la plastia gástrica. En uno de ellos se realizó una exclusión bipolar del esófago y sobrevivió; en el otro paciente no se realizó exclusión y se intentó controlar la fuga mediante la colocación de un nuevo stent, pero tras un ingreso prolongado el paciente finalmente falleció. Al tercer paciente, posterior al año 2012, y cuya necrosis fue descubierta por endoscopia, se le reintervino de manera inmediata, realizándosele una exclusión bipolar del esófago con esofagostomía y gastrostomía. Los 2 pacientes con exclusión bipolar de la serie que sobrevivieron fueron intervenidos en un ingreso posterior y se les reconstruyó la continuidad digestiva con una coloplastia.
En 9 pacientes se utilizó el stent para conseguir el cierre de la fístula. En ningún caso hubo problemas en la colocación del mismo. En los 7 casos de fugas tipo i, ii y iii el stent consiguió sellar la fístula y, tras su retirada, se comprobó endoscópicamente su cierre. En los 2 casos de fugas tipo iv anteriores al año 2010, y en los que no se realizó endoscopia, el stent no dio resultado, por lo que retrasó una toma de decisión correcta.
La mortalidad hospitalaria en los pacientes con fuga fue de 5,5%, pero hay que contabilizar otro fallecimiento tras el alta. Se trataba de un paciente con fuga tipo ii al que se colocó un stent y que presentó una neumonía por aspiración masiva.
A medio plazo, 6 de los 18 pacientes (33,3%) con fuga desarrollaron una estenosis de la anastomosis y precisaron dilataciones neumáticas. En pacientes sin fuga esta complicación ocurrió en 5 de 59 pacientes (8,5%). La media de sesiones de dilataciones fue de 3.
DiscusiónA pesar de que la fuga anastomótica representa una de las complicaciones más frecuentes y graves después de la esofagectomía, hasta el momento no se ha conseguido un consenso sobre su definición y clasificación1,4,7,15,16, lo que condiciona que los resultados sean muy dispares. Algunos autores definen las fugas basándose en los hallazgos radiológicos, mientras que otros lo hacen a partir de su impacto clínico2,7,8,15–17.
En 4 series amplias18–21, con 3.129 pacientes intervenidos, el porcentaje de dehiscencias osciló entre 12 y 21%. En nuestra serie, la incidencia de fuga cervical tras esofagectomía por cáncer es del 23,3%; no obstante dos terceras partes de las fugas son de tipo i y ii, que no tienen repercusión sistémica y son más sencillas de tratar.
La variabilidad de los resultados se asocia con una gran variabilidad en su tratamiento, dado que el manejo de las fugas, en general, y el uso de endoprótesis22, en particular, es con frecuencia una decisión intuitiva y no responde a una estrategia preestablecida. En nuestra serie un paciente con fístula tipo i fue sobretratado con un stent, aunque es posible que hubiera sido suficiente con la simple observación. El análisis de nuestra experiencia nos ha llevado a reconocer la necesidad de diseñar un protocolo para conseguir un diagnóstico precoz de esta complicación y mejorar los resultados.
Un sinnúmero de clasificaciones han sido utilizadas para valorar la gravedad de las fugas1,4,7,12,15. Entre ellas, Veeramootoo et al.4 tienen en cuenta criterios clínicos, analíticos y radiológicos; el grupo de DeMeester23 utiliza principalmente la endoscopia y el grupo de Luketich3 se basa en criterios clínicos y endoscópicos.
Las manifestaciones clínicas pueden ser muy dispares, desde un paciente asintomático en las fugas tipo i hasta cuadros muy graves como el distrés o el shock séptico en las fugas tipo iv. Esta variación depende del tamaño de la fuga, su forma de difusión y la presencia de isquemia o necrosis en la plastia gástrica17. Síntomas y signos como la taquicardia supraventricular, fibrilación auricular, alteración del estado mental, aumento de los requerimientos de oxígeno, fiebre, hipotensión, disminución de la diuresis, y/o sepsis nos alertan de la posible presencia de una fuga anastomótica y deberían estimular un mayor nivel de sospecha en cuanto a su diagnóstico1.
El esofagograma es el procedimiento más comúnmente utilizado para valorar la seguridad de una anastomosis esofágica. En nuestro centro se realiza de rutina el sexto día postoperatorio, y permite definir la ubicación y la forma de difusión de las fugas. Hay autores que propugnan que no es necesaria su realización, dada la frecuencia de falsos negativos4,24. La TC con contraste nos aporta una gran información sobre la expansión de la fuga y sus consecuencias en la cavidad torácica. No obstante, ni el esofagograma ni una TC normal descartan una isquemia de la plastia gástrica12.
La introducción de la endoscopia en el diagnóstico de las fugas anastomóticas ha permitido valorar con mayor exactitud la isquemia/necrosis de la plastia gástrica y la magnitud de la dehiscencia anastomótica25. La isquemia/necrosis es uno de los factores de riesgo más importantes para la producción de fuga anastomótica4 y puede ser potenciado por la alteración del flujo sanguíneo gástrico tras la construcción de la plastia, por tensión en los bordes anastomóticos, por una distensión temprana de la plastia, por inestabilidad hemodinámica (incluyendo el uso de agentes vasopresores) o por aporte disminuido de oxígeno (anemia aguda e hipoxemia)16. Existe cautela y reticencia en cuanto al uso de la endoscopia como método diagnóstico en estos pacientes12,16, ante la posibilidad de causar una lesión de la anastomosis recién confeccionada debido al traumatismo físico causado por el endoscopio o por la insuflación de aire durante la exploración. Su introducción en nuestro protocolo nos ha permitido diagnosticar una fístula tipo iv el quinto día postoperatorio, así como su tratamiento inmediato12,23.
Por otro lado, como se ha señalado, la morbilidad asociada y la estancia hospitalaria en nuestra serie aumentan de forma significativa en relación directa con la fuga anastomótica. Obviamente, entre los pacientes con fuga confirmada, existe una mayor necesidad de utilizar o prolongar procedimientos invasivos como drenajes, sondas o vías que redundan en un aumento de la estancia en cuidados intensivos y en consecuencia de la estancia hospitalaria global17,26. Sin embargo, como se observa en la tabla 3, los pacientes sin fuga no están exentos de complicaciones graves y la mortalidad es principalmente debida a otras causas distintas de la fuga, respiratorias en particular.
El tipo de anastomosis realizada ha influido sobre la incidencia de fugas. La anastomosis semimecánica latero-lateral propuesta por Collard ha sido la que menos fugas ha presentado (18,4%) y, por el contrario, la semimecanica latero-lateral descrita por Orringer nos ha dado malos resultados (44,4%). La causa de esta diferencia quizás radique en que las plastias gástricas estrechas son poco adecuadas para las anastomosis tipo Orringer10, por lo que las hemos abandonado.
La incidencia de estenosis tardías en nuestra serie ha sido del 33,3% en los pacientes con fuga y del 8,5% en los pacientes sin fuga. Esta cifra es sensiblemente inferior a la que observamos en la literatura, donde casi dos terceras partes de los pacientes con fuga precisarán una o varias dilataciones neumáticas, frente al 21% de los pacientes sin fuga3.
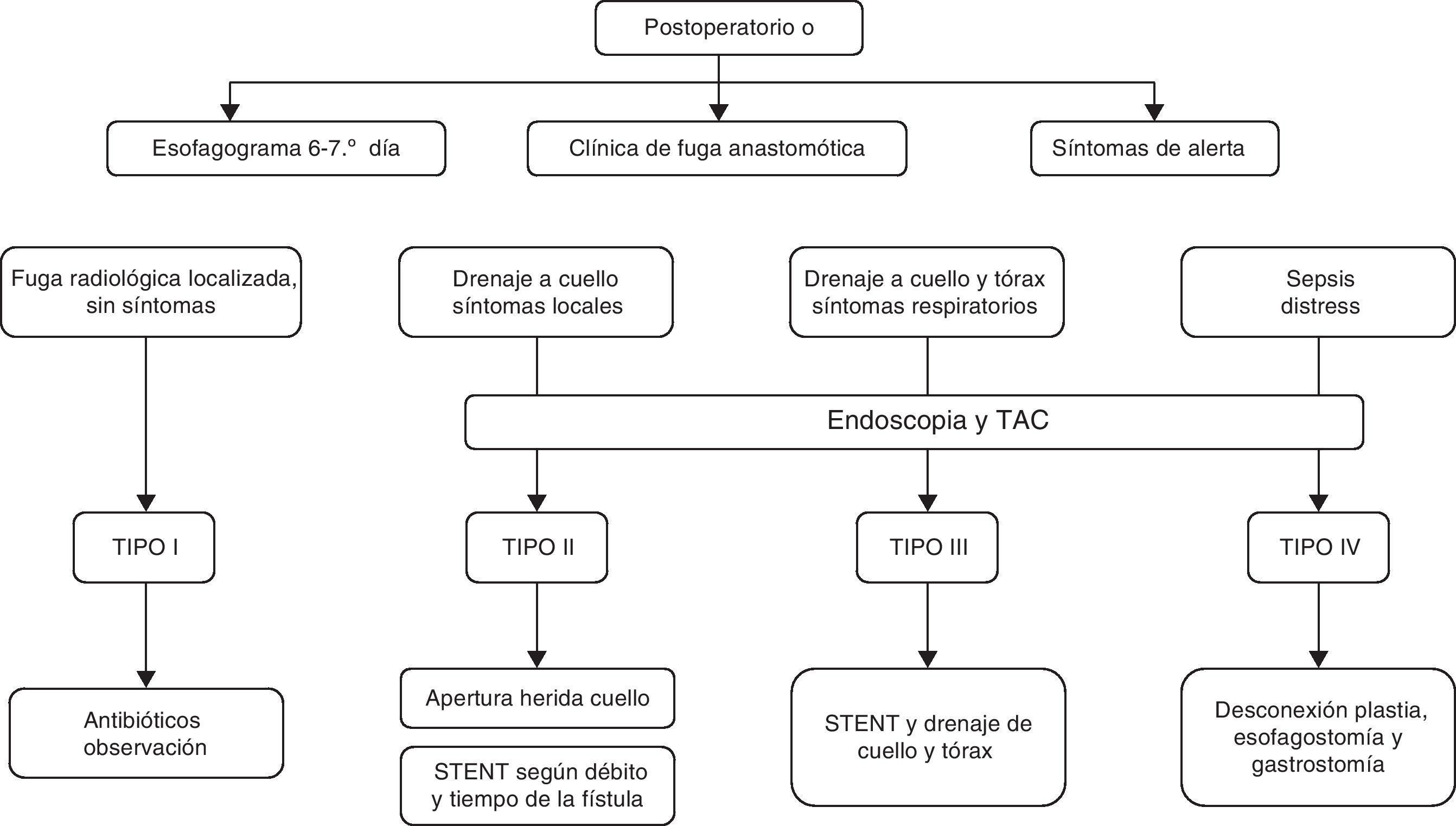
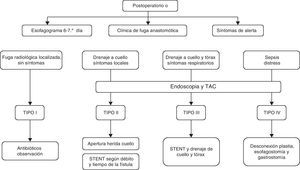
Nuestro actual algoritmo diagnóstico-terapéutico para el tratamiento de las fugas se muestra en la figura 1. El uso de endoprótesis y el drenaje de las colecciones cobran un protagonismo especial en el control tanto del origen de la fuga como de sus consecuencias. En el caso concreto de las fugas tipo iv, el algoritmo sugiere la desconexión inmediata cuando existe isquemia con repercusión sistémica. Creemos que su aplicación sistemática, en particular con la utilización de la endoscopia en el diagnóstico precoz, aunque no hubiera modificado sustancialmente el tratamiento realizado, muy probablemente habría reducido las demoras en la sucesión de las medidas adoptadas.
En conclusión, la fuga anastomótica tiene un impacto significativo en el curso perioperatorio del paciente. La revisión que hemos llevado a cabo en nuestros pacientes y la experiencia adquirida nos han permitido sistematizar su proceso diagnóstico y terapéutico y elaborar una propuesta de algoritmo que necesita ser validado en una serie prospectiva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.