Los tumores del estroma gastrointestinal (GIST) representan el 2% de los tumores digestivos. La cirugía constituye el único método curativo en los casos localizados. El abordaje laparoscópico se ha extendido en los últimos años. Presentamos nuestra experiencia en el tratamiento de los GIST.
Material y métodosEntre 1997 y 2010 se ha intervenido con intención curativa a 40 pacientes de un total de 45 diagnosticados de GIST. Recogimos prospectivamente datos referentes a: características demográficas, localización y biología tumoral, diagnóstico, tipo de cirugía y resultados de la misma.
ResultadosSe trataba de 24 varones y 16 mujeres con una edad media de 66,7 años. La localización fue gástrica en 24 casos (60%), en el intestino delgado 13 (32,5%), en el colon 2 (5%) y en el esófago 1 (2,5%). Fueron intervenidos por laparotomía 27 casos, 12 mediante laparoscopia (1 toracoscopia) y 1 resección endoscópica en tumor de sigma. Tras una mediana de seguimiento de 31 meses (2-120) han recidivado 4 casos (10%) todos tras laparotomía. Dos pacientes del grupo de laparotomía han fallecido por la neoplasia. Tras el estudio univariante los factores pronósticos para la RL fueron: tamaño tumoral (p=0,0001), número de mitosis (p=0,001), tratarse de un tumor localmente avanzado (p=0,01) y la rotura tumoral (p=0,002). Tras el estudio multivariante solo permanece el tamaño (p=0,029; RR 1,363; IC 95% 1,033-1,799). Para la supervivencia, tras el estudio univariante, se muestra significativa la presencia de tumor localmente avanzado, mientras que ningún factor se muestra significativo tras el estudio multivariante.
ConclusionesLa correcta estadificación preoperatoria es básica para la decisión del abordaje quirúrgico a emplear.
Gastrointestinal stromal tumours (GIST) make up 2% of gastrointestinal tumours. Surgery is the only treatment method in localised cases. The laparoscopic approach has increased over the last few years. We present our experience in the treatment of GIST.
Material and methodsA total of 40 patients with 45 GIST had been subjected to surgical treatment between 1997 and 2010. Data was retrospectively collected on, demographic characteristics, location and tumour biology, diagnosis, type of surgery and the results of that surgery.
ResultsA total of 24 males and 16 women, with a mean age of 66.7 years, were treated. The location was gastric in 24 cases (60%), small intestine in 13 (32.5%), colon in 2 (5%) and oesophagus in 1 case (2.5%). Laparotomy was performed in 27 cases, 12 by laparoscopy (1 thoracoscopy), and 1 endoscopic sigmoid tumour resection. Four cases (10%), all after laparotomy, had recurred after a median follow-up of 31 months (2-120), and 2 patients of the laparotomy group died due to their cancer. After a univariate analysis, the prognostic factors for a laparoscopic recurrence were: tumour size (P=.0001), mitosis number (P=.001), being a locally advanced tumour (P=.01) and a ruptured tumour (P=.002). Only size remained as a prognostic factor after the multivariate analysis (P=.029; RR 1.363; 95% CI; 1.033-1.799). The presence of a locally advanced tumour was shown to be significant in the univariate analysis, while there were no significant factors after the multivariate analysis.
ConclusionsCorrect preoperative staging is essential for deciding which surgical approach to employ.
Los tumores del estroma gastrointestinal (GIST) representan el 2% de los tumores del aparato digestivo1. Pueden originarse en cualquier porción del tubo digestivo desde el esófago al recto. La localización más frecuente es gástrica (60%), seguida del intestino delgado (25-30%), colon y recto (10%) y cavidad abdominal (5%)2. Su comportamiento varía desde los claramente benignos hasta los metastásicos al diagnóstico. Se han utilizado distintas clasificaciones para intentar predecir el comportamiento de los mismos que tienen en cuenta el tamaño tumoral, el número de mitosis por 50 campos de gran aumento (CGA) y la localización tumoral3,4.
La cirugía constituye el único método curativo en los casos de tumores localizados y se debe realizar en el contexto de un abordaje multidisciplinar que incluya cirujanos, radiólogos, patólogos y oncólogos5,6. A pesar de no existir un consenso sobre qué tumores son subsidiarios de un tratamiento laparoscópico, cada vez son más los autores que propugnan dicho acceso7–9. Los factores determinantes del acceso laparoscópico han sido clásicamente el tamaño y la localización10,11, aunque recientemente se han publicado series con excelentes resultados tanto en tumores de mayor tamaño como en tumores de localización intestinal12,13.
El objetivo del presente estudio es mostrar la experiencia de nuestra unidad en el manejo quirúrgico de estos tumores.
Material y métodosAnalizamos de forma retrospectiva los datos de los pacientes diagnosticados de GIST en nuestro hospital durante el periodo 1997-2010. De los 45 casos diagnosticados, 40 de ellos fueron intervenidos con intención curativa (cirugía R0 o R1) y son la base de nuestro estudio.
El diagnóstico preoperatorio fue mediante TC en todos los casos, endoscopia en los localizados en estómago y a partir de 2007 ecoendoscopia para los localizados en estómago y esófago.
Se analizan los datos referentes a edad, sexo, localización, tipo histológico, inmunohistoquimia, tamaño, número de mitosis por 50 CGA, tipo de cirugía, hallazgos durante la cirugía, resultados de la cirugía, rotura tumoral intraoperatoria, márgenes de resección, complicaciones postoperatorias, recidiva y supervivencia.
Los pacientes fueron clasificados en grupos de riesgo de recidiva según la clasificación propuesta por Fletcher et al.2
Definimos los tumores como localmente avanzados cuando en los estudios preoperatorios o en los hallazgos durante la intervención se aprecia afectación de algún órgano distinto al de origen pero que no contraindica la resección quirúrgica curativa.
El abordaje por laparoscopia fue iniciado en 2005, para los tumores localizados en estómago y con un tamaño menor de 5cm. Posteriormente la indicación de laparoscopia fue ampliada a los tumores localizados en intestino delgado y en esófago y a los tumores de mayor tamaño considerados como localizados en la estadificación preoperatoria. La decisión de abordaje laparoscópico se tomó de forma individualizada para cada paciente teniendo en cuenta la estadificación preoperatoria. No utilizamos de forma rutinaria estudio anatomopatológico de los bordes de resección.
Desde 2009 los pacientes con riego alto de recidiva reciben tratamiento adyuvante con imatinib (400mg/día) durante un año.
El seguimiento fue realizado mediante valoración clínica y TC cada 6 meses durante los 2 primeros años, anual hasta los 5 años y control clínico anual posteriormente. Se realizó gastroscopia anual durante los 2 primeros años postoperatorios en los casos de tumores gástricos.
La recidiva local (RL) se definió como el crecimiento del tumor en la misma localización del tumor original o en cavidad abdominal. La recidiva metastásica se definió como la presencia de tumor en hígado o cualquier órgano extraabdominal.
Para analizar los factores que tienen relación con la recidiva y la supervivencia se realizó una regresión logística de Cox. La significación se estableció para un valor de p<0,05.
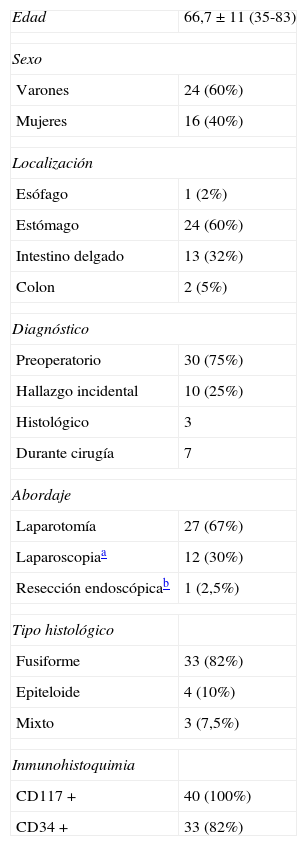
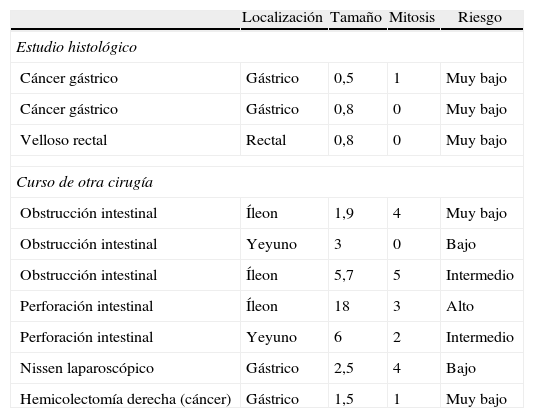
ResultadosSe intervino con intención curativa a un total de 40 pacientes, 24 varones y 16 mujeres, con una edad media de 66,7 años. La tabla 1 muestra las características demográficas de los pacientes operados, localización tumoral, diagnóstico, el tipo de abordaje empleado y las características de los tumores. En nuestra serie todos los casos fueron CD117+. De los 10 casos de hallazgo incidental 5 fueron durante laparotomía por obstrucción o perforación intestinal, un caso durante un Nissen laparoscópico, un caso en una resección de colon derecho; un caso se diagnosticó tras el estudio de un pólipo velloso de recto y 2 tras el estudio de piezas de gastrectomía por cáncer gástrico. Las características de estos tumores se indican en la tabla 2.
Características de los pacientes y tumores
| Edad | 66,7±11 (35-83) |
| Sexo | |
| Varones | 24 (60%) |
| Mujeres | 16 (40%) |
| Localización | |
| Esófago | 1 (2%) |
| Estómago | 24 (60%) |
| Intestino delgado | 13 (32%) |
| Colon | 2 (5%) |
| Diagnóstico | |
| Preoperatorio | 30 (75%) |
| Hallazgo incidental | 10 (25%) |
| Histológico | 3 |
| Durante cirugía | 7 |
| Abordaje | |
| Laparotomía | 27 (67%) |
| Laparoscopiaa | 12 (30%) |
| Resección endoscópicab | 1 (2,5%) |
| Tipo histológico | |
| Fusiforme | 33 (82%) |
| Epiteloide | 4 (10%) |
| Mixto | 3 (7,5%) |
| Inmunohistoquimia | |
| CD117 + | 40 (100%) |
| CD34 + | 33 (82%) |
Características de los tumores hallados casualmente
| Localización | Tamaño | Mitosis | Riesgo | |
| Estudio histológico | ||||
| Cáncer gástrico | Gástrico | 0,5 | 1 | Muy bajo |
| Cáncer gástrico | Gástrico | 0,8 | 0 | Muy bajo |
| Velloso rectal | Rectal | 0,8 | 0 | Muy bajo |
| Curso de otra cirugía | ||||
| Obstrucción intestinal | Íleon | 1,9 | 4 | Muy bajo |
| Obstrucción intestinal | Yeyuno | 3 | 0 | Bajo |
| Obstrucción intestinal | Íleon | 5,7 | 5 | Intermedio |
| Perforación intestinal | Íleon | 18 | 3 | Alto |
| Perforación intestinal | Yeyuno | 6 | 2 | Intermedio |
| Nissen laparoscópico | Gástrico | 2,5 | 4 | Bajo |
| Hemicolectomía derecha (cáncer) | Gástrico | 1,5 | 1 | Muy bajo |
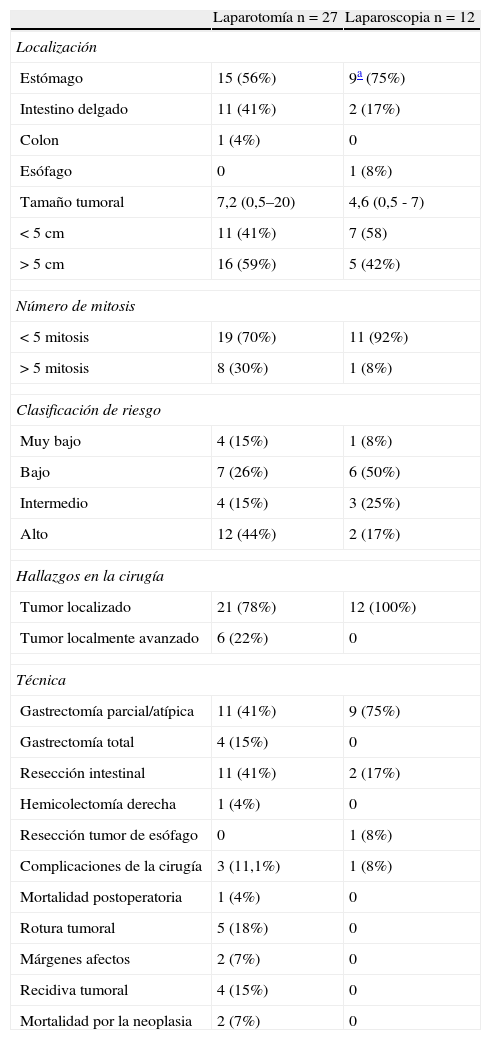
La tabla 3 muestra los datos relativos al tratamiento quirúrgico y los resultados del mismo. En el grupo de pacientes intervenidos por vía laparoscópica no se ha realizado ninguna conversión a cirugía abierta, no hemos apreciado ningún caso de rotura tumoral, infiltración del borde de resección ni implantes en los orificios de los trócares. Un caso de tumor esofágico fue intervenido por vía toracoscópica. Dos casos de pequeños tumores submucosos de la unión esofagogástrica fueron intervenidos mediante laparoscopia intragástrica.
Características tumorales según el abordaje
| Laparotomía n=27 | Laparoscopia n=12 | |
| Localización | ||
| Estómago | 15 (56%) | 9a (75%) |
| Intestino delgado | 11 (41%) | 2 (17%) |
| Colon | 1 (4%) | 0 |
| Esófago | 0 | 1 (8%) |
| Tamaño tumoral | 7,2 (0,5–20) | 4,6 (0,5 - 7) |
| < 5cm | 11 (41%) | 7 (58) |
| > 5cm | 16 (59%) | 5 (42%) |
| Número de mitosis | ||
| < 5 mitosis | 19 (70%) | 11 (92%) |
| > 5 mitosis | 8 (30%) | 1 (8%) |
| Clasificación de riesgo | ||
| Muy bajo | 4 (15%) | 1 (8%) |
| Bajo | 7 (26%) | 6 (50%) |
| Intermedio | 4 (15%) | 3 (25%) |
| Alto | 12 (44%) | 2 (17%) |
| Hallazgos en la cirugía | ||
| Tumor localizado | 21 (78%) | 12 (100%) |
| Tumor localmente avanzado | 6 (22%) | 0 |
| Técnica | ||
| Gastrectomía parcial/atípica | 11 (41%) | 9 (75%) |
| Gastrectomía total | 4 (15%) | 0 |
| Resección intestinal | 11 (41%) | 2 (17%) |
| Hemicolectomía derecha | 1 (4%) | 0 |
| Resección tumor de esófago | 0 | 1 (8%) |
| Complicaciones de la cirugía | 3 (11,1%) | 1 (8%) |
| Mortalidad postoperatoria | 1 (4%) | 0 |
| Rotura tumoral | 5 (18%) | 0 |
| Márgenes afectos | 2 (7%) | 0 |
| Recidiva tumoral | 4 (15%) | 0 |
| Mortalidad por la neoplasia | 2 (7%) | 0 |
En el grupo de laparotomía se han asociado 2 esplenectomías programadas asociadas a gastrectomía total, en uno de ellos se realizó también resección de la cola del páncreas. En otro paciente con gastrectomía distal se realizó exéresis parcial del mesocolon transverso. En los tumores de intestino delgado se han realizado 2 resecciones extendidas: un caso con resección de cúpula vesical, y otro caso con cistectomía parcial y resección en bloque de asa sigmoidea.
En 2 casos se evidenció un margen de resección infiltrado por el tumor. Uno de localización yeyunal (tumor de bajo riesgo) y otro gástrico (tumor de alto riesgo) ninguno de los cuales fue reintervenido. El paciente con tumor gástrico de alto riesgo siguió un tratamiento postoperatorio con imatinib durante un año. Ninguno de los 2 casos ha recidivado tras un seguimiento de 95 meses (yeyunal) y 20 meses (gástrico).
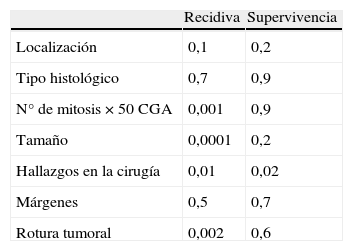
Tras una mediana de seguimiento de 31 (2-120) meses han recidivado 4 casos (10%) todos ellos intervenidos por laparotomía. La localización de la recidiva ha sido en 3 casos peritoneal y hepática y en un caso exclusivamente hepática. El periodo libre de enfermedad ha sido de 42 meses. Tras el análisis univariante, los factores predictivos de recurrencia son: tamaño, número de mitosis, tratarse de un tumor localmente avanzado y presencia de rotura tumoral durante la cirugía (tabla 3). Tras el análisis multivariante solo el tamaño se muestra como factor significativo (p=0,029; RR 1,363 IC 95% 1,033-1,799).
Se han producido 2 muertes por la neoplasia lo que supone una mortalidad del 5%. Los factores que se han mostrado significativos para la supervivencia tras el análisis univariante se exponen en la tabla 4. Ningún factor se ha mostrado significativo tras el análisis multivariante.
DiscusiónDesde la primera descripción de los tumores GIST por Mazur y Clark14 el número de diagnósticos de estos tumores ha ido en aumento por la mayor precisión diagnóstica. Clásicamente el diagnóstico se establecía por criterios histológicos a los que se unió la determinación por inmunohistoquimia de CD11715. Asimismo en casos dudosos es útil el estudio genético de PDGRFA o de las mutaciones en c-kit que ofrecen el diagnóstico y son útiles para determinar el pronóstico de los GIST16.
También se da un aumento de los casos diagnosticados de forma casual en el estudio de otras enfermedades, hallazgos casuales en laparotomías o en autopsias. En nuestra serie el 24% de los casos fueron hallazgos casuales en laparotomías durante el tratamiento de otros procesos o en el estudio histológico de piezas de resección por otras enfermedades, lo que concuerda con los datos referidos por Goettsch et al.17.
La cirugía supone el único tratamiento curativo en los GIST localizados. El objetivo es la resección completa del tumor con integridad de la pseudocápsula y la obtención de unos márgenes microscópicos negativos. La cavidad peritoneal debe ser cuidadosamente explorada para la identificación de posibles metástasis o diseminación peritoneal del tumor18. A pesar de una resección R0 hay una gran variabilidad en el comportamiento de los GIST dependiente de distintas características del tumor, con unas tasas de recidiva que varían del 0 al 90%19,20. Las recidivas se localizan con mayor frecuencia en el peritoneo, lecho tumoral o en el hígado como enfermedad metastásica. La afectación ganglionar es excepcional por lo que no está indicada la linfadenectomía salvo en casos de afectación macroscópica evidente de las adenopatías regionales19,21.
La cirugía constituye también el tratamiento de elección en los casos en los que con una resección extendida se consiga una eliminación completa del tumor. En los casos en los que la cirugía suponga una resección «invalidante» (esofaguectomía, duodenopancreatectomía cefálica, operación de Miles), o en aquellos casos en los que es imposible la resección total o la obtención de unos márgenes libres estaría justificado realizar un tratamiento preoperatorio con imatinib para conseguir una reducción tumoral y poder realizar una cirugía completa o menos mutilante5,22.
El tratamiento quirúrgico debe ser planificado tras la estadificación por las pruebas de imagen en colaboración con un radiólogo experto para verificar la resecabilidad del tumor23. Nuestro grupo considera obligatoria la realización de una TC preoperatoria para la evaluación de la resecabilidad y descartar la presencia de metástasis o carcinomatosis. En caso de dudas está indicada la realización de una PET para el diagnóstico de metástasis hepáticas o carcinomatosis peritoneal24. La correcta estadificación preoperatoria es la base para decidir el abordaje quirúrgico y la técnica a emplear y debe procurarnos información sobre la localización del tumor, el tamaño y la posible afectación de estructuras vecinas (extensión local). Asimismo son importantes para la decisión del abordaje quirúrgico las características del paciente y la experiencia del cirujano en cirugía laparoscópica.
En los últimos años han aumentado las comunicaciones de series7–9,25–27 en las que se demuestra la viabilidad y seguridad del abordaje mínimamente invasivo para el tratamiento de los GIST. El abordaje laparoscópico obtiene los mismos resultados en cuanto a recidiva y supervivencia con las ventajas propias de la cirugía mínimamente invasiva9,28,29. La laparoscopia permite, en casos seleccionados, la realización de las técnicas necesarias según la localización tumoral11,30. El desarrollo del abordaje laparoscópico debe ser paulatino en el contexto de un tratamiento multidisciplinar y tras la adecuada capacitación de los cirujanos en cirugía laparoscópica. En nuestra serie no se ha presentado recidiva ni mortalidad por la neoplasia en los casos intervenidos por laparoscopia y el desarrollo de complicaciones postoperatorias es menor que tras la cirugía abierta.
Los factores pronósticos de RL supervivencia aceptados son el tamaño y el número de mitosis, a los que se ha unido la localización tumoral2,3. En nuestra serie los factores que se han mostrado significativos para el desarrollo de RL tras el análisis univariante han sido el tamaño, el número de mitosis el hecho de ser un tumor localmente avanzado y la rotura tumoral durante la cirugía. Solo permanece la característica de ser un tumor localmente avanzado como significativo tras el análisis multivariante.
La rotura tumoral ha sido descrita como un factor determinante de la aparición de recidivas locorregionales5,31. En nuestro caso la presencia de rotura tumoral se asocia de forma significativa, en el análisis univariante, al desarrollo de recidiva local (p=0,002). La principal desventaja teórica de la cirugía laparoscópica ha sido la posibilidad de rotura tumoral durante la manipulación del tumor con el consiguiente riesgo de recidiva tumoral. En nuestra serie todos los casos de rotura tumoral ocurrieron durante laparotomías. Se trataba de tumores de gran tamaño (media10,4cm; rango 5,7-18), en los que parece más importante el tamaño tumoral y la facilidad de disección del tumor en conjunto que el propio abordaje y se han descrito una serie de medidas para evitar la rotura durante la cirugía laparoscópica. Así, Novitsky et al. postulan la abstención de manipulación directa del tumor con la instrumentación laparoscópica para evitar la rotura tumoral24.
No hemos verificado recidivas en las puertas de entrada de los trócares al igual que otros autores28,32. La extracción de la pieza de resección tras la cirugía laparoscópica se realiza siempre en un dispositivo plástico tras realizar una minilaparotomía acorde al tamaño del tumor.
El manejo de los márgenes de resección afectos está todavía por definir. En nuestra serie los 2 casos con márgenes de resección afectos no han presentado recidiva tras 20 y 95 meses de seguimiento, sin haber sido reintervenidos. Como se ha indicado, el objetivo principal de la cirugía es la exéresis completa del tumor con bordes de resección libres (R0), pero ante la presencia de unos bordes de resección afectos (R1) las indicaciones para una resección de los mismos están condicionadas por la facilidad técnica de una resección adecuada y el estado general del paciente para soportar una nueva cirugía5,12,33. En el caso del tumor gástrico con margen afecto se trataba de un paciente pluripatológico en el que la reintervención hubiera supuesto la realización de una gastrectomía total y como citan diversos autores5,20,33 no está totalmente demostrado el beneficio de una nueva intervención en caso de márgenes afectos. Son más importantes para el desarrollo de recidiva factores como el tamaño, el número de mitosis y la localización.
ConclusionesLa correcta estadificación preoperatoria es básica para la decisión del abordaje quirúrgico a emplear. El abordaje laparoscópico de estos pacientes mantiene los mismos resultados oncológicos que los obtenidos tras cirugía convencional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.