El verde de indocianina es una tinción fluorescente visible con luz cercana al infrarrojo. Es útil para la identificación de las estructuras anatómicas (tracto biliar, uréteres, paratiroides, conducto torácico), la vascularización de tejidos (en anastomosis en cirugía colorrectal, esofágica, gástrica, bariátrica, para plastias y colgajos en cirugía de pared abdominal, hepática, en hernias estranguladas en la isquemia intestinal), para la identificación de tumores (hígado, páncreas, suprarrenal, implantes en la carcinomatosis peritoneal, tumores retroperitoneales y linfomas) y para la identificación del ganglio centinela y del mapeo linfático de tumores malignos (cáncer de estómago, mama, colon, recto, esófago y piel). Las evidencias son muy alentadoras, aunque se necesita la estandarización de su uso y más estudios prospectivos y aleatorizados con mayor número de pacientes para obtener conclusiones definitivas sobre su uso.
El objetivo de esta revisión de la literatura es proveer una guía para el uso de la fluorescencia con verde de indocianina en procedimientos de cirugía general.
Indocyanine Green is a fluorescent substance visible in near-infrared light. It is useful for the identification of anatomical structures (biliary tract, ureters, parathyroid, thoracic duct), the tissues vascularization (anastomosis in colorectal, esophageal, gastric, bariatric surgery, for plasties and flaps in abdominal wall surgery, liver resection, in strangulated hernias and in intestinal ischemia), for tumor identification (liver, pancreas, adrenal glands, implants of peritoneal carcinomatosis, retroperitoneal tumors and lymphomas) and sentinel node identification and lymphatic mapping in malignant tumors (stomach, breast, colon, rectum, esophagus and skin cancer). The evidence is very encouraging, although standardization of its use and randomized studies with higher number of patients are required to obtain definitive conclusions on its use in general surgery.
The aim of this literature review is to provide a guide for the use of ICG fluorescence in general surgery procedures.
La fluorescencia es una luminiscencia que caracteriza a las sustancias que son capaces de absorber energía en forma de radiaciones electromagnéticas, para posteriormente emitir parte de esa energía en forma de dicha radiación, pero de longitud de onda diferente1.
El verde de indocianina (indocyanine green [ICG]) es una tinción tricarbocianida fluorescente visible con luz cercana al infrarrojo (near infra-red [NIR]) o por sistemas láser, que fue aprobada por la Food and Drug Administration en 19562.
El ICG se hace fluorescente cuando es activado con la NIR, con unos picos de absorción y de emisión de 805-835nm, respectivamente2,3. La fluorescencia se detecta mediante la utilización de cámaras específicas que transmiten esta señal a un monitor, a través del cual se pueden identificar las estructuras en las que se encuentra la tinción3.
Tras la administración intravenosa, el ICG se une rápidamente a las proteínas plasmáticas, eliminándose de forma inalterada por la bilis, sin recirculación enterohepática, con una vida media plasmática de 3-5min y metabolismo hepático2,3. Cuando se inyecta directamente sobre un tejido, el ICG se une a las proteínas y alcanza el ganglio linfático más cercano en pocos minutos, para posteriormente unirse a los ganglios linfáticos regionales después de 1-2h de su inyección3.
En la última década, el uso de la fluorescencia se ha extendido en cirugía general, particularmente en cirugía mínimamente invasiva, gracias al uso del sistema óptico y las fuentes de luz que se requieren para realizar el abordaje laparoscópico o robótico3–8.
El objetivo de esta revisión de la literatura es proveer una guía para orientar en el uso de la fluorescencia en procedimientos quirúrgicos y analizar sus principales aplicaciones en cirugía general.
Método de aplicación del verde de indocianinaPreparación del verde de indocianinaEl ICG se administra usualmente diluido con agua destilada3,6,9–12. En caso de que su utilización sea para identificar el ganglio linfático centinela de drenaje de un tumor, el ICG se diluye con albúmina9,10. El objetivo de su uso con albúmina viene determinado por su capacidad de detenerse en ese primer ganglio de drenaje y poderse identificar adecuadamente9,10. Este medicamento no debe diluirse con soluciones salinas (suero fisiológico, solución de Ringer), ya que podrían producirse precipitaciones del colorante4.
Vía de administraciónEl ICG puede administrarse por diferentes vías, en función de las estructuras a visualizar3,7,13–18. La vía intravenosa es utilizada para identificar intraoperatoriamente la vascularización de tejidos, para realizar una anastomosis o para identificar tejidos con hipoperfusión o isquemia, utilizándose también esta vía para la identificación de tumores, o diferentes estructuras anatómicas3,7,13,14. Para la detección de ganglio centinela o para realizar un mapeo linfático durante la linfadenectomía en el caso de neoplasias malignas9,10, por ejemplo en caso de tumores gastrointestinales, el ICG puede administrarse peritumoral en la capa submucosa o subserosa de la pared intestinal15,16. Por otro lado, el ICG puede administrarse directamente en la vesícula biliar, para la identificación del árbol biliar, o en los uréteres17,18.
Contraindicaciones del uso del verde de indocianina y toxicidadSe debe tener precaución en pacientes con hipersensibilidad al ioduro de sodio, alérgicos al iodo, con hipertiroidismo clínico, adenomas tiroideos autónomos y alteraciones autónomas focales y difusas de la glándula tiroides, en pacientes con hepatopatías y durante el embarazo3,4. La dosis tóxica letal observada en ratas por vía intravenosa es de 87mg/kg de peso corporal y para administración intraperitoneal en ratones es de 650mg/kg de peso corporal4. Hasta el momento no se han descrito efectos adversos o casos de sobredosis del medicamento ni alteraciones de los valores de laboratorio como consecuencia de una sobredosis en humanos3,4.
Sistemas de detecciónPara poder visualizar la fluorescencia emitida por el ICG es necesario tener un sistema de detección que consiste en una fuente de luz de resolución de espectros, una óptica con capacidad de captación de luz con filtros especiales, y una cámara preparada para ello, al igual que el software de control y el hardware de procesamiento, entrada y visualización19. Para obtener la fluorescencia, las moléculas de ICG deben ser iluminadas por una luz NIR o láser con un filtro infrarrojo19,20.
Recientemente, el desarrollo de una nueva tecnología permite detectar intraoperativamente la fluorescencia emitida por el ICG en modo de superposición21,22. Esta modalidad de visualización se compone tanto de la imagen de luz blanca estándar como de la luz NIR superpuesta21,22. En comparación con la tecnología anterior de visualización NIR, con la que era posible visualizar sólo las estructuras fluorescentes, las imágenes en superposición permiten realizar la cirugía con el soporte directamente con la fluorescencia, sin cambiar a luz blanca visualizando estructuras fluorescentes y no fluorescentes al mismo tiempo, como una realidad aumentada21,22.
Una de las limitaciones de esta tecnología es la evaluación subjetiva por parte del cirujano de la captación de la fluorescencia durante la cirugía23–31. A pesar de que se han publicado varias revisiones y metaanálisis en la literatura, la valoración subjetiva de la fluorescencia se sigue considerando como un sesgo debido a la heterogeneidad de la misma25–27. Por esta razón, para cuantificar dicha fluorescencia, recientemente se han propuesto varios tipos de software para obtener una evaluación objetiva de la fluorescencia y establecer mejor la valoración de la perfusión de los tejidos23–31. Estos programas informáticos procesan la señal fluorescente generando una curva de fluorescencia-tiempo (fluorescence-time-curve [FTC]), obteniendo una serie de parámetros diferentes que reflejan la perfusión tisular25,28. No obstante, hay varios factores que pueden influir en la cantidad de fluorescencia, como la concentración plasmática de ICG, los factores de perfusión sistémica (incluida la presión arterial, el gasto cardíaco y la vasoconstricción) y los distintos sistemas de detección25,29. A pesar de los resultados alentadores obtenidos en cirugía plástica, cirugía oftálmica y neurocirugía, los estudios publicados son muy heterogéneos, y actualmente no se dispone de una metodología gold standard estandarizada25,30,31. A la espera de desarrollos tecnológicos en cuanto a la cuantificación de la fluorescencia, parece que la dosis fija de ICG por kg de peso para cada paciente, la configuración de la cámara NIR fija estable y los factores de perfusión sistémica son fundamentales para una cuantificación homogénea25.
Identificación de estructuras anatómicasVía biliarLa fluorescencia con ICG permite realizar una colangiografía virtual a tiempo real intraoperatoria durante la colecistectomía laparoscópica y evitar situaciones de potencial riesgo de lesión de la vía biliar13,14,17,32–47.
El ICG, al concentrarse a nivel hepático y excretarse por la bilis, hace posible que se dibuje la anatomía del árbol biliar13,14,17,32–47. El uso del ICG para la identificación de la vía biliar ha sido evaluado en múltiples estudios en los que se ha demostrado altas tasas de detección del conducto cístico hasta del 100%13,32,33, aunque esta tasa de detección baja en casos de colecistitis aguda, debido al proceso inflamatorio13,14,17,32–47.
La alta fluorescencia del hígado puede impedir o dificultar la identificación del árbol biliar, proponiéndose su inyección 12-24h antes de la cirugía13,14,17,32–47. Es cierto que con los nuevos sistemas de imagen, con sistemas avanzados de visualización, se puede trabajar con luz al infrarrojo sin cambiar a un sistema blanco/negro, facilitando la identificación de la vía biliar sin excesivas molestias de esa alta fluorescencia del hígado13,14,17,32–47. Por otra parte, también se ha propuesto para evitar este problema su inyección directa intravesicular13,14,17,32–47, aunque este sistema tiene la desventaja que un cálculo en el cístico puede bloquear su difusión y que si se derrama el ICG puede dificultarse su uso intraoperatorio13,14,17,32–47.
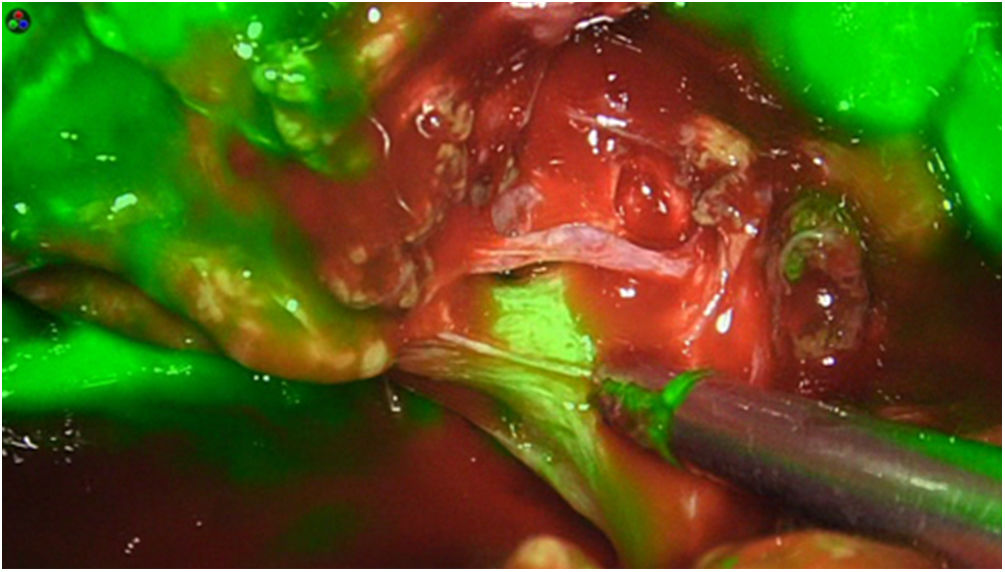
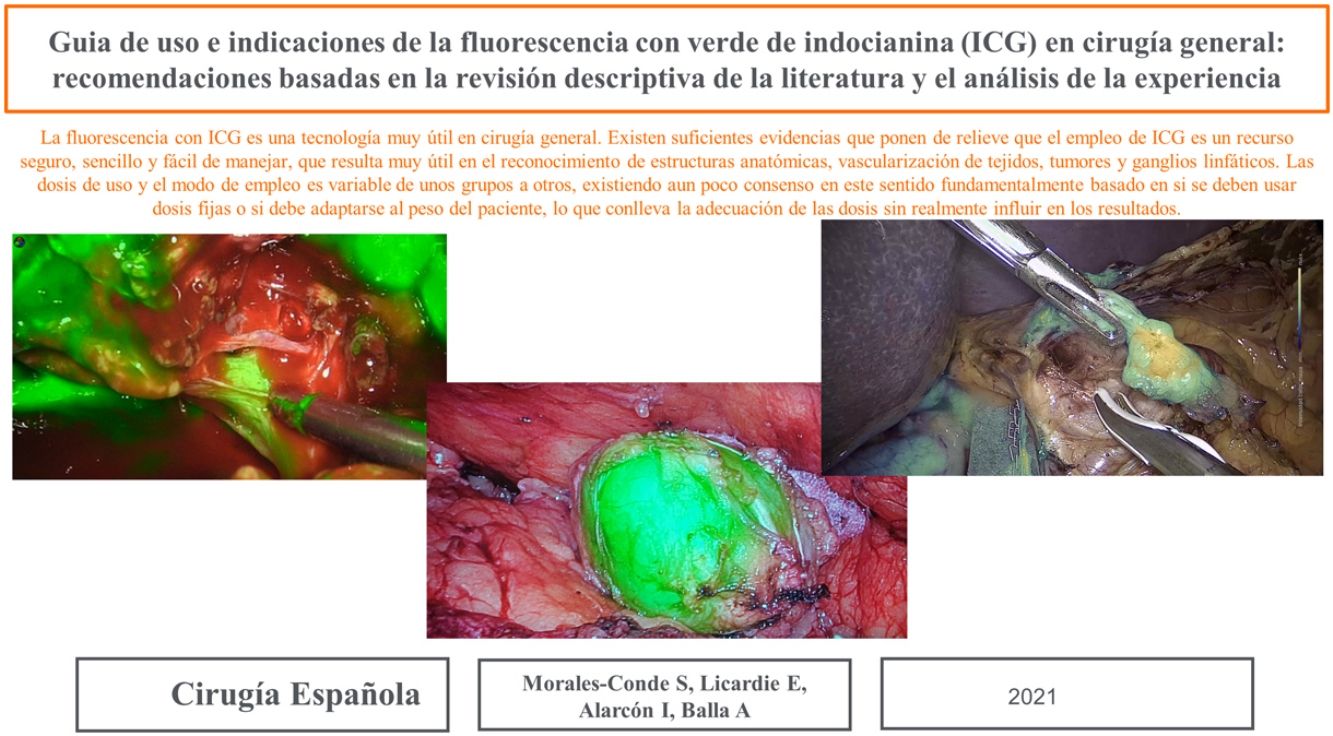
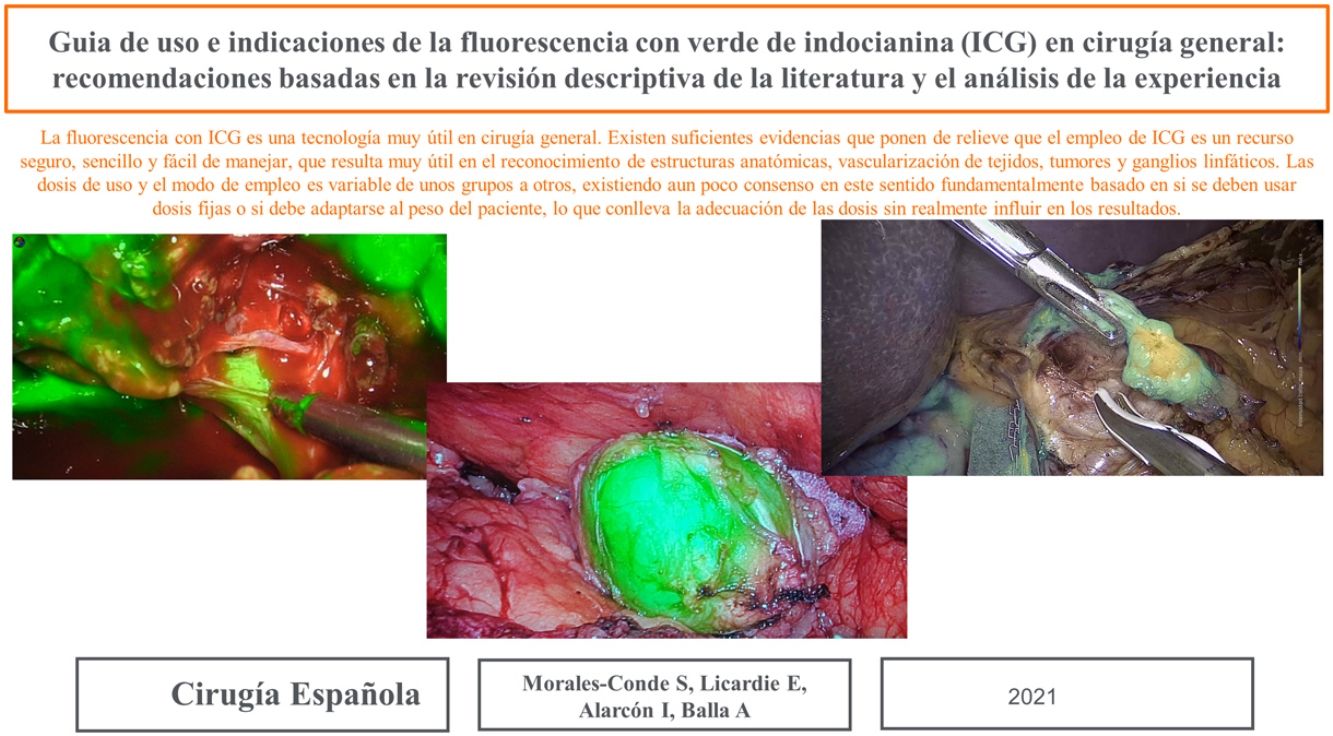
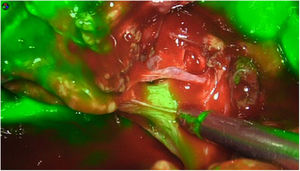
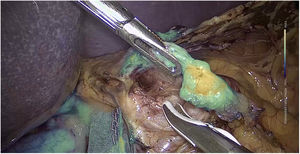
La dosis y administración de ICG para la identificación de la vía biliar con fluorescencia se comenta en la tabla 1. Nuestra forma de uso consiste en su inyección intravenosa en el momento de la inducción anestésica (20-30min antes de la cirugía) en una dosis prefijada de 15mg de ICG diluido en 3cm3 de agua destilada (fig. 1).
Dosis y vía de administración del verde de indocianina (ICG) para la valoración de estructuras anatómicas
| Autores | N. de pacientes | Solución | Dosis | Método de administración | Tiempo de administración |
|---|---|---|---|---|---|
| Vía biliar | |||||
| Boni et al.13 | 52 | Solución salina | 0,4mg/kg | Intravenoso | 14±9min antes de la cirugía |
| Graves et al.17 | 11 | Agua estéril | 0,025mg/ml (1ml) | Intravesicular | Durante la cirugía |
| Dip et al.33 | 45 | n.e. | 0,05mg/kg | Intravenoso | 60min antes de la cirugía |
| Schols et al.34 | 30 | n.e. | 2,5mg en total | Intravenoso | A la inducción de anestesia |
| Buchs et al.36 | 23 | n.e. | 2,5mg en total | Intravenoso | 30-45min antes de la cirugía |
| Quaresima et al.37 | 44 | Agua estéril | 0,1±0,1 mg/Kg | Intravenoso | 10,7±8,2h antes de la cirugía |
| Lehrskov et al.39 | 60 | n.e. | 0,05mg/kg | Intravenoso | A la inducción de anestesia |
| Hiwatashi et al.40 | 65 | n.e. | 2,5mg en total | Intravenoso | 2h antes de la cirugía |
| Daskalaki et al.41 | 184 | n.e. | 2,5mg en total | Intravenoso | 45min antes de la cirugía |
| Dip et al.42 | 321 | n.e. | 0,05mg/kg | Intravenoso | 45min antes de la cirugía |
| Broderick et al.43 | 400 | Agua estéril | 7,5mg en total | Intravenoso | 45min antes de la cirugía |
| Bleszynski et al.44 | 108 | n.e. | 4mg en total | Intravenoso | A la inducción de anestesia |
| Liu et al.46 | 46 | n.e. | 0,125mg/ml (10ml) | Intravesicular | Durante la cirugía |
| Gené Škrabec et al.47 | 20 | Agua estéril | 0,25mg/ml(agua estéril 1ml +bilis 9ml) | Intravesicular | Durante la cirugía |
| Morales-Conde et al. en práctica clínica habitual | - | Agua estéril | Dosis de 15mg en 3cm3 | Intravenoso | A la inducción de anestesia (20-30min antes de la cirugía) |
| Uréteres | |||||
| Siddighi et al.18 | >10 | Agua estéril | 25mg en 10ml por lado | Catéter ureteral | Antes de la cirugía bajo anestesia general |
| Mandovra et al.50 | 30 | Agua estéril | 5mg en 2ml por lado | Catéter ureteral | Antes de la cirugía bajo anestesia general |
| Ryu et al.51 | 7 | n.e. | n.e. | Catéter ureteral | Antes de la cirugía bajo anestesia general |
| White et al.52 | 16 | n.e. | 2,5mg/ml por 5ml por por lado | Catéter ureteral | Antes de la cirugía bajo anestesia general |
| Morales-Conde et al. en práctica clínica habitual53 | - | Agua estéril | Relleno de catéter con una dilución de25mg/5cm3 | Catéter ureteral | Antes de la cirugía una vez bajo anestesia general |
| Paratiroides | |||||
| Van den Bos et al.55 | 30 | Agua estéril | 2,5mg/ml (3ml) | Intravenoso | 1. Antes de la extracción del hemitiroides2. Después de la extracción del hemitiroides |
| Razavi et al.56 | 43 | n.e. | 5mg | Intravenoso | Al final de la cirugía |
| Rudin et al.57 | 86 | n.e. | 3ml | Intravenoso | Durante la cirugía |
| Papavramidis et al.61 | 60 | n.e. | 5mg (1 ml) | Intravenoso | 1. Después la extracción del tiroides |
| Alesina et al.62 | 5 | n.e. | 2,5mg en total | Intravenoso | 1. Después la movilización del tiroides en autofluorescencia sin ICG2. Con administración de ICG |
| Lerchenberger et al.63 | 50 | Agua estéril | 5mg (1ml) | Intravenoso | 1. Después la movilización del tiroides en autofluorescencia sin ICG2. Con administración de ICG |
| Conducto torácico | |||||
| Vecchiato et al.64 | 20 | Solución salina | 0,5mg/kg | Por vía percutáneabilateralmente en los ganglios inguinales superficiales | Antes de la toracoscopiaen esofagectomía total, y después la laparoscópicaen la esofagectomía de la Ivor Lewis |
| Chakedis et al.65 | 6 | Solución salina | 2,5mg/ml(1-2ml) | Por vía subcutánea en el dorso del pie izquierdo | 15min antes de la disección del nivel IV del cuello |
n.e.: no especificado.
Las lesiones del uréter han sido descritas durante cirugía colorrectal, con una incidencia que varía entre el 0,15-0,66%48. Para la identificación de los uréteres se han utilizado diferentes métodos como la utilización de stents luminosos49. Sin embargo, este tipo de dispositivos no está exento de riesgos, incluido las lesiones ureterales, hematuria, infecciones del tracto urinario, y la imposibilidad de sobrepasar una estenosis49.
Para la identificación de los uréteres, el ICG se inyecta a través de la inserción de la punta de un catéter en el orificio ureteral mediante cistoscopia en el mismo acto quirúrgico bajo anestesia general antes de comenzar el procedimiento, lo que puede reducir las complicaciones iatrogénicas al no forzar su entrada, y permitir rellenar los mismos con ICG incluso existiendo una estenosis parcial, ya que el líquido podría superarla, y poder así identificarlos18,50–53. El motivo de esta forma de utilización es debido a que el ICG se elimina por vía hepática, y por tanto no alcanza el uréter al administrarse de manera intravenosa2,3,18 (tabla 1).
Nuestra forma de uso consiste en la colocación de un catéter por urología en la desembocadura de los mismos en la vejiga y en rellenar los mismos con una dosis de 25mg en 5cm3 de agua destilada, cerrando dicho catéter durante la cirugía pudiendo drenar la orina alrededor del mismo en la vejiga53 (tabla 1).
ParatiroidesLa fluorescencia con ICG puede ser útil para la identificación de las glándulas paratiroides durante la cirugía del tiroides54–58. Recientemente se ha podido observar que la autofluorescencia (AF) de las paratiroides, sin necesidad de administrar ICG, puede ser de gran utilidad para dicha identificación utilizando dispositivos de infrarrojo cercano a las mismas, aproximadamente 2-3cm59,60. Se ha descrito que la AF puede llegar a tener un 96-98% de eficacia para la identificación de las paratiroides59,60. Sin embargo, la mayoría de los autores describen que es de mayor utilidad para verificar la identificación y vascularización de las glándulas una vez que el cirujano ya las ha localizado, con lo cual la AF puede ser útil como una herramienta de confirmación anatómica intraoperatoria y para valorar y predecir la hipocalcemia postoperatoria59–63 (tabla 1).
Conducto torácicoLa fluorescencia ICG se puede utilizar para identificar el conducto torácico (CT)64,65. La lesión del CT puede ocurrir durante la esofagectomía, la disección del cuello o la cirugía pulmonar y el desarrollo de quilotórax es una complicación quirúrgica temida64,65. La inyección subcutánea de ICG cerca de las estaciones de los ganglios linfáticos puede ayudar a detectar el CT intraoperatoriamente para evitar lesiones iatrogénicas64,65 (tabla 2).
Dosis y vía de administración del verde de indocianina (ICG) para la valoración de la perfusión de tejidos
| Autores | N. de pacientes | Solución | Dosis de ICG | Método de administración | Tiempo de administración |
|---|---|---|---|---|---|
| Cirugía colorrectal | |||||
| Boni et al.3 | 107 | Agua soluble | 0,2mg/kg | Intravenoso | Después de la sección del mesenterio, antes de la anastomosis |
| Gröne et al.71 | 18 | n.e. | 15mg en total | Intravenoso | Antes de la sección proximal del colon |
| Jafari et al.72 | 139 | n.e. | Desde 3,75 a 7,5mg | Intravenoso | Después da la movilización del colon y de la anastomosis |
| Kin et al.73 | 173 | n.e. | 3ml | Intravenoso | Antes de la sección proximal del colon |
| De Nardi et al.74 | 118 | Agua estéril | 0,3mg/kg | Intravenoso | Antes de la sección proximal del colon y después da la anastomosis |
| Kawada et al.75 | 68 | n.e. | 5mg en total | Intravenoso | Antes de la sección proximal del colon |
| Kim et al.76 | 123 | n.e. | 10mg en total | Intravenoso | Después da la movilización del colon |
| Hasegawa et al.77 | 141 | n.e. | 5mg en total | Intravenoso | Antes de la sección proximal del colon |
| Ishii et al.78 | 223 | n.e. | 5mg en total | Intravenoso | Antes de la sección proximal del colon |
| Watanabe et al.79 | 211 | n.e. | 0,25mg/kg | Intravenoso | Antes de la sección proximal del colon |
| Morales-Conde et al.80 | 192 | Agua estéril | 15mg en total | Intravenoso | Antes de la sección proximal del colon |
| Wada et al.81 | 112 | n.e. | 5mg en total | Intravenoso | Antes de la sección proximal del colon |
| Chang et al.82 | 110 | n.e. | 5mg en total | Intravenoso | Antes de la sección proximal del colon |
| Tsang et al.83 | 62 | n.e. | 10mg | Intravenoso | Después de la sección proximal del colon |
| Impellizzeri et al.84 | 98 | Agua soluble | 12,5mg en 5ml | Intravenoso | Después da la movilización del colon y la ligadura de los vasos, antes de la sección del colon |
| Alekseev et al.85 | 187 | n.e. | 0,2mg/kg | Intravenoso | Antes de la sección proximal del colon |
| Morales-Conde et al. en práctica clínica habitual | - | Agua estéril | Dosis única de 15mg en 3cm3 | Intravenoso | Colon izquierdo/recto: antes de la sección de colon proximalColon derecho/ángulo esplénico: antes de la sección del con e íleon |
| Cirugía esofágica | |||||
| Kitagawa et al.86 | 46 | n.e. | 5mg en total | Intravenoso | Antes de la construcción del tubo gástrico y después de la transposición en tórax |
| Sarkaria et al.87 | 42 | Solución acuosa | 10 en total | Intravenoso | Antes de la construcción del tubo gástrico |
| Karampinis et al.88 | 35 | n.e. | 7,5mg en total | Intravenoso | Después de la creación del tubo gástrico y antes de la transposición en tórax |
| Kumagai et al.89 | 70 | n.e. | 2,5mg en total | Intravenoso | Después de la creación del tubo gástrico y antes de la transposición en tórax |
| Rino et al.90 | 33 | n.e. | 2,5mg en total | Intravenoso | Después de la creación del tubo gástrico y antes de la transposición en tórax |
| Yukaya et al.91 | 27 | n.e. | 0,1mg/kg | Intravenoso | Después de la creación del tubo gástrico y antes de la transposición en tórax |
| Zehetner et al.92 | 150 | n.e. | 2,5 en total | Intravenoso | Después de la creación del tubo gástrico y antes de la transposición en tórax |
| Shimada et al.93 | 40 | n.e. | 2,5mg en total | Intravenoso | Después de la creación del tubo gástrico, antes y después de la transposición en tórax |
| Koyanagi et al.94 | 40 | n.e. | Desde 1,25 a 2,5mg en total | Intravenoso | Después de la creación del tubo gástrico y después de la transposición en tórax |
| Noma et al.95 | 71 | n.e. | 12,5mg en total | Intravenoso | Después de la creación del tubo gástrico y después de la transposición en tórax |
| Luo et al.96 | 86 | Agua estéril | 0,5mg/kg | Intravenoso | Después de la creación del tubo gástrico y antes de la transposición en tórax |
| Morales-Conde et al. en práctica clínica habitual | - | Agua estéril | Dosis única de 15mg en 3cm3 | Intravenoso | Tras realizar el tubo gástrico antes del último disparo de la endograpadora |
| Cirugía gástrica | |||||
| Huh et al.98 | 30 | n.e. | 2,5mg en total | Intravenoso | Después de la anastomosis |
| Kim et al.99 | 20 | n.e. | 7,5mg en total | Intravenoso | Antes de la anastomosis |
| Morales-Conde et al. en práctica clínica habitual | - | Agua estéril | Dosis única de 15mg en 3cm3 | Intravenoso | Antes de la anastomosis |
| Cirugía bariátrica | |||||
| Ortega et al.100 | 86 | n.e. | 3ml | Intravenoso | Después de la gastrectomía vertical |
| Di Furia et al.101 | 43 | n.e. | 5ml | Intravenoso | Después de la gastrectomía vertical |
| Morales-Conde et al. en práctica clínica habitual | - | Agua estéril | Dosis única de 25mg en 5cm3 | Intravenoso | Gastrectomía vertical: después de realizarloby-pass gástrico: tras realizar la anastomosis |
| Valoración en hernia estrangulada | |||||
| Gianchandani Moorjani et al.102 | 3 | n.e. | 10mg en 2ml | Intravenoso | n.e. |
| Daskalopoulou et al.103 | 1 | n.e. | 3ml | Intravenoso | Después de la reducción de la hernia en el abdomen |
| Ryu et al.104,105 | 2 | n.e. | 10mg en 2ml | Intravenoso | Después de la reducción de la hernia en el abdomen |
| Ryu et al.106 | 1 | n.e. | 10mg en 2ml | Intravenoso | Después de la reducción de la hernia en el abdomen |
| Morales-Conde et al. en práctica clínica habitual | - | Agua estéril | Dosis única de 15mg en 3cm3 | Intravenoso | Una vez reducido el contenido estrangulado y reparada la hernia |
| Valoración en isquemia intestinal | |||||
| Karampinis et al.107 | 52 | n.e. | 7,5mg en total | Intravenoso | Durante la exploración de la cavidad abdominal |
| Alexander et al.108 | 1 | n.e. | 0,25mg en total | Intravenoso | Durante la exploración de la cavidad abdominal |
| Reconstrucción de pared abdominal | |||||
| Cho et al.110 | 10 | n.e. | n.e. | Intravenoso | Después de la creación del colgajo |
| Shao et al.111 | 88 | n.e. | 10mg en total | Intravenoso | Después de la creación del colgajo |
| Colavita et al.112 | 15 | n.e. | 5mg en total | Intravenoso | Antes de la incisión y antes del cierre de piel |
| Wormer et al.113 | 46 | n.e. | 5mg en total | Intravenoso | Antes de la incisión y antes del cierre de piel |
| Morales-Conde et al. en práctica clínica habitual | - | Agua estéril | Dosis única de 15mg en 3cm3 | Intravenoso | Antes del cierre de la piel |
| Valoración del colgajo para la reconstrucción en cirugía de mama | |||||
| Hembd et al.115 | 506 | Solución salina | 7,5mg en 3cm3 | Intravenoso | 10 a 15min después de la anastomosis vascular del colgajo |
| Alstrup et al.116 | 77 | Solución salina | 7,5mg en total | Intravenoso | Durante la operación y después detransposición del colgajo a la zona receptora |
| Chirappapha et al.117 | 29 | n.e. | 0,25mg/kg | Intravenoso | Después de obtener el colgajo pediculado por completo |
| Anker et al.118 | 42 | n.e. | 0,3mg/kg | Intravenoso | Tras completar la retirada del colgajo antes de la sección del pedículo |
| Valoración de los límites de la resección hepática anatómica | |||||
| Kobayashi et al.120 | 13 | n.e. | 2,5mg | Intravenoso | Después de ligar la vena porta |
| 92 | 5mg carmín de índigo | 0,25mg | Intraportal | Después de clampar la arteria hepática derecha o izquierda | |
| Marino et al.121 | 25 | n.e. | 2,5mg en total | Intravenoso | Después de clampar la rama portal del área hepática en la que se encuentra el tumor que se va a extirpar |
| Solución salina | 2,5mg en total | Intraportal | Después de pinzar la arteria y la vena porta | ||
| Urade et al.122 | 3 | n.e. | 2,5mg en total | Intravenoso | Después del cierre del pedículo hepático |
| Nishino et al.123 | 10 | n.e. | - | Intravenoso | Después del cierre del pedículo hepático |
| Xu et al.124 | 27 | Agua estéril | 1ml de 0,025mg/ml | Intravenoso | Después del cierre del pedículo hepático |
| 9 | Agua estéril | 5-10ml de 0,025mg/ml | Intraportal | Después de la oclusión de la vena porta o del pedículo de Glisson de la zona a resecar | |
| Aoki et al.125 | 14 | n.e. | 1ml de 0,025 mg/ml | Intraportal | Por vía percutánea antes de iniciar la cirugía |
| Ito et al.126 | 3 | Carmín de índigo: 5mlMicroburbujas de perflubutano: 0,3ml | 0,25mg | Intraportal | Por vía percutánea antes de iniciar la cirugía |
n.e.: no especificado.
La valoración de la vascularización de los tejidos para realizar una anastomosis ha sido demostrada en distintas áreas de la cirugía general66, como la cirugía colorrectal3,67–85, esofágica86–97, gástrica98,99 y bariátrica100,101. Además, su uso se ha expandido para establecer la necesidad de realizar una resección intestinal en hernias estranguladas102–106 o valorar la extensión de la resección en procesos de isquemia intestinal en cirugía de urgencias107–109, para la valoración de la viabilidad de tejidos en cirugía de la hernia y reconstrucción de pared abdominal110–113, para evaluar la perfusión del tejido del colgajo en la reconstrucción mamaria114–118 y para la resección anatómica hepática119–126.
Las dosis y forma de administración en cada uno de los usos que se plantean a continuación vienen recogidos en la tabla 2.
Perfusión de tejidos para la realización de anastomosisEl mejor momento para valorar la vascularización para realizar una anastomosis es a la primera llegada del colorante al realizar angiografía de fluorescencia con ICG (AF-ICG), ya que el ICG es una pequeña molécula, que puede difundirse a través del flujo capilar submucoso a lo largo del tiempo fuera de los límites de las zonas isquémicas inicialmente delimitadas por el mismo127. Este fenómeno puede conducir a una sobreestimación cualitativa de la zona perfundida, cuando dicha estimación se basa únicamente en la presencia de una señal fluorescente, llevando a una confusión y a realizar una anastomosis en tejido mal perfundido127.
La ventaja más evidente de la técnica de AF-ICG es la visualización en tiempo real de la perfusión sanguínea a los tejidos127. Sin embargo, existen aún problemas a resolver como el hecho de no permitir la evaluación del retorno venoso, cuyo daño puede influir también en la viabilidad de una anastomosis o en el desarrollo de una estenosis posterior, o el lavado de los tejidos para poder hacer una reevaluación de una zona de anastomosis90.
Una vez que los vasos y los tejidos están teñidos, el marcado realce dura unos 5min, hasta que el hígado segrega el ICG en la bilis intacta, habiéndose establecido que el tiempo de lavado de la zona a realizar la anastomosis es de unos 15-20min para poder realizar una reinyección y una nueva valoración2,3.
Cabe señalar que la mayoría de los documentos comentados en relación con el uso del AF-ICG no incluyen una evaluación cuantitativa objetiva de la angiografía de fluorescencia66,80,81. Un método estandarizado para evaluar objetivamente y cuantitativamente la perfusión anastomótica podría dar lugar a nuevos cambios de estrategia en estos pacientes, pero todavía no se dispone de un instrumento de dichas características ampliamente aceptado23,24,80,81,91. Además, la cuantificación daría más valor a su reinyección para una reevaluación de la perfusión de un tejido en concreto23–31.
La tabla 2 muestra las dosis y vías de administración para la valoración de perfusión por parte de diferentes autores. Nuestro grupo usa una dosis fija de 3cm3 de agua destilada con 15mg de ICG intravenosa en todos los casos excepto en los pacientes bariátricos y con índice de masa corporal mayor de 40kg/m2, donde la dosis que utilizamos es de 5cm3 con 15mg de ICG. Dicha infusión la realizamos antes de la sección del colon o íleon en cirugía colorrectal, antes de realizar la anastomosis en cirugía gástrica (para valorar el muñón duodenal y la zona donde vamos a realizar la anastomosis), antes de la última carga de endograpadora durante la realización del tubo gástrico en cirugía esofágica (para evitar la confusión en la interpretación con la influencia de la vascularización submucosa gástrica) y tras realizar la gastrectomía vertical y la anastomosis en el by-pass gástrico en cirugía bariátrica para valorar el estado final del procedimiento.
Perfusión de tejidos para la valoración de su viabilidad en urgenciasa) Hernia estranguladaEn la literatura únicamente se han descrito pocos casos sobre el uso de AF-ICG en relación con las hernias inguinales y umbilicales102–106. Sin embargo, los resultados parecen prometedores, favoreciendo principalmente la prevención de resecciones intestinales innecesarias102–106 (tabla 2).
b) Isquemia intestinalSe está estudiando la aplicación clínica de la AF-ICG durante la cirugía de urgencia por isquemia intestinal107–109. Karampinis et al. describen un cambio de estrategia quirúrgica en el 11,5% de los casos107; sin embargo, en un estudio experimental, Seeliger et al. reportan una discrepancia entre la evaluación de la mucosa y la serosa109, por lo que se requieren más estudios para investigar esta aplicación (tabla 2).
Sin embargo, es importante puntualizar que, en los casos de urgencia mencionados, la AF-ICG sólo evalúa la isquemia arterial y no la venosa90,102–109.
Reconstrucción de pared abdominalLa fluorescencia con ICG parece ser de utilidad también para disminuir las tasas de complicaciones en casos de hernia y de reconstrucción de pared abdominal110–113.
En la literatura se reporta el uso de AF-ICG en casos de reconstrucción compleja de la pared abdominal tratada con separación anterior de componentes, mostrando reducción en las tasas de necrosis cutánea postoperatoria e infección de la herida quirúrgica110–113 (tabla 2).
Valoración del colgajo para la reconstrucción en cirugía de mamaLa necrosis del colgajo tras la reconstrucción mamaria es una de las complicaciones postoperatorias más temidas tanto por la paciente como por el cirujano, y la hipoperfusión es la principal causa relacionada con el fallo del colgajo114–118. La AF-ICG permite evaluar la perfusión del colgajo y crear un colgajo más preciso, lo que reduce la tasa de complicaciones postoperatorias, los estudios de imagen postoperatoria, las visitas de seguimiento, las biopsias y reintervenciones de revisión114–118.
Valoración de los límites de la resección hepática anatómicaLa AF-ICG también es útil para facilitar la identificación de márgenes hepáticos para la resección anatómica del hígado en caso de tumor hepático, mostrando resultados prometedores119–126.
Se han descrito varias estrategias intraoperatorias con el fin de delimitar los márgenes para obtener una correcta resección hepática119–126. Con la «técnica de tinción negativa» (negative staining technique), después de administrar por vía intravenosa el ICG, tras clampar temporalmente de la rama portal que drena al tumor o al parénquima de la región hepática a extirpar, permite identificar los márgenes del segmento no teñido, y resecarlo a lo largo de la demarcación119–126. La «técnica de tinción positiva» (positive staining technique) consiste en la inyección de ICG directamente en una (single-staining) o más (multiple-staining) ramas portales, con la arteria y las venas portales clampadas para evitar el lavado del colorante119–126. De este modo, el parénquima hepático que se va a extirpar aparece teñido con fluorescencia119–126. En la «técnica de contratinción» (counterstaining technique), la inyección de ICG se realiza en la rama portal del parénquima hepático que debe conservarse119–126. De este modo, el parénquima hepático que se va a extirpar no aparece teñido119–126. Otra estrategia para la resección hepática anatómica se denomina «técnica de tinción negativa paradójica» (paradoxical negative staining technique): cuando la vena hepática de drenaje está ocluida por el tumor, se produce la regurgitación del flujo portal119–126. En tal situación, el territorio portal regurgitado se muestra como un defecto de fluorescencia incluso cuando se punciona la vena porta y se inyecta ICG119–126 (tabla 2).
Identificación de tumoresTumores primarios de hígado y metástasis hepáticasLa fluorescencia con ICG permite la identificación de las lesiones hepáticas128–136. El tejido hepático sano elimina el ICG en un plazo de 2h, mientras el tejido peritumoral lo podría retener por la compresión que se produce en los conductos biliares por el propio tumor, marcando un halo que permite identificar la lesión y marcar los límites de resección, circunstancia que se observa en las metástasis hepáticas128,129,135. Por su parte, el carcinoma hepatocelular es identificado porque el ICG se retiene dentro de la lesión permitiendo la identificación del mismo128,129 (tabla 3).
Identificación de tumores
| Autores | N. de pacientes | Solución | Dosis | Método de administración | Tiempo de administración |
|---|---|---|---|---|---|
| Tumores primarios de hígado y metástasis hepáticas | |||||
| Peloso et al.128 | 25 | n.e. | 0,5mg/kg | Intravenoso | 24h antes de la cirugía |
| Abo et al.130 | 117 | Agua destilada | 0,5mg/kg | Intravenoso | 24h antes de la cirugía |
| Terasawa et al.131 | 41 | n.e. | 0,5mg/kg | Intravenoso | 3 días antes de la cirugía |
| Ishizawa et al.132 | 26 | n.e. | 0,5mg/kg | Intravenoso | En mediana 3 días antes de la cirugía |
| Inoue et al.133 | 24 | n.e. | 2,5mg / 2,5mg | Intravenoso /intraportal | Después de la ligadura del hilio/después de la ligadura de la arteria hepática |
| Morita et al.134 | 58 | n.e. | 0,5mg/kg | Intravenoso | En media 14,7 días antes de la cirugía |
| Lieto et al.135 | 9 | n.e. | 0,5mg/kg | Intravenoso | 24h antes de la cirugía |
| Yao et al.136 | 18 | n.e. | 2,5mg / 2,5mg | Intravenoso /intraportal | Para hepatectomía derecha: después de la ligadura de los vasos derechos |
| Tumores pancreáticos | |||||
| Rho et al.138 | 37 | n.e. | 5mg en total | Intravenoso | Durante la disección del proceso uncinado |
| Hutteman et al.139 | 8 | n.e. | Desde 5 a 10mg | Intravenoso | Después de la exposición de la neoplasia |
| Newton et al.140 | 20 | n.e. | Desde 2,5 a 5mg | Intravenoso | 24h antes de la cirugía |
| Paiella et al.141 | 10 | Solución salina | 25mg en total(5 bolos de 5mg) | Intravenoso | Durante la cirugía |
| Shirata et al.142 | 23 | n.e. | 2,5mg en total | Intravenoso | Durante la cirugía |
| Tumores adrenales | |||||
| Colvin et al.143 | 40 | n.e. | Desde 3,8 a 20mg | Intravenoso | Después de la exposición del espacio retroperitoneal |
| Arora et al.144 | 55 | Agua destilada | 5mg en total | Intravenoso | Durante la cirugía |
| Sound et al.145 | 10 | Agua destilada | Desde 7,5 a 18,8mg | Intravenoso | Después de la exposición del espacio retroperitoneal |
| Lerchenberger et al.146 | 3 | n.e. | 5mg por cada suprarrenal | Intravenoso | Después de la exposición del espacio retroperitoneal |
| Tuncel et al.147 | 8 | Agua destilada | 5mg en total | Intravenoso | Después de la exposición del espacio retroperitoneal |
| Implantes peritoneales | |||||
| Veys et al.150 | 20 | n.e. | 0,25mg/kg | Intravenoso | Después de visualizar la cavidad abdominal |
| Liberale et al.151 | 14 | n.e. | 0,25mg/kg | Intravenoso | Después de visualizar la cavidad abdominal |
| Barabino et al.152 | 10 | Solución estéril de glucosa al 5% | 0,25mg/kg | Intravenoso | Después de visualizar la cavidad abdominal |
| Filippello et al.153 | 10 | n.e. | 0,25mg/kg | Intravenoso | 24h antes de la cirugía |
| Lieto et al.154 | 4 | n.e. | 0,25mg/kg | Intravenoso | Después de visualizar la cavidad abdominal |
| Morales-Conde et al. en práctica clínica habitual155 | - | Agua destilada | Dosis única de 15mg en 3cm3 | Intravenoso | Después de visualizar la cavidad abdominal |
| Tumores retroperitoneales | |||||
| Morales-Conde et al. en práctica clínica habitual | - | Agua destilada | Dosis única de 15mg en 3cm3 | Intravenoso | En la inducción anestésica (20-30min antes de la cirugía) |
| Perfusión de tejidos para la valoración de su infiltración - linfoma intestinal | |||||
| Morales-Conde et al. en práctica clínica habitual156 | - | Agua estéril | Dosis única de 15mg en 3cm3 | Intravenoso | Una vez identificada la posible zona de afectación por linfoma |
| Diagnóstico de linfoma y otras patologías mediante biopsia de adenopatías | |||||
| Morales-Conde et al. en práctica clínica habitual | - | Agua destilada | Dosis única de 15mg en 3cm3 | Intravenoso | En la inducción anestésica (20-30min antes de la cirugía) |
n.e.: no especificado.
La aplicación de la fluorescencia con ICG para la identificación de tumores pancreáticos, aunque no es usada de manera rutinaria, parece ser prometedora137–142. Se ha utilizado para comprobar la extirpación completa del mesopáncreas en el caso de las pancreaticoduodenectomías laparoscópicas137–139, y dado que la extirpación total del margen retroperitoneal es un importante factor pronóstico, podría tener un valor de suma importancia137 (tabla 3).
Tumores adrenalesLa identificación de las glándulas suprarrenales (GS) y de sus límites anatómicos puede resultar difícil143–147. En base a la diferencia en la perfusión entre las GS y los tejidos circundantes, dichas glándulas, y los diferentes tipos de tumores localizados en las mismas, pueden ser identificados143–147. Los tumores adrenocorticales son reconocidos fácilmente por la mayor fluorescencia, sin embargo, los feocromocitomas son hipofluorescentes143–147. Esta tecnología podría encontrar su uso para poder valorar el aporte sanguíneo al tejido adrenal remanente146,147 (tabla 3).
Carcinomatosis peritonealLa detección preoperatoria de metástasis peritoneales es difícil con las técnicas de imagen de las que disponemos148–155. Un adecuado diagnóstico y estadificación son importantes para la elección de la mejor opción terapéutica148–154. Parece que la aplicación clínica de la fluorescencia con ICG en la carcinomatosis peritoneal debe reservarse en pacientes con índice de carcinomatosis menor de 8, ya que en pacientes en los que se ha diagnosticado de manera preoperatoria una amplia diseminación metastásica peritoneal, el valor de la fluorescencia es limitado152,153.
En pacientes con carcinomatosis peritoneal de cáncer colorrectal, la estadificación y la integridad de la cirugía citorreductora son factores pronósticos importantes152. Las imágenes guiadas por fluorescencia pueden ser una herramienta que facilite la evaluación intraoperatoria de los márgenes tumorales e implantes no detectados más allá de los métodos actuales de palpación e inspección visual148–155.
La mayoría de los estudios reportados, después de realizar una exploración clínica de la cavidad abdominal, administraron 0,25mg/kg de ICG por vía intravenosa para detectar lesiones fluorescentes, orientando así su escisión148–152,154,155. Solamente Filippello et al. evaluaron las lesiones peritoneales ex vivo tras su escisión153 (tabla 3).
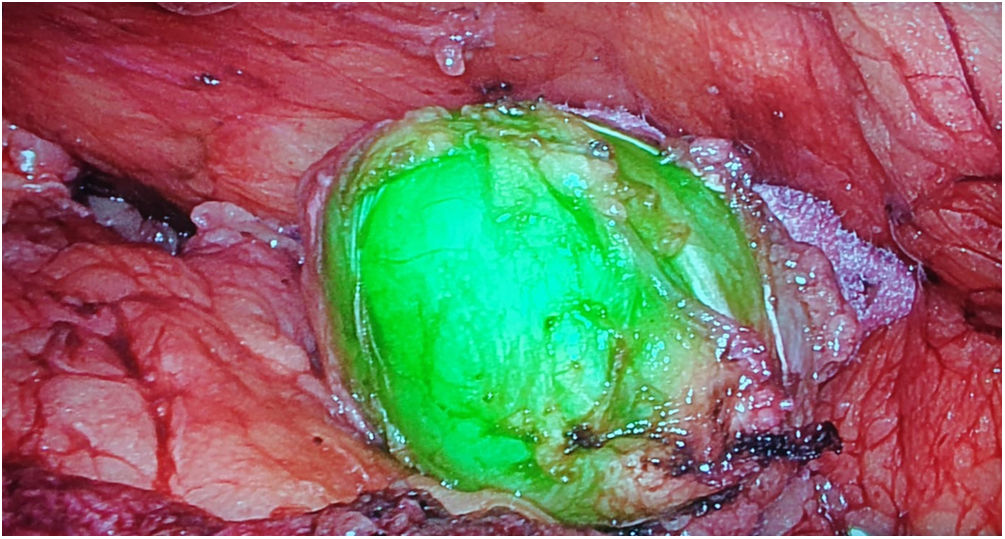
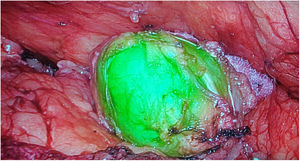
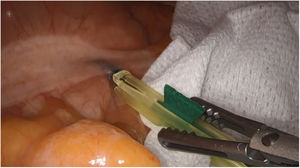
Tumores retroperitonealesNuestro grupo ha comenzado recientemente con el uso de esta tecnología en la identificación de tumores a este nivel. Recientemente nos ha servido para la extirpación de un Schwanoma localizado a nivel retroperitoneal, así como para valorar sus límites de resección durante su disección (fig. 2). Para este uso realizamos una inyección 30min antes de la cirugía (en la inducción anestésica) ya que el tumor, al estar hipervascularizado, retendría el ICG, permitiendo su identificación y correcta exéresis (tabla 3).
Perfusión de tejidos para la valoración de su infiltración - linfoma intestinalFernández Veiga et al. presentaron su experiencia en un caso de linfoma intestinal156. Tras la administración de 15mg de ICG por vía intravenosa antes de la cirugía, la fluorescencia permitió visualizar un segmento de intestino delgado y sus ganglios linfáticos que fueron biopsiados, resultando un linfoma folicular156 (tabla 3).
Diagnóstico de linfoma y otras patologías mediante biopsia de adenopatías de difícil accesoEn muchas ocasiones se da la circunstancia de la existencia de linfomas que precisan ser diagnosticados siendo preciso la biopsia de adenopatías que se encuentran en lugares de difícil acceso, tales como el retroperitoneo, cuello o mediastino. Estas adenopatías presentan una importante hipervascularización, lo que nos ha ayudado a localizarlas gracias a la retención que realizan del ICG una vez inyectados previamente durante la inducción anestésica, teniendo experiencia nuestro grupo con éxito en casos con adenopatías en cuello, en muslo y en retroperitoneo.
Esta misma forma de trabajo nos ha servido para detectar sospechas de adenopatías patológicas en retroperitoneo por recidiva de tumores germinales, realizando este abordaje también con un resultado muy satisfactorio (tabla 3).
Aplicaciones del verde de indocianina en la linfadenectomía - ganglio centinela y mapeo linfáticoGanglio centinelaEl ICG para la identificación del ganglio centinela en cirugía oncológica está encontrando un importante desarrollo con la idea de realizar una cirugía conservadora y evitar linfadenectomías extensas cuando no son necesarias, teniendo un gran desarrollo en cirugía del cáncer gástrico157–159 y de la mama160–163.
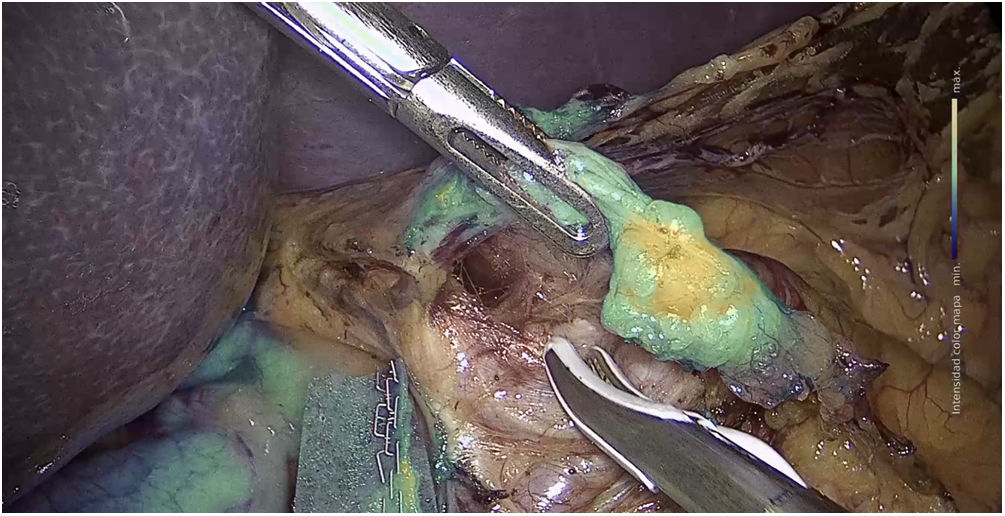
a) Cirugía de estómagoEntre los estudios publicados en relación con la identificación del ganglio centinela mediante fluorescencia con ICG en el cáncer gástrico, se reportan tasas de identificación de los mismos entre un 90 y 100%157–159 (fig. 3). En el SEntinel Node ORIented Tailored Approach (SENORITA) trial se compara la gastrectomía laparoscópica estándar con la cirugía laparoscópica de navegación en el ganglio centinela y resección endoscópica o segmentaria en los T1N0M0159. Con esta técnica la cirugía para preservar el estómago se llevó a cabo en el 81,4% de los pacientes159 (tabla 4).
Ganglio centinela y mapeo linfático
| Autores | N. de pacientes | Solución | Dosis | Método de administración | Tiempo de administración |
|---|---|---|---|---|---|
| Cirugía de estómago - ganglio centinela | |||||
| Bok et al.158 | 13 | n.e. | 0,5ml (2,5mg) | En la submucosa en los 4 cuadrantes peritumoral durante la endoscopia | Al principio de la intervención |
| An et al.159 | 245 | Albúmina de suero humano radiomarcada con 99mTc | 2,5mg/ml | En la submucosa en los 4 cuadrantes peritumoral durante la endoscopia | Al principio de la intervención |
| Cirugía de mama - ganglio centinela | |||||
| Wishart et al.160 | 100 | n.e. | 2ml (0,5%) | 1ml por vía intradérmica1ml por vía subcutánea en el borde de la aréola | Al principio de la intervención |
| Mieog et al.161 | 24 | Agua estéril y albúmina sérica humana | 1,6ml(desde 50 a 1.000μM) | Una punción peritumoral o periareolar | Al principio de la intervención |
| Jung et al.162 | 24 | Agua destilada y albúmina sérica humana | 0,3ml (0,6mg) | Una punción peritumoral o periareolar | Al principio de la intervención |
| Takemoto et al.163 | 24 | Agua destilada | 2ml (10mg) | Una punción subareolar | Al principio de la intervención |
| Cirugía colorrectal - mapeo linfático | |||||
| Currie et al.166 | 30 | n.e. | 5mg/ml | En la submucosa a los 4 cuadrantes peritumoral durante colonoscopia | Al principio de la intervención |
| Handgraaf et al.167 | 5 | Nanocoloide | 0,4ml | En la submucosa a los 4 cuadrantes peritumoral durante colonoscopia | Al principio de la intervención |
| Nishigori et al.168 | 21 | n.e. | 0,2-0,3ml (2,5mg/ml) | En la submucosa en 2 o 3 punciones peritumoral durante colonoscopia | Desde 1 a 3 días antes de la intervención |
| Kazanowski et al.169 | 5 | Agua estéril | 2-5ml | En la submucosa alrededor del tumor durante colonoscopia | Durante la cirugía |
| Noura et al.170 | 25 | n.e. | 5mg/ml | En la submucosa a los 4 cuadrantes peritumoral | Al principio de la intervención |
| Zhou et al.16 | 12 | n.e. | 0,1mg/ml | En la submucosa a los 4 cuadrantes del tumor | Al principio de la intervención |
| Watanabe et al.171 | 31 | Agua estéril | 2,5mg/ml | Punciones en la subserosa a los 4 cuadrantes peritumoral | Al principio de la intervención |
| Chand et al.172 | 10 | n.e. | 1ml(desde 0,5 a 1,6mg/ml) | Punciones en la subserosa a los 4 cuadrantes peritumoral | Después de la ligadura vascular y la movilización del colon |
| Morales-Conde et al. en práctica clínica habitual. Colon: | - | Agua estéril | Dos habones a una concentración de 3cm3 con 15mg de ICG | Punciones en la subserosa a los 2 cuadrantes peritumorales | Al principio de la intervención |
| Morales-Conde et al. en práctica clínica habitual. Recto medio/alto: | - | Agua estéril | Dos habones a una concentración de 3cm3 con 15mg de ICG | Punciones en la submucosa a los 2 cuadrantes peritumorales | 12-24h antes de la intervención |
| Morales-Conde et al. en práctica clínica habitual. Recto bajo: | - | Agua estéril | Dos habones a una concentración de 3cm3 con 15mg de ICG | Punciones en la submucosa a los 2 cuadrantes peritumorales | Al principio de la intervención |
| Cirugía de esófago - mapeo linfático | |||||
| Schlottmann et al.11 | 9 | Agua estéril | 0,5cm3 (1,25mg/ml) | En la submucosa en los 4 cuadrantes peritumoral durante endoscopia | Antes de la parte laparoscópica |
| Hachey et al.174 | 10 | Agua estéril o albúmina sérica | 2,5mg/ml | En la submucosa en los 4 cuadrantes peritumoral durante endoscopia | Al principio de la intervención |
| Yuasa et al.175 | 20 | n.e. | 0,5ml | Dos punciones peritumoral en la submucosa | Después de la toracotomía |
| Morales-Conde et al. en práctica clínica habitual | - | Agua estéril | 1,25mg/ml | En la submucosa en los 4 cuadrantes, 0,5cm3 peritumoral mediante endoscopia | 12-24h antes de la intervención |
| Cirugía de estómago - mapeo linfático | |||||
| Ohdaira et al.176 | 6 | n.e. | 1ml (33μg/ml) | En la submucosa en los 4 cuadrantes peritumoral durante endoscopia | El día antes de la intervención |
| Miyashiro et al.177 | 10 | n.e. | 0,25-1,25mg/0,5ml | 4-8 punciones peritumoral durante endoscopia | Al principio de la intervención |
| Lee et al.178 | 20 | n.e. | 1ml | En la submucosa en los 4 cuadrantes peritumoral durante endoscopia | Al principio de la intervención |
| Shoji et al.179 | 20 | n.e. | 0,5ml | A los 4 cuadrantes peritumoral durante endoscopia | Después de la sección del gran epiplón |
| Tajima et al.180 | 3125 | n.e. | 0,5ml | - En la submucosa a los 4 cuadrantes peritumoral durante endoscopia- Punciones en la subserosa a los 4 cuadrantes peritumoral | - Desde 1 a 3 días antes de la intervención- Al principio de la intervención |
| Kusano et al.181 | 22 | n.e. | 0,5ml | Punciones en la subserosa a los 4 cuadrantes peritumoral | Al principio de la intervención |
| Tummers et al.182 | 26 | Nanocoloide y solución salina | 1,6ml (0,05mg) | Punciones en la subserosa a los 4 cuadrantes peritumoral | Al principio de la intervención |
| Liu et al.183 | 61 | n.e. | 0,3125mg/0,5mlpor cuadrante | En la submucosa en los 4 cuadrantes peritumoral durante endoscopia | El día antes de la intervención |
| Chen et al.184 | 129 | Agua estéril | 0,3125mg/0,5mlpor cuadrante | En la submucosa en los 4 cuadrantes peritumoral durante endoscopia | 20-30h antes de la intervención |
| Baiocchi et al.185 | 13 | n.e. | 2,5mg/ml por la endoscopia (1-3ml)0,25mg/ml por la cirugía (1-3ml) | En la submucosa en los 4 cuadrantes peritumoral durante endoscopia o subserosa durante la cirugía | El día antes de la intervención o al principio de la intervención |
| Morales-Conde et al. en práctica clínica habitual | - | Agua estéril | 1,25mg/ml | En la submucosa en los 4 cuadrantes, 0,5cm3 peritumoral mediante endoscopia | 12-24h antes de la intervención |
| Cirugía de melanoma - mapeo linfático | |||||
| Göppner et al.186 | 24 | Agua estéril | 0,25mg/ml | Punciones subcutáneas alrededor del tumor | Al principio de la intervención |
n.e.: no especificado.
La fluorescencia con ICG ha demostrado una elevada sensibilidad en la detección del ganglio centinela en el cáncer de mama160–163. Existe un estudio en 100 pacientes con ganglio clínicamente negativo en las que se compararon distintas técnicas para la detección del ganglio centinela160. Se detectó con una sensibilidad del 100% con ICG, la combinación de ICG y azul de metileno presentó una sensibilidad del 95% y la combinación ICG con radioisótopo del 72,2%160. En este estudio, la dosis administrada justo antes de la cirugía fue de 2ml al 0,5% de ICG (1ml por vía intradérmica y 1ml por vía subcutánea), observándose su efecto a los 5-10min160. La terapia combinada incluyendo ICG podría ser un método factible y seguro para la identificación del ganglio centinela en estos pacientes162,163 (tabla 4).
Mapeo linfáticoa) Cirugía colorrectalEl ICG en la detección intraoperatoria de ganglios linfáticos en cáncer colorrectal puede utilizarse para realizar un mapeo linfático durante la linfadenectomía16,164–172 (tabla 4), siendo este aspecto especialmente importante si estos ganglios no están presentes en la zona de disección habitual, lo que cambiaría la estrategia quirúrgica con esta información159,168.
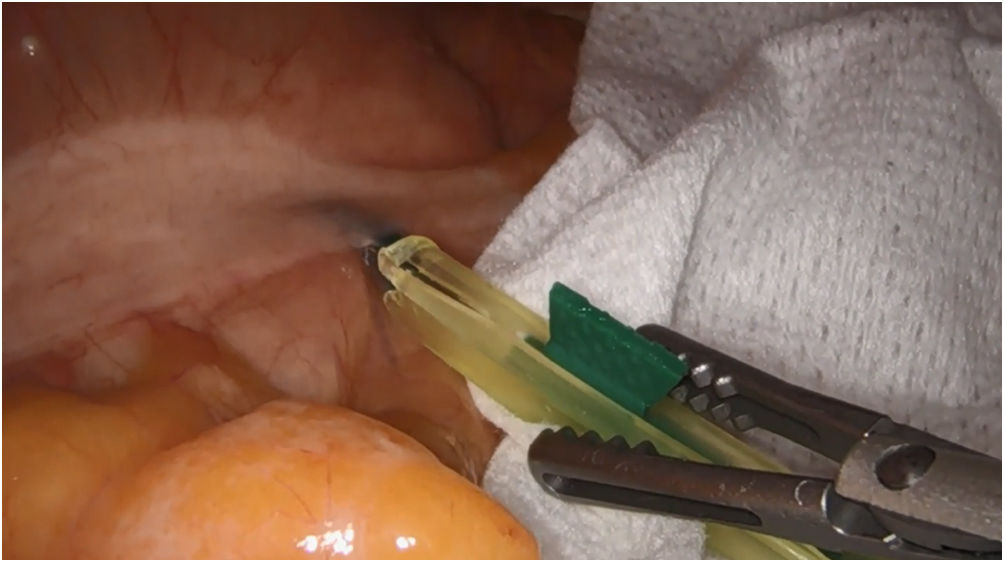
En cirugía de colon se realiza la inyección peritumoral de forma intraoperatoria por vía laparoscópica a nivel subseroso, no lográndose el objetivo en todos los casos, bien porque se derrama contenido o porque no da tiempo a que se difunda adecuadamente, siendo necesario establecer métodos más fiables para realizar la inyección16,166–172. Nuestro grupo, para favorecer el drenaje linfático una vez realiza la inyección del ICG (fig. 4), inicia la disección en el colon derecho por vía craneal, para preservar el drenaje linfático y dar tiempo a la difusión del ICG, observando su utilidad en la exéresis completa del mesocolon. Por su parte, en el ángulo esplénico el uso del ICG puede mostrar el drenaje del tumor hacia el territorio de la arteria mesentérica inferior o la arteria cólica media.
Así mismo, en cirugía del recto se puede inyectar justo antes de comenzar el procedimiento por medio de la utilización de un rectoscopio rígido o mediante rectoscopia flexible 12-24h antes de la cirugía, siendo preciso definir la mejor forma de realizarlo. En la cirugía de recto podría tener un valor añadido en la valoración de la necesidad de realizar una extirpación de las cadenas ganglionares laterales.
b) Cirugía de esófagoEl cáncer de esófago se disemina de una forma multidireccional a través de linfáticos de la submucosa a las estaciones linfáticas regionales, siendo las metástasis linfáticas uno de los factores pronósticos más importantes11,173–175, y la linfadenectomía extensa necesaria para mejorar el pronóstico11,173–175. La fluorescencia con ICG está siendo estudiada para el mapeo linfático para la realización de una linfadenectomía guiada11,173–175. Los primeros estudios han mostrado un aumento del número de adenopatías cuando se realiza el ICG para el mapeo linfático11,173–175. Sin embargo, más estudios son necesarios antes de introducir este procedimiento en la práctica clínica diaria convencional, aunque parece ser de utilidad teniendo en cuenta las limitaciónes actuales11,173–175 (tabla 4).
c) Cirugía de estómagoLa mayoría de trabajos hablan únicamente del mapeo linfático guiado por fluorescencia con ICG de forma descriptiva, ya que en realidad no se modifica la estrategia quirúrgica planificada inicialmente176–185. Sin embargo, todos los estudios concluyen que las imágenes de fluorescencia de ICG tienen una alta sensibilidad e imágenes guiadas para la identificación de ganglio centinela y del mapeo linfático176–185 (tabla 4).
Baiocchi et al. han mostrado que todas las adenopatías que fueron metastásicas captaban ICG, no existiendo adenopatías metastásicas sin captar ICG185. Además, este estudio mostró que en algunos pacientes fue necesario extender la linfadenectomía fuera del territorio estándar debido a la existencia de ganglios que captaban ICG, observando en un caso que existía una adenopatía positiva185.
Lógicamente estos hallazgos deben confirmarse con nuevos estudios y en casos de neoadyuvancia o tumores avanzados.
d) Cirugía de melanomaLa dosis de ICG habitualmente utilizada para el mapeo linfático en caso de melanoma es de 2ml, a una concentración de 0,25mg/ml186. Pocos minutos después de la inyección, se incrementa la dosis hasta reinyectar un máximo de 2ml, con una dosis total máxima inyectada de 3,5mg de ICG (o 5ml) por paciente186. Con la administración antes de la cirugía de 2ml de ICG (2,5mg/ml), se ha conseguido una tasa de detección de ganglios del 80% con ICG186 (tabla 4).
ConclusionesLa fluorescencia con ICG es una tecnología muy útil en cirugía general. Existen suficientes evidencias que ponen de relieve que el empleo de ICG es un recurso seguro, sencillo y fácil de manejar, que resulta muy útil en el reconocimiento de estructuras anatómicas, vascularización de tejidos, tumores y ganglios linfáticos. Las dosis de uso y el modo de empleo es variable de unos grupos a otros, existiendo aún poco consenso en este sentido, fundamentalmente basado en si se deben usar dosis fijas o si debe adaptarse al peso del paciente, lo que conlleva la adecuación de las dosis sin realmente influir en los resultados. Así mismo, la dilución con albúmina parece indicada solamente para los casos de su uso para el ganglio centinela, mientras que lo convencional es diluirlo con agua destilada.
Lógicamente se necesitan más estudios prospectivos y aleatorizados con numerosas muestras de pacientes para sacar conclusiones definitivas sobre el uso y modo de empleo de la fluorescencia en cirugía general, aunque la evidencia reunida hasta ahora es muy alentadora.
Contribuciones de los autoresSalvador Morales-Conde: diseños de estudio, adquisición de datos, análisis e interpretación de resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Eugenio Licardie: diseños de estudio, adquisición de datos, análisis e interpretación de resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Isaias Alarcón: diseños de estudio, adquisición de datos, análisis e interpretación de resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Andrea Balla: diseños de estudio, adquisición de datos, análisis e interpretación de resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Conflicto de interesesSalvador Morales-Conde, Eugenio Licardie, Isaias Alarcón y Andrea Balla no tienen conflictos de intereses o vínculos financieros que revelar.