Introducción
La cirugía hepática laparoscópica (CHL) de los tumores hepáticos sólidos (THS) es de difícil aplicabilidad, sobre todo a los THS de gran tamaño, los que afectan a segmentos posteriores del lóbulo derecho, los que están próximos a venas suprahepáticas, vena cava inferior o ramas portales y los que puedan requerir segmentectomías posteriores o hepatectomías mayores1-6. Recientemente, algunos autores4-6 han comunicado la resección de segmentos posteriores e incluso la realización de hepatectomías derechas e izquierdas empleando la cirugía laparoscópica asistida (CLA), lo que les ha permitido abordar estas lesiones con mayor seguridad.
Después de realizar las primeras 20 resecciones hepáticas laparoscópicas7, algunas de segmentos posteriores7,8, hemos podido realizar una hepatectomía derecha reglada (segmentos V a VIII) (HD) y otra izquierda (segmentos II a IV) (HI).
Pacientes y método
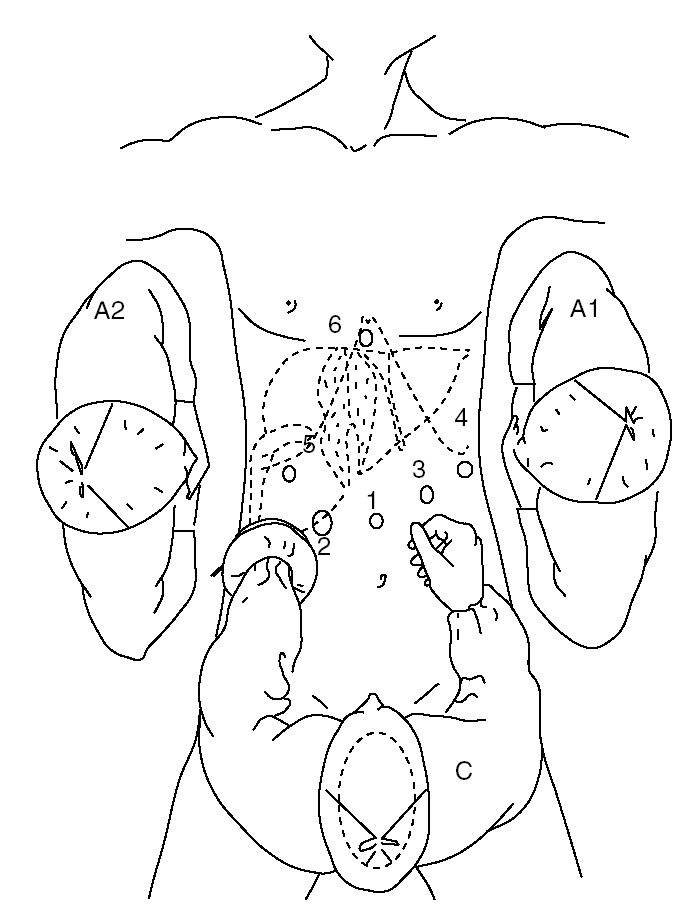
Entre enero de 2003 y junio de 2006, hemos realizado el abordaje laparoscópico en 31 pacientes con THS, cuya media de edad era 58 años (intervalo, 26-76 años), de los que 16 (51%) eran mujeres. En 24 casos se trataba de metástasis hepáticas (23 de carcinoma colorrectal, MHCCR, y 1 caso de tumor neuroendocrino del páncreas con una metástasis hepática); en 2 casos se trataba de tumores malignos primarios del hígado (un leiomiosarcoma y un hepatocarcinoma en hígado sano) y los 5 restantes fueron tumores benignos (2 casos de adenomas, 1 hiperplasia nodular focal, 1 hemangioma en la base del lóbulo izquierdo y 1 hemangioma gigante en lóbulo hepático izquierdo, con anemia y crecimiento progresivo, que había pasado de 10 a 16 cm en los últimos 6 meses); 9 se realizaron con cirugía totalmente laparoscópica (CTL) y 22, con CLA. De esta serie, presentamos la primera HD y HI, empleando la CLA7 según nuestra técnica, que se describe a continuación: se coloca al paciente en decúbito supino, independientemente de la localización de la lesión, con las piernas abiertas y ligeramente flexionadas hacia la pelvis. El cirujano se sitúa entre las piernas, el primer ayudante, a la izquierda del paciente y el segundo ayudante, que maneja la cámara, a la derecha, empleando para ello un segundo monitor (fig. 1). Se inicia la intervención realizando una incisión transversa en el flanco derecho, a 3-5 traveses de dedo del reborde costal derecho (desde la línea axilar media a la línea axilar anterior). Se secciona los músculos abdominales hasta la vaina anterior del recto. Con la mano se libera las adherencias de cirugía previa y se introduce el Omniport® (Tyco®). Con la mano izquierda del cirujano dentro del abdomen, se introduce un trocar supraumbilical de 10 mm en una zona libre de adherencias (trocar n.o 1) y se crea el neumoperitoneo (12 mmHg de CO2). A la derecha del trocar umbilical, se coloca un trocar de 12 mm (trocar n.o 2) y a la izquierda, otro de 10 mm (trocar n.o 3); otro de 10 mm, en flanco izquierdo, línea axilar media (trocar n.o 4), para introducir el clamp vascular con el que podremos realizar la maniobra de Pringle; y los 2 restantes a nivel subcostal derecho y subxifoideo (fig. 1, trocares 5 y 6) para introducir las pinzas de separación hepática. A través de los trocares 5 y 6, introduciendo la óptica por uno de ellos se consigue una mejor visión de las venas suprahepáticas (VSH) y de los ligamentos posteriores derechos e izquierdos, que se puede seccionar al introducir tijeras o croché a través del otro trocar; si fuera necesario, se puede movilizar el lóbulo derecho hasta la vena cava inferior (VCI).
Fig. 1. Esquema de la posición del paciente, el cirujano, los ayudantes y los trocares. C: cirujano; A1: primer ayudante; A2: segundo ayudante.
Posteriormente, se realiza ecografía con sonda abdominal (Entos®, CT8, Phillips) introducida por el Omniport®. La mano izquierda del cirujano facilita la movilización del hígado y la disección del pedículo hepático y permite seccionar el ligamento triangular y coronario derecho hasta la VCI y la VSH derecha, consiguiendo la rotación manual del lóbulo derecho. En las lesiones del lóbulo izquierdo facilita la sección de sus ligamentos y el control vascular es similar a las lesiones del lóbulo derecho.
Caso clínico 1
Varón de 70 años que se intervino el 26 de marzo de 2004 de un adenocarcinoma de sigma a 12 cm del margen anal (B1 de la clasificación de Astler-Coller) con metástasis hepáticas sincrónicas (pT2 pN0 ,0/15, M1), realizando una resección anterior baja, siendo el CEA y Ca 19.9 preoperatorios normales. La tomografía computarizada (TC) preoperatoria detectó un nódulo de 1,5 cm en el lóbulo superior izquierdo pulmonar (LSIP) y 2 lesiones hepáticas en el lóbulo hepático derecho (LHD), una de 3 cm centrohepática y otra periférica en el segmento VIII. Se le realizó tomografía por emisión de positrones (PET) el 19 de mayo de 2005, que detectó 4 nódulos hipermetabólicos en el LHD indicativos de metástasis. No había captación pulmonar.
Con el diagnóstico de adenocarcinoma en estadio D se planificó quimioterapia (QMT) adyuvante, por el servicio de oncología, a base de oxaliplatino y 5-fluorouracilo (10 ciclos). En la PET realizada en abril de 2005 no había ningún foco de captación.
En la TC helicoidal con reconstrucción 3D angiográfica, realizada en octubre de 2005, se evidenció un nódulo de 1,5 cm en el LSIP y 4 metástasis en el LHD, la mayor, de 3 cm y localización central, adyacente a la vena suprahepática derecha. La PET realizada en noviembre de 2005 presentó captación en el LSIP y 3 lesiones en el LHD (segmentos VIII, V y VI). Los marcadores tumorales seguían siendo normales (CEA, 1,4 ng/ml; Ca 19.9, 7,44 U/ml).
Se planificó, dada la progresión de la enfermedad, una HD en una primera intervención y resección de metástasis pulmonar una vez recuperado. En la TC con volumetría, el volumen hepático total era 1.310 ml; el volumen tumoral, 12 ml, y el volumen hepático residual (VHR), 417 ml (el 32% del volumen total). Consideramos insuficiente el VHR y se decidió realizar previamente embolización preoperatoria de porta derecha. En la TC realizada 6 semanas tras la embolización, el VHR es 664 ml (el 53% del volumen total).
El 7 de abril de 2006 se intervino mediante nuestra técnica de CLA. La presión venosa central se mantuvo entre +4 y +7 mmHg. Se realizó exploración manual y laparoscópica de la cavidad abdominal, descartando enfermedad diseminada. Tras la realización de la colecistectomía, se realizó movilización completa del LHD hasta llegar a la vena cava inferior y la VSH derecha, sin rodearla. La sección de colaterales a VCI se realizó con ligaduras, clips metálicos y Ligasure®. Se realizó la disección arteria hepática derecha, ligando ramas anterior y posterior, disección de vena porta derecha y sección entre ligaduras reforzadas con clips metálicos. Se efectuó la disección del parénquima hepático con bisturí armónico, hasta identificar el pedículo biliar derecho, que se seccionó con endograpadora vascular articulada Tyco 2,5 cm, y la identificación de venas hepáticas procedentes del lóbulo derecho que drenaban a VSH media, que se seccionan con Ligasure Atlas® 10 mm. Se llevó a cabo la disección de VSH derecha que posee 2 ramas independientes, que se seccionan en el interior del parénquima hepático con sutura vascular 2,5 cm apoyadas en fundas de goretex; la hemostasia y comprobación de fugas biliares, dejando drenaje aspirativo.
El 20 de junio de 2006 se realizó la resección en cuña de metástasis pulmonar en LSIP, y se le dio el alta el quinto día postoperatorio.
Caso clínico 2
Mujer de 44 años, diagnosticada de hemangioma gigante de 10 cm en mayo de 2005. En controles posteriores, en la resonancia magnética (RM) y la TC se apreciaba crecimiento del tumor a 16 cm, por lo que se indicó cirugía. La intervención se realizó mediante CLA7. Realizamos disección de arteria hepática y vena porta izquierdas vía laparoscópica. La arteria hepática fue ligada y seccionada entre ligaduras y la vena porta fue seccionada con endograpadora vascular de 2,5 cm. Se realizó movilización de todo el lóbulo izquierdo hasta la VSH izquierda, sin rodearla. Se realizó sección del parénquima hepático con Ligasure Atlas® y sección de VSH media e izquierda con endograpadora vascular de 2,5 cm apoyadas en fundas de goretex. La hemostasia se completó con Tissuelink®, dejando drenaje aspirativo.
Resultados
En ambos pacientes no hubo complicaciones intraoperatorias ni postoperatorias. El tiempo quirúrgico en la HD fue de 360 min y en la HI fue de 240 min. La HD no precisó transfusión y el hematocrito preoperatorio fue del 40% y al alta, del 34%. La HI precisó transfusión de 2 U, probablemente relacionado con un hematocrito preoperatorio bajo, del 30%. En ambos casos, la bilirrubina total y las transaminasas postoperatorias fueron normales. La actividad de protrombina postoperatoria fue superior al 70% en ambos casos. Las estancias hospitalarias fueron de 5 y 3 días, respectivamente.
Discusión
El número de casos de resecciones hepáticas por laparoscopia publicados en las series sobre THS consultadas es tan escaso que incluso en un estudio multicéntrico europeo8 sólo se comunican 37 casos realizados en 11 centros, lo que supone sólo 3,3 casos por centro. Lo mismo ocurre con una serie recientemente publicada en España9. Si analizamos las resecciones hepáticas mayores, la experiencia es aún menor. Con esta corta experiencia es muy difícil extraer conclusiones con respecto a las indicaciones, los resultados a largo plazo en lesiones malignas, etc., y la mayoría de las series se limita a aportar el número de procesos, la localización y el tamaño de las lesiones y los resultados postoperatorios inmediatos, tal y como ocurre en nuestra experiencia (31 resecciones laparoscópicas en THS hasta junio de 2006). En este sentido, y con el fin de establecer las indicaciones de las hepatectomías por laparoscopia en THS, son necesarios estudios prospectivos con seguimientos a largo plazo que comparen la seguridad (morbimortalidad) y la eficacia curativa entre la vía abierta y la laparoscópica. Además, las intervenciones deberían ser realizadas por los mismos cirujanos, con experiencia en cirugía hepática y laparoscópica.
Algunos autores1-3,8,10 consideran que la resección hepática empleando la CTL estaría indicada en lesiones menores de 5 cm, localizadas en la región anterior del lóbulo derecho (segmentos V y VI de Couinaud) o en el lóbulo izquierdo. En segmentos I, VII y VIII, consideran que la dificultad es mayor debido al difícil acceso y a que estos segmentos poseen comunicaciones con las venas hepáticas y VCI. En nuestra experiencia, empleando la CLA descrita por nuestra unidad7, estas indicaciones podrían expandirse, ya que, teniendo al paciente en decúbito supino, el cirujano, situado entre las piernas del paciente, tiene la mano izquierda introducida en el abdomen por el flanco derecho y puede manejar el hígado, tanto el lóbulo derecho como el izquierdo, de forma similar a como lo manejaría por cirugía abierta. Podemos movilizar el lóbulo derecho completamente, disecar la VCI ligando sus colaterales con el caudado, podemos comprimir el pedículo portal, suprahepático y el parénquima, en el caso de lesiones vasculares, etc. Fong et al5 trataron a 11 pacientes mediante CLA con la mano derecha del cirujano introducida en epigastrio, y tuvieron que convertir en 6 de ellos. Antonetti et al11 también emplearon CLA combinando la resección hepática con la crioablación. La mayoría de los 9 pacientes resecados presentaban lesiones situadas en lóbulo izquierdo y segmentos derechos anteriores del lóbulo derecho. Huang et al6 aportan 7 pacientes resecados con lesiones localizadas en segmentos posteriores del lóbulo derecho, empleando la CLA, introduciendo en epigastrio la mano derecha del cirujano, que se sitúa a la izquierda del paciente, estando éste en decúbito lateral (3 lesiones localizadas en el segmento VII y 4 en el segmento VI, con un tamaño entre 1,8-4 cm). O'Rourke et al4 realizaron 12 hepatectomías derechas laparoscópicas, de las que convirtieron en 2 casos y 5 precisaron de CLA. Recientemente, Buell et al12 comunicaron en una revisión su técnica con CLA, con 2 cirujanos situados a ambos lados del paciente. Comunicaron la resección de 100 lesiones recogidas en 2 centros (University of Cincinnati y Northwestern Memorial Hospital de Chicago). En las resecciones del lóbulo izquierdo, el cirujano se sitúa a la derecha del paciente e introduce su mano derecha para movilizar el lóbulo izquierdo. En las resecciones del lóbulo derecho, el cirujano se sitúa a la izquierda del paciente e introduce su mano izquierda para movilizar el lóbulo derecho. Ambas situaciones tienen el inconveniente de que el brazo del cirujano se cruza con la cámara introducida a nivel umbilical. Comunican la realización de 31 lobectomías (20 derechas y 11 izquierdas), con un tamaño tumoral en THS de 6 cm (rango, 1-8 cm), con un paciente fallecido. Con nuestra técnica de CLA, dado que el cirujano se sitúa entre las piernas, al introducir la mano izquierda por el flanco derecho, podemos liberar adherencias con facilidad, controlar los pedículos sin interferir con la cámara u otros instrumentos y, además, podemos abordar lesiones tanto del lóbulo derecho como del lóbulo izquierdo, sin modificar la posición del paciente ni de los cirujanos. Además, con la mano derecha el cirujano puede manejar todos los instrumentos de sección y disección a través de las puertas de entrada.
Algunos autores5,6,11,12 comunican las ventajas de la CLA respecto a la CTL en lesiones posteriores del lóbulo derecho (segmentos VI, VII y VIII). En la CTL, para abordar estas lesiones, se coloca al paciente en decúbito lateral izquierdo. En nuestra técnica CLA, a diferencia de la empleada por otros autores5,6,11,12, el cirujano situado entre las piernas del paciente introduce su mano izquierda por el handport y realiza fácilmente la movilización de todo el lóbulo derecho hasta llegar a VCI y suprahepática derecha, manejando los instrumentos de sección con la mano derecha. El paciente se colocó en todos los casos en decúbito supino, independientemente de la localización de la lesión a tratar, ya que la movilización completa de los lóbulos derecho e izquierdo permite un buen acceso a los segmentos derechos e izquierdos. Por otra parte, la mano izquierda del cirujano gira el hígado hacia el lado izquierdo del paciente, y es posible, además, la introducción de compresas detrás del lóbulo derecho (una vez liberado de sus ligamentos) para mantener el giro del hígado hacia la izquierda. La introducción de la mano izquierda del cirujano permite no sólo la localización de la lesión mediante palpación, sino, en caso necesario, controlar el pedículo hepático, las suprahepáticas y la línea de sección hepática para el mejor control de la hemostasia.
La exploración ecográfica y manual del hígado es fundamental para conocer la relación con los vasos, asegurar el margen de resección y evaluar la enfermedad hepática en las lesiones malignas. El rendimiento de la exploración ecográfica y manual con la CLA es superior al de la CTL, gracias a la palpación de la mano introducida por el handport y el empleo de sondas de mayor resolución que las empleadas por vía laparoscópica. Además, la palpación de la superficie hepática permite una mejor caracterización anatómica de las lesiones preexistentes e incluso la detección de otras no identificadas preoperatoriamente4-6. En la serie de Gigot et al8, la mayoría con técnica CTL, sobre lesiones malignas, todas fueron exploradas visualmente y sólo el 65% por ecografía.
Las complicaciones técnicas fundamentales son la hemorragia durante la sección del parénquima o por desgarro durante la disección de los vasos portales, VCI y VSH, y la embolia aérea. Los métodos de sección del parénquima en cirugía hepática abierta están bastante perfeccionados, y se consigue realizar sin transfusión casi el 70-80% de las resecciones hepáticas. Por contra, en cirugía laparoscópica, los medios de hemostasia no están totalmente perfeccionados. Así, algunos autores prefieren el empleo del bisturí armónico, pinzas bipolares o bisturí ultrasónico (cavitrón); el empleo del bisturí de argón es controvertido porque aumenta la presión intraabdominal y con ello el riesgo de embolia aérea. Otros prefieren el empleo de endograpadora lineal vascular para seccionar los vasos de mayor calibre12. Nosotros preferimos el empleo del bisturí armónico y Ligasure Atlas® para la sección del parénquima y la endograpadora para la sección de los elementos portales y suprahepáticos, apoyados en material hemostático. Finalmente, completamos la hemostasia con Tissuelink® en la superficie de corte y sustancias hemostásicas.
Algunos estudios han demostrado que la realización de la maniobra de Pringle reduce las pérdidas hemáticas. Así, Cherqui et al2,3 realizaron la hepatectomía con oclusión vascular del pedículo portal, de forma continua o intermitente, y comunicaron tiempos de oclusión superiores a 1 h en 2 de los 30 pacientes que describieron3. Más complejo técnicamente es el control vascular de venas suprahepáticas en las resecciones hepáticas mayores1-3. Nosotros en ambos casos realizamos disección de los pedículos suprahepáticos, sin rodearlos, y la sección se produce en el interior del parénquima. Creemos que una disección correcta del pedículo portal con oclusión hemihepática y una liberación suficiente de los ligamentos hepáticos hasta la VCI y la VSH permiten realizar resecciones mayores con suficientes garantías para el control del sangrado y evitar el riesgo de embolia aérea.
Estas experiencias confirman que la resección laparoscópica de THS es segura, con una morbimortalidad baja, y se puede ampliar incluso a resecciones hepáticas mayores.
Correspondencia. Dr. R. Robles Campos.
Unidad de Trasplante Hepático. Hospital Universitario
Virgen de la Arrixaca.
Ctra. Madrid-Cartagena, s/n. 30120 El Palmar. Murcia. España.
Correo electrónico: rirocam@um.es
Manuscrito recibido el 11-7-2006 y aceptado el 11-7-2006.