Sr. Director:
La hiperplasia celular heterogénea, en grados diversos, de las glándulas paratiroides y el aumento de la concentración inmunorreactiva de hormona paratiroidea se encuentran entre las primeras manifestaciones de las alteraciones del metabolismo mineral en pacientes con insuficiencia renal crónica (IRC).
Pequeños nódulos producidos por proliferación celular monoclonal se forman dentro de una hiperplasia difusa, que progresa hacia una hiperplasia nodular1. Las mutaciones genéticas y reajustes de estas células en la hiperplasia nodular no son totalmente conocidas, lo cual es necesario para poder establecer en el futuro un método de detección definitivo y eficaz para la prevención de la hiperplasia paratiroidea en la uremia2,3.
En los últimos años varios investigadores han demostrado que el fósforo desempeña un papel esencial en el desarrollo del hiperparatiroidismo secundario e hiperplasia de las células principales4. Ya que el fósforo regula la producción de 1,25D3 mediante alteración de la enzima 1-alfa-hidroxilasa, es posible que la retención de fósforo sea mediada mediante un descenso en la síntesis de 1,25D3. Esto es observable en pacientes con IRC incipiente. En estadios avanzados de IR, la reducción de masa renal limita la producción de 1,25D3. Además, hoy día sabemos que el fósforo per se, e independientemente de las concentraciones de calcio iónico y de 1,25D3, puede aumentar la síntesis y la secreción de hormona paratiroidea (PTH) tanto in vitro como in vivo. Las anomalías descritas en el metabolismo de la vitamina D no se caracterizan sólo por bajos valores de 1,25D, sino también del número de receptores a la vitami na D. Por ello, las glándulas paratiroideas son resistentes a la acción de la 1,25D3 y son necesarias altas concentraciones farmacológicas de la misma en sangre para suprimir los valores elevados de PTH en la IRC avanzada. Por ello, la corrección del fósforo sérico es imperativa para que la 1,25D3 pueda controlar los valores de hormona paratiroidea. Otra observación conocida es la secreción ya no suprimible relacionada con el tamaño glandular en el hiperparatiroidismo secundario (HPTS)5.
Estos conocimientos no sirven, no obstante, para explicar las alteraciones genéticas y moleculares últimas que determinan la proliferación celular y la hiperplasia en el hiperparatiroidismo secundario a insuficiencia renal crónica.
Asistimos actualmente a un considerable estudio de las bases genéticas y moleculares del crecimiento celular en el hiperparatiroidismo. En los pasados 10 años, cambios genéticos (ret, menin) fueron relacionados en la patogenia de los síndromes MEN-2 y MEN-1. Diferentes mutaciones en los receptores de los sensores de calcio han sido identificadas en el hiperparatiroidismo severo neonatal y en la hipercalcemia familiar hipocalciúrica. El gen HRPT2, responsable del desarrollo del hi perparatiroidismo hereditario, ha sido localizado en el locus 1q21-31. Otras alteraciones genéticas también han sido analizadas y parecen estar relacionadas con diferentes tipos de hiperparatiroidismo6,7. Recientes estudios demuestran que la tumorogénesis del hiperparatiroidismo familiar, del esporádico y del urémico responde a alteraciones genéticas diferenciadas y a un modelo no progresivo8.
Asimismo, se han descrito expresiones elevadas del TGF-alfa en el gen mensajero y a nivel proteico, junto con elevadas expresiones de EGF-r en células hiperplásicas y adenomatosas, lo que sugiere que los factores de crecimiento interactúan con su receptor para producir proliferación celular paratiroidea, tal vez por un mecanismo autocrino9.
La mayoría de los adenomas, y en muchos casos de HPTS en pacientes urémicos, evidencian un elevado set point (concentración extracelular de Ca2++ concentración de Ca2+ o mitad de la máxima inhibitoria de secreción de PTH). Se ha demostrado una reducción significativa en la reducción de la inmunorreactividad de los receptores de Ca2+, tanto en adenomas como en el HPTS, como posible expresión reducida del receptor proteico y que puede contribuir a la elevación del set point observado en estos pacientes10. Observamos que existe una vía común, tanto en adenomas como en el HPTS, que pueda explicar el hecho observado.
Los mecanismos de tumorogénesis en la hiperplasia y neoplasia parecen ser diferentes11,12. Sin embargo, no se encuentran descritas las repercusiones de los estímulos proliferativos en pacientes urémicos sobre enfermedad paratiroidea previa.
La proliferación policlonal está ligada al efecto de algún factor mitógeno, con proliferación de tipo hiperplasia, mientras que la mutación somática determinará una proliferación monoclonal, tipo adenoma-carcinoma, según algunos autores13. En la hiperplasia paratiroidea en la uremia, inicialmente crecen de forma difusa y policlonal, hasta que un foco (monoclonal) crece ocupando la mayoría de la glándula, transformándose en un proceso monoclonal3.
Solamente una glándula afectada de HPTP demostró un modelo policlonal en un estudio reciente2. Parece ser, con los datos existentes hasta el momento, que indican la uniclonalidad de los adenomas paratiroideos, mientras que dicho concepto se encuentra en conflicto con el diagnóstico de hiperplasia y afectación multiglandular.
El desarrollo de cambios monoclonales en glándulas obtenidas en pacientes con HPTS complica aún más el tratamiento de pacientes mantenidos en hemodiálisis14. Las células de la hiperplasia nodular tienen una menor densidad de receptores de calcitriol y sensores de calcio que la hiperplasia difusa y son más resistentes a la terapia médica incluyendo el calcitriol. Uno de estos nódulos puede crecer de forma más vigorosa que otros y ocupar la mayor parte de la glándula afectada1.
En la hiperplasia secundaria causada por la uremia, principalmente una sobreexpresión de PRAD1/ciclina D1 puede que no sea la mayor anomalía genética responsable de la tumoro génesis y que se encuentren implicados otros mecanismos asociados15.
Estudios sobre la inmunoexpresión de la p53 no han demostrado ser útiles en la diferenciación de subgrupos histopatológicos paratiroideos. Sin embargo, la inmunodetección de la p53 ha sido observada de forma más frecuente en el HPTS en pacientes urémicos, así como que cambios en la p53 pueden representar una respuesta celular en situaciones hiperprolifera tivas16.
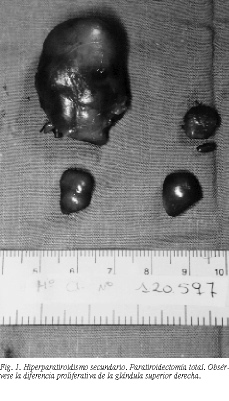
El presente caso puede resultar ilustrativo en el sentido de que, en pacientes con insuficiencia renal crónica e hiperparatiroidismo secundario, el estímulo de proliferación celular repercute tanto en glándulas normales como en aquellas que sufrían una enfermedad previa, como el adenoma, y que probablemente obedezcan a una naturaleza monoclonal de desarrollo. La imagen (fig. 1) corresponde a una paratiroidectomía total en un paciente en hemodiálisis, con osteodistrofia, dolor y prurito que no respondió a tratamiento médico. Llama la atención el tamaño exclusivamente desproporcionado de la glándula paratiroidea superior derecha, en relación con el proceso hiperplásico de las restantes. Los estudios histopatológicos no demostraron, no obstante, diferencias entre las 4 glándulas. No pudimos realizar en aquellos momentos estudios genéticos y de clonalidad. Puede inferirse la uniclonalidad de las lesiones observadas en todas las glándulas.