Introducción
La cirugía pancreática ha evolucionado significativamente desde la descripción de la duodenopancreatectomía cefálica (DPC) por Whipple1. Durante las últimas décadas se han descrito diversas técnicas exeréticas con la finalidad de disminuir la morbilidad postoperatoria a corto y largo plazo. Sin embargo, no fue hasta 1978 que Traverso et al2 publicaron la primera alternativa real a la técnica de la DPC, con la preservación del píloro (DPC-PP). Los estudios para comparar ambas técnicas no se hicieron esperar, y finalmente esta última quedó establecida como opción técnica en tumoraciones periampulares3. En cuanto a afección benigna, los pacientes afectos de pancreatitis crónica durante las décadas de los años setenta y ochenta eran sometidos a pancreatectomías agresivas4-7. Sin embargo, algunos grupos eran críticos respecto a los resultados posquirúrgicos7. Siguiendo el principio de economizar parénquima sano, Beger et al8,9 describieron la resección parcial de la cabeza del páncreas con preservación duodenal (PCPD) como técnica útil en casos de pancreatitis crónica. Comparando las dos técnicas (DPC-PP y PCPD), se evidenció que no había diferencias en cuanto al control del dolor, e incluso la PCPD parecía ser superior en cuanto a calidad de vida postoperatoria10. En esta misma línea, Frey et al11 abogaron por una resección más económica de la cabeza del páncreas junto con una derivación longitudinal del ducto pancreático, en casos de pancreatitis crónica. En dos estudios comparativos posteriores, se demostró que dicha técnica era similar en morbilidad postoperatoria, e incluso mejoraba la calidad de vida del paciente respecto a la DPC12,13. Más tarde, el grupo de Berna14 describió una técnica que podría aportar beneficios de las intervenciones de Frey et al. Como vemos, las variaciones de las técnicas de resección pancreática con preservación duodenal son muy numerosas. Así, si tenemos en cuenta el parénquima pancreático que se va a resecar, se han descrito técnicas que abarcan desde la excavación o resección muy limitada de la cabeza del páncreas con preservación del duodeno15 hasta la resección total de la cabeza del páncreas propuesta por Takada et al16, pasando por las intervenciones que abogan por la resección parcial o subtotal de la cabeza pancreática con o sin drenaje del ducto pancreático, comentadas anteriormente8,14,17. En cuanto al manejo del duodeno remanente, también han aparecido técnicas que asocian una duodenectomía parcial con el fin de evitar al paciente la DPC18,19. Así pues, la cirugía conservadora de la región duodenopancreática ha quedado bien establecida en la pancreatitis crónica, e incluso algunos grupos han comenzado a utilizar estas técnicas para tratar tumores benignos e incluso con potencial de malignidad incierto18,19. Ahora bien, la complejidad técnica de este tipo de intervenciones puede ser superior a la de la DPC y las complicaciones, incluso frecuentes; por lo tanto, las indicaciones están en debate. El objetivo de este estudio es evaluar la experiencia acumulada en cuanto a la evolución postoperatoria durante los últimos años en el empleo de la CC de la región duodenopancreática.
Material y método
Desde el año 1996 hasta el 2006, hemos realizado CC por afección localizada en la región cefálica del páncreas en 24 pacientes. Hemos definido CC como cualquiera de las siguientes técnicas: pancreatectomía cefálica con preservación duodenal (PCPD), resección del proceso uncinado (RUN) y enucleación de tumores quísticos (EN). Se ha excluido a 2 pacientes sometidos a DPC por presentar isquemia duodenal intraoperatoria durante PCPD. Únicamente se ha considerado los casos de CC de cabeza pancreática, excluyendo obviamente las lesiones de cuello, cuerpo o cola de páncreas. La técnica quirúrgica se planificó de forma preoperatoria tras la realización de una tomografía computarizada (TC) helicoidal; en los casos necesarios se añadió estudio mediante resonancia magnética (RM), colangiografía por RM y ecoendoscopia. Se indicó el estudio citológico y análisis de marcadores tumorales intraquísticos mediante punción guiada por TC en los casos con diagnóstico dudoso. El estudio de imagen lo evaluó el mismo radiólogo en todos los casos. Finalmente, se indicó CC a los pacientes con afección inflamatoria o neoplásica benigna o de potencial de malignidad incierto en el estudio preoperatorio. En todos los casos se administró antibioticoterapia profiláctica intraoperatoria y se dejó drenaje cerrado aspirativo durante un mínimo de 5 días postoperatorios. Se ha realizado un estudio estadístico descriptivo de la serie presentada, excluyendo del estudio los tumores neuroendocrinos sólidos con el fin de homogeneizar la serie.
Técnica quirúrgica
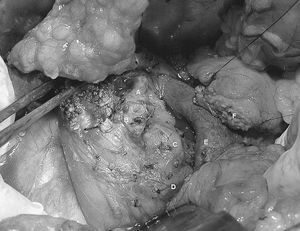
Pancreatectomía cefálica con preservación duodenal (PCPD). Se ha indicado PCPD en pancreatitis crónica y en los tumores cuyo diagnóstico preoperatorio fue benigno o de potencial de malignidad incierto con independencia del tamaño. Dicha técnica se reservó para el tratamiento de lesiones localizadas en el espesor de la cabeza pancreática o lesiones de cabeza pancreática excéntricas en contacto con el ducto principal. La resección se realizó a nivel del marco duodenal y se inició con la identificación de la arteria hepática y la arteria gastroduodenal (fig. 1). A continuación, procedimos a la sección del cuello pancreático, maniobra que falitita la disección y la preservación de la arteria gastroduodenal, separándola del páncreas en su trayecto retroduodenal. La arteria pancreatoduodenal anterosuperior se ligó en su porción más distal posible, con el fin de preservar intacta la irrigación duodenal20,21. Por último, se realizó la resección pancreática en la porción caudal preservando la vascularización pancreatoduodenal inferior22. A nuestro entender, la preservación de la fascia retropancreática es básica para preservar la irrigación de la cabeza del páncreas (figs. 2 y 3). En cuanto a la sección parenquimatosa pancreática, se realizó mediante pinza de coagulación monopolar y sutura con monofilamento en caso de ser necesario. A continuación, se ligó el conducto de Wirsung en su unión con el conducto biliar (fig. 2). Una vez completada la exéresis, se practicó una anastomosis pancreatoyeyunal. La vía biliar distal se preservó en la medida de lo posible, realizando hepatoyeyunostomía en los casos de estenosis biliar secundaria a pancreatitis crónica.
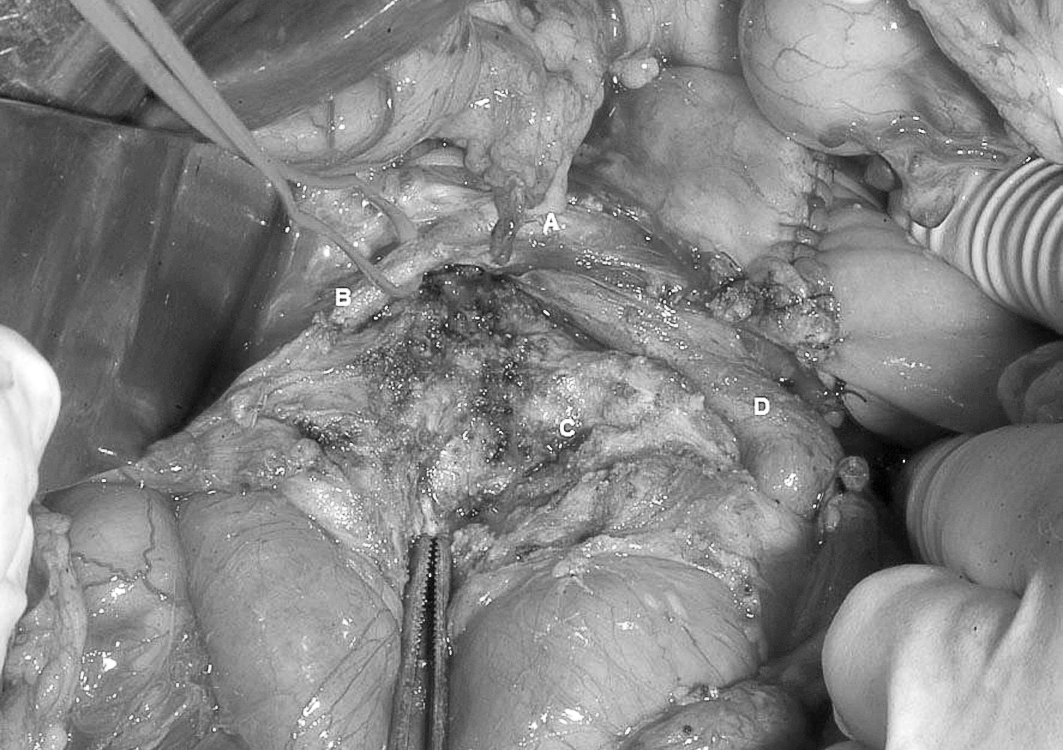
Fig. 1. Pancreatectomía cefálica con preservación duodenal, detalle de la disección arterial. A: arteria hepática. B: arteria gastroduodenal. C: lecho de resección pancreática. D: vena mesentérica superior.
Fig. 2. Pancreatectomía cefálica con preservación duodenal, detalle de la preservación de la fascia retropancreática y vascularización pancreaticoduodenal inferior. A: vía biliar distal. B: conducto de Wirsung seccionado a nivel de la papila. C: fascia retropancreática. D: vascularización pancreaticoduodenal inferior. E: vena mesentérica superior.
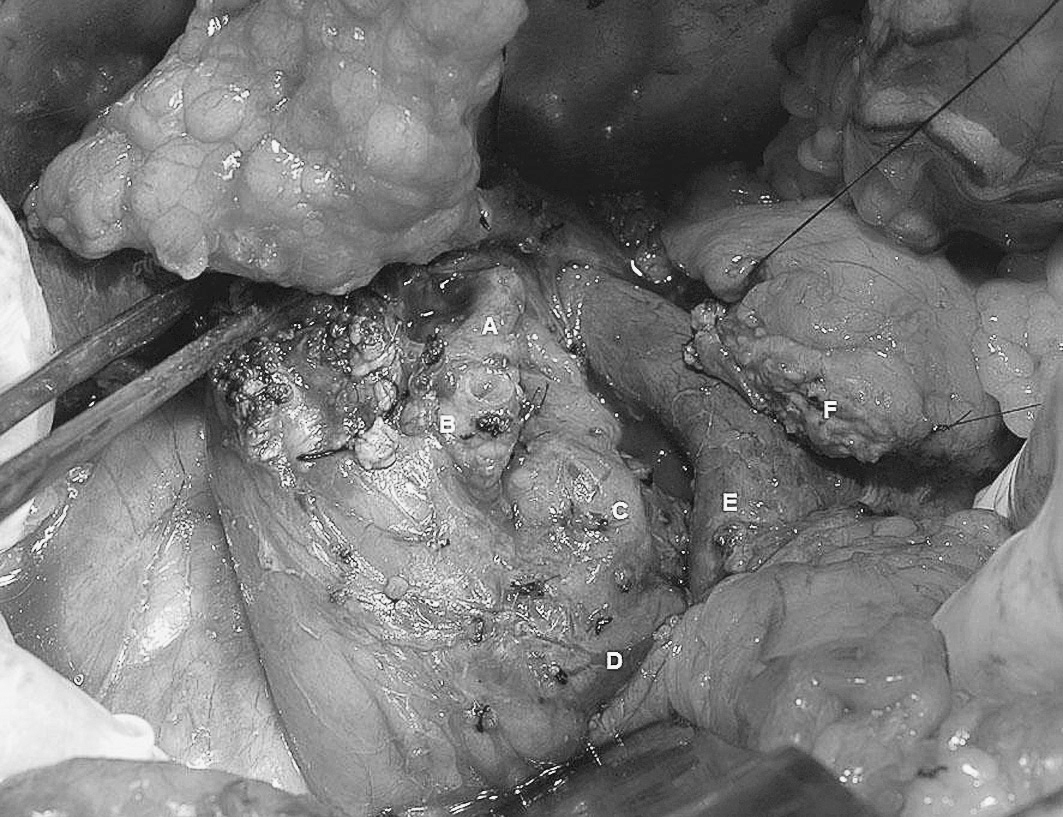
Fig. 3. Pancreatectomía cefálica con preservación duodenal, detalle del campo operatorio tras efectuar la resección. A: cuello pancreático. B: margen duodenopancreático remanente. C: duodeno y antro gástricos. D: arteria hepática. E: vena mesentérica superior.
Resección del proceso uncinado (RUN). La RUN se indicó en lesiones claramente localizadas en el proceso uncinado, sin afección vascular venosa ni arterial y sin proximidad al conducto de Wirsung. Tras la realización de maniobra de Kocher se procedió a la resección del tejido pancreático afecto.
Enucleación (EN). Se indicó en los tumores quísticos sin criterios de malignidad y sin contacto con el conducto de Wirsung. Durante la cirugía se evitó la lesión del conducto principal para disminuir la aparición de fístula pancreática postoperatoria, con la realización de ecografía intraoperatoria en la mayoría de los pacientes.
Estudio anatomopatológico
Todas las piezas de resección fueron estudiadas por un mismo patólogo. Se realizó un estudio intraoperatorio de la pieza de resección, en todos los casos para descartar malignidad o afección del margen de resección pancreático, incluso en los pacientes intervenidos por pancreatitis crónica. En el caso de diagnosticarse un adenocarcinoma pancreático, se hubiese indicado DPC, situación que no ocurrió en ningún caso. El tamaño de la lesión resecada se registró en caso de tratarse de tumoración quística.
Resultados
Datos de filiación
Recogimos 24 CC realizadas en nuestro centro entre los años 1996 y 2006. Fueron 13 varones y 11 mujeres con una media de edad ± desviación típica (intervalo) de 50 ± 15 (19-73) años. Los pacientes varones se intervinieron mayoritariamente por pancreatitis crónica (PC) en 8 casos y tumor papilar mucinoso intraductal (TPMI) en 4, y 1 cistoadenoma seroso (CAS). Mientras que entre las mujeres las afecciones más frecuentemente registradas fueron el CAS y la PC, en 3 casos respectivamente. En cuanto a las características preoperatorias, la mayoría de los pacientes pertenecían al grupo 2 de clasificación de la ASA (13/24; 54%).
Estudio anatomopatológico
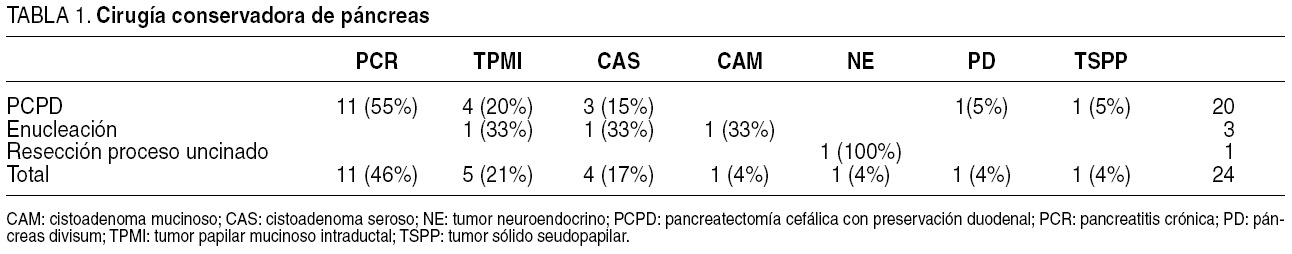
Los pacientes fueron intervenidos por PC en 11 casos, CAS en 4, TPMI en 5, y lesiones de estirpe diversa en los 4 casos restantes. En concreto se trataba de 1 cistoadenoma mucinoso, 1 páncreas divisum, 1 tumor sólido seudopapilar y 1 tumor neuroendocrino quístico (tabla 1). El tamaño de la lesión se recogió en 7 tumoraciones quísticas, con una media de 37 ± 21 mm (10-70 mm). En todos los pacientes hubo correlación entre el estudio de presunción preoperatorio y el postoperatorio en cuanto a la ausencia de malignidad de las lesiones intervenidas.
Pancreatitis crónica
Se intervino a 10 pacientes por dolor y 1 por sospecha de neoplasia quística cefálica. En el estudio preoperatorio se evidenciaron diversas alteraciones morfológicas en el páncreas. Así, se identificó lesión tumoral inflamatoria en 10 casos y calcificaciones pancreáticas en 9 casos. En 7 casos las calcificaciones afectaban a la cabeza del páncreas y en 2 se localizaban de forma difusa. La dilatación del ducto principal se registró en 9 casos y la dilatación de la vía biliar en 5. En un total de 2 pacientes se evidenció compresión duodenal. Por último, en 8 pacientes se diagnosticó seudoquiste de cabeza del páncreas en el estudio realizado.
Intervención quirúrgica
Realizamos PCPD a 20 (83%) pacientes (figs. 1-3), RUN a 1 (4%) y EN a 3 (13%). El tiempo quirúrgico medio empleado fue de 391 ± 13 (240-480) min en las PCPD y de 266 ± 69 (140-380) min en las EN.
Evolución postoperatoria
En cuanto a la evolución postoperatoria, la serie presenta una morbilidad general del 54% (13/24), sin mortalidad postoperatoria. Se registraron 14 complicaciones en 11 pacientes del grupo PCPD, 1 complicación en el grupo EN, y 1 complicación en el grupo RUN. Ningún paciente presentó vaciamiento gástrico lento. Las complicaciones registradas en el grupo PCPD fueron 3 infecciones de herida, 3 fístulas pancreáticas, 2 hemoperitoneos, 2 fístulas biliares, 2 complicaciones médicas (accidente cerebrovascular y broncospasmo grave), 1 infección respiratoria y 1 hemorragia digestiva. En concreto, la fístula pancreática apareció en 3 pacientes, en 1 de ellos únicamente fue una determinación bioquímica en la que no hubo repercusión clínica (fístula de grado A, ISGPF)23. El paciente fue dado de alta a los 11 días sin complicaciones. En 2 de ellos, la fístula pancreática se consideró de grado B por presentar sepsis asociada o ser motivo de reingreso o de ingreso prolongado. En un paciente ésta perduró durante más de 3 semanas y fue motivo de reingreso por fiebre, y se le dio el alta finalmente a los 18 días sin fístula. En otro paciente, dicha complicación se asoció a hemoperitoneo y hemorragia digestiva, finalmente fue solventado mediante arteriografía y embolización de arteria gastroduodenal. El paciente fue dado de alta a los 43 días con débito escaso por drenaje percutáneo, que se le retiró a la semana del alta. Dos pacientes presentaron fístula biliar tras PCPD. Uno de ellos requirió la colocación de drenaje percutáneo en una colección intraabdominal, que posteriormente presentó débito bilioso. A dicho paciente se le dio el alta a los 30 días del ingreso tras resolución del cuadro. El segundo paciente presentó una fístula de alto débito que obligó a drenaje mediante colangiografía transparietohepática (CTPH) y luego colocación de prótesis. La fístula biliar se mantuvo hasta la colocación del drenaje biliar mediante CTPH, a los 45 días de la intervención. El paciente del grupo RUN presentó una complicación en forma de fístula pancreática de grado A, resuelta espontáneamente. El paciente fue dado de alta con drenaje intraabdominal a los 11 días, y se le retiró en control ambulatorio a los 18 días de la intervención. Del mismo modo, en el grupo EN se registró una fístula pancreática grado A, resuelta en 17 días.
La mediana de estancia hospitalaria postoperatoria fue de 11 (7-43) días, y se transfundió a 4 pacientes durante las primeras 48 h postoperatorias. Ningún paciente ha presentado recidiva de la enfermedad durante el seguimiento de los tumores resecados, con un seguimiento medio de 17 meses, cerrando el estudio en noviembre de 2006. En cuanto a los pacientes afectos de PC, el seguimiento medio fue de 13 meses. La ausencia de dolor se registró en 7 casos y la presencia de dolor ocasional en 4. Ningún paciente refirió pérdida de peso tras la intervención. La cirugía no modificó el control de la glucemia en 2 pacientes previamente diabéticos. Únicamente 1 paciente evidenció hiperglucemia tras la intervención, sin requerir insulinización.
Discusión
La preservación del duodeno en la pancreatectomía cefálica nació de la preocupación de los grupos de cirugía con experiencia por conservar al máximo la funcionalidad pancreática. En 1989, Beger et al24 publicaron una serie con una evolución postoperatoria satisfactoria, en 128 pacientes. Con ello se demostró que la cirugía conservadora pancreática era factible. Más tarde, se puso de manifiesto el beneficio funcional de dicha técnica respecto a la DPC10. Estudios centrados en fisiología pancreática exocrina han demostrado empeoramiento de la función pancreática tras DPC, no evidentes tras PCPD25. Además, la función endocrina tampoco parece empeorar tras PCPD, manteniendo la glucemia y las concentraciones de péptido C plasmático e insulina26. El estudio presentado no hace referencia a los beneficios a largo plazo de estas técnicas. Como hemos comentado, el objetivo del presente análisis ha sido revisar la experiencia adquirida en los últimos años en el empleo de diversas técnicas de CC no tan sólo por pancreatitis crónica, sino también por lesiones quísticas benignas y por lesiones con potencial de malignidad incierto.
Morbilidad postoperatoria
La resección económica pancreática no está exenta de complicaciones y, de hecho, un 50% de los pacientes presentados han tenido algún tipo de complicación. Como es sabido, la morbilidad de la CC es elevada27. La isquemia duodenal es una de las preocupaciones mayores de la PCPD. Según algunos autores, la movilización del duodeno-páncreas o maniobra de Kocher podría ser la causa de mayor morbilidad postoperatoria27,28, probablemente en relación con la sección de vascularización retroperitoneal y la aparición de isquemia duodenal. Pedrazzoli et al27 defienden la cirugía de preservación duodenal sin maniobra de Kocher. En concreto, realizan 7 PCPD con maniobra de Kocher y 6 sin ésta, y observan una mayor tasa de complicaciones en el grupo con dicha maniobra. En nuestro centro, realizamos la maniobra de Kocher antes de la resección del páncreas cefálico, ya que de este modo se facilita la cirugía. Además, intentamos preservar la fascia retropancreática para evitar la necrosis duodenal. Con respecto a la morbilidad aparecida tras la PCPD, hemos evidenciado fístula pancreática en un 15% de los pacientes. El tratamiento conservador ha sido suficiente en todos los casos, aunque en 2 de ellos la estancia se vio sensiblemente alargada. Los 2 pacientes que presentaron isquemia duodenal durante la cirugía fueron excluidos del estudio, ya que finalmente se les practicó una DPC. En un 10% de los pacientes se evidenció fístula biliar, una de ellas de alto débito y difícil resolución. La hepatoyeyunostomía por estenosis coledocal se llevó a cabo en 4 pacientes, sin que ninguno de ellos presentara complicaciones biliares postoperatorias. Así pues, parece que la asociación de derivación biliar no comporta riesgo elevado, y se podría considerarla una opción en casos de estenosis biliar previa a la intervención o al sospechar lesión isquémica intraoperatoria. Con respecto a la morbilidad asociada a EN, se sabe que la aparición de fístula pancreática es más frecuente tras esta técnica que tras DPC, tal y como ha ocurrido en nuestra experiencia. En el artículo del grupo de la Universidad Johns Hopkins se refleja una mayor incidencia de fístulas pancreáticas entre el grupo de EN que en el de resecciones (50% frente a 12%; p = 0,05). Sin embargo, la fístula pancreática que aparece tras DPC comporta mayor morbilidad y mortalidad que la asociada a EN. Por otra parte, la resección pancreática tampoco está exenta de complicaciones, como diabetes postoperatoria (10%) e incluso mortalidad postoperatoria29.
Ampliación de indicaciones de la pancreatectomía cefálica con preservación duodenal (PCPD)
Como ya hemos comentado, diversos grupos han publicado su experiencia en PCPD por pancreatitis crónica con resultados favorables10,24. En nuestro centro, 11 pacientes fueron intervenidos por pancreatitis crónica con PCPD por su afección cefálica severa. Anteriormente, dichos pacientes habrían sido sometidos a DPC. Sin embargo, en el momento actual la preservación del duodeno es técnicamente factible y, por tanto, debemos tratar la enfermedad pancreática de la forma menos agresiva posible. Como vemos, la pancreatitis crónica es una indicación aceptada de la cirugía pancreática conservadora.
Ahora bien, ¿está justificado realizar cirugía pancreática limitada en tumores benignos o incluso en tumores con potencial de malignidad incierto? Hay controversia en cuanto al tratamiento quirúrgico indicado en las lesiones cefálicas, por la dificultad técnica que puede acarrear la práctica de una PCPD sobre un páncreas sano30. De acuerdo con nuestros resultados, creemos que la ampliación de esta técnica a casos de tumores benignos o de potencial de malignidad incierto puede estar justificada. En esta línea, Pedrazzoli et al27 publican su experiencia con 13 pacientes sometidos a PCPD por lesiones benignas o intermedias diferentes a pancreatitis crónica. En concreto, indicaron PCPD en 3 CAS, 5 tumores endocrinos pancreáticos, 2 lesiones quísticas finalmente diagnosticadas de seudoquistes pancreáticos, 1 TPMI, 1 quiste congénito y 1 quiste pancreático postraumático. En su discusión hacen referencia a la poca difusión de dicha técnica y se comenta que en 2001 se había publicado 72 casos de PCPD por lesiones distintas de pancreatitis crónica27. En concreto, se habían realizado PCPD por lesiones quísticas (50 pacientes), tumores endocrinos pancreáticos (8 pacientes), TPMI (6 pacientes) y una miscelánea (8 pacientes)16,28,31-39. En nuestro centro, 9 pacientes fueron intervenidos con PCPD por lesiones distintas de la pancreatitis crónica. El TPMI fue el motivo de dicha intervención en 4 casos, seguido por el CAS en 3, el tumor sólido seudopapilar (TSPP) en 1 y un caso de páncreas divisum. En nuestra experiencia, la localización y el tamaño de las lesiones no fue motivo para contraindicar dicha intervención, siempre que el estudio peroperatorio no indicara carcinoma invasivo.
En España, Fernández-Cruz et al22 han comenzado a utilizar PCPD en alguna de sus variantes como técnica útil en lesiones de TPMI con afección de páncreas cefálico. En nuestra opinión, el estudio peroperatorio de los casos compatibles con TPMI o tumores benignos ha de realizarse de forma rigurosa y la aportación por un patólogo especializado en patología pancreática es fundamental. Incluso con esta precaución, el grupo de Rochester ha descrito recidivas del 8,6% (5/58) tras pancrea-tectomía parcial con margen negativo o hiperplásico40.
Si analizamos a todos los pacientes intervenidos por TPMI, se trataba de lesiones con displasia moderada en 4 pacientes y severa en 1. Con respecto a la extensión de la lesión en el páncreas, se identificó afección de rama ductal secundaria en 3 o mixta en 2. El estudio del margen de resección demostró que era normal en 2 casos, afecto de displasia leve en 2 y denudado en 1. Teóricamente, algunos autores aconsejan que deberíamos tratar a los pacientes hasta que el margen de resección fuera normal o con hiperplasia papilar41. Sin embargo, puede haber algunos impedimentos para conseguir dicho objetivo por el contexto clínico del paciente o porque el estudio definitivo del margen puede presentar dificultades. En concreto, Paye describe 3 falsos negativos en el estudio peroperatorio del margen de 41 pacientes intervenidos. Por otra parte, las características del paciente como la edad puede hacer desaconsejable la pancreatectomía total o subtotal. En nuestro grupo, hemos considerado como aceptable un margen normal, afecto de hiperplasia papilar o displasia leve. Por otro lado, algunos grupos han defendido el empleo de técnicas de pancreatectomía económica incluso para el tratamiento de lesiones malignas de bajo grado18,19,33. La preocupación tras la realización de PCPD por lesiones de potencial de malignidad incierto debe ser la curación desde el punto de vista oncológico. Siech et al42 publicaron en 2000 una serie unicéntrica con 12 PCPD realizadas por tumores quísticos. De ellos, 5 pacientes resecados por CAS no presentaron recidiva. Sin embargo, el 50% de los cistoadenomas mucinosos (CAM, 1 de 2 pacientes), el 33% de TPMI (1 de 3 pacientes) y 50% de los neuroendocrinos (1 de 2 pacientes) sí presentaron recidiva de la enfermedad. Tras ello, el grupo de Ulm aconseja resecciones pancreáticas estándar para tratar lesiones de potencial de malignidad incierto. Actualmente, en nuestra experiencia, ningún paciente de los presentados ha tenido recidiva tumoral, aunque las lesiones analizadas en esta serie de pacientes son benignas o de potencial de malignidad incierto.
Ampliación de indicaciones de la enucleación (EN)
La EN está aceptada como tratamiento de lesiones pancreáticas neuroendocrinas a pesar de que puede haber recidiva hasta en un 9% de los casos43. Sin embargo, ¿es lícito realizar esta cirugía para tratar lesiones quísticas pancreáticas? La literatura no es homogénea y algunos grupos desaconsejan la EN como tratamiento de lesiones quísticas de páncreas. Sin embargo, la mayoría de dichas series son antiguas, como la publicada por el grupo de Rochester en 1992 acerca de 8 casos de EN por cistoadenoma seroso, con 2 casos de mortalidad postoperatoria y 4 reintervenciones44. De igual forma, el grupo de Ulm publicó en 1998 su experiencia. Siech et al45 prefieren resecciones económicas a la EN como tratamiento en lesiones quísticas, y no utilizan esta técnica en ningún caso. Más recientemente, Talamini et al29 compararon en un estudio 10 EN y 36 resecciones pancreáticas realizadas todas ellas por cistadenoma mucinoso. Si nos centramos en las lesiones cefálicas, se enuclearon 6 (60%) y se resecaron 7 (27%). Ninguno de los pacientes intervenidos presentó recidiva tras la cirugía, con un seguimiento medio de 43 meses. Por otra parte, el grupo de Winsconsin ha publicado también su experiencia en la EN de tumores pancreáticos30. En su artículo, Kiely et al comparan la experiencia de dicho grupo en la EN y la resección por CAS (10), CAM (16) y tumor neuroendocrino (4). Ninguno de los pacientes presentó recidiva tumoral, con un seguimiento medio de 38 (1-122) meses. Se aconseja la EN como intervención aceptable en lesiones quísticas de pequeño tamaño localizadas en cabeza, cuello y cuerpo pancreáticos, dejando la resección para lesiones de cola de páncreas. En nuestra serie, las 3 lesiones enucleadas (CAS, CAM, TPMI) se localizaban en la cabeza, al excluir otras localizaciones. Como ya hemos comentado, en ningún caso registramos recidiva tumoral. En nuestra opinión, la preservación del parénquima sano es básica para poder mantener las funciones fisiológicas del duodeno y el páncreas. Así, en pacientes afectos de tumoraciones quísticas cefálicas, se debería plantear la posibilidad de realizar EN, independientemente del tamaño de la lesión, siempre que la localización lo haga aconsejable. Por último, al referirnos de nuevo al tratamiento del TPMI esta vez mediante EN, creemos que la afección de ramas pancreáticas secundarias podría tratarse de forma conservadora con un estudio del margen de resección negativo43,46,47. Como ya hemos comentado anteriormente, el único paciente tratado mediante EN por TPMI no ha presentado recidiva.
En definitiva, tras analizar la experiencia obtenida en estos años y evidenciar una nula mortalidad con morbilidad aceptable, creemos que debería valorarse la utilización de las diferentes técnicas de CC duodenopancreática como opción alternativa a la duodenopancreatectomía cefálica.
Correspondencia: Dr. J. Busquets i Barenys.
Hospital de Bellvitge.
Feixa Llarga, s/n. 08907 L'Hospitalet de Llobregat (Barcelona).
España.
Correo electrónico: jbusquets@csub.scs.es
Manuscrito recibido el 31-1-2007 y aceptado el 31-5-2007.