La estenosis significativa del tronco celiaco habitualmente cursa de forma asintomática. No obstante, cuando se interrumpe la arcada de las arterias pancreatoduodenales, puede producirse isquemia visceral. El objetivo de este estudio es determinar si la estenosis preoperatoria del tronco celiaco es un factor de riesgo de complicaciones en pacientes sometidos a duodenopancreatectomía (DPC).
Material y métodosHemos analizado retrospectivamente a 58 pacientes consecutivos sometidos a DPC. Hemos relacionado la estenosis significativa del tronco celiaco con la evolución posquirúrgica. En todos los casos se ha realizado un estudio mediante tomografía computarizada multidetector (TCDM) de 16 canales en tres fases hepáticas. Hemos revisado la TCDM prequirúrgica centrándonos en la morfología del tronco celiaco, especialmente la presencia o ausencia de estenosis significativa (> 50%).
ResultadosEncontramos estenosis del tronco celiaco > 50% en 13 pacientes (22%). La mortalidad total fue de 3 pacientes (5%). La morbilidad total fue del 62%. En 16 pacientes (28%) hubo complicaciones graves, de los que 8 (62%) pertenecen al grupo de estenosis significativa del tronco celiaco (p=0,004); 10 pacientes (17%) presentaron fístula pancreática, 5 (38%) vs. 5 (11%) (p=0,036); 14 pacientes (24%) necesitaron reoperación, 7 (54%) vs. 7 (16%) (p=0,009); 7 pacientes (12%) presentaron hemoperitoneo, 4 (31%) vs. 3 (7%) (p=0,038), en los grupos con y sin estenosis del tronco celiaco respectivamente.
ConclusionesLa estenosis radiológicamente significativa del tronco celiaco es un factor de riesgo de complicaciones graves tras DPC. El estudio del calibre de la AMS con TCDM debería ser sistemático antes de una DPC. Debería valorarse preoperatoriamente la corrección de la estenosis significativa del tronco celiaco.
Significant celiac trunk or artery stenosis (CAS) is normally asymptomatic. However, when the arteries of the pancreatoduodenal arcade are occluded, it could trigger a visceral ischaemia. The objective of this study is to determine whether preoperative CAS is a risk factor for developing complications in patients subjected to duodenopancreatectomy (DPC).
Material and methodsWe have retrospectively analysed 58 consecutive patients subjected to DPC. We have associated significant CAS with post-surgical outcome. In all cases a 16-channel multidetector computed tomography (MDCT) in three hepatic phases was performed. We have reviewed the pre-surgical MDCT focusing on the morphology of the celiac artery (CA), particularly in the presence or absence of significant stenosis (>50%).
ResultsWe found CAS >50% in 13 patients (22%). The overall mortality was 5% (3 patients). Serious complications developed in 16 (28%) patients, 8 (62%) of whom belonged to the group with significant CAS (P=.004). Ten patients (17%) had a pancreatic fistula, 5 (38%) vs. 5 (11%) (P=.036); Fourteen patients (24%) needed new surgery, 7 (54%) vs. 7 (16%) (P=.009); Seven patients (12%) had a haemoperitoneum, 4 (31%) vs. 3 (7%) (P=.038), in the group with and without CAS, respectively.
ConclusionsSignificant radiological CAS is a risk factor of serious complications after DPC. The study of the calibre of the superior mesenteric artery (SMA) with MDCT should be routine before a DPC. The correction of a significant CAS should be evaluated preoperatively.
La estenosis del tronco celiaco en la población general cursa habitualmente de forma asintomática. Ello se debe a los diferentes sistemas vasculares que puede suplementar su irrigación. Sin embargo, su presencia en pacientes que van a ser sometidos a una duodenopancreatectomía cefálica (DPC) puede conllevar importantes complicaciones isquémicas. Estas complicaciones derivan de interrumpir la comunicación entre el tronco celiaco y la arteria mesentérica superior (AMS). La principal comunicación entre estos dos sistemas son la arteria gastroduodenal (AGD) y las arterias pancreaticoduodenales, que en caso de estenosis del tronco celiaco suplen su vascularización. Durante la pancreatectomía, especialmente cuando la causa es maligna, la radicalidad oncológica conduce a la esqueletización de tronco celiaco, arteria hepática (AH) y AMS con la sección de sus ramas colaterales. Esta disección, en caso de estenosis del tronco celiaco, puede producir isquemia visceral y de las anastomosis digestivas necesarias para la reconstrucción.
Múltiples estudios han establecido la prevalencia de estenosis del tronco celiaco, que va desde el 2% del estudio de Berney et al1 sobre pacientes sometidos a DPC, al 49,7% del estudio de Szilagyi et al2 sobre población general. Mientras que en los estudios sobre población occidental1 la causa más frecuente de estenosis del tronco celiaco fue la arteriosclerosis, en los estudios como el del coreano Park3 sobre población oriental, la causa más frecuente era la compresión extrínseca.
La tomografía computarizada multidetector (TCMD) es muy sensible para diagnosticar las anomalías vasculares y estenosis del tronco celiaco y otras anomalías vasculares4. Debido a las posibles complicaciones que se derivan de estas anormalidades vasculares, así como su prevalencia, la detección preoperatoria puede ser clave para realizar una adecuada planificación prequirúrgica5.
El objetivo de este trabajo es estudiar si la estenosis significativa del tronco celiaco es un factor de riesgo de complicaciones en pacientes sometidos a DPC.
Pacientes y métodoHemos realizado un estudio retrospectivo de todos los pacientes sometidos consecutivamente a DPC entre 2006 y 2009 por tumores periampulares, relacionando la presencia prequirúrgica de estenosis significativa del tronco celiaco con la evolución clínica posquirúrgica.
DiagnósticoEn todos los casos se ha realizado un estudio mediante TCDM de 16 canales (Phillips Mx8000) en tres fases después de la inyección de 150ml de medio de contraste. En la fase arterial, a los 30 s de la inyección de contraste se consigue un máximo realce del tronco celiaco y la AMS. Se puede estudiar las variaciones anatómicas, las estenosis y el contacto del tumor con la AMS, fundamental para decidir la resecabilidad quirúrgica. En la fase portal, 70 s después de la inyección se puede estudiar el páncreas. En esta fase, la diferencia de realce entre el tumor y el parénquima sano es máxima, lo que permite definir mejor los límites del tumor, su contacto con la vena mesentérica superior (VMS) y su posible invasión. También se estudia la posible existencia de metástasis hepáticas y ganglionares. Posteriormente se realiza una fase de equilibrio a los 3 min de la inyección, que es cuando el contraste se ha difundido por todos los parénquimas para caracterizar alguna lesión hepática hipovascular (quiste y hemangiomas).
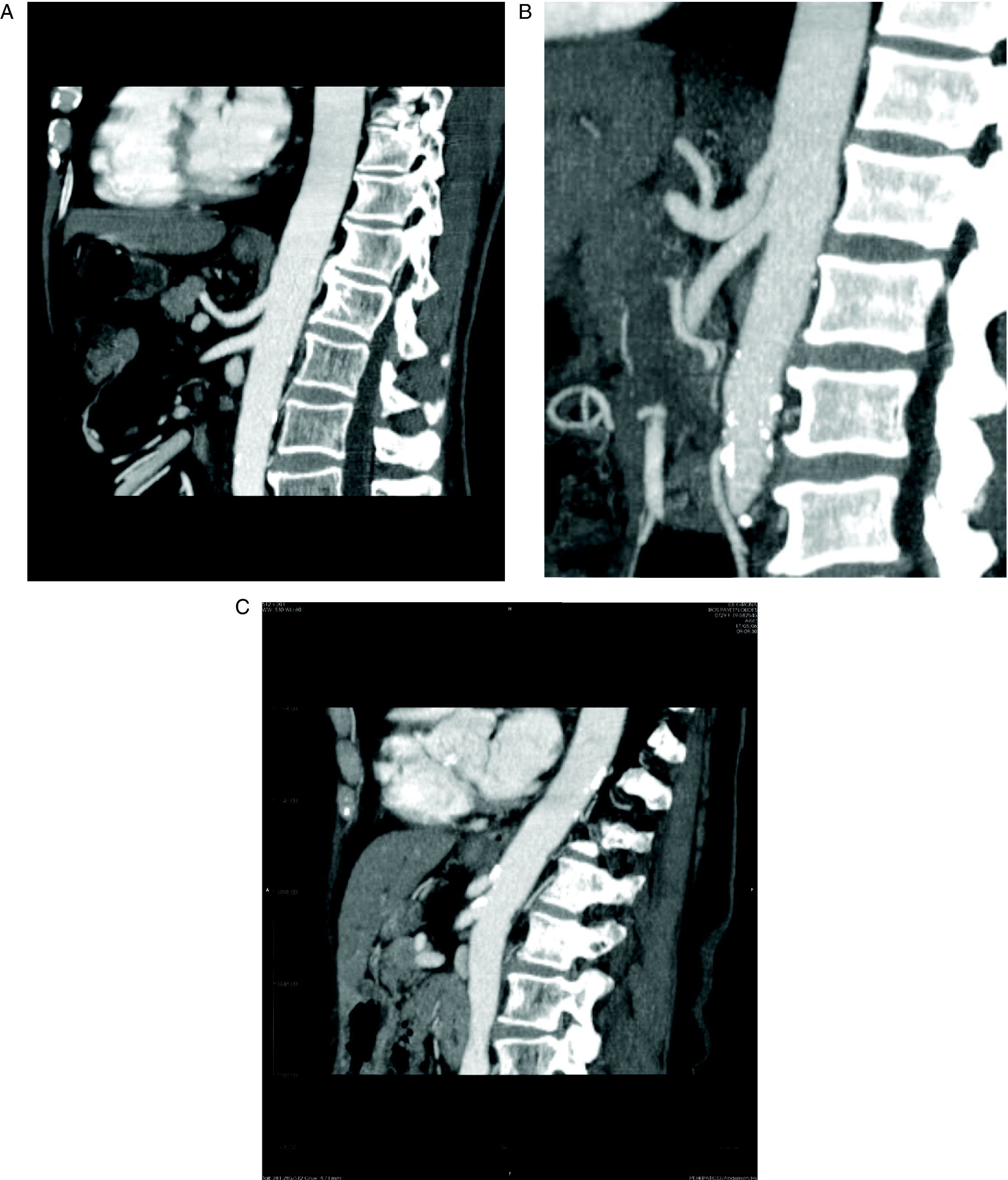
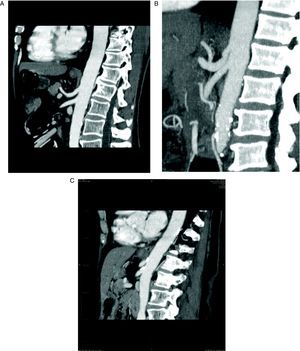
Para el diagnóstico de estenosis del tronco celiaco, se ha realizado una revisión retrospectiva por un radiólogo especializado en TCDM abdominal, sin conocimiento previo de la evolución postoperatoria, de todos los pacientes consecutivos sometidos a DPC. Para la revisión se realizaron reconstrucciones sagitales en fase arterial de la morfología del tronco celiaco, mediante técnicas MIP (maximal intensity projection). Se definió estenosis significativa del tronco celiaco como la que afecta a más del 50% del calibre del vaso (fig. 1A).
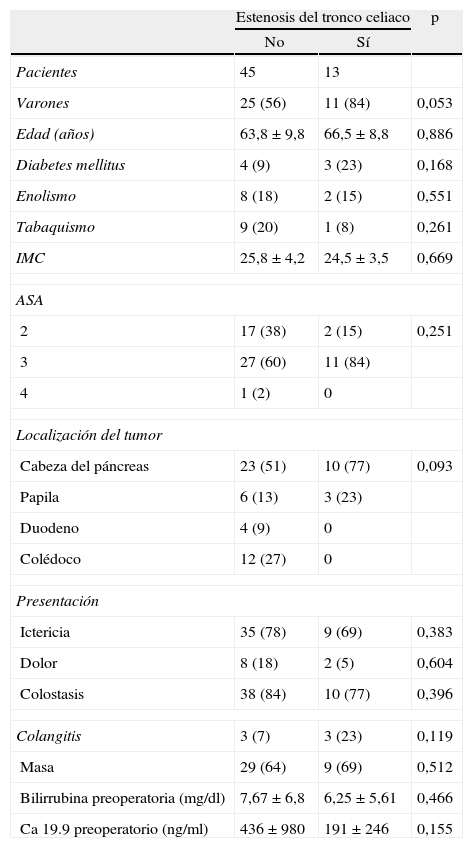
A: tomografía computarizada multidetector, reconstrucción con técnica MIP (maximal intensity projection) en proyección sagital del tronco celiaco (TC) y la arteria mesentérica superior (AMS). B: estenosis del TC por impronta del ligamento arcuato. C: estenosis del TC y de la AMS por arteriosclerosis.
La DPC se efectuó mediante la técnica publicada anteriormente6. Brevemente, se realizó incisión subcostal bilateral. Después de la exploración oncológica manual y por ecografía, se desciende el ángulo hepático del colon y se realiza una maniobra de Kocher. Una vez movilizada la cabeza pancreática, se efectúa la linfadenectomía interaortocava con disección de la AMS a nivel de su salida de la aorta. A continuación, en el espacio inframesocólico, se diseca la VMS y la AMS. Se secciona la primera asa yeyunal y se efectúa el descruzamiento. Seguidamente, en el espacio supramesocólico, se secciona el duodeno pospilórico preferentemente o el antro gástrico. A continuación se realiza linfadenectomía de la AH y del pedículo hepático con ligadura de la AGD (antes de ligarla se efectúa el test del pinzamiento observándose el latido de la AH y la coloración del hígado). Se continúa con la sección de conducto biliar hepático común y colecistectomía; sección del cuello pancreático, separación del proceso uncinado y ligadura de las arterias pancreaticoduodenales inferiores ramas de la AMS (previamente liberada). Finalmente, ligadura del tronco venoso gastrocólico y de las venas pancreáticas con extracción de la pieza. La reconstrucción siempre se realizó con una única asa, efectuándose primero la pancreatoyeyunostomía o la pancreatogastrostomía. La hepatoyeyunostomía se confeccionó a continuación de forma T-L y finalmente se realizó la gastroyeyunostomía en posición antecólica en la mayoría de los pacientes. Se colocó un drenaje aspirativo de baja presión multiperforado en la vecindad de la anastomosis pancreática. Al final de la intervención, se retiró la sonda nasogástrica.
Seguimiento postoperatorioSe sometió a todos los pacientes a un protocolo de tratamiento postoperatorio que comprende analgesia por vía epidural con bupicaína, octreotida s.c. 0,1mg/8 h, procinéticos (eritromicina y metoclopramida endovenosos), sueroterapia, analgesia y bloqueadores de la bomba de hidrogeniones. Se realizó analítica con hematología, bioquímica y proteína C reactiva los días 1, 2, 3, 5, 7 y cuando estaba indicado clínicamente. Se determinó diariamente la amilasa en el líquido de drenaje y en plasma. Se realizó TCDM al final de la primera semana o cuando estaba indicado clínicamente. No se administró sistemáticamente nutrición enteral o parenteral, solamente en caso de complicaciones graves o retraso de vaciamiento gástrico. Al tercer día postoperatorio, si la amilasa en el drenaje era < 3 veces el valor plasmático, se retiraba el drenaje abdominal.
Complicaciones postoperatoriasSe recogieron prospectivamente los datos operatorios, duración de la intervención, pérdidas hemáticas, transfusión, etc. Las complicaciones postoperatorias (principalmente hemorragia, fístula pancreática y retraso de vaciamiento gástrico) se clasificaron siguiendo la clasificación de Dindo el al7 y ISGPF8.
Análisis estadísticoLos datos se analizaron mediante el programa estadístico SPSS versión 15.0 para Windows. La estadística descriptiva utilizada para las variables cuantitativas se basó en el cálculo de las medias±desviaciones estándar, y para las variables cualitativas, en el cálculo de proporciones. Se aplicó la prueba de Kolmogorov-Smirnov para comprobar la normalidad de las variables.
Las pruebas de estadística analítica utilizadas para la comparación de proporciones fueron el test de la χ2 o, en caso de no cumplirse las condiciones necesarias para su aplicación, la prueba exacta de Fisher. Para la comparación de dos medias se utilizó la t de Student o la U de Mann-Whitney en caso de no cumplirse supuestos de normalidad. En todas las pruebas se consideró estadísticamente significativo p<0,05.
ResultadosDesde 2006 a 2009, se sometió a DPC con intención radical a 58 pacientes consecutivos, que son la base del estudio.
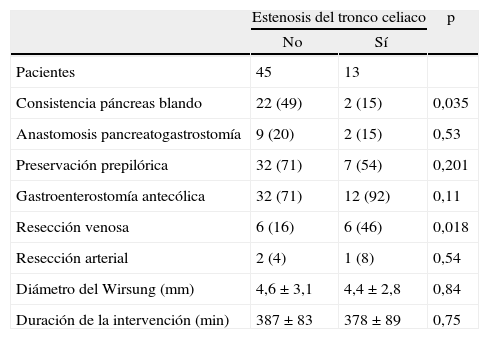
Datos epidemiológicosLa media de edad fue 64,5 (37-82) años. Había mayoría de varones, pero no fue significativo (p=0,053). La clasificación de la American Society of Anesthesiologist (ASA) fue mayoritariamente ASA III en 38 pacientes (65%), ASA II en 19 (33%) y ASA IV en 1 (2%), sin diferencias entre ambos grupos. La presentación clínica del tumor fue como ictericia en 44 pacientes (76%); la mayoría de los casos presentaban además colestasis (48 pacientes, 83%), como imagen radiológica de masa en 38 (66%), dolor en 10 (17%) y con cuadro de colangitis en 6 (10%). La concentración media de bilirrubina preoperatoria fue de 6,4±6,5mg/dl; se realizó drenaje biliar preoperatorio mediante colangiopancreatografía retrógrada endoscópica (CPRE) en 26 casos (45%); la bilirrubina media previa al drenaje fue 12,6±8,8mg/dl. En los datos demográficos no había diferencias entre el grupo con y sin estenosis del tronco celiaco (tabla 1).
Datos epidemiológicos
| Estenosis del tronco celiaco | p | ||
| No | Sí | ||
| Pacientes | 45 | 13 | |
| Varones | 25 (56) | 11 (84) | 0,053 |
| Edad (años) | 63,8±9,8 | 66,5±8,8 | 0,886 |
| Diabetes mellitus | 4 (9) | 3 (23) | 0,168 |
| Enolismo | 8 (18) | 2 (15) | 0,551 |
| Tabaquismo | 9 (20) | 1 (8) | 0,261 |
| IMC | 25,8±4,2 | 24,5±3,5 | 0,669 |
| ASA | |||
| 2 | 17 (38) | 2 (15) | 0,251 |
| 3 | 27 (60) | 11 (84) | |
| 4 | 1 (2) | 0 | |
| Localización del tumor | |||
| Cabeza del páncreas | 23 (51) | 10 (77) | 0,093 |
| Papila | 6 (13) | 3 (23) | |
| Duodeno | 4 (9) | 0 | |
| Colédoco | 12 (27) | 0 | |
| Presentación | |||
| Ictericia | 35 (78) | 9 (69) | 0,383 |
| Dolor | 8 (18) | 2 (5) | 0,604 |
| Colostasis | 38 (84) | 10 (77) | 0,396 |
| Colangitis | 3 (7) | 3 (23) | 0,119 |
| Masa | 29 (64) | 9 (69) | 0,512 |
| Bilirrubina preoperatoria (mg/dl) | 7,67±6,8 | 6,25±5,61 | 0,466 |
| Ca 19.9 preoperatorio (ng/ml) | 436±980 | 191±246 | 0,155 |
ASA: clasificación de la American Society of Anestesiology; IMC: índice de masa corporal.
Los datos expresan n (%) o media±desviación estándar.
Se realizó una revisión retrospectiva de los estudios preoperatorios con TCDM en las 58 DPC. Encontramos una estenosis del tronco celiaco > 50% en 13 pacientes (22%). Radiológicamente, había contacto del tumor con la VMS < 25% en 3 pacientes (5%), de un 25-50% en 5 (9%), > 50% en 3 (5%) y trombosis de la VMS en 1 caso. Había afección tumoral radiológica de la AH en 2 pacientes (4%).
Datos operatoriosSe llevó a cabo preservación prepilórica en la mayoría de las operaciones (39 pacientes, 67%). La reconstrucción se realizó con pancreatoyeyunostomía en 47 casos (82%) o pancreatogastrostomía en 11 casos (18%). La gastroyeyunostomía fue antecólica en 44 pacientes (76%) o retrocólica en 14 (24%), sin diferencias entre ambos grupos. En el grupo sin estenosis del tronco celiaco, fue significativamente más frecuente la consistencia blanda del páncreas, mientras que se realizó con mayor frecuencia resección venosa en el grupo con estenosis del tronco celiaco (tabla 2).
Datos operatorios
| Estenosis del tronco celiaco | p | ||
| No | Sí | ||
| Pacientes | 45 | 13 | |
| Consistencia páncreas blando | 22 (49) | 2 (15) | 0,035 |
| Anastomosis pancreatogastrostomía | 9 (20) | 2 (15) | 0,53 |
| Preservación prepilórica | 32 (71) | 7 (54) | 0,201 |
| Gastroenterostomía antecólica | 32 (71) | 12 (92) | 0,11 |
| Resección venosa | 6 (16) | 6 (46) | 0,018 |
| Resección arterial | 2 (4) | 1 (8) | 0,54 |
| Diámetro del Wirsung (mm) | 4,6±3,1 | 4,4±2,8 | 0,84 |
| Duración de la intervención (min) | 387±83 | 378±89 | 0,75 |
Los datos expresan n (%) o media±desviación estándar.
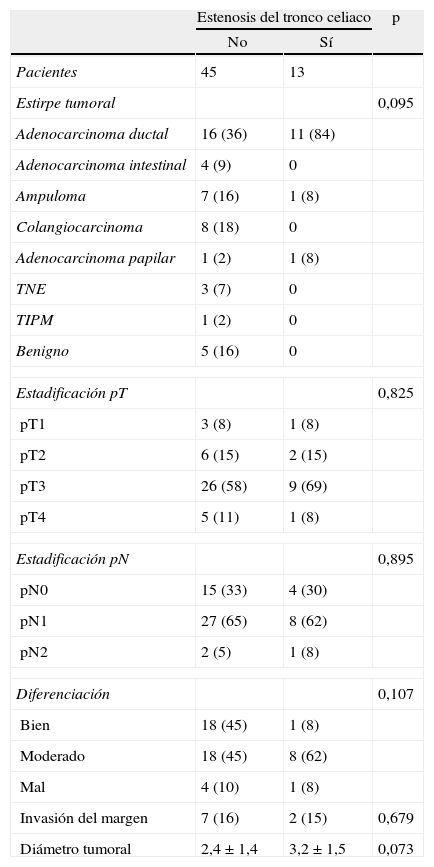
En nuestra serie la estirpe tumoral más frecuente fue el adenocarcinoma ductal de páncreas (47%) y en segundo lugar el colangiocarcinoma (14%) y el ampuloma (14%). Con respecto a la estadificación tumoral, la mayoría fueron valorados como pT3 (62%), N1 (61%), moderadamente diferenciados (52%) y sin invasión del margen (85%). En ninguno de estos datos analizados se obtuvieron diferencias significativas (tabla 3).
Datos patológicos
| Estenosis del tronco celiaco | p | ||
| No | Sí | ||
| Pacientes | 45 | 13 | |
| Estirpe tumoral | 0,095 | ||
| Adenocarcinoma ductal | 16 (36) | 11 (84) | |
| Adenocarcinoma intestinal | 4 (9) | 0 | |
| Ampuloma | 7 (16) | 1 (8) | |
| Colangiocarcinoma | 8 (18) | 0 | |
| Adenocarcinoma papilar | 1 (2) | 1 (8) | |
| TNE | 3 (7) | 0 | |
| TIPM | 1 (2) | 0 | |
| Benigno | 5 (16) | 0 | |
| Estadificación pT | 0,825 | ||
| pT1 | 3 (8) | 1 (8) | |
| pT2 | 6 (15) | 2 (15) | |
| pT3 | 26 (58) | 9 (69) | |
| pT4 | 5 (11) | 1 (8) | |
| Estadificación pN | 0,895 | ||
| pN0 | 15 (33) | 4 (30) | |
| pN1 | 27 (65) | 8 (62) | |
| pN2 | 2 (5) | 1 (8) | |
| Diferenciación | 0,107 | ||
| Bien | 18 (45) | 1 (8) | |
| Moderado | 18 (45) | 8 (62) | |
| Mal | 4 (10) | 1 (8) | |
| Invasión del margen | 7 (16) | 2 (15) | 0,679 |
| Diámetro tumoral | 2,4±1,4 | 3,2±1,5 | 0,073 |
TNE: tumor neuroendocrino.
Los datos expresan n (%) o media±desviación estándar.
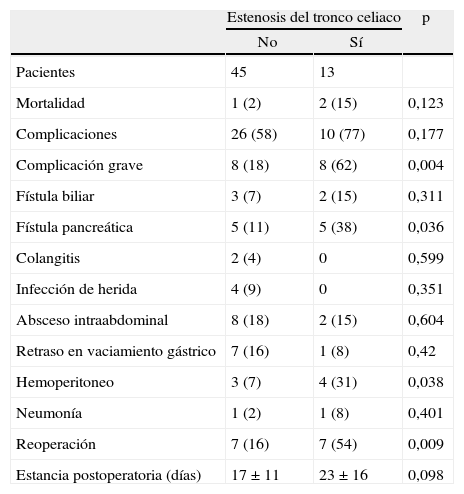
La mortalidad perioperatoria total de este estudio fue de 3 pacientes (5%), y hubo algún tipo de complicación en el 62% de las intervenciones. Según la clasificación de Dindo et al5, dividiendo en complicaciones mayores las superiores al grado 3a (intervenciones que requieran anestesia general), el porcentaje de complicaciones sería del 28%. Hubo diferencia significativamente mayor de complicaciones graves en el grupo con estenosis del tronco celiaco. También hubo mayor número de fístulas pancreáticas, hemoperitoneo y reoperaciones en el grupo con estenosis del tronco celiaco. La estancia postoperatoria fue menor en el grupo sin estenosis del tronco celiaco, aunque no alcanzase significación estadística (tabla 4).
Mortalidad y complicaciones
| Estenosis del tronco celiaco | p | ||
| No | Sí | ||
| Pacientes | 45 | 13 | |
| Mortalidad | 1 (2) | 2 (15) | 0,123 |
| Complicaciones | 26 (58) | 10 (77) | 0,177 |
| Complicación grave | 8 (18) | 8 (62) | 0,004 |
| Fístula biliar | 3 (7) | 2 (15) | 0,311 |
| Fístula pancreática | 5 (11) | 5 (38) | 0,036 |
| Colangitis | 2 (4) | 0 | 0,599 |
| Infección de herida | 4 (9) | 0 | 0,351 |
| Absceso intraabdominal | 8 (18) | 2 (15) | 0,604 |
| Retraso en vaciamiento gástrico | 7 (16) | 1 (8) | 0,42 |
| Hemoperitoneo | 3 (7) | 4 (31) | 0,038 |
| Neumonía | 1 (2) | 1 (8) | 0,401 |
| Reoperación | 7 (16) | 7 (54) | 0,009 |
| Estancia postoperatoria (días) | 17±11 | 23±16 | 0,098 |
Los datos expresan n (%) o media±desviación estándar. Complicación grave: complicación > 3a según Dindo et al4.
También se revisaron retrospectivamente los estudios con TCDM realizados durante el postoperatorio en los 13 pacientes con estenosis significativa del tronco celiaco. En 7 pacientes no había signos de isquemia visceral ni hepática y sólo 2 presentaron complicaciones, consistentes en coleperitoneo y colección intraabdominal. Dos pacientes presentaban signos de isquemia hepática en la TCDM, ambos con complicaciones: hemoperitoneo postoperatorio precoz y hemoperitoneo tardío secundario a fístula pancreática grave en el último. Un paciente presentaba en la TCDM hemoperitoneo e infarto esplénico. Otro paciente presentaba signos de colitis isquémica y otro, neumoperitoneo secundario a perforación colónica. En un paciente con estenosis del tronco celiaco, que presentó fístula pancreática grave con hemoperitoneo tardío, no se pudo realizar la TCDM postoperatoria.
DiscusiónLa DPC se ha establecido como el mejor tratamiento para los tumores periampulares y otras enfermedades benignas que afecten primordialmente a la cabeza del páncreas9,10. La derivación precoz de estos pacientes a centros con una elevada casuística ha conseguido disminuir la mortalidad por debajo del 5%11–17. No obstante, las complicaciones postoperatorias, principalmente las derivadas de las fístulas pancreáticas, hemorragia o retraso de vaciamiento gástrico, son todavía frecuentes18,19.
Está bien descrito que la estenosis del tronco celiaco puede ser una fuente de isquemia visceral si se interrumpen estas vías de suplencia durante una cirugía exerética (p. ej., la duodenopancreatectomía)20–22. En la literatura también hay estudios que estiman la incidencia de estenosis del tronco celiaco tanto en población general3,23 como la sometida a DPC1,5, incluso describen casos aislados con las posibles soluciones quirúrgicas24. No obstante, otros autores opinan que raramente la estenosis del tronco celiaco conduce a problemas clínicos importantes tras una DPC3,5,20,25.
Por otra parte, en la bibliografía hay pocas series que intenten establecer cuál es el riesgo de complicaciones postoperatorias tras la DPC y su relación con la estenosis del tronco celiaco. La serie más numerosa es la del hospital Beaujon, que realizó sistemáticamente una evaluación multidisciplinaria de la existencia de estenosis del tronco celiaco antes de la cirugía pancreática en 545 pacientes5. La incidencia de estenosis del tronco celiaco en su serie es del 11%, pero en la mayoría de los casos se trataba de estenosis extrínsecas por compresión del tronco celiaco por el ligamento arcuato (fig. 1B). Este problema parece que es frecuente en la población oriental3, pero no es la causa más frecuente de estenosis del tronco celiaco en los pacientes añosos que van a someterse a una DPC26,27.
El hallazgo más importante de nuestro estudio es el significativo aumento de complicaciones quirúrgicas graves, fístula pancreática, hemorragia y reintervenciones en pacientes con estenosis significativa del tronco celiaco en la reconstrucción de la TCDM preoperatoria (tabla 4). Los estudios radiológicos postoperatorios también coincidieron con los hallazgos preoperatorios. Así pues, sólo 2 de los pacientes sin signos de isquemia visceral en la TCDM postoperatoria presentaron complicaciones graves, probablemente no secundarias a isquemia visceral. Por el contrario, todos los pacientes con signos de isquemia visceral o hepática en la TCDM postoperatoria presentaron complicaciones graves, entre ellas tres hemoperitoneos tardíos secundarios a fístula pancreática grave.
En general, se recomienda realizar la maniobra del pinzamiento de la AGD antes de seccionarla. Si desaparece el pulso en la AH, se recomienda abandonar la DPC o, en algún caso aislado, efectuar una revascularización de la AH24. En todos nuestros pacientes realizamos una prueba de pinzamiento de la AGD antes de ligarla, y en ningún caso se observó una desaparición completa del flujo en la AH o una disminución significativa del latido. No obstante, los pacientes con estenosis radiológica preoperatoria presentaron más complicaciones, que podrían atribuirse a secuelas de la isquemia visceral21,22,26,27. Probablemente, la maniobra del pinzamiento de la AGD no es suficiente para detectar estenosis incompletas del tronco celiaco, aunque sean hemodinámicamente significativas. Pero por otra parte, no todos los pacientes con estenosis radiológicamente significativa presentaron complicaciones atribuibles a isquemia visceral. Por lo tanto, son necesarios otros estudios hemodinámicos para confirmar el grado de isquemia5.
En todos nuestros pacientes, la causa más probable de la estenosis del tronco celiaco era arteriosclerosis (fig. 1C). En ningún caso con estenosis significativa se encontraron imágenes compatibles con compresión por el ligamento arcuato (fig. 1B). Esto es fácil de explicar, si tenemos en cuenta que la media de edad de nuestros pacientes era > 60 años y que la mayoría eran varones (tabla 1). Probablemente, el estudio con técnicas MIP del calibre del tronco celiaco y la AMS debería constar sistemáticamente en los informes de los estudios preoperatorios con TCDM en pacientes que van a ser sometidos a DPC. Si se detecta preoperatoriamente la estenosis del tronco celiaco y parece significativa y secundaria a arteriosclerosis, el mejor tratamiento es la colocación de un stent por radiología intervencionista.
ConclusionesLa estenosis radiológica significativa del tronco celiaco es un factor de riesgo de complicaciones graves tras DPC. La TCDM preoperatoria parece ser un método diagnóstico más sensible y más objetivo que la maniobra del pinzamiento de la AGD para detectar la estenosis del tronco celiaco. El estudio del calibre de la AMS con TCDM debería ser sistemático antes de una DPC. Debería valorarse preoperatoriamente la corrección de la estenosis hemodinámicamente significativa del tronco celiaco, porque el riesgo de complicaciones es más elevado.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.