Introducción
El comportamiento biológico y clínico de las metástasishepáticas procedentes del cáncer colorrectal (MHC) es menos pesimista que el delas procedentes de otros tumores sólidos, como el de mama o el del pulmón, decirculación sistémica. Es evidente que, en estos últimos, el hígado es unasiento más en su diseminación por todo el cuerpo; por el contrario, el colones el primer filtro que capta las células tumorales que le llegan por víaportal. Aunque la explicación resulta lógica y tentadora, sin embargo, escapa acierta evidencia científica, como lo explica el hecho de que pacientes contumores digestivos M0, también con circulación portal, y extirpados de formaradical (páncreas, estómago) tengan cifras de supervivencia a los 5 años menoresque las de pacientes con MHC resecadas con éxito. Aunque desconocidos, estáclaro que hay ciertos factores que relacionan el cáncer de colon con susmetástasis hepáticas, más allá del mero hecho anatómico de su relación venosaportal, que influyen de forma determinante en una evolución clínica natural másfavorable1.
Sean cuales fueran los factores causantes de estecomportamiento más "indolente" de las MHC, lo cierto es que hanposibilitado un enorme y creciente esfuerzo enfocado hacia su tratamiento curativoque, hoy día, es únicamente la resección quirúrgica. Así, en pacientescuidadosamente seleccionados con MHC subsidiarias de ser resecadas es posibleobtener supervivencias a los 5 años que oscilan, según las series, entre un 20y un 50%2.
El protagonismo de la cirugía en el tratamiento de las MHCes un capítulo cerrado a cualquier debate que ya no discute nadie; así lodemostraron Wilson y Adson3 en el año 1976, quienes, de formaatrevida y comprometida, subrayaron en una serie de pacientes con MHCresecables, no operados por diferentes motivos, una supervivencia media de 21meses para las metástasis únicas y de 15 meses para las metástasis múltiples,con supervivencia cero a los 5 años (en su propia serie de MHC resecadaspresentaron una supervivencia del 28% a los 5 años).
Junto a estas cifras moderadamente optimistas, portratarse, no lo olvidemos, de una enfermedad oncológica avanzada en estadio IV,hay otras realidades que aconsejan prudencia y cautela:
La resección de las MHC en el momento de su diagnósticoes sólo posible en un 20-30% de los casos.
El 70-80% de los pacientes que no son candidatos a lacirugía tiene un pronóstico muy sombrío a pesar de recibir protocolos dequimioterapia paliativa, cuyos índices de respuesta en la actualidad sonpróximos al 50%, con una supervivencia media de 9-12 meses. Este altoporcentaje de enfermos irresecables y su supervivencia < 1 año ha implicadoa diferentes grupos en el desarrollo de la cirugía de rescate tras laquimioterapia neoadyuvante con 5 fluorouracilo (5-FU), leucovorina yoxaliplatino (downstaging quimiotherapy).
A pesar de los esfuerzos encaminados hacia una mejorselección preoperatoria de los pacientes con MHC, hacia las innovacionestecnológicas en el instrumental quirúrgico empleado, hacia la consagración delas unidades quirúrgicas especialmente adiestradas en este tipo de cirugía y aladvenimiento de nuevas quimioterapias adyuvantes administradas de formaregional mediante bombas de infusión en la arteria hepática o de forma sistémica,la supervivencia media a los 5 años no ha registrado grandes variaciones y sesitúa en torno al 30%.
Finalmente, más del 50% de los pacientes con MHCresecadas morirá a causa de una recidiva de la enfermedad que, además, conrelativa frecuencia tendrá lugar en el propio hígado remanente.
Por ello, aunque las bases del tratamiento de las MHC estánbien establecidas, es preciso revisar sus puntos débiles para superarlos yaumentar en la medida de lo posible el rendimiento curativo de los tratamientosaplicados. Este empeño de superación impulsó en la primera mitad de la décadade los años noventa el principio de la aplicación de la medicina basada en lamejor evidencia clínica. Fieles a este compromiso, el motivo de esta revisiónes establecer el grado de evidencia clínica que hay en la bibliografíaespecializada en el tratamiento quirúrgico, como medida única o complementaria,en el manejo de las MHC. En suma, pretendemos contribuir al ejercicio de lapráctica quirúrgica al servicio de la medicina basada en la evidencia ycontestar a la pregunta que sirve de título al trabajo: metástasis hepáticas deorigen colorrectal: ¿es posible la cirugía basada en la mejor evidenciaclínica?
Resección quirúrgica de las metátasiscolorrectales
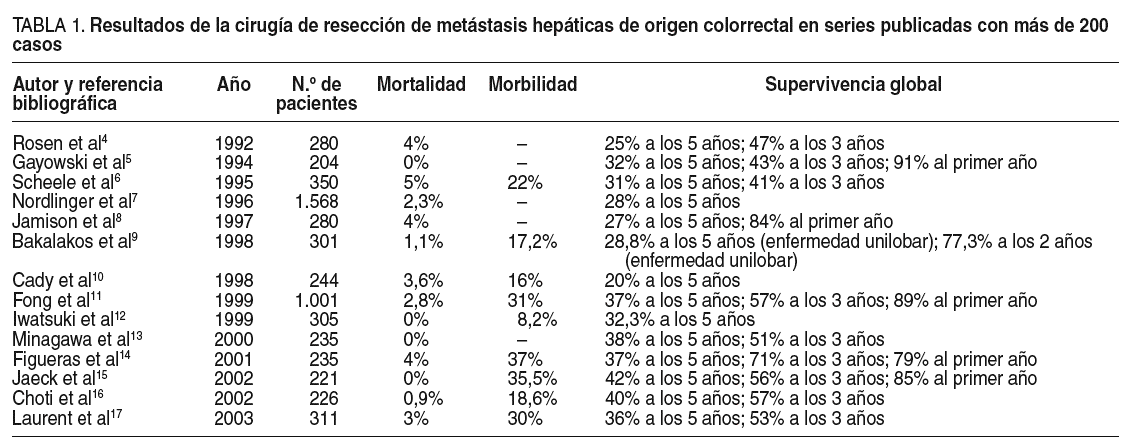
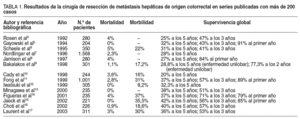
La bibliografía especializada en los últimos 20 añoscoincide en presentar la cirugía exerética de las MHC como la opción conmayores cifras de supervivencia a los 5 y 10 años. Además, desde unaperspectiva de superespecialización dentro de nuestra profesión quirúrgica, queexige unidades de especial dedicación a esta cirugía, se consiguen estosresultados con cifras de mortalidad y morbilidad muy bajas4-17(tabla 1). Por desgracia, un porcentaje muy pequeño de pacientes con MHC(10-30%) es candidato a la cirugía en el momento del diagnóstico18.Las razones son, en primer lugar, una imposibilidad técnica para llevar a cabouna cirugía solvente con garantías de éxito proximidad de la MHC a estructurasbiliares o vasculares que imposibilitan unos adecuados márgenes de resección,implantes múltiples en el hígado, y en segundo lugar, una imposibilidadfuncional debido a un volumen hepático residual estimado después de la cirugíaincapaz de acometer las funciones vitales propias del hígado.
Sin embargo, la evidencia clínica de las series consultadasestá supeditada a los resultados analizados de manera retrospectiva, algo que,como no podía ser de otra manera, ocurre en muchos otros capítulos dentro de lacirugía oncológica. Por tanto, el verdadero beneficio de la cirugía, el que seconcluye a partir de estudios controlados diseñados de forma prospectiva yaleatorizada, es imposible de conocer, ya que la ética más elemental de unaunidad de cirugía hepática, dedicada a la investigación clínica por su altovolumen de enfermos, no permitiría un estudio comparativo de pacientes con MHCresecables y características epidemiológico-patológicas similares, donde cadauno fuera asignado de forma aleatoria a uno de estos 2 grupos distintos: a) grupo de tratamiento quirúrgico, y b) grupo de tratamiento no quirúrgico. Con todo ello, sin embargo, laevidencia de la cirugía, como mejor alternativa en el tratamiento, se presume apartir de los datos de supervivencia tan bajos publicados en otras series depacientes no operados con MHC potencialmente resecables3.
Factores pronósticos en la cirugía de las MHC (tabla 2)
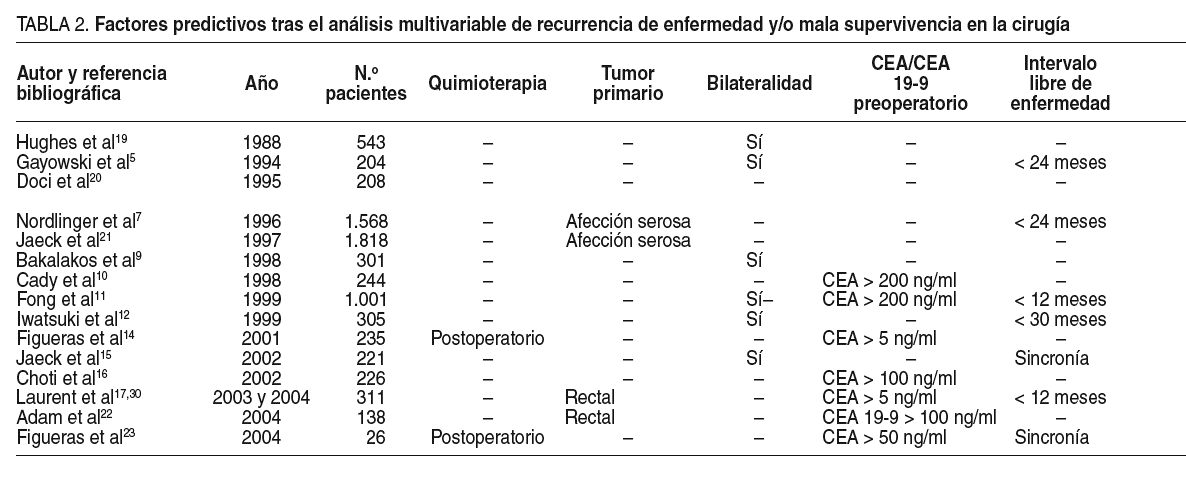
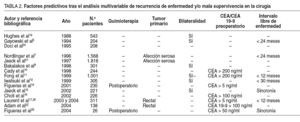
La ausencia de evidencia clínica de grado I ha impulsado,dentro de la investigación clínica retrospectiva, un fuerte deseo poridentificar, en el grupo reducido de pacientes con MHC resecadas, aquellosfactores asociados con un índice mayor de recurrencia y, por tanto, con unpronóstico más severo.
El listado de todos los factores se expone en la tabla 2.Entre ellos encontramos los siguientes:
1. Tamaño de la MHC (de lamayor si son varias).
2. Número de MHC.
3. Cifras preoperatorias deantígeno carcinoembrionario (CEA).
4. Bilateralidad de lostumores.
5. La estadificación TNM deltumor primario colorrectal.
6. Intervalo transcurridodesde el diagnóstico del carcinoma colorrectal hasta el hallazgo de las MHC.
7. La presencia deenfermedad extrahepática.
8. El año en el que elenfermo fue operado.
9. El empleo dequimioterapia adyuvante.
10. La localización rectaldel tumor primario.
11. La morbilidad asociadacon la cirugía hepática.
12. La edad del paciente.
13. Los márgenes deresección.
Antes de desarrollarlos es preciso puntualizar que hemosrecogido las series que superan la cifra de 200 pacientes, salvo 222,23que hacen referencia a pacientes con metástasis inicialmente inoperables quehan sido rescatados tras quimioterapia neoadyuvante, y a enfermos con MHCrecidivadas tras una primera resección.
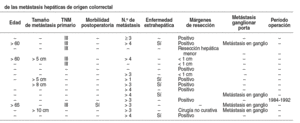
Así, relacionados con la carga tumoral se enumeran lossiguientes: tamaño de la metástasis: > 5 cm7,11,> 8 cm12o > 10 cm22; número de metástasis > 111,>= 310,12,16,17,19,22o > 45,7,14,15,23; cifras preoperatorias de CEA: > 5 ng/ml14,17,> 5023, >10016 o > 20010,11, ybilateralidad de los tumores5,9,10,11,12,15.
La importancia de la variable "número demetástasis" adquiere todavía mayor protagonismo en algunas series que, alconsiderarla como variable independiente sobre la que centrar su estudio desupervivencia a los 5 años de la intervención quirúrgica, encontraronsignificación estadística. Así, Hughes et al19 obtuvieron unasupervivencia de 18% en los pacientes con 3 o más metástasis resecadas frente aun 37% en los pacientes con una única metástasis; Gayowski et al5encontraron una supervivencia de 19% en los pacientes con 4 o más metástasisresecadas frente a un 45% en los pacientes con una única metástasis y,finalmente, Fong et al11 hallaron una supervivencia de 24% en lospacientes con más de 4 metástasis resecadas frente a un 47% en los pacientescon una única metástasis.
La estadificación TNM en el tumor primario colorrectal y elintervalo transcurrido desde el diagnóstico del carcinoma colorrectal hasta elhallazgo de las MHC, ambos factores relacionados con las característicaspropias del tumor primario, son también variables analizadas.
Hughes et al19 acreditaron una supervivencia alos 5 años del 47% en pacientes con MHC resecadas cuando el tumor colorrectalprimario estaba en estadio II, y del 23% cuando estaba en estadio III. En lospacientes registrados por Fegiz et al24, la supervivencia a los 5años de la exéresis de las MHC fue del 32% en estadio II, y del 11% en estadioIII. Gayowski et al5 y Fong et al11 obtuvieron resultadossimilares: un 53 y un 43% para los tumores en estadio II, y un 28 y un 35% paralos tumores en estadio III.
En relación con el tiempo transcurrido como factor de malpronóstico, las series que lo incluyen entre una de sus variables designificación estadística oscilan entre un tiempo < 30 meses12,< 24 meses5,7, < 12 meses11,17 o incluso 0 meses,es decir, sincronía en el diagnóstico del tumor colorrectal primario y la MHC15,23.
La presencia de enfermedad extrahepática resecada en elmismo acto quirúrgico es una variable incluida en todas las series consultadassobre la cual no hay consenso. Dos de las más citadas, la de Fong et al11,del Hospital Memorial Sloan Kettering Cancer Center de Nueva York (es la seriehasta el momento que incluye mayor número de pacientes de una únicainstitución, 1.001 pacientes), y la de Iwatsuki et al12, del ThomasE. Starlz Transplantation Institute de la Universidad de Pittsburgh, laconsideran como una contraindicación relativa a la cirugía sobre la MHC porasociar un porcentaje de supervivencia a los 5 años del 18 y del 0%,respectivamente. Sin embargo, en muchas otras series5,7,10,14,16,tras el análisis multivariable de las variables consideradas a estudio comofactores de recurrencia, la enfermedad extrahepática no consta entre ellas. Eneste sentido, es oportuno citar a Figueras et al14, quienes, a pesarde haber registrado en este subgrupo de pacientes supervivencias a los 5 añosdel 0% debido a la ausencia de cualquier otro tratamiento efectivo que no seael quirúrgico y a la ausencia de datos procedentes de trabajos prospectivoscontrolados, acometen la resección de las MHC junto con la de la enfermedadextrahepática.
Gran parte de las series consultadas, al presentar laenfermedad extrahepática como variable independiente de recurrencia, no serefieren a ella de forma singularizada. Es decir, en el cálculo de lasupervivencia actuarial según el método de Kaplan-Meier no se registra si lasdistintas localizaciones extrahepáticas (metástasis pulmonares, infiltracióndel diafragma, nódulos peritoneales, recidiva locorregional del tumor primario,infiltración ganglionar del hilio hepático, etc.) comportan diferentessupervivencias; por el contrario, los pacientes para el estudio univariable omultivariable, si procede, son agrupados en "enfermedad extrahepática:sí", "enfermedad extrahepática: no". Es lógico suponer que todoello obedece a las obligaciones metodológicas que impone la estadística, aunquela ausencia de datos en este sentido motivó que Rodgers et al25, enuna revisión publicada en el año 2000, se interesaran por la importancia quelas distintas series centradas en la cirugía de las MHC daban a la afecciónganglionar del hilio hepático como variable independiente de recurrencia y, portanto, de pronóstico. De 185 estudios publicados en inglés, extraídos a partirde una búsqueda electrónica en diferentes bases de datos médicas (Medline,Embase, Cancerlit) entre los años 1964-1999, sólo 5 recogían de formaindependiente la supervivencia de los pacientes con ganglios hiliares positivostras una linfadenectomía reglada del hilio hepático asociada con la cirugíahepática. En total 83 pacientes, de los cuales sólo 4 (4,81%) sobrevivían a los5 años de la cirugía.
Jaeck et al15, en un estudio prospectivo nocontrolado publicado con posterioridad al año 1999, no encontraron mayorescifras de morbilidad o de estancia postoperatoria en el grupo de pacientes conlinfadenectomía sistemática asociada con la exéresis hepática, aun cuando estalinfadenectomía incluía los grupos ganglionares del ligamento hepatoduodenal yde la porción retropancreática (grupo I) y los grupos ganglionares de laarteria hepática y del tronco celíaco (grupo II). En el análisis multivariableencontraron que el riesgo de recidiva de las MHC resecadas era 15,1 veces mayorcuando los ganglios del hilio hepático estaban afectados. Además, observaronque la supervivencia a los 3 años del conjunto de pacientes con afecciónganglionar era del 38% si los ganglios pertenecían al grupo I, y del 0% si losganglios pertenecían al grupo II. Peor aún, ninguno de los pacientes con gangliospositivos del grupo II sobrevivió al año de la cirugía.
A la vista de estos resultados es imposible saber si lalinfadenectomía sistemática conllevará una mayor supervivencia para nuestrospacientes. En efecto, la respuesta sólo la encontraremos en el contexto de unestudio prospectivo controlado que compare ambas estrategias quirúrgicas (con osin linfadenectomía). Ahora bien, a la espera de más estudios que lo desmientanse puede aventurar que, salvo que haya afección ganglionar macroscópica del grupoII, cuya malignidad sea confirmada mediante un estudio anatomopatológicointraoperatorio, la presencia de adenopatías ganglionares en el ligamentohepatoduodenal no debería ser un motivo para desaconsejar la cirugía deresección de las MHC. Más aún, la linfadenectomía sistemática debería llevarsea cabo en todos los pacientes durante la hepatectomía por MHC para identificara los pacientes de alto riesgo y determinar en ellos cuál puede ser laquimioterapia adyuvante más apropiada17.
La serie de Choti et al16, con un total de 226pacientes con MHC a los que se realizaron resecciones hepáticas mayores conintenciones curativas, advierte otra variable determinante en la recurrencia noreconocida en ninguna otra serie: el año en el que el paciente fue operado.Efectivamente, el estudio advierte que los pacientes operados en la franja deaños comprendida entre 1984 y 1992 presentaron un riesgo de recidiva 2,13 vecesmayor frente a los operados entre los años 1993 y 1999. Nadie duda de lanecesidad de equipos quirúrgicos adiestrados para emprender reseccioneshepáticas mayores26, aunque la diferencia encontrada por estosautores no puede imputarse a una variación en el equipo humano responsable detodas las cirugías durante los 15 años de recogida de datos que, en esencia,fue el mismo. Al efectuar un estudio bivariable entre ambos grupos advirtierondiferencias en 2 aspectos: el empleo de la ecografía intraoperatoria (EIO) y laaplicación adyuvante de la quimioterapia fue mayor en el grupo de enfermosoperados en la franja de 1993-1999 (EIO: 38% en el primer grupo, 79% en elsegundo; quimoterapia adyuvante: datos no expuestos en el artículo).
La EIO ha permitido mejorar la selección de los pacientes,ya que permite identificar metástasis que no habían sido advertidas por lastécnicas de imagen preoperatorias (MHC < 2 cm) o identificar márgenes deresección no adecuados; en esencia, modificar el manejo de los pacientes dentrodel quirófano hasta en un 44% de los casos27. Por ello, espresumible que en del primer grupo cronológico de la serie de Choti et al16,con cirugía aparentemente curativa sobre las MHC pero sin EIO, algunos enfermosfueran catalogados de forma errónea como R0. Por ser un estudio retrospectivoes imposible comprobar hasta qué punto la EIO afectó a la supervivencia de unoy otro grupo. Por otra parte, por ser ésta una técnica barata, inocua y que nocomporta mucho tiempo de quirófano, aproximadamente 20 min, consideramos quediseñar un estudio prospectivo controlado para averiguar su verdadero papel enla supervivencia de estos pacientes no tendría ningún sentido.
La quimoterapia adyuvante como elemento determinante en lasupervivencia del paciente con MHC resecadas, valorada por Choti et al demanera indirecta por no tratarse de una variable independiente entre losfactores pronósticos de recidiva sino elemento diferenciador entre los 2 gruposcronológicos anteriormente referidos, es sin embargo protagonista en la seriede Figueras et al28. Estos autores la incluyen como una de las 4variables identificadas de forma independiente como factor predictivo derecurrencia (tabla 2). En su serie publicada de 256 resecciones hepáticas porMHC en 235 pacientes, 99 recibieron quimioterapia sistémica adyuvante en unrégimen basado en 5-FU y ácido folínico. La supervivencia actuarial a los 5años de todos los pacientes fue del 36%, incrementada hasta un 53% en elsubgrupo de pacientes receptores de quimioterapia. El riesgo relativo ajustadoen este último grupo de pacientes fue 0,3; dicho en otros términos, de lospacientes fallecidos a los 5 años desde la cirugía, 3 habían recibidoquimioterapia y 7 no la habían recibido. Los 2 grupos de pacientes fueronsimilares, excepto que los que habían recibido la quimioterapia adyuvante eranmás jóvenes, una mayor proporción no había recibido quimioterapia preoperatoriay había más casos de metástasis sincrónicas al tumor primario. Ninguno de estos3 elementos diferenciadores (edad, tiempo de aparición de las MHC desde eltumor primario y quimioterapia preoperatoria) fue un factor pronóstico en elanálisis multivariable por lo que, finalmente, concluyeron cierta evidencia delfactor protector de la quimoterapia adyuvante, que debería ser contrastada conestudios prospectivos aleatorizados.
Adam et al29, del hospital Paul Brousse deParís, aportan un nuevo factor independiente predictivo de peor supervivencia:la localización rectal del tumor primario. En este estudio, la serie inicial depacientes fue diferente, ya que consistía en un grupo que en un principio fueconsiderado portador de MHC irresecables, que finalmente pudieron serextirpadas tras una quimioterapia de rescate realizada con éxito (downstagingquimiotherapy) consistente en 5-FU y leucovorinaasociada con oxaliplatino (70%), irinotecán (7%) o ambos (4%). El grupo depacientes incluido en este estudio es, según nuestra opinión, el responsable dela aparición de esta nueva variable. En efecto, la disección oncológicamediante la extirpación de todo el mesorrecto es una técnica laboriosa querequiere meticulosidad y paciencia. No es aventurado considerar que, en muchosde estos pacientes, en el momento de la cirugía del tumor primario había ya MHCconsideradas irresecables y que, por ello, la técnica quirúrgica se limitó a laexéresis del tumor sin atender a los principios de radicalidad que la cirugíaoncológica demanda para obtener un adecuado control macroscópico de laenfermedad.
La serie de Laurent et al30, en la que seincluye a 311 pacientes operados de MHC entre los años 1985 y 2000, es únicaporque incluye entre sus factores la morbilidad asociada con la cirugíahepática. La fístula biliar (17% de los pacientes), el absceso subfrénico (17%de los pacientes) y el derrame pleural (15%) fueron las complicaciones másfrecuentes y se asociaron con un riesgo relativo ajustado de 1,79, suficientepara comportar significación estadística. Comoquiera que las 3 complicacionescitadas tienen en común el desarrollo de una sepsis, la asociación deinmunodepresión facilitaría la proliferación de micrometástasis y, finalmente,conllevaría una peor supervivencia.
La edad del paciente en el momento de recibir la resecciónde las MHC, como factor independiente de mal pronóstico, sólo se recoge en 3series5,7,17. Una cuidadosa selección de los pacientes operados,incluso de pacientes mayores, y una técnica quirúrgica esmerada capaz deminimizar los riesgos quirúrgicos serán posiblemente las razones por las que laedad avanzada no comporte peores supervivencias.
La importancia de los márgenes de resección queda reflejadaal contemplar que es el factor más veces incluido entre las series estudiadas,en todas menos en 2. Su importancia es mayor, quizá, si tenemos en cuenta quees el único factor sobre el cual el cirujano ejerce un control definitivo. Porello, entendemos que el estudio anatomopatológico de los márgenes debe hacerseinmediatamente después de la exéresis quirúrgica. Así, si se comprobara lainfiltración en cualquiera de los márgenes la resección siempre puedeampliarse.
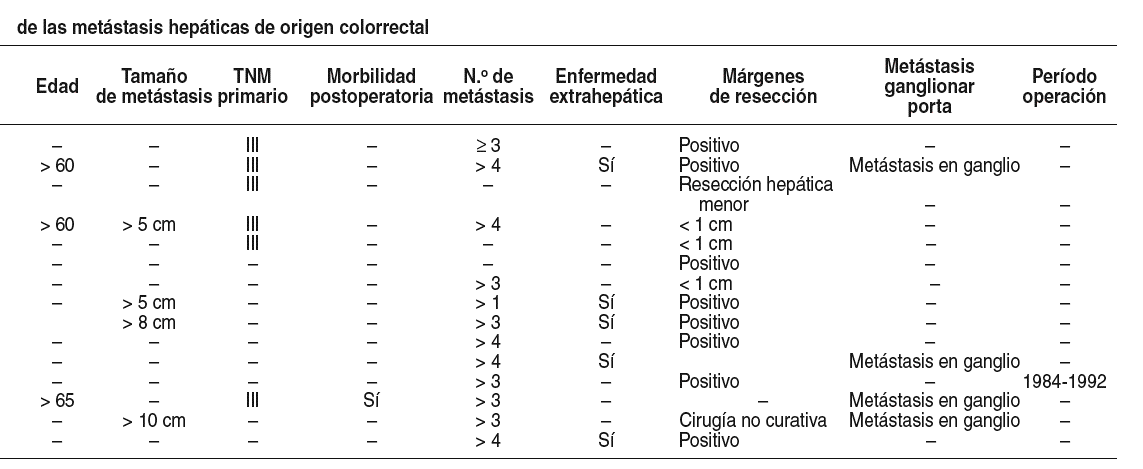
La identificación de pacientes con MHC resecadas con mayorriesgo de recidiva es una meta necesaria para medir la eficacia de los nuevosagentes oxaliplatino, irinotecán como quimioterapia adyuvante. Han surgidoasí diferentes escalas clínicas de puntuación con marcado significadopronóstico, en las que una mayor puntuación se asocia con una peorsupervivencia (asignando a cada factor de mal pronóstico un punto). Así,Gayowski et al5 basan la suya en el tamaño de las metástasis > 2cm, el número de lesiones > 1 y la presencia de lesiones en ambos lóbulos;Cady y Stone31 basan la suya en el número de metástasis > 3, losvalores de CEA preoperatorio >200 ng/ml y los márgenes de resección < 1cm; Nordlinger et al7 basan la suya en una edad > 60 años,ganglios presentes en el tumor primario, invasión de la serosa en el tumorprimario, número de metástasis > 4, intervalo libre de enfermedad entre eltumor primario y la MHC < 2 años, tamaño de la metástasis más grande > 5cm y márgenes de resección < 1 cm; Fong et al11 basan la suya enganglios presentes en el tumor primario, valores de CEA preoperatorio > 200ng/ml, número de tumores > 1, tamaño del tumor mayor > 5 cm e intervalolibre de enfermedad entre el tumor primario y la MHC < 12 meses; yfinalmente, Iwatsuki et al12 basan la suya en márgenes positivos,enfermedad extrahepática, número de tumores > 2, tamaño de las metástasismás grande > 8 cm, intervalo libre de enfermedad entre el tumor primario yla MHC < 30 meses y presencia de tumor en los 2 lóbulos.
El análisis de las 5 escalas de puntuación pone demanifiesto la falta de unidad de criterios en la inclusión de variables y enlas cifras absolutas dentro de las variables, lo que dificulta su objetivofinal: seleccionar a los pacientes que pueden beneficiarse de una quimioterapiaadyuvante. Se podría creer que estas diferencias no son muy amplias; sinembargo sí son suficientemente significativas, como lo demuestra el hecho deque un mismo paciente sometido al rigor matemático de diferentes escalasquedaría encasillado en distintos grupo de riesgo12. Solamenteaquella escala de las enumeradas cuyos valores sean contrastados con otrospacientes, procedentes de instituciones sanitarias distintas (como así ocurriócon la escala pronóstica para el cáncer gástrico de Maruyama et al), será laque adquiera mayor valor. Por desgracia, en el momento actual no hay constanciade que esto haya ocurrido.
Técnicas alternativas que mejoran elíndice de resecabilidad
En los últimos 15 años se han desarrollado diferentestécnicas de ablación como alternativa a las limitaciones funcionales y técnicasde la cirugía convencional. Su verdadera aplicación, empleadas de maneraaislada o junto con la cirugía, es el control local de la enfermedad cuando lacirugía no puede hacerlo, sobre todo en los pacientes cuyo único foco deenfermedad es el hígado.
Ablación con criocirugía (ACC). Esta técnica consiste en la congelación y descongelación de lostumores hepáticos por medio de una sonda introducida en el seno del tumor queemana nitrógeno líquido. Los ciclos de congelación/descongelación,teóricamente, acaban destruyendo la célula tumoral. Requiere casi siempre unabordaje laparotómico y solamente las lesiones periféricas son subsidiarias deeste tratamiento, ya que las centrales, situadas junto a grandes vasos, son másdifíciles de controlar por ser éstos fuentes de calor. Sin embargo, con todoello se pueden destruir tumores hasta de 6 cm.
La indicación más generalizada de la ACC en pacientesportadores de MHC es la ablación paliativa de nódulos considerados irresecablespor cirugía convencional. Algunas de las series publicadas han alcanzado cifrasde supervivencia a los 2 años próximas al 60%32,33, aunque lainterpretación de los datos es compleja por tratarse de series con un escasonúmero de pacientes y con criterios de inclusión muy heterogéneos en cuanto anúmero de nódulos, tamaño de los nódulos, naturaleza de los nódulos (MHC ohepatocarcinoma) y administración de quimioterapia adyuvante.
Hasta el momento, hay un trabajo prospectivo aleatorizadopublicado en el año 199734 en el que se comparan los resultadosentre un grupo de pacientes con criocirugía y un grupo de pacientes con cirugíaconvencional, ambos de características demográfico-histopatológicas similares,durante un período de seguimiento de 10 años. Los resultados de supervivencia yde intervalo libre de enfermedad fueron superiores en el grupo de lacriocirugía. Desde nuestro punto de vista, los resultados no deben ser tenidosen cuenta, ya que solamente un 20% de los enfermos del grupo de la criocirugíarecibió una ablación propiamente dicha, es decir, mediante la introducción deuna sonda en el seno del tumor. En el 80% restante se realizó una resección, demayor o menor envergadura, con instrumental quirúrgico similar al convencional,aunque mediante la incorporación de "criodispositivos" queseccionaban el parénquima hepático por medio de las bajas temperaturas queemanaban.
Gallinger35 está dirigiendo otro estudioprospectivo no aleatorizado de casos-control cuyo seguimiento final no haterminado todavía, aunque sí la inclusión de pacientes, con objeto de compararlos resultados de la ACC con los de la cirugía convencional. Los grupos fueronsimilares en cuanto a las características demográfico-histopatológicas, salvo enel número de las MHC, que fue superior en el de la ACC (3 ± 1 frente a 2 ± 1).Hasta el momento, los resultados en la supervivencia están siendo claramentefavorables al grupo de la cirugía convencional (a los 3 años, un 80% desupervivencia en el grupo resección frente a un 40% en el grupo ACC). Debido alas características del estudio, en el que el criterio de elección en uno uotro grupo no se debió al azar sino al resultado de una selección cuidadosa delos casos, no se puede inferir con certeza que para el tratamiento de las MHCla ACC sea peor que la cirugía convencional. Sin embargo, muestra una vez máslas dificultades metodológicas, por razones de ética, con las que la comunidadcientífica se topa para diseñar un estudio prospectivo aleatorizado, sobre todocuando la evidencia apunta hacia la cirugía como el tratamiento más oportuno sies factible obtener márgenes de seguridad.
Como complemento de la cirugía, ha sido empleada paradestruir restos tumorales cuando los márgenes de resección no estaban claros.En un estudio reciente de Australia36, la ACC fue empleada con estefin en 48 pacientes con márgenes de resección positivos en la biopsiaintraoperatoria. La recurrencia del tumor en los bordes de resección sepresentó en 7 pacientes (14%). Por el contrario, la recurrencia en los bordesde resección de pacientes cuyo margen fue positivo en el estudio patológicodefinitivo, y no en el intraoperatorio, fue mayor, de un 48%.
La ACC ha sido empleada también para el control local de laenfermedad cuando el número total de metástasis normalmente > 4 no permitaacometer una cirugía de resección. Sin embargo, el papel de la ACC en lasupervivencia final de estos pacientes es difícil de suponer. Valgan comoejemplo 2 trabajos36,37 en cuyas conclusiones advirtieron que lospacientes con ACC y cirugía simultáneas para el control de las MHC múltiplestenían una supervivencia similar a la de los que habían recibido tratamientoquirúrgico único con márgenes adecuados. A pesar de este inicial optimismo conla ACC complementaria de la cirugía, imputarla únicamente el éxito de susresultados podría resultar aventurado por 2 motivos37: a) una mayoría de los pacientes incluidos en el estudio recibiótambién quimioterapia adyuvante (no se especifican los medicamentos ni laduración de los ciclos), y b) más de las dosterceras partes de los pacientes presentaron recurrencia de su enfermedad a los26 meses de seguimiento medio, por lo que hubo una falta de armonía entre lascurvas de supervivencia y las de intervalo libre de enfermedad.
Ablación de los tumores hepáticos por radiofrecuencia(ARF). Esta técnica ofrece, frente a la anterior,la posibilidad de ubicar la sonda sin abordaje quirúrgico, emplazándola en elseno del tumor mediante técnicas radiológicas. La emisión de radiofrecuenciadesde la sonda genera temperaturas altísimas en el núcleo tumoral obteniendouna necrosis coagulativa de éste. Su enorme potencial inicial es, por un lado,la posibilidad de aplicación por control radiológico, lo que evita la laparotomía,y por el otro, su menor complejidad de aplicación y sus menores costes que lacrioterapia. Sin embargo, las lesiones no deben ser > 2 cm38. Laintroducción en el mercado de diversos dispositivos de aplicación, cada vezmejor diseñados, es posible que permita realizar ablaciones de lesionesmayores, pero por el momento hay que esperar el resultado de los grupos detrabajo que los están manipulando.
La aplicación de radiofrecuencia sin laparotomía permite suempleo complementario previo a la cirugía con el objeto de disminuir el tamañode las metástasis y posibilitar la intervención en pacientes inicialmenteconsiderados irresecables39. Sin embargo, con esta utilidad losdatos son todavía muy escasos y es imposible extraer ninguna conclusión firme.
Su empleo asociada con la cirugía de forma similar a locomentado con anterioridad en relación con la ACC, control local de MHCmúltiples que no pueden ser todas resecadas por cirugía, es poco alentador.Abdalla et al40, en 158 pacientes en los que la cirugía no pudocontrolar toda la enfermedad hepática en el momento de la laparotomía,recurrieron a la ARF como medida única en 57 pacientes, o como medidacomplementaria a la cirugía en 101. La recurrencia hepática de la enfermedad enambos grupos con ARF fue superior, y fue 4 veces mayor en el grupo de la ARFaislada frente al de la cirugía aislada (el 44 frente al 11%). Lasupervivencia, como cabía esperar, también fue menor cuando se empleó la ARF(supervivencia a los 4 años después de la cirugía del 65%, después de la ARFmás cirugía del 36%, después de la ARF del 22%). Ahora bien, como terapiaúnica, en estudios prospectivos no controlados41,42 en los que se haincluido a pacientes no candidatos a la cirugía exerética se han obtenidomejores supervivencias frente a la quimioterapia convencional paliativa, dehasta de un 30% a los 5 años.
Embolización por vía percutánea de la vena porta. El porcentaje de parénquima hepático necesario para sobrevivir trasuna resección por MHC debe rondar cifras próximas al 25%, alcanzando el 40% siel paciente va a recibir altas dosis de quimioterapia o si tiene algunaenfermedad hepática de base43,44. Mediante tomografía computarizadaespiral es posible estimar la extensión de la resección hepática de manerapreoperatoria y seleccionar a los pacientes que presentan mayor riesgo deinsuficiencia hepática postoperatoria45. La embolización por víapercutánea de la vena porta que nutre al hígado, izquierdo o derecho, portadorde las MHC, es capaz de inducir una hipertrofia compensadora en el lóbulocontralateral. De esta forma es posible rescatar a un 60% de estos pacientes,antaño considerados irresecables por motivos funcionales, y operarlos 3-9semanas más tarde con cifras de morbilidad, mortalidad y supervivenciaactuarial a los 5 años similares a las de las series de la tabla 146.
En el supuesto de que también haya MHC en el lóbulocontralateral al embolizado, la hipertrofia compensadora puede inducir sucrecimiento e imposibilitar cualquier acción quirúrgica. Azoulay et al46se encontraron con esta limitación en el 28,5% de sus pacientes. Másrecientemente, Fusai y Davidson47 subrayan la utilidad de laquimioterapia postembolización en este grupo especial de pacientes.Efectivamente, cuando se les administraba quimioterapia tras la embolizaciónobtuvieron un descenso medio de 20 ml en las MHC contralaterales, sin perjuiciode la hipertrofia compensadora del parénquima que las albergaba; por elcontrario, sin la administración de la quimioterapia, el volumen medio de lasMHC se incrementó en 84 ml.
Rerresección de las MHC. Sila resección quirúrgica de las MHC es la única alternativa de cura, larerresección de las MHC en aquellos pacientes ya operados cuya enfermedadrecidive en el propio hígado también lo será. Los criterios de inclusiónoperatoria deberían ser los mismos que si se tratara de la operación practicadaen un primer tiempo. El remanente hepático de estos pacientes es friable por laquimioterapia posterior a la primera cirugía y por la propia regeneraciónhepática. Sin embargo, con una técnica adecuada, la morbimortalidadperoperatoria y la supervivencia a los 5 años son similares a las de la cirugíarealizada en un primer tiempo. Como cabía esperar, en 2 estudios retrospectivosen los que se incluyó a pacientes con rerresección hepática por recurrencia delas MHC48,49, los factores pronósticos de una nueva recurrenciafueron similares a los que motivaron la primera, ampliamente expuestos conanterioridad.
Otra modalidad de rerresección hepática es la que interesaa un paciente con MHC en el que, por su condición de bilateralidad extensa,cualquier operación en un tiempo estaría contraindicada por la imposibilidad deobtener un remanente hepático de suficiente volumen. En este supuesto espreciso resecar el hígado del lado que asiente las MHC de menor tamaño, paraque la resección sea menor y, en consecuencia, la regeneración del remanentehepático y el crecimiento de las MHC que alberga también sea inferior. Labilateralidad debe ser tan extensa que la embolización de la vena porta,anteriormente citada también en casos de bilateralidad, sea inútil. Hasta elmomento hay 1 solo estudio en el que se incluye a pacientes con estas premisas.Adam et al50, de un total de 398 pacientes con enfermedadirresecable por bilateralidad, pudieron llevar a cabo una resección en dostiempos en 13 pacientes. La supervivencia media de estos pacientes fue de 31meses, pero con una alta mortalidad postoperatoria, del 15%. Otros estudios hanrecogido mortalidades similares entre la primera y segunda hepatectomía, cuandoésta fue debida a recurrencia, por lo que la alta mortalidad de Adam et al50no debe ser imputada a cuestiones técnicas de la cirugía, sino a la terapiamultidisciplinaria tan agresiva (quimioterapia, embolización de la vena porta ycrioterapia) que este grupo reducido de pacientes recibió entre la primera ysegunda cirugía.
Estudios prospectivos aleatorizados en lacirugía de las MHC
Los estudios de estas características se centran en laquimioterapia adyuvante a la cirugía curativa con márgenes de seguridad, con elfin de validarla o rechazarla. Las preguntas que se plantean en esencia son:cuál es la vía de administración idónea: intrarterial o sistémica, y cuáles sonlos medicamentos adecuados.
La arteria hepática es el aporte vascular fundamental delas MHC y, por ello, cualquier terapia dirigida a la metástasis por esta víatendría máximo efecto sobre ella y mínimas consecuencias sistémicas. Sinembargo, en 3 estudios prospectivos aleatorizados de reciente publicación no seha podido demostrar un claro beneficio sobre la supervivencia de laquimioterapia adyuvante intrarterial hepática (IAH), presentando, además,complicaciones de cierta entidad: toxicidad biliar y problemas técnicosrelacionados con la colocación y el funcionamiento de las bombas de infusión.
El primero, multicéntrico y realizado en Alemania en 226pacientes51, no demostró mayor supervivencia en el grupo depacientes operados que recibió quimioterapia con 5-FU y leucovorina por víaintraarterial, sin otra quimioterapia sistémica, frente al grupo de pacientesoperado sin tratamiento adyuvante. El segundo52, llevado a cabo enel Memorial Sloan-Kettering Center en 156 pacientes, objetivó una mejorrespuesta (menor recidiva de la enfermedad hepática y mayor supervivencia) enel grupo que recibió quimioterapia sistémica con 5-FU y ácido folínico asociadacon floxuridina (FUDR) administrada IAH, frente al grupo que recibió de formasistémica 5-FU y ácido polínico, aunque sólo a los 2 años de la operación. Enel tercero53, conducido por el Eastern Cooperative Oncology Group,se incluyó a 109 pacientes con un máximo de 3 metástasis operadas con márgenesde seguridad que fueron aleatorizados a no recibir tratamiento adyuvante o arecibir una quimioterapia sistémica e IAH similar a la del anterior estudio.Los resultados a los 3 años demostraron en el grupo de tratamiento un menoríndice de recurrencia, aunque sin repercusión en la supervivencia global.
El papel de la quimioterapia sistémica adyuvante con 5-FU yleucovorina ha sido publicado en 2 estudios54,55. Aunque hubo ciertoincremento en la supervivencia del grupo que recibió la quimioterapia, éste noresultó significativo.
No obstante, a pesar de esta falta de respuesta a laadyuvancia intraarterial y sistémica, es preciso mantener la prudencia alrespecto, sobre todo en un contexto como el actual, en el que nuevos fármacos(oxaliplatino e irinotecán) han demostrado mejores respuestas en laquimioterapia paliativa. Es preciso que oncólogos y cirujanos aunemos esfuerzosen el diseño de estudios que contemplen estos 2 fármacos en un régimen deadyuvancia.
Algoritmo de actuación en el Departamentode Cirugía de la Universidad de California San Francisco (UCSF)
La ilusión por encontrar a los pacientes que respondenmejor a la cirugía de las MHC es una constante de este departamento.Actualmente, Warren et al56 investigan el papel que desempeña laexpresión del factor de crecimiento intravascular (FCI) en la progresión de lasMHC. En un modelo experimental de ratones manipulados genéticamente con MHCconsiguieron demostrar una reducción significativa en el volumen tumoral de susmetástasis cuando fueron tratados con inyecciones intraperitoneales deanticuerpos dirigidos frente al FCI. La investigación de este factor y de otros(p53, inestabilidad de microsatélites, etc.) en el cáncer de colon quedesarrolla MHC permitirá algún día categorizar mejor a los enfermos frente a lacirugía y la quimioterapia. Por el momento, la falta de estudios prospectivosaleatorizados y de una escala clínica de significación pronóstica que se aceptede forma universal no ayuda a resolver el enigma.
Por esto y porque no hay otras alternativas a la cirugía,el Departamento de Cirugía de la UCSF, basado en la mejor evidencia clínicadisponible, propone la cirugía siempre que ésta sea realizable, incluso cuandose trate de recurrencias de la enfermedad en el propio hígado. La falta de unaevidencia clara en el beneficio de la quimioterapia adyuvante, administrada deforma sistémica o IAH, nos invita a considerarla tan sólo si se participa enensayos clínicos.
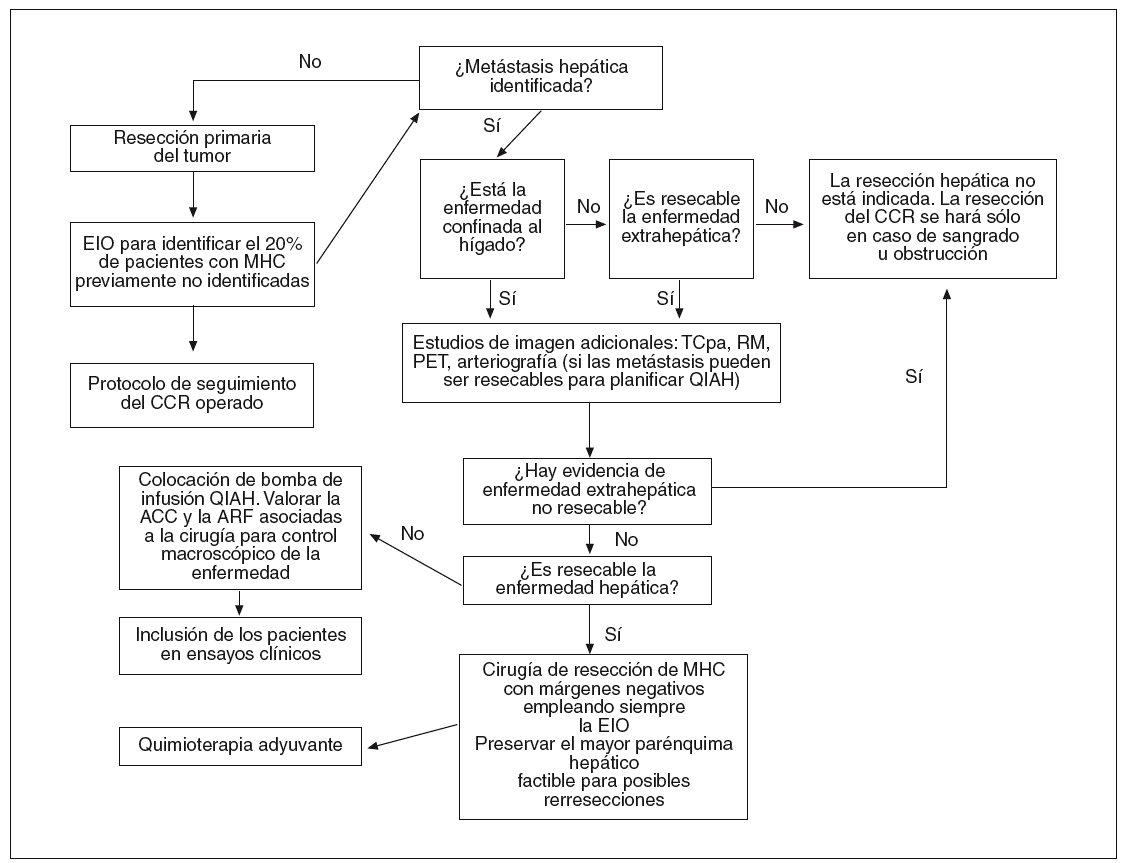
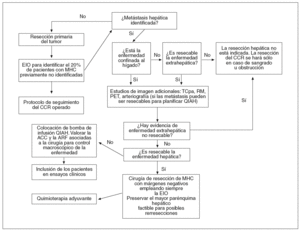
En la figura 1 ilustramos el algoritmo de actuación ante unenfermo con MHC que se propone desde el Departamento de Cirugía de la UCSF. Alobservarlo con detalle se podrá comprobar que, en la actualidad, elDepartamento está inmerso en ensayos clínicos con el oxaliplatino administradode forma sistémica como quimioterapia adyuvante, y el FUDR administrado IAH enlos pacientes en los que la cirugía no ha erradicado toda la enfermedad. Asimismo,se estudia el papel de la ARF en este último grupo de pacientes.
Fig. 1. Algoritmo deactuación en el Departamento de Cirugía de la Universidad de California SanFrancisco.MHC: metástasis hepáticas de origencolorrectal; CCR: carcinoma colorrectal; TCpa: tomografía computarizada trasportografía arterial; RM: resonancia magnética; PET: tomografía por emisión depositrones; EIO: ecografía intraoperatoria; QIAH: quimioterapia intraarterialhepática; ACC: ablación con criocirugía; ARF: ablación con radiofrecuencia.
Agradecimientos
La presente revisión se realizó durante unaestancia de tres meses en el Departamento de Cirugía de la Universidad deCalifornia San Francisco (UCSF), financiada con una ayuda económica delPrograma Estancias de Profesores de Universidad e Investigadores del CSIC y deOPIS en Centros de Enseñanza Superior y de Investigación Extranjeros(Resolución de 12 de agosto de 2004 de la Secretaría de Estado de Universidadese Investigación), y una beca de la AEC para la ampliación de estudios deespecialistas del año 2004.