Introducción
La realización de la biopsia selectiva del ganglio centinela en los pacientes con melanoma permite conocer la extensión de la enfermedad hacia el territorio de drenaje linfático correspondiente sin la necesidad de la linfadenectomía y la morbilidad asociada1,2. Con la introducción de esta técnica se ha comprobado, además, que las ideas clásicas de territorios fijos de drenaje linfático no son tan ciertas como se creía. Por el contrario, hay una gran variabilidad interindividual en los drenajes linfáticos de las distintas regiones cutáneas3. Ya se conocían regiones corporales conflictivas respecto al drenaje linfático. Así, las zonas cercanas a la línea media en el tronco muestran drenajes en ocasiones "no esperados"4,5 que, de no conocerse, podrían llevar a realizar linfadenectomías absolutamente innecesarias y a dejar sin estudiar otras cuencas linfáticas que realmente son interesantes en ese caso concreto. Por estas razones, diversos estudios han demostrado que la realización de estudios gammagráficos preoperatorios dirigidos hacia la localización de los drenajes linfáticos propios de la lesión en estudio no sólo es conveniente, sino imprescindible3,6,7. Esto es especialmente aplicable en el caso de los melanomas cutáneos localizados en el tronco, en los que la variabilidad de los drenajes linfáticos que nos podemos encontrar, tanto en número como en localización, es en teoría mayor que en los melanomas de las extremidades8,9.
En este trabajo nos proponemos 2 objetivos: a) estudiar los resultados de una adecuada detección gammagráfica y quirúrgica del ganglio centinela en melanomas cutáneos dependiendo de la localización anatómica del tumor primario, y b) comprobar si entre ellos hay diferencias clínicas e histológicas y, especialmente, en lo referente a la variabilidad del drenaje linfático y al número de ganglios centinela encontrados que puedan explicar esas posibles diferencias.
Pacientes y método
Gammagrafía
Se estudió a un total de 212 pacientes intervenidos por melanoma cutáneo entre abril de 1998 y mayo de 2004 en los que se realizó la biopsia selectiva del ganglio centinela. En todos ellos se utilizó la técnica mediante radiotrazador con una partícula coloidal (Lymphoscint®, Amesham, Saluggia, Italia) de 50-100 nm marcada con tecnecio 99 metaestable. Se inyectó 1 µCi (37 MBq) en 1 ml repartido en 4 inyecciones intradérmicas, de 250 µCi cada una, alrededor de la lesión o de la cicatriz de exéresis en el caso de haberse quitado previamente, siempre que se hubiese reconstruido mediante sutura directa, sin colgajos ni injertos. El trazador se inyectó entre 2 y 4 h antes de la cirugía y, tras la inyección bajo gammacámara, se realizó un estudio secuencial dinámico durante 5 min obteniendo 1 imagen cada 10 s. Inmediatamente después se hizo un registro estático en la misma proyección durante 180 s, con matriz de 256 * 256. Se consideró que la localización gammagráfica era adecuada si mostraba 1 o más drenajes con 1 o más ganglios definidos y persistentes, y ganglio o ganglios centinelas como los primeros que aparecían y se mantenían en el tiempo, procediendo a su localización y marcaje topográfico. Si no era así se realizaba un registro tardío a la hora, o incluso un segundo registro tardío a las 2 h. En total estudiamos a 96 pacientes con melanoma en las extremidades (68 inferiores y 28 superiores), a 89 con melanoma en el tronco y a 27 pacientes con melanoma de cabeza y cuello. En una paciente coexistían 2 lesiones, una en la planta de talón derecho y otra en la región aquílea derecha, diagnosticadas de melanoma lentiginoso acral, por lo que el número de lesiones estudiadas fue de 213 (97 en las extremidades, 89 en el tronco y 27 en la cabeza y el cuello). En total se registraron 259 drenajes linfáticos desde los melanomas (133 en el caso de los melanomas de tronco, 98 en los de los miembros y 28 en los de la cabeza y el cuello). En una paciente con un melanoma de 0,9 mm según el índice de Breslow, localizado en miembro inferior, y en 3 casos de melanoma de cabeza y cuello no se localizó drenaje linfático después de 2 linfogammagrafías.
Biopsia quirúrgica
En los casos con una localización gammagráfica adecuada se realizó la biopsia selectiva del ganglio o los ganglios centinelas. No se utilizaron colorantes. Debe señalarse que el equipo quirúrgico de la biopsia del ganglio centinela fue el mismo en todos los casos, así como el especialista en medicina nuclear. De las 209 lesiones estudiadas que presentaron 1 o más drenajes se abordaron 206 quirúrgicamente para localizar el ganglio o los ganglios centinelas. No se abordaron los casos de ganglios localizados en el mediastino o intratorácicos (3 casos). Se definió como ganglio centinela todo aquel que presentara más de 10 veces la actividad "de fondo", considerada como la registrada en una zona alejada de la zona de inyección y el lecho quirúrgico. Se consideró adecuada la identificación del ganglio centinela si el estudio histopatológico evidenciaba una estructura de ganglio linfático en la biopsia realizada. El estudio histopatológico e inmunohistoquímico de los ganglios se realizó de forma diferida mediante tinciones con hematoxilina-eosina, S-100 y HMB-45.
En cuanto a la lesión primaria, en la misma intervención se ampliaron los márgenes en relación con el índice de Breslow (< 1 mm: margen de 1 cm; 1-4 mm: margen de 2 cm; > 4 mm: margen de 2-3 cm), con reconstrucción con cierre con sutura primaria, colgajo o injerto según el defecto y la zona anatómica considerada.
Características generales
La edad media de los pacientes fue de 52,10 ± 15,39 años (rango, 13-82 años). Había un 56,13% de mujeres y un 43,87% de varones. El tipo histológico más frecuente fue el melanoma de extensión superficial (72,76%). El tamaño medio de la lesión fue de 12,54 ± 7,61 mm (rango, 5-50 mm) y el índice de Breslow de 1,75 ± 0,12 (rango, 0,2-11).
La técnica se indicó en lesiones de índice de Breslow > 1mm y en aquellas < 1 mm que asociaron factores de mal pronóstico (regresión, ulceración, infiltración linfovascular, Clark IV, etc.). En conjunto se encontró una media de 1,22 ± 0,61 drenajes linfáticos por lesión estudiada (rango, 0-7) y 1,24 ± 0,51 ganglios por drenaje (rango, 1-4). El paciente con 7 drenajes distintos era un varón con un melanoma de extensión superficial de 1,5 cm de diámetro y 0,75 mm de Breslow asociado a una importante regresión y localizado en la región preesternal que, tras la inyección del trazador, mostró canales de drenaje hacia el territorio axilar bilateral, 2 al mediastino posterior, 2 intercostales y 1 en cadena mamaria interna (o mediastino anterior), con ganglios centinelas en cada uno de estos drenajes de los que no se realizó abordaje quirúrgico. En su seguimiento está asintomático y libre de enfermedad a los 43 meses.
Método estadístico
Mediante el test de la *2 se compararon las diferencias entre los 3 grupos anatómicos para la localización adecuada, tanto de la gammagrafía preoperatoria como de la identificación correcta de los ganglios centinela durante la intervención.
Se recogieron como variables de estudio la edad y el sexo de los pacientes, el tipo histológico, el tamaño (diámetro máximo en mm) y el índice de Breslow de las lesiones, el número de drenajes por lesión, el número de ganglios centinela por drenaje (identificados en la intervención como ganglios con más de 10 veces la actividad "de fondo") y la positividad o no del estudio de los ganglios. Los resultados se agruparon en función de que el tumor primario estuviese localizado en el tronco, en las extremidades o en la cabeza y el cuello. Para valorar las diferencias entre las medias de las variables cuantitativas se utilizó las pruebas de análisis de varianza y de la *2 para la comparación de las variables cualitativas. Se consideraron estadísticamente significativos los valores de p < 0,05.
En los casos de tumores de cabeza y cuello se registró también si el drenaje coincidía con una zona correspondiente a una glándula salival y si este hecho se relacionaba con la localización inadecuada del ganglio centinela. El análisis se realizó mediante la prueba de la *2 para tablas de contingencia.
Resultados
Resultados de la detección gammagráfica e intraoperatoria del ganglio centinela (tabla 1)
En la detección gammagráfica preoperatoria encontramos diferencias significativas para el grupo de tumores de cabeza y cuello, en el que sólo un 88,8% de los casos presentó 1 o más drenajes linfáticos adecuados para su localización quirúrgica posterior. Tanto en los melanomas de tronco como en los de las extremidades se evidenciaron porcentajes mayores de drenajes linfáticos (100 y 98,9%, respectivamente) (p < 0,001).
En la identificación correcta del ganglio centinela también la localización del melanoma en la cabeza y el cuello mostró unos peores resultados. Así, sólo un 79,1% de los casos intervenidos por melanoma de cabeza y cuello presentó una adecuada identificación del ganglio centinela, frente a tasas de detección adecuada del 98,9% para los melanomas de las extremidades y del 98,8% para los de tronco (p < 0,0005).
Resultados de la comparación de variables (tablas 2-4)
En el estudio de nuestros pacientes encontramos diferencias significativas en cuanto al sexo, con asociación entre la localización del melanoma en el tronco en los varones y, sobre todo, la localización en las extremidades en las mujeres (p < 0,0005). También fueron significativamente mayores los pacientes con melanomas de cabeza y cuello (p < 0,001) (tabla 2).
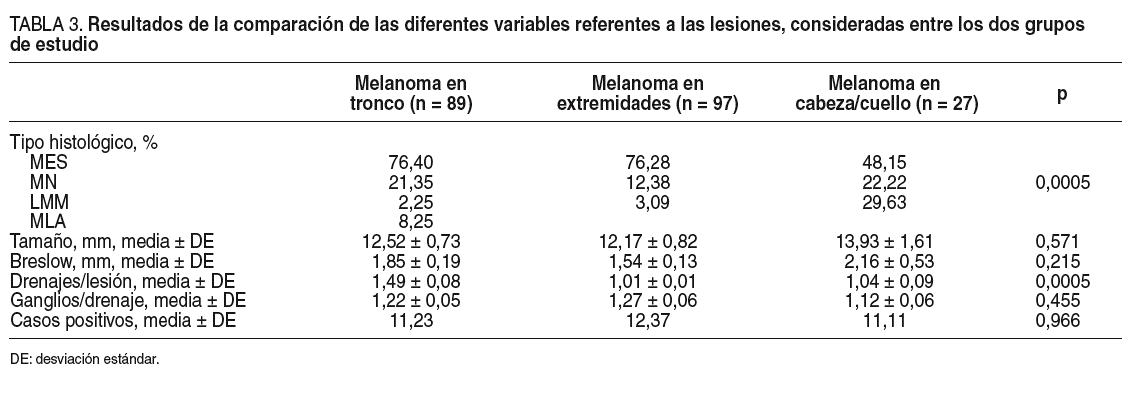
Cuando nos centramos en el estudio de las lesiones, no encontramos diferencias en el tamaño ni en el índice de Breslow entre las que se localizan en las extremidades, el tronco o la cabeza y el cuello (tabla 3). Los melanomas nodulares fueron menos frecuentes en las extremidades que en el tronco o la cabeza y el cuello, y los lentigos malignos melanomas fueron más habituales en la cabeza y el cuello (tabla 3).
Al estudiar los resultados concretos de la biopsia del ganglio centinela es posible observar que mientras los melanomas localizados en las extremidades y en la cabeza y el cuello suelen tener un único drenaje linfático, los del tronco presentan una mayor variabilidad en sus drenajes. Mientras que 36 (40,44%) casos de los melanomas de tronco presentaron drenajes múltiples, sólo 2 (2,06%) de los localizados en las extremidades y 4 (14,81%) de los de cabeza y cuello lo hicieron, lo que se confirma en el estudio estadístico al haber diferencias significativas en el número de drenajes por tumor (p < 0,0005). No se encontraron diferencias significativas entre el número de ganglios hallados por drenaje linfático (p = 0,455).
En la tabla 4 se muestra la distribución del número de drenajes en cada grupo, así como su localización.
Al analizar los resultados de la adecuada identificación del ganglio centinela en los tumores de cabeza y cuello observamos que la localización del drenaje en un área correspondiente a una glándula salival es un factor que se relaciona con la detección inadecuada del ganglio centinela (5 de 14, es decir, un 35,7% de fallos) frente a su localización en otra área (0 de 10, un 100% de aciertos) (p < 0,0005).
Discusión
La afección ganglionar es el factor pronóstico más importante en la mayoría de los tumores sólidos, incluido el melanoma10. La técnica clásicamente utilizada para conocer si hay afección ganglionar y, para algunos autores, con intención terapéutica es la linfadenectomía regional. En el caso del melanoma se ha comprobado que la linfadenectomía regional electiva no influye en el período libre de enfermedad ni en la supervivencia de pacientes que no tengan enfermedad ganglionar11-20. El objetivo de la biopsia selectiva del ganglio centinela es la adecuada estadificación del tumor para evitar linfadenectomías innecesarias20. Con la técnica de la biopsia del ganglio centinela se pretende localizar el ganglio o los ganglios linfáticos con mayores probabilidades de estar afectados en primer lugar cuando se produce la extensión linfática del tumor. Con los trazadores con isótopos radiactivos es posible realizar una linfogammagrafía preoperatoria para localizar cuáles son los drenajes del tumor concreto que estamos estudiando. Varios trabajos hacen hincapié en la necesidad de esta exploración preoperatoria3,6,7, fundamental en el caso del melanoma debido a la amplia variedad de localizaciones anatómicas en las que se puede encontrar el tumor primario. Nuestros resultados apoyan esta idea, especialmente cuando se trata de melanomas del tronco. En éstos hemos encontrado un mayor número de casos con múltiples drenajes linfáticos cuando se comparan con melanomas que afectan a las extremidades y a la cabeza y el cuello.
Otros autores han descrito la discordancia entre el sitio esperable al que debe drenar un determinado melanoma y el real al que drena cuando se estudia mediante linfogammagrafía. Así, se ha calculado que la discordancia en los melanomas localizados en el tronco es cercana al 25%, frente al 13% de los de las extremidades superiores o el 5,3% de los de las inferiores8. Incluso entre los localizados en el tronco, la capacidad de predecir el lugar del drenaje varía en función de que se consideren más o menos cercanos a la línea media9. El flujo linfático unidireccional que se produce en las extremidades implica que el ganglio centinela se encontrará proximal a la lesión, mientras que en el caso de las lesiones de tronco y de cabeza y cuello, el flujo es multidireccional, lo que hace imposible predecir su localización21-23.
La localización anatómica de la lesión posee valor pronóstico independiente en estudios realizados con análisis multivariable24-26 y, en líneas generales, las lesiones localizadas en las extremidades y, entre ellas, las situadas en las extremidades superiores poseen un mejor pronóstico que las localizadas en la cabeza, el cuello, el tronco y las áreas palmoplantares y subungueales27,28. Para explicar este diferente pronóstico se ha sugerido que los melanomas de localización axial pueden tener un diagnóstico más tardío, drenar a más de un territorio linfático y po-seer mayor irrigación, lo cual favorecería la aparición de metástasis. De todas formas, en nuestros pacientes no hemos encontrado diferencias en la afección ganglionar según la localización de la lesión primaria.
Una conclusión extrapolable de nuestros resultados es la mayor posibilidad de extensión extratumoral a través de más vías linfáticas, algunas inabordables para su estadificación, y otras incluso no sospechadas si no se realiza el estudio linfogammagráfico para detectar las posibles vías de drenaje de los ganglios centinela. De esta forma, localizaciones no habituales y difícilmente abordables, como en mediastino y retroperitoneo, explicarían en parte el peor pronóstico de los melanomas de tronco29.
Como drenaje atípico abordable quirúrgicamente, en un caso de melanoma situado en la región interescapular detectamos 2 drenajes linfáticos, 1 hacia la axila y 1 hacia un grupo ganglionar extraaxilar localizado lateral a la escápula y rodeado por los músculos supraespinoso, infraespinoso y la porción larga del músculo tríceps, en el denominado espacio triangular intermuscular30. Esta localización se ha observado también en otras series, concretamente hasta en el 10,4% de los melanomas localizados en la espalda31, y en su manejo debe abordarse como un drenaje independiente y no considerarse como una estación secundaria30,31.
Una consecuencia de la aplicación clínica directa de lo anterior es que la localización en el tronco de un melanoma cutáneo debería ser un parámetro considerado en el estudio y en la selección de las pruebas complementarias para el seguimiento de estos pacientes. De esta forma, la presencia de drenajes no abordables, como intratorácicos o retroperitoneales, debe sugerir la necesidad de realizar exploraciones complementarias específicas (sobre todo de diagnóstico por imagen) y, por lo general, no incluidas en el protocolo de seguimiento habitual, para estos casos en concreto, que permitan detectar recidivas locorregionales de forma precoz. A este respecto cabe reseñar el seguimiento de 1 caso de los que no se abordó el ganglio centinela (varón con drenaje axilar biopsiado y negativo y drenaje mediastínico no abordado) que desarrolló metástasis en estos territorios (mediastínicos y pulmonares) y falleció.
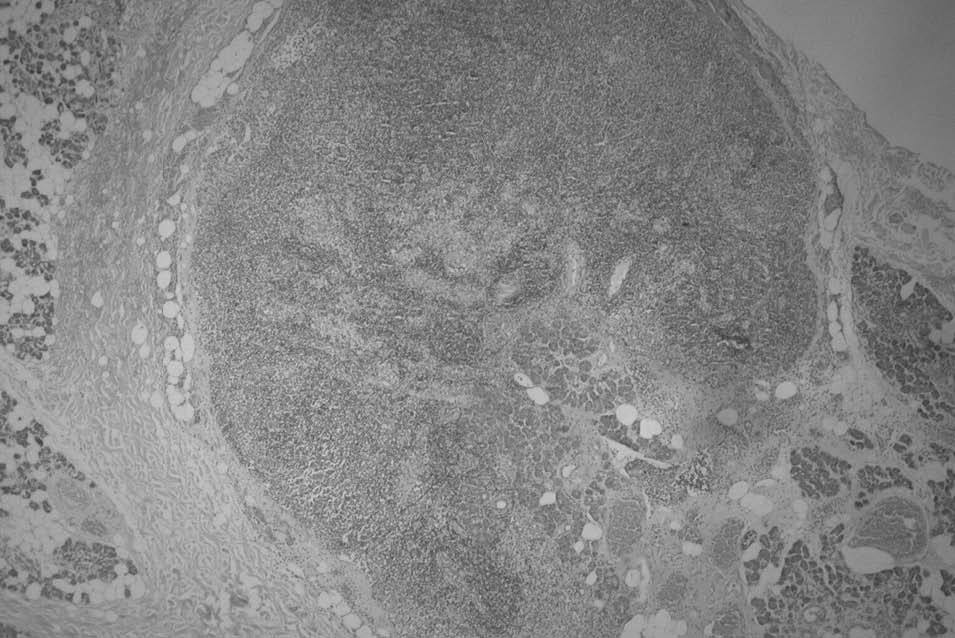
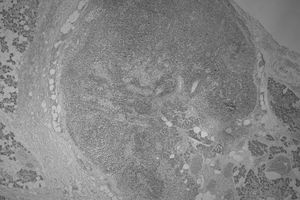
En relación con los melanomas localizados en la cabeza y el cuello, también se ha descrito una mayor dificultad para determinar los drenajes linfáticos correspondientes y el ganglio centinela3,8,32. Tanto en nuestra experiencia previa33 como en la de otros autores34, la localización del drenaje adyacente a la zona anatómica correspondiente a una glándula salival ha resultado ser un factor de interferencia para la adecuada identificación del ganglio centinela, lo que se ratifica con los resultados de este trabajo. En 5 de 14 casos de nuestra serie que drenaban al territorio adyacente a una glándula salival, la muestra remitida para estudio patológico, que presentaba una adecuada captación del trazador, no evidenció estructura ganglionar y sí tejido glandular. Incluso en un caso se pudo identificar tejido glandular dentro de una estructura linfoide intraparotídea (fig. 1). Esto no ocurrió en ninguno de los casos cuyo drenaje se dirigió hacia territorios linfáticos que no fueran cercanos a estas glándulas. Diversas explicaciones hipotéticas pueden considerarse a este respecto: la captación focal del trazador por tejido glandular, la captación por ganglios linfáticos intraglandulares con infiltración grasa o glandular (que impida una correcta identificación histológica), o la captación del trazador por inclusiones de tejido glandular dentro de un ganglio, a su vez, intraglandular35. Aunque la "curva de aprendizaje" también podría ser un factor relacionado con este hecho, debe cuestionarse en nuestra serie, pues sólo uno de ellos se produjo en los primeros 50 casos y los otros 4 fallos se han observado en los últimos 100 casos.
Fig. 1. Ganglio linfático intraparotídeo con inclusiones de parénquima salival intraganglionar (hematoxilina-eosina; x40).
Como conclusiones destacamos que los melanomas cutáneos localizados en el tronco presentan una mayor variabilidad en las vías de drenaje, con un mayor número de drenajes por lesión, que los localizados en las extremidades y en cabeza y cuello, y que la localización del drenaje linfático adyacente a la zona de las glándulas salivales puede interferir con la adecuada detección e identificación del ganglio centinela en los tumores localizados en la cabeza y el cuello.