Los nódulos tiroideos son una enfermedad frecuente que causa habitualmente angustia al paciente y preocupación al cirujano. Aunque el riesgo de malignidad es bajo en general, es preciso distinguir estos casos para su selección quirúrgica, evitando tiroidectomías innecesarias en pacientes con procesos benignos, que son la mayoría. Los cambios que se han ido produciendo a lo largo de las últimas décadas en el diagnóstico y tratamiento de estos procesos nos han llevado a realizar un estudio de la situación actual en esta materia.
Presentamos en este trabajo una revisión de los conocimientos actuales sobre esta enfermedad y de la evolución de los métodos diagnósticos en los últimos años, valorando especialmente la que hoy por hoy es la "prueba reina" en el diagnóstico de los nódulos tiroideos: la citología por punción-aspiración con aguja fina. Asimismo, se presentan las estrategias diagnósticas y terapéuticas más aceptadas en la actualidad y se destacan especialmente los aspectos que siguen siendo objeto de controversia.
Thyroid nodules are common lesions that produce anguish in patients and concern in their physicians. Although the likelihood of malignant transformation is generally low, it is necessary to identify the patients at risk and, thus, requiring surgical treatment, in order to avoid unnecessary thyroidectomies in patients with benign disease, who constitute the majority. The changes introduced in the diagnosis and treatment of these lesions in recent decades induced us to study the present situation.
We reviewed the current knowledge of this disease and recent changes in the diagnostic methods, especially assessing the principle test for thyroid nodules, fine-needle aspiration biopsy (FNAB). We also discuss the most widely employed diagnostic and therapeutic approaches, with special attention to those aspects that currently remain controversial.
Introducción
Los nodulos tiroideos son un problema clínico común y constituyen la alteración tiroidea más frecuente, con una incidencia que aumenta con la edad1. La prevalencia de nódulos tiroideos palpables en adultos americanos se ha estimado en un 4-7%2 (9 millones de adultos en los EE.UU.3, con un ritmo de nueva aparición del 0,08% anual)4, de los que la mitad son nódulos solitarios. La distribución por sexos es de 5-6:1, con predominio en el sexo femenino y con una proporción prácti camente constante tanto en estudios americanos como eu ropeos5-7. Aparecen nuevos nódulos a un ritmo de 0,1% al año, multiplicándose por 20 en casos de irradiación de cabeza, cuello o tórax8. Sin embargo, la verdadera prevalencia de nódulos tiroideos se ha demostrado muy superior. Cuando se consideran los datos de ultrasonografía o necropsia, las cifras son 10 veces superiores8, con estudios en series de autopsias que revelan que el 50% de los adultos presentan dichos nódulos, si bien la mayoría de ellos son impalpables9,10. En esta línea, Horlocker et al han demostrado con ultrasonografía de alta resolución que el 50% de los pacientes tienen nódulos tiroideos a los 50 años11.
El descubrimiento de un nódulo tiroideo palpable en un paciente, especialmente cuando se trata de un nódulo solitario o de un nódulo dominante en un tiroides multinodular, no sólo inquieta al paciente, sino que obliga al cirujano a descartar la presencia de un carcinoma, pues aunque sólo en el 5-11% de estos nódulos se confirma su malignidad, en el caso de nódulos fríos estas cifras pueden llegar hasta el 17%12. En realidad, los rangos de malignidad son muy variables según las series, oscilando entre el 0-1,5 y el 30%2,13-15. La mayoría de los nódulos tiroideos son benignos y el cáncer de tiroides es proporcionalmente raro, con una incidencia de cerca de 4 casos/100.000 individuos/año16, constituyendo sólo el 1% de todos los procesos malignos3 y el 0,5% de las muertes relacionadas con cáncer17. Sin embargo, datos de autopsias han demostrado que el cáncer oculto de tiroides, papilar en la mayoría de los casos, tiene una prevalencia del 6-28%18,19. A pesar de que la historia natural del cáncer de tiroides, en especial la de estos tumores (microcarcinomas) menores de 1 cm, implica habitualmente un curso lento e indolente, con una tasa de muertes de 6 por millón, también es cierto que tumores pequeños y aparentemente inocuos, menores de 1 cm, pueden producir metástasis importantes y precoces e incluso conducir a la muerte20.
El reto para el cirujano consiste en valorar el riesgo de malignidad de un nódulo tiroideo (solitario o dominante en una enfermedad multinodular), en el contexto de las más frecuentes enfermedades nodulares tiroideas benignas. La actuación ante un nódulo tiroideo es controvertida21,22, con extremos en autores que proponen cirugía agresiva23 y muchos cirujanos que adoptan una actitud más conservadora. Probablemente, el planteamiento más correcto se encuentre en un término medio, con un estudio selectivo para cada caso, usando de manera adecuada las técnicas diagnósticas disponibles, cada vez más fiables, aunque nunca al 100%, identificando a aquellos pacientes con procesos malignos que requerirán cirugía y evitando tiroidectomías innecesarias en pacientes con lesiones benignas, que son la mayoría. Dada la elevada prevalencia de estos nódulos y la posibilidad de malignidad, es pues precisa una estrategia adecuada para su diagnóstico y tratamiento
Patogenia
La denominación de nódulo tiroideo tiene significaciones diferentes: para el clínico se trata de un crecimiento localizado del tejido tiroideo (nódulo único) acompañado o no de crecimiento del resto del tiroides (bocio nodular); para el ecografista son lesiones circunscritas o redondeadas con características ecogénicas diferentes; para el patólogo son lesiones que distorsionan el tejido tiroideo normal y entre las que se incluyen nódulos verdaderos, cuando no tienen cápsula, generalmente múltiples, circunscritos y compuestos por folículos llenos de coloide, y adenomas cuando son únicos, poseen cápsula fibrosa con vasos de pared gruesa como detalle prominente, habitualmente celulares (folicular o papilar) con arquitectura uniforme. Ambas lesiones pueden sufrir cambios degenerativos con necrosis, hemorragia y fibrosis con distorsión del tejido glandular24-28.
El tejido tiroideo normal microscópicamente está compuesto por folículos formados por una capa única de células epiteliales o tirocitos que rodean al coloide en el centro, donde en ocasiones se puede encontrar un material cristalino birrefringente constituido por cristales de oxalato de calcio. Cada 20-40 fo lículos constituyen un lóbulo. Mediante el microscopio electrónico se observa que las células foliculares contienen liposomas con retículo endoplásmico complementario, mitocondrias pe queñas y núcleo redondeado con cromatina homogénea, desmosomas bien desarrollados y barras terminales entre las cé lulas. Entre las epiteliales se encuentran las células parafoliculares o C, que poseen gránulos secretorios y son identificables por inmunotinción para calcitonina. El estroma tiroideo, en términos de volumen, constituye el componente menor del tejido tiroideo y tiene un papel de soporte. Cada folículo está rodeado por una capa delgada de fibroblastos, con una red de capilares estrechamente aplicada y que se cree permite una comunicación humoral entre epitelio y estroma.
Después de su diferenciación en el feto, el tejido tiroideo crece lentamente de manera paralela con el peso del cuerpo y permanece igual durante la vida adulta, donde la célula se divide aproximadamente 5 veces para mantener un lento recambio que compensa la muerte celular, manteniendo además durante esta época su capacidad de responder a los estímulos que disminuyen la secreción hormonal, con hipertrofia e hiperplasia originada por aumento en la secreción de tirotrofina (TSH)28,29. La célula folicular tiroidea mantiene además un potencial propio de crecimiento que se establece después del nacimiento, y que posteriormente puede cambiar en una o ambas células hijas de una célula madre adulta que se divide, cambio que deviene estable y heredable como un nuevo rasgo, lo que también ocurre en las otras funciones de los tirocitos como la síntesis de tiroglobulina y el umbral de respuesta a la TSH, tanto para la endocitosis como para la actividad de la tiroperoxidasa en el borde apical de la célula. El mecanismo que controla el crecimiento del estroma y la proliferación endotelial de los capilares tiroideos es desconocido, por lo que su desarrollo dependería de señales o comunicaciones entre las células y los tirocitos29,30.
Para estudiar la formación del nódulo tiroideo se han em pleado modelos animales, como el carnero murino de suraustralia, el ganado vacuno africander y la cabra alemana (durante la cría) en los cuales con regímenes dietéticos con déficit de yodo, con el uso de derivados tiouracilos o con dietas con aniones, que impiden la captación de yodo, se produce elevación de TSH, con lo que se origina hiperplasia, seguida de múltiples lesiones no encapsuladas (nódulos), posteriormente encapsuladas (adenomas) y, ocasionalmente, se desarrollan carcinomas. Este proceso se ha estudiado también en el ser humano, con el que se ha podido establecer que la TSH controla el crecimiento y la función del tiroides; que concentraciones elevadas de gonadotropina coriónica humana (HCG) son capaces de activar el tiroides; que el déficit de yodo, aun en ausencia de TSH, es capaz de provocar una oleada de divisiones celulares; que las hormonas tiroideas controlan el crecimiento de la glándula; que la hormona del crecimiento (GH), quizás a través de los factores de crecimiento insulínico (IGF) y el péptido intestinal vasoactivo (VIP), inducen crecimiento pero no aumento de la función del tiroides, y que la somatostatina inhibe el crecimiento glandular31-36. La HCG, la GH y la TSH comparten la misma subunidad * , por lo que probablemente el estímulo del crecimiento de las células tiroideas se produzca a través del receptor de la TSH37.
El desarrollo de la inmunología permitió posteriormente conocer diversas inmunoglobulinas dirigidas contra el receptor tiroideo de TSH (TSab), que pueden favorecer (TSI) o no (TBII) el crecimiento y función, además de que existen otros autoanticuerpos que sólo estimulan el crecimiento (TGI)38,39.
Los tirocitos, como otras células, también responden a una serie de sustancias conocidas como factores de crecimiento, que pueden ser producidos por ellas (autocrinas) o por tejidos o células vecinas (paracrinas y yuxtacrinas) entre las que se citan el factor de crecimiento epidérmico (EGF) y factor transformador * (TGF * ), factor de crecimiento del fibroblasto (FGF), el factor de crecimiento insulínico (IGF II), el factor de crecimiento derivado de plaqueta (PDGF), interleucina 1, interferón gamma, transferrina, prostaglandina (E) y los oncogenes, que estimulan el crecimiento tiroideo36, mientras que el factor beta transformador del crecimiento (TGF ß ) inhibe el crecimiento del tiroides, probablemente mediante regulación de la producción de IGF I40, 41. Parece ser que los estrógenos también influyen en el crecimiento de las células del tiroides, lo que expli caría el mayor riesgo del sexo femenino para desarrollar neoplasias tirodeas42,43. Se ha descrito también disminución del crecimiento en respuesta a sustancias exógenas, como la bromocriptina o la octreotidea44 y el tamoxifeno43. Muchas de estas sustancias también actúan sobre las células endoteliales y los fibroblastos.
Al parecer, cada paso en la síntesis hormonal y del crecimiento tiroideo presenta elementos que lo controlan y que tanto pueden estimularlas como inhibirlas; así, la proliferación celular está regulada por protooncogenes promotores del crecimiento contrabalanceadas por genes supresores de éste. Mediante mutaciones, los protooncogenes se transforman en oncogenes que influyen en el crecimiento y ellos o sus productos pueden reemplazar factores de crecimiento, inducir receptores para éstos, originar señales de transducción o factores de transcripción. Entre los oncogenes de interés en la glándula tiroides se han descrito45-49 los del receptor de membrana TSHr, las proteínas G (ras H-ras, K-ras y N-ras y gsp), las tirosincinasas (ret-PTC, trk y erb-B receptor de EGF, con c-erbB2/neu y c-erbB) y la proteína nuclear myc (c-myc y n-myc). Entre los genes supresores se han descrito el p53 y el RB (retinoblastoma). Las vías mediante las cuales las sustancias antes mencionadas controlan la proliferación celular son tres, y todas parten de la interrelación hormona-receptor con posterior estimulación de diferentes sistemas intracelulares como son: la adenilciclasa-c-AMP-proteincinasa A, fosforilación proteica y síntesis de ADN en el núcleo, siendo este sistema el utilizado por la TSH y las Tsab, vía tirosincinasa, que tiene dos vertientes: a) diacilglicerol, proteincinasa C, fosforilación proteica y respuesta nuclear, y b) trifosfato de inositol, calcio y fosforilación proteica, siendo empleadas estas vías por EGF, insulina, FGF e IGF, y por último la cascada fosfolipasa C, fosforilación proteica y acción nuclear, mecanismo utilizado por la TSH, el trifosfato de adenosina (ATP) y la acetilcolina35,36.
Los estudios realizados tanto en seres humanos como en animales han demostrado que el adenoma tiroideo tiene un origen monoclonal, es decir, un solo tipo o clase de célula pierde el mecanismo de control del crecimiento, que puede ser transmitido a las células hijas, mientras que en caso del nódulo propiamente dicho, el origen es policlonal, es decir, a partir de diferentes tipos de células o clones, lo que explicaría su mayor componente estromal. Los nódulos fríos estarían formados por células sin capacidad para iodinar o endocitar la tiroglobulina formando grandes lagos de la misma (bocios coloides). En los demás casos, los nuevos folículos retendrían su habilidad para captar iodo y sintetizar hormonas. Los nódulos pueden asimismo ser localizados o múltiples y crecer lenta o rápidamente; el patrón de crecimiento es diferente no sólo entre células sino, además, entre folículos. Así pues, mientras un grupo de células está activo en crecimiento y función, otros estarían inactivos, produciendo heterogeneidad de función.
Evaluación clínica
Existen cuatro tipos de casos que requieren una especial atención. Por una parte, aquellos en que las características clínicas del nódulo son un rápido crecimiento, dureza, fijación a estructuras adyacentes o presencia de linfadenopatía, todo ello indicativo de carcinoma. Por otra, la aparición de un nódulo tiroideo en un paciente con antecedentes de irradiación previa de cabeza, cuello o tórax, habida cuenta que los carcinomas relacionados con radiación son con frecuencia multifocales. La irradiación previa del tiroides confiere a la presencia de un nódulo solitario un riesgo de malignidad del 20-50%50-52; además, una historia de irradiación condiciona el tratamiento quirúrgico, aconsejandose un abordaje más agresivo. Sin embargo, hay que recordar que existen estudios en los que la radiación no aumenta la frecuencia de cáncer clínicamente detectable sino la frecuencia de detección de carcinomas in situ en pacientes mas jóvenes53, 54, y que estudios realizados en relación con el incidente nuclear de Chernobyl han puesto de manifiesto que hay un aumento de la incidencia de cáncer de tiroides pero la mayoría de tipo papilar y de escasa agresividad55-56. En cualquier caso, cabe esperar una cada vez menor incidencia de estos casos, al no aceptarse en la actualidad muchas de las indicaciones de radioterapia que se realizaron en épocas anteriores, aunque dado el efecto a largo plazo, siguen constituyendo un factor a tener en cuenta.
Otro grupo de riesgo especial lo constituyen los niños menores de 14 años que presentan un nódulo solitario, pues tienen un 40-50% de posibilidades de que éste sea maligno57, 58. Parece que este mayor riesgo está en relación con la exposición a radiaciones ionizantes59. La evolución y pronóstico suelen ser mejores que en mayores de 40-50 años60-64. Y, por último, otro grupo de riesgo serían los pacientes con una enfermedad de Graves que presentan un nódulo gammagráficamente hipofuncionante, que conllevan un riesgo aumentado de carcinoma; además, en estas circunstancias el carcinoma parece tener un comportamiento más agresivo que en pacientes eutiroideos65. Algunos autores recomiendan directamente la intervención quirúrgica en estos casos.
Sin embargo, la mayoría de los pacientes que presentan nódulos tiroideos no se incluyen en ninguna de estas cuatro categorías. Los nódulos tiroideos son normalmente asintomáticos y se descubren de modo casual por el propio paciente o durante un examen médico rutinario. Un estudio clínico cuidadoso, con particular atención a los posibles factores clínicos de riesgo (tabla 1), proporciona indicadores importantes sobre el diagnóstico y la posible necesidad de intervención. La aparición de dolor es infrecuente, pero algunos tumores malignos pueden producir sensación de incomodidad en el cuello. La aparición de dolor debe sugerir infección inflamación, hemorragia o carcinoma anaplásico. Con respecto a la presencia de uno o múltiples nódulos, parece ser que la aparición de un nódulo dominante en una glándula multinodular implica los mismos riesgos de malignidad que un nódulo solitario66. El desarrollo de un nuevo nódulo solitario o el crecimiento rápido de un nódulo dominante preexistente deben hacer sospechar malignidad, pero un nódulo maligno puede presentar un crecimiento extremadamente lento y permanecer durante años antes de ser diagnosticado. Sin embargo, la presentación súbita de un bulto doloroso en el tiroides es casi patognomónica de hemorragia en un nódulo coloide, que es importante reconocer, ya que es habitual la resolución espontánea en pocas semanas sin necesidad de intervención médica.
Los factores geográficos pueden tener un papel en el desarrollo del carcinoma papilar, que parece tener una mayor incidencia en regiones ricas en yodo67, a diferencia del carcinoma folicular, más frecuente en áreas de bocio endémico por deficiencia de yodo68.
Los nódulos tiroideos son más frecuentes en mujeres y cuando aparece un nódulo solitario en el varón conlleva un mayor riesgo de malignidad69. Una historia familiar de trastornos endocrinos puede orientar hacia un carcinoma medular (CMT), que constituye el 7% de los cánceres de tiroides y en más del 20% de los casos forma parte de un síndrome MEN 2 (A o B) o, con menos frecuencia, se trata de un CMT familiar no MEN. La coexistencia de otras enfermedades endocrinas, especialmente el feocromocitoma, debe ser descartada previamente a cualquier intervención sobre el tiroides. El carcinoma papilar tiene también, en ocasiones, carácter familiar70, y se ha descrito en asociación con la poliposis adenomatosa familiar (síndrome de Gardner)71 y el síndrome de ataxia-telangiectasia72.
El paciente se encuentra habitualmente eutiroideo, pero la presencia de datos de disfunción tiroidea puede ayudar a establecer el diagnóstico. Por ejemplo, el hipertiroidismo sugiere un nódulo tóxico autónomo, mientras que el hipotiroidismo hace pensar en una enfermedad de Hashimoto nodular o un cambio linfomatoso en una enfermedad de Hashimoto. La palpación determina si se trata de un verdadero nódulo solitario o un nódulo dominante en un bocio multinodular. En cerca del 50% de los casos de nódulo clínicamente solitario, éste forma parte de una glándula multinodular73, como se comprueba en ecografía o en el estudio histológico postoperatorio. A esta distinción se le prestó en el pasado una atención inadecuada, pero los datos actuales sugieren unos riesgos de malignidad similares en ambos casos74,75. Esto es de especial interés en los casos de bocio multinodular con un nódulo dominante que aumenta rápidamente de tamaño, que debe tratarse como si fuera un verdadero nódulo solitario. Un nódulo duro y fijo sugiere malignidad76, aunque algunos carcinomas papilares se pueden presentar como lesiones quísticas y el carcinoma folicular puede ser hemorrágico y blando. Por el contrario, un nodulo coloide benigno puede ser duro por una calcificación distrófica. El valor de la consistencia del nódulo es sólo relativo. Sin embargo, la presencia de adenopatías es altamente indicativa de malignidad76. El denominado tiroides aberrante lateral con cambios quísticos en un nódulo linfático cervical afectado por un carcinoma papilar puede confundirse con un quiste branquial.
La aparición de una paresia recurrencial en ausencia de enfermedad respiratoria o cirugía tiroidea previa es altamente indicativa de malignidad, con invasión directa por el tumor. Ocasionalmente, esta paresia nerviosa puede ser debida a compresión por una enfermedad nodular coloide benigna, en cuyo caso suelen coexistir síntomas de compresión de esófago y/o tráquea que pueden requerir, por sí mismos, intervención quirúrgica independientemente de la sospecha de benignidad o malignidad del proceso.
Procedimientos diagnósticos
Datos de laboratorio
La función tiroidea se estudia mediante la determinación de T3 y T4 libres y TSH, que habitualmente serán normales, requiriéndose secuencias diagnósticas específicas en caso de no ser así, en especial gammagrafía. A veces se puede encontrar un nódulo maligno en asociación con una enfermedad de Graves o una tiroiditis, pero en la actualidad es raro que un nódulo maligno sea la causa de un hipertiroidismo. La determinación de anticuerpos antitiroideos y tiroglobulina añaden pocos datos a la exploración clínica. Hay autores que sugieren que los niveles de tiroglobulina pueden ser útiles para orientar entre adenoma y carcinoma folicular77. Asimismo, parece ser que el seguimiento de las concentraciones de tiroglobulina en el tratamiento con levotiroxina puede predecir la disminución o no del volumen del nódulo con la terapia supresiva78. Cuando hay una historia familiar indicativa de MEN 2 debe determinarse la calcitonina sérica como ayuda diagnóstica, aunque su mayor valor es la monitorización del paciente tras la cirugía por CMT, no siendo necesaria su determinación sistemática en todos los pacientes con nódulos de tiroides.
Técnicas de imagen
La presencia de extensión retrosternal o desviación traqueal puede estudiarse mediante radiografía de tórax, tomografía axial computarizada o resonancia magnética nuclear, que pueden ser también de utilidad en el estudio de extensión en los casos de malignidad. Pueden aportar en algunos casos datos que pueden orientar el diagnóstico (calcificaciones por cuerpos de psamoma en carcinomas diferenciados, márgenes espiculados e irregulares en las imágenes de RMN de los carcinomas, adenopatías, etc.), si bien su utilidad en este último sentido es bastante limitada.
La ecografía es una técnica operador-dependiente, y puede identificar nódulos de hasta 0,3 mm de diámetro79. Diferencia entre estructuras quísticas y sólidas, y permite comprobar el estado del resto de la glándula y detectar posibles lesiones multifocales, pero no es de gran ayuda en el diagnóstico general de malignidad. Es también útil como guía de la punción-aspiración con aguja fina (PAAF) en casos seleccionados. Como características ecográficas de posible benignidad se han referido un patrón completamente anecogénico, un patrón hipoecogénico con realce posterior, un patrón hiperecogénico (20% de los casos) y la calcificación periférica. Como hallazgos indicativos de malignidad se citan un patrón hiperecogénico sin realce posterior, la existencia de un halo periférico incompleto, los márgenes irregulares y la presencia de microcalcificaciones. Aunque se creía que las lesiones hipoecoicas (como ocurre con el cáncer de mama) indicaban de malignidad, éste es un dato poco específico80,81. Es difícil estudiar mediante ecografía las lesiones mixtas. Habitualmente representan una enfermedad coloide con hemorragia asociada en degeneración, pero pueden corresponder también a un tumor en la pared de un quiste. Por ello, el valor de la ecografía en el estudio rutinario de los nódulos tiroideos tiene un valor limitado82.
La gammagrafía tiroidea se ha usado para clasificar los nódulos en no funcionantes (fríos), normofuncionantes (templados) e hiperfuncionantes (calientes), como resultado de su capacidad para captar los isótopos radiactivos. El 99mTc-pertecnectato es tal vez el más usado por su disponibilidad en los servicios de medicina nuclear y fácil uso, pero tiene menor capacidad de discriminación entre actividad tiroidea y actividad circundante; el 123INa suele emplearse cuando se precisa una gammagrafía con trazador yodado, reservándose el 131INa para casos de sospecha de carcinoma diferenciado de tiroides o si no se dispone de 123I, para uso terapéutico debido al mayor porcentaje de radiación ß que produce, y en la búsqueda de metástasis. En casos específicos se puede emplear también el 201Tl-cloruro (metástasis carcinoma papilar), 99mTc-MIBI (metásta sis, linfoma, carcinoma medular), citrato de 67Ga (carcinoma anaplásico, tiroiditis, linfoma y absceso tiroideos), 99mTc(V) DMSA (carcinoma medular) y 131I/123I-MIBG (metástasis carcinoma medular)83. Se suele recomendar inicialmente la gammagrafía con 99mTc-pertecnectato y reservar los trazadores yodados para los casos en que con el anterior fueran nódulos templados y persistiera sospecha de carcinoma84. La gammagrafía con 201Tl-cloruro se recomienda también en los pacientes con sospecha de nódulo autónomo hiperfuncionante en los que no se aprecia adecuadamente el resto del tiroides en el estudio con yodo o tecnecio, y en los que está desaconsejada la estimulación con TSH por el riesgo de hipertiroidismo, especialmente en los pacientes de mayor edad85.
El hallazgo de un nódulo caliente se suele interpretar como signo de benignidad, y, debido a las limitaciones de la técni ca, los pocos casos de malignidad asociados a nódulos calientes86,87 son probablemente consecuencia de focos "fríos" de cáncer adyacentes a la lesión "caliente", que conducen a una errónea interpretación. Más del 80% de los nódulos son fríos, pero menos del 20% de éstos son malignos88,89. Un 10% son templados, y el 10% de ellos son malignos. Sólo el 5% de los nódulos son calientes, y, de éstos, menos del 5% son malignos89. Puede haber discrepancias90 entre las imágenes obtenidas con 123-131I y 99mTc. En definitiva, la gammagrafía es muy pobre para distinguir entre nódulos benignos y malignos91, y su papel en la actualidad está limitado a la identificación de tejido tiroideo con funcionamiento autónomo, lo cual es de especial interés en la distinción entre adenoma tóxico y nódulo frío en el contexto de una enfermedad de Graves (TSH baja)92. Sin embargo, su uso sistemático sigue ampliamente difundido.
El escáner fluorescente es una técnica cuyo valor para la determinación de la benignidad o malignidad de un nódulo tiroideo aún no se ha probado. Usa la técnica de determinación in vivo mediante rayos X del contenido en yodo intratiroideo93,94. En la actualidad es una herramienta de investigación y su papel como técnica diagnóstica en el futuro es incierto, debido, entre otros factores, al coste de su realización.
Biopsia con aguja
La biopsia con aguja tru-cut o vim silverman es un buen método para diferenciar los nódulos tiroideos benignos y malignos. Sin embargo, es un método doloroso y con poca aceptación por el paciente y con riesgo potencial de complicaciones severas, como hemorragias, punción traqueal o lesión recurrencial. No está claro que se pueda diseminar una posible neoplasia por la aguja (en una serie de Miller95 con más de 3.000 biopsias no se produjo ningún caso y el número de falsos negativos fue sólo del 1%). Las lesiones menores de 3 cm no son aptas para esta técnica
Citología por aspirado (FNAB-FNAC-PAAF-PAB)
Es la técnica alternativa a la anterior, y mucho más aceptable y usada en la actualidad. Los trabajos pioneros realizados en Escandinavia96-98 han conducido a la aceptación casi universal de la PAAF como el método de elección para el diagnóstico de los nódulos tiroideos. Aunque la PAAF de nódulos tiroideos se describió hace más de 60 años, esta técnica no empezó a contar con amplia aceptación hasta principios de los años ochenta. Este retraso se debió, entre otros factores, al temor de que la introducción percutánea de una aguja en una tumoración maligna pudiera favorecer su diseminación y siembra en el trayecto de la aguja. La excepcionalidad con que se ha comunicado este hecho ha llevado a descartar este riesgo, con lo que la PAAF se usa ampliamente en la evaluación de pacientes con nódulos tiroideos.
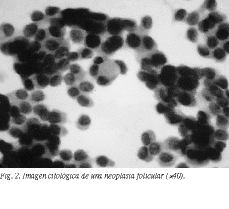
La PAAF tiene una buena aceptación por parte de los pacientes y escasas complicaciones, y puede repetirse fácilmente en caso de ser necesario. Es sencilla de realizar en nódulos mayores de 1 cm, o menores si son superficiales. Puede diagnosticar con certeza nódulos coloides, tiroiditis, carcinoma papilar, medular y anaplásico, linfomas e incluso cánceres secundarios, y es también de gran utilidad en el diagnóstico de lesiones metastásicas de orígen tiroideo99. Su mayor limitación es la evaluación del nódulo folicular, en el que se requiere estudio histológico para distinguir entre adenoma y carcinoma folicular, pues el diagnóstico diferencial entre ambos consiste en la determinación de la presencia de invasión capsular y vascular, aunque pueden existir datos citológicos altamente orientadores100. En estos casos, una biopsia con tru-cut puede aportar información útil, pero es preferible considerar estas lesiones como potencialmente malignas y derivarlas directamente para escisión quirúrgica, salvo en el caso de que el nódulo sea hiperfuncionante. El hallazgo de que se produce aneuploidía del ADN con frecuencia, tanto en los adenomas como en los carcinomas foliculares101,102, hace pensar que las neoplasias foliculares deberían considerarse y tratarse como una sola entidad. Por otra parte, parece ser que en niños y adolescentes se produce un mayor número de falsos negativos103, por lo que en estos casos los resultados de la PAAF deben interpretarse con gran cautela.
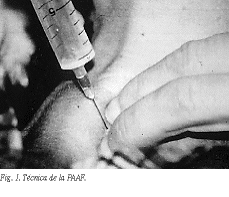
Técnica
La técnica de la PAAF, ampliamente descrita, es sencilla y está libre de complicaciones significativas104. Se emplea una aguja del calibre 23-25 G con una jeringa de 10 ml, con un dispositivo especial para manejar la jeringa, y se realizan 3 o 4 aspiraciones sin necesidad de anestesia. El aspecto del material obtenido puede orientar sobre la etiología del proceso. Así pues, por ejemplo, la obtención de un líquido rosado puede orientar hacia un quiste benigno y la extracción de un líquido claro como agua puede corresponder a un quiste de paratiroides. El material se coloca y extiende sobre un portaobjetos, existiendo diferentes técnicas para las extensiones según el tipo de muestra con objeto de obtener mayor concentración posible de partículas de tejido105. Unos de éstos se dejan secar al aire y se tiñen con tinción tipo Romanowsky o May-Grünwald-Giemsa, con las que se identifica mejor el material extracelular como el coloide o los depósitos de amiloide y los elementos inflamatorios, observándose bien los detalles citoplasmáticos, y otros se fijan en alcohol y se tiñen con anilinas (hematoxilina-eosina o método de Papanicolaou), con lo que se definen mejor las características nucleares. Si se obtiene líquido quístico, debe concentrarse mediante filtrado antes de procesarlo. Es de importancia capital la interpretación de las preparaciones por un citopatólogo experto, siendo los parámetros diagnósticos más importantes a valorar: la cuantía de la celularidad obtenida, su forma de descamación, la morfología celular y nuclear y la existencia o no de material extracelular. Parece ser que se obtienen mejores resultados cuando realiza las tomas el mismo citopatólogo que después estudiará las extensiones citológicas106. Otros autores107,108 usan el método de "bloque de células" con el que se conserva la arquitectura tiroidea, lo que facilita el diagnóstico. También se pueden utilizar estudios inmunohistoquímicos y tinciones especiales. Se usan al menos 6 punciones en cada caso.
Categorías citodiagnósticas
Los resultados del estudio citológico de los especímenes obtenidos por PAAF pueden ser negativos, positivos, indeterminados o inadecuados. Como caracteristicas citológicas indicativas de benignidad se han referido la presencia de abundante coloide, escasa celularidad y la presencia de material quístico con presencia de macrófagos y cristales de colesterol. Una citología benigna (negativa) corresponde habitualmente a adenoma coloide (macrofolicular) y se suele apreciar abundante coloide y células foliculares típicas. También las tiroiditis se incluyen en esta categoría. En una PAAF compatible con malignidad se puede encontrar un contenido celular mayor que en el nódulo coloide, poco o ningún coloide y/o coloide denso "en chicle de mascar". La celularidad se dispone en folículos y placas sólidas, y pueden observarse células poligonales densas de contorno más rígido que las de Hurtle, cuerpos de Psamoma (50% de los carcinomas papilares) o agujeros intranucleares. Una citología maligna (positiva) puede corresponder a carcinoma papilar (70%), folicular (15%), medular (5-10%) o anaplásico (3%), linfoma (3%) y, más raramente a metástasis. Una citología indeterminada puede deberse a una neoplasia microfolicular, de células de Hürthle o embrionaria. Los nódulos con componente fibrótico importante pueden ser también causa de dificultades diagnósticas109. Los frotis inadecuados se producen con mayor frecuencia en los casos de quistes (quistes simples o los adenomas degenerados) debido habitualmente al escaso contenido celular del aspirado y, en ocasiones, a la presencia de hemorragias. En este sentido, es preciso advertir que existen series en las que hasta un 13% de los casos de citología de contenido quístico se asocian a malignidad110. En la mayoría de las series, las categorías benigna y maligna suman el 80% del total, correspondiendo el resto a casos indeterminados y frotis inadecuados104,111, con más de un 70% de casos benignos104,112, cifras similares a las referidas por autores de nuestro medio113.
Fiabilidad
Para basar la decisión quirúrgica sólo en los hallazgos de la PAAF, los rangos de falsos positivos y negativos deben ser aceptables. Aunque es relativamente simple y barata, para considerarla como una prueba diagnóstica realmente fiable el valor predictivo de un resultado negativo (benigno) debe ser próximo al 100%, dejando virtualmente en 0% la posibilidad de que exista una neoplasia maligna (valor predictivo negativo). Numerosos estudios han tratado de evaluar este aspecto comparando los resultados de la PAAF con el diagnóstico histopatológico en pacientes que se sometieron a intervención quirúrgica. En dos amplios estudios realizados en los que se utilizó antes de la cirugía se han encontrado un 0% de falsos positivos y unos falsos negativos del 2,2 (con posterior tendencia al 0%)98 y 0,7%, respectivamente114.
El valor predictivo negativo de un resultado benigno oscila entre el 89 y 98%, con una media del 94%, o lo que es lo mismo, unos falsos negativos del 6%. Como cabe esperar, el valor predictivo negativo de un resultado indeterminado es mucho menor, con unos falsos negativos del 27%. En estos estudios, de 363 resultados positivos (malignos), 349 se confirmaron como tales en el estudio histopatológico, resultando una tasa de falsos positivos del 4%. Así pues, la certeza diagnóstica global para lesiones benignas y malignas de la PAAF es del 95%. En conjunto, el valor predictivo para citodiagnósticos positivos, negativos e indeterminados es del 94, 96, y 73%, respectivamente. Estos resultados se han obtenido de series de grandes centros de referencia, con lo que la duda reside en si estos resultados son extrapolables a centros menores, con un número más reducido de casos. Parece ser que con unos 40-50 procedimientos al año realizados por personal entrenado pueden obtenerse resultados similares115,116.
Los resultados "sospechosos" en la PAAF suponen un dilema, siendo preferible un exceso de precaución que aumente la sensibilidad del método, aunque también lo hagan los falsos positivos. En un estudio de Grand et al114, el 23% de las lesiones sospechosas resultaron ser malignas, obteniéndose resultados similares por otros grupos98,117. Como factores de mayor riesgo en estos casos se han citado las lesiones sospechosas de carcinoma papilar y los pacientes mayores de 50 años con sospecha de neoplasia folicular o de células de Hurtle118.
La introducción de la PAAF en el estudio preoperatorio ha conducido a un aumento de la incidencia de tumores malignos, en los pacientes que se someten a cirugía, del 10 al 31 y hasta el 50%4,119,120, y a una mejor selección de los casos, con una reducción de los pacientes que se someten a cirugía tiroidea, con las correspondientes implicaciones en cuanto a costes y riesgos quirúrgicos121,122. Hay autores que sugieren que no se debería obviar la técnica en ningún paciente con bocio123.
La PAAF es también útil como herramienta diagnóstica y terapéutica en los quistes tiroideos. Esto es importante si se tiene en cuenta que los nódulos quísticos puros o mixtos representan el 6-25% de todos los nódulos tiroideos124. La aspiración del quiste elimina muchas lesiones pequeñas, pero un 6% requerirán escisión quirúrgica cuando queda un nódulo residual125, pues una citología negativa no excluye una neoplasia. Se ha usado también la inyección de agentes esclerosantes en el interior del quiste, como tetraciclina, y en nódulos autónomos hiperfuncionantes y nódulos fríos124,126. Una vez aspirado un quiste, debería realizarse una nueva PAAF del tejido adyacente, pero existen autores que no lo consideran necesario si el quiste desaparece completamente y no presenta nuevas manifestaciones clínicas. Los quistes recurrentes pueden ser aspirados hasta 3 veces si es necesario, y parece ser que la terapia supresiva con tiroxina podría evitar la reacumulación124. Ante la persistencia, debe indicarse cirugía. Asimismo, los quistes mayores de 4 cm deben extirparse quirúrgicamente por el mayor riesgo de malignidad que conllevan89, 127. La hemorragia de un nódulo coloide (con clínica dolorosa súbita) produce un aspirado teñido de sangre pero, salvo en estos casos, la presencia de sangre en el aspirado de quistes tiroideos debe considerarse sospechosa de malignidad y plantearse la intervención quirúrgica.
La PAAF tiene un menor valor en los nódulos con características clínicas indicativas de malignidad, en los que aparecen en el contexto de un bocio tóxico difuso o una enfermedad de Graves, y en los que se presentan en pacientes con historia de radiación de cabeza, cuello o tórax. En estos casos se debe indicar cirugía independientemente de los hallazgos citológicos.
En conclusión, la PAAF es un método seguro, fácil, fiable y con una importante relación coste-beneficio para la diferenciación entre nódulos tiroideos benignos y malignos. En 1994, Delbridge et al128 demostraron que el análisis de los especímenes de PAAF mediante espectroscopia por resonancia magnética de protones (PMRS) puede mejorar la evaluación diagnóstica y evitar cirugía innecesaria en casos de neoplasia folicular benigna. Recientemente, Henry et al y otros autores129,130 han demostrado que el uso de una técnica inmunohistoquímica para la detección de tiroperoxidasa (TPO) con el anticuerpo monoclonal denominado MOAB 47 puede ser útil para el diagnóstico preoperatorio de malignidad con una sensibilidad, especificidad y precisión global del 100, 86,7 y 89%, respectivamente. Sin embargo, son necesarios más estudios para establecer hasta qué punto la asociación de PAAF con MOAB 47 y PMRS puede mejorar la sensibilidad, especificidad y precisión global. En esta búsqueda para mejorar los resultados de la PAAF hay que citar también otra serie de técnicas cuyo valor real está por demostrar, como la detección de variantes del CD44 mediante la reacción en cadena de la polimerasa en el ARN obtenido por PAAF131, la determinación de ADN mediante citometría de flujo132, las técnicas de citología cuantitativa133 y de identificación del AgNOR134, o la determinación de inmunorreactividad para lactoferrina, que parece aumentar en casos de neoplasia135. Hay autores que refieren mejoras en el diagnóstico cuando los resultados de la PAAF se relacionan con otras variables clínicas a través de predicciones para cada paciente mediante un modelo obtenido por el sistema de regresión logística136.
Estrategia diagnóstica y relación coste-beneficio en la evaluación del paciente con un nódulo tiroideo
Debido a su certeza, simplicidad y bajo coste, la PAAF ha reemplazado prácticamente a la ecografía y gammagrafía en el estudio del paciente eutiroideo con un nódulo tiroideo, como prueba de primera elección. En épocas anteriores, a estos pacientes se les habría solicitado una ecografía y gammagrafía tiroideas. Tras ello, si el nódulo hubiera sido sólido y "frío", el paciente se habría sometido a cirugía. Con esta sistemática, sólo el 20% de los nódulos resecados son carcinomas104. Hoy día, en la mayoría de los centros el paciente se habría sometido a una citología por PAAF, con un coste menor. Con la PAAF como procedimiento diagnóstico de primera línea, el 50% de los nódulos extirpados son carcinomas y se reduce de forma significativa el número de pacientes que se someten a cirugía104. Las ventajas en cuanto a costes son evidentes.
Ante un paciente que presenta un nódulo tiroideo se recomienda la realización de una PAAF como primera prueba. Nosotros preferimos realizar también en primera instancia una ecografía dado que, aunque escasas, las posibles complicaciones de la PAAF pueden distorsionar la arquitectura ecográfica del nódulo, con lo que no podríamos disponer de un referente adecuado para los casos en que los resultados de la citología sean benignos y se indique seguimiento. Estos cambios tras la punción se han comprobado en gammagrafía e histología, produciéndose a veces proliferación vascular o necrosis del nódulo, incluso con desaparición clínica de éste137-142. Esta ecografía inicial puede ser también útil para guiar la PAAF, lo cual es de especial interés a la hora de obtener muestras de las regiones sólidas de los nódulos quísticos o mixtos y en tumores pequeños. Por otra parte, la detección de posibles adenopatías puede orientar la decisión en casos dudosos.
Si la citología resultara benigna, se aconseja observación, con seguimiento clínico y ecográfico del tamaño del nódulo. No parece ser de gran utilidad la terapia supresora con levotiroxina y puede tener efectos perjudiciales, sobre todo cardíacos y óseos143-146. Algunos autores recomiendan, asimismo, repetir la PAAF al año147, aunque otros lo consideran innecesario si clínicamente no se han detectado cambios148. En todo caso, debe procederse a la exéresis quirúrgica si aparecen en cualquier momento de la evolución datos sospechosos.
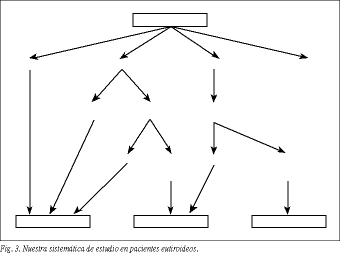
Si los resultados del estudio citológico fueran malignos, la indicación quirúrgica queda inmediatamente establecida. En el caso de resultados indeterminados, hay autores que proponen intervención quirúrgica sistemática149, mientras que otros consideran indicada la práctica de una gammagrafía150, de forma que si el nódulo fuese hipo o normofuncionante se debería indicar intervención y si fuese hiperfuncionante, observación como en el caso de los benignos, dadas las escasas tasas de malignidad. En este sentido, parece preferible valorar previamente la TSH, indicando intervención si ésta es normal y realizando gammagrafía sólo si las concentraciones son bajas pues, dado que sólo el 10% de los nódulos son hiperfuncionantes, es más razonable y menos costoso realizar primero la determinación de TSH. En los casos de muestras inadecuadas, debe repetirse la PAAF. Nuestra sistemática habitual de estudio en pacientes eutiroideos es la reflejada en la figura 3.
Una duda que se plantea es la actitud a seguir ante los "incidentalomas" tiroideos impalpables, existiendo autores que desaconsejan intervención e incluso la realización de PAAF u otros estudios en estos casos84, salvo que sea familiar de un paciente con carcinoma medular, basándose en el escaso potencial maligno, incluso aunque se tratara de un pequeño carcinoma. Nosotros discrepamos de esta actitud puesto que, a priori, es imposible distinguir qué microcarcinomas evolucionarán a lesiones clínicamente significativas y cuáles no, siendo precisa, a nuestro modo de ver, al menos la filiación del proceso.
Historia natural
La historia natural de los nódulos tiroideos benignos ha recibido poca atención en el pasado, pero es importante para predecir la evolución y determinar las actuaciones adecuadas. Un estudio de Grant et al114, en el que se siguieron durante más de 6 años a 641 pacientes sometidos a PAAF, demostró un bajo porcentaje de falsos negativos (0,7%), pero no documentó los cambios concretos en los nódulos benignos. Kuma et al151 re examinaron clínicamente a pacientes con nódulos tiroideos considerados benignos, tras 10-30 años. La mayoría de los nódulos benignos disminuían con el tiempo y el 36% desaparecía. Sin embargo, de los nódulos que continuaban creciendo, en el 26,3% se comprobó malignidad. En un estudio más reciente de este mismo grupo152 se ha empleado el reexamen clínico junto a PAAF guiada por clínica y ecografía, estudiando nódulos de 9-11 años de evolución. El 99% de los nódulos seguían siendo benignos y la mayoría disminuyeron de tamaño o desaparecieron durante el seguimiento. En el 21-23% hubo un aumento de tamaño, con un porcentaje de malignidad del 4,5%.
Tratamiento
Tratamiento médico
En la selección de pacientes para indicación de tratamiento médico se aconseja incluir a aquellos con una historia clínica de benignidad, los que son ecográficamente quísticos o mixtos, los que son gammagráficamente templados o calientes y los que permanecen estables o se reducen tras terapia con T4. Aunque la administración de hormonas tiroideas puede ser una "terapia supresiva" beneficiosa en el bocio difuso coloide, una vez que se ha desarrollado la formación de nódulos su beneficio, según algunos estudios, parece ser escaso12,144. Sin embargo, existen otros estudios no aleatorizados que sugieren que el tratamiento con tiroxina disminuye en un 50% o más el tamaño nodular en aproximadamente el 30% de los pacientes12. De cualquier modo, fallan en el adecuado control de los grupos, pues no siempre se excluían los pacientes con hipotiroidismo subclínico y los nódulos no siempre se han medido con métodos objetivos.
Existen también cuatro trabajos prospectivos aleatorizados en pacientes con nódulos benignos solitarios que comparan el efecto de la tiroxina a dosis supresoras durante 6-12 meses frente a placebo o ningún tratamiento, controlando el tamaño del nódulo mediante ecografía. Tres de los estudios sólo in cluían a pacientes con nódulos coloides144,146,153, pero el cuarto incluía también a pacientes con nódulos degenerativos, hiperplásicos y fibróticos154. En dos estudios no se apreciaron beneficios con la terapia144,146. En el tercero153, la terapia con tiroxina obtuvo reducciones en un 45% de los casos frente al 26% que se obtuvo con placebo, pero en cuanto al número de pacientes con reducción del nódulo mayor o igual al 50% no hubo diferencias significativas. En el cuarto154, en el 39% de los pacientes tratados se produjo una reducción mayor del 50%, lo que no ocurrió en ninguno de los no tratados. Sin embargo, esta reducción se produjo sólo en nódulos con volumen inferior a 10 ml. En este último estudio, las características citológicas del nódulo predecían el efecto de la terapia, siendo éste mayor en nódulos degenerativos o coloides.
A pesar de los resultados a corto plazo, no hay datos de eficacia a largo plazo lo que, junto a la posibilidad de efectos indeseables, hace controvertido el uso de la terapia supresiva en los nódulos tiroideos, así como la duda sobre si es preferible, en caso de emplearse, una supresión marcada o media155. En cuanto a efectos indeseables de la terapia supresora, se producen a largo plazo disminuciones de la densidad mineral ósea de un 5-9% en mujeres posmenopáusicas, pero no se han observado los mismos efectos en varones y mujeres premenopáu sicas, y la terapia sustitutiva con estrógenos en mujeres postmenopáusicas aminora las mencionadas pérdidas óseas156,157. Puede producir asimismo fibrilación auricular en mayores de 60 años e hipertrofia de ventrículo izquierdo con posible disfunción, si bien los resultados de los estudios realizados en este sentido son dispares143,158-160. En cualquier caso, se aconseja no mantener la terapia más allá de 2-3 meses si en este tiempo no se aprecian disminuciones de tamaño84. Por otra parte, la supresión de TSH con la administración de T4 también reduce el tamaño de un nódulo maligno hasta en un un 16% de casos12,161, por lo que hay que tener precaución con este tipo de tratamientos.
El tratamiento supresivo en pacientes eutiroideos con nódulo autónomo hiperfuncionante no está indicado debido al riesgo de inducción de hipertiroidismo. La mayoría de estos nódulos permanece con tamaño estable (un 86% en 1-15 años)162, pero un 5% se vuelven hipertiroideos cada año, siendo más frecuente en nódulos que miden más de 3 cm en el momento del diagnóstico y especialmente en ancianos162,163, y requerirán actuaciones terapéuticas específicas.
La exposición detallada de las peculiaridades del tratamiento médico en el contexto del bocio multinodular (radioyodo, cirugía, etc.) y de los bocios tóxicos uni o multinodulares (antitiroideos, radioyodo, esclerosis con etanol, cirugía, etc.) excede de los propósitos de esta revisión.
Indicaciones quirúrgicas
La indicación quirúrgica en los pacientes portadores de nódulos tiroideos debe ser sentada conjuntamente entre cirujanos y endocrinólogos. Las bases para sentar la indicación quirúrgica son los factores de riesgo clínico y la PAAF. Aunque la citología es de una enorme ayuda diagnóstica, los hallazgos clínicos siguen siendo los más importantes y pueden llevar al cirujano a intervenir, con independencia de los hallazgos citológicos. Los síntomas compresivos tambien justifican la intervención, siendo de utilidad en estos casos la TAC, la RMN y los estudios de función respiratoria.
Nosotros indicamos intervención en los nódulos incluidos en los criterios citológicos del Hospital de Karolinska en los grupos II (sospechosas, con proliferación folicular con abundante celularidad y escasa o nula cantidad de coloide) y III (aspirados definitivos de citología maligna); nódulos benignos con clínica y radiología de compromiso de espacio como compresión de órganos vecinos o prolongación intratorácica; nódulos hiperfuncionantes, si no modifica el tamaño tras la terapia supresora, si existe riesgo de osteoporosis y/o enfermedad cardíaca y si el tamaño es mayor de 3 cm; y, en general, en nódulos extratiroideos con PAAF de quiste tirogloso o branquial, sexo varón con edad inferior a 20 años, consistencia dura, tamaño superior a 4 cm o, de forma relativa, si el paciente solicita la intervención.
Cirugía tiroidea por enfermedad nodular
Al igual que el resto de la cirugía endocrina, la cirugía tiroidea requiere el abordaje por un equipo multidisciplinario y en particular anestesistas y cirujanos especialmente entrenados en esta enfermedad. En el preoperatorio deben tenerse en cuenta una serie de factores, como la valoración de la movilidad de la columna cervical que permita prever dificultades de última hora, la valoración del tracto aerodigestivo superior (laringoscopia indirecta), revisando especialmente la situación de las cuerdas vocales, presencia de tiroides ectópico o posibles problemas de intubación o quirúrgicos por invasión de estructuras adyacentes por una posible neoplasia, recurriendo si es preciso a estudio gastroduodenal baritado, fibrobroncoscopia, endoscopia, etc. Del mismo modo, puede ser necesario realizar una arteriografía en casos en que por el resto de datos se sospeche tiroides intratorácico primario, para delimitar adecuadamente el origen de su vascularización. No debe olvidarse tampoco la adecuada corrección del hiper o hipotiroidismo que pudiera presentar el paciente. Es conveniente también incluir en el estudio preoperatorio al menos una determinación de calcio, para valorar una posible enfermedad paratiroidea asociada, pues ésta existe en un 0,43% de los pacientes con afección tiroidea frente al 0,1% de enfermedad paratiroidea aislada que aparece en la población general164.
Una vez en el acto quirúrgico, inicialmente y tras conseguir una adecuada exposición, se examina el lado ipsolateral a la vez que el nódulo, prestando especial atención a sus características y a la localización de posibles adenopatías. Debe asimismo palparse el lado contralateral para descartar posibles nódulos no descubiertos con anterioridad. Si el nódulo es realmente único, debe practicarse una lobectomía total, incluyendo en bloque el istmo y el lóbulo piramidal y respetando las paratiroides, el nervio laríngeo superior y el nervio recurrente, siguiendo las precauciones genéricas a adoptar en toda cirugía tiroidea. Esta actuación asegura el examen histológico completo de la lesión sin riesgo de diseminación tumoral. Es preferible dedicar un poco más de tiempo a realizar una lobectomía total que una reintervención para eliminar el remanente ipsolateral, por los menores riesgos que conlleva.
El estudio histológico por sección por congelación de la pieza puede confirmar el diagnóstico preoperatorio y ayudar en la decisión de la cirugía definitiva, con un 70-95% de aciertos según las series, aunque hay autores que sólo la consideran necesaria en los casos en que la PAAF no fuese concluyente138,165,169. En un 5% de los casos, la histología definitiva difiere de la obtenida en la biopsia por congelación, siendo esto más frecuente en los casos de carcinoma folicular. Si se confirma una enfermedad benigna, no se requiere más resección salvo que exista una enfermedad multinodular contralateral significativa y se debe entonces realizar lobectomía contralateral subtotal o total, según los autores170. En el caso de tumor papilar o folicular se debe realizar una tiroidectomía total y el vaciamiento ganglionar adecuado, no pareciendo necesaria la exéresis formal en bloque de estos ganglios.
El problema aparece cuando se trata de una lesión folicular que requiere estudio histológico con inclusión en parafina para evidenciar con certeza la invasión capsular. Si ésta no se aprecia con certeza en el examen de la pieza congelada o existen discordancias entre éste y la PAAF, es preferible esperar el estudio definitivo y reintervenir en caso de ser necesario sobre un territorio virgen. Un carcinoma folicular mínimamente invasivo puede tratarse de forma suficiente con una lobectomía según algunos autores. Con este abordaje conservador, el riesgo de realizar una intervención menor de la necesaria es menor del 6%171 y se evitan los riesgos de una cirugía tiroidea innecesariamente extensa. Si es preciso, se puede realizar una tiroidectomía "de totalización" con suficiente seguridad en manos expertas172.
Con una técnica cuidadosa, en pacientes seleccionados y con las precauciones adecuadas, la cirugía de los nódulos tiroideos podría llevarse a cabo con criterios de corta estancia173,174.
Conclusión
Los nódulos tiroideos son una enfermedad frecuente, especialmente si se consideran datos ecográficos, con predominio en mujeres adultas. Aunque el riesgo de malignidad es bajo en general, es preciso distinguir estos casos para su selección quirúrgica, evitando tiroidectomías innecesarias en pacientes con procesos benignos. Los factores patogénicos son complejos y los avances en su estudio permitirán un conocimiento mayor del proceso y un diagnóstico y tratamiento más adecuado de estos pacientes. La prueba diagnóstica de elección es la PAAF, fácil de realizar y altamente fiable en manos expertas, pero se sigue investigando para mejorar su rendimiento. No obstante, no se debe olvidar que es sólo una prueba complementaria y que serán la clínica y el buen juicio de endocrinólogos y cirujanos, haciendo uso de los demás medios diagnósticos que sean necesarios según los casos, los que establezcan las pautas terapéuticas más adecuadas para cada caso concreto.