Introducción
Desde la introducción de la biopsia selectiva del ganglio centinela (BSGC) en el tratamiento del cáncer de mama en estadios precoces, con el objetivo de determinar el pronóstico y el estadio de la enfermedad1, la realización sistemática de la linfadenectomía completa se ha abandonado2, y queda reservada a las pacientes en las que el ganglio centinela es positivo o no se localiza. A la espera de los resultados de los grandes estudios aleatorizados que comparen la BSGC y la linfadenectomía sistemática3, a efectos de control local de la enfermedad y supervivencia a largo plazo, múltiples publicaciones muestran ya la eficacia de la técnica en su aplicación clínica, con tasas de recurrencia, por el momento, inferiores a las que existían cuando se realizaba el vaciamiento axilar sistemático4. Esta última observación podría indicar incluso una mejora en el control local de la enfermedad, que ha de ser al menos equiparable al que se conseguía con la linfadenectomía.
Sigue existiendo una amplia diversidad en la metodología con la que se realiza la BSGC en las neoplasias mamarias. Aún hay muchas opiniones enfrentadas en cuanto al radiocoloide idóneo, la vía óptima de inyección, las indicaciones, los criterios de exclusión, el uso de colorantes, la intervención quirúrgica de la cadena mamaria interna, la importancia de las micrometástasis, etc.
Tras validar nuestro propio procedimiento5, los objetivos de este estudio han sido, por una parte, comprobar si mantenemos similar eficacia y seguridad con la técnica, una vez que la BSGC se aplica en fase terapéutica, y por otra parte, evaluar la aparición de enfermedad relacionada con el cáncer de mama en el seguimiento de las pacientes.
Pacientes y método
Pacientes
El grupo de estudio incluyó 169 lesiones malignas de mama (estadios I y II), halladas en 168 mujeres (una con cáncer bilateral), con una media de edad de 55,6 (rango, 29-80) años. Estas pacientes fueron remitidas durante el período febrero de 2003-febrero de 2007 a la unidad de mama, donde se realizó el diagnóstico prequirúrgico de carcinoma invasivo, mediante punción-citología o biopsia con aguja gruesa. El tumor se localizaba en la mama derecha en 78 (46%) de los 169 casos, y en la izquierda, en 91 (54%) casos. En 90 (53%) casos la lesión era palpable, y en 79 (47%), no lo era.
Se excluyó a las pacientes con axila clínicamente positiva, tratamiento neoadyuvante previo, tumor mayor de 3 cm, carcinoma inflamatorio y carcinoma multicéntrico.
Procedimiento BSGC
Se realizó siempre linfogammagrafía durante la mañana anterior a la intervención quirúrgica; se administró 74-111 MBq de 99mTc marcado con una partícula coloidal de estaño de 50-600 nm (Hepatate®, GE Healthcare), preparada con alta concentración específica (volumen de dilución, 4 ml). Se administraron 0,5-1 ml en los casos en que se practicó inyección intratumoral con control ecográfico (21 lesiones) y 2 ml cuando se realizó periareolar (131 lesiones). En 17 ocasiones la administración del radiocoloide fue combinada, o bien se realizó reinyección periareolar tras intratumoral fallida, sin migración gammagráfica. Se añadió siempre un ligero masaje después de la inyección. Se empleó una cámara Elscint Apex SPX-4 para la adquisición a los 30 min, 120 min y, en caso de ser necesario, 180 min. Las imágenes se registraron en proyecciones anterior u oblicua anterior y lateral, con la paciente en pie y/o en decúbito supino: esta última siempre fue de elección para la marcación cutánea, con la intención de reproducir lo más fielmente posible la postura en la mesa quirúrgica.
Durante la intervención quirúrgica se empleó la sonda detectora de rayos gamma (Europrobe®, Nucliber) para identificar el ganglio centinela. Se consideró ganglio centinela el de mayor actividad y cualquier otro cuyo recuento fuera al menos el 10% de aquél. Tras su exéresis y comprobación ex vivo, se procedió al rastreo residual del lecho quirúrgico, que también se palpó con detenimiento. Ocasionalmente, se extirpó alguna otra adenopatía que se consideró sospechosa, bien por su tamaño, bien por un recuento límite, y que no se consideró falso negativo de la técnica. Las pacientes con ganglio centinela positivo o no localizado fueron sometidas a linfadenectomía axilar. No se practicó tratamiento quirúrgico de la cadena mamaria interna en ningún caso, por consenso del comité de mama. Tampoco se utilizaron colorantes para la detección quirúrgica.
Para el exámen intraoperatorio de los ganglios centinela de más de 1 cm se practicó estudio por congelación y raspado citológico; para los de tamaño inferior a 1 cm se realizó raspado para citología. El análisis definitivo incluyó cortes cada 0,2 cm para hematoxilina-eosina e inmunohistoquímica: EMA y CK-7.
Seguimiento
Una vez finalizado el procedimiento quirúrgico, y con los resultados definitivos de anatomía patológica, el comité de mama decidió el tratamiento adyuvante: radioterapia externa en los casos de cirugía conservadora, quimioterapia u hormonoterapia según criterios convencionales.
Se sigue controlando a todas las pacientes en la unidad de mama, incluido examen clínico (palpación axilar) cada 6 meses durante los primeros 3 años y anual, posteriormente, así como mamografía cada 12 meses.
Análisis estadístico
Se realiza un análisis descriptivo de los resultados de la muestra. Las variables cuantitativas se expresan como media y rango.
Resultados
La extirpación del tumor primario se llevó a cabo mediante cirugía conservadora en 131 (77,5%) pacientes. Se realizó mastectomía simple en las 38 (22,5%) restantes, debido a que presentaban multifocalidad o márgenes escasos en la tumorectomía, o porque se trataba de una mama de pequeño tamaño o bien por elección voluntaria de este procedimiento por la paciente. El diagnóstico final fue de carcinoma ductal infiltrante en 147 casos, carcinoma lobulillar infiltrante en 11, mixto en 1 y carcinoma intraductal (extenso o microinfiltrativo) en 10. El tamaño definitivo de la lesión primaria estaba comprendido entre 0,5 y 3,5 (media, 1,4) cm.
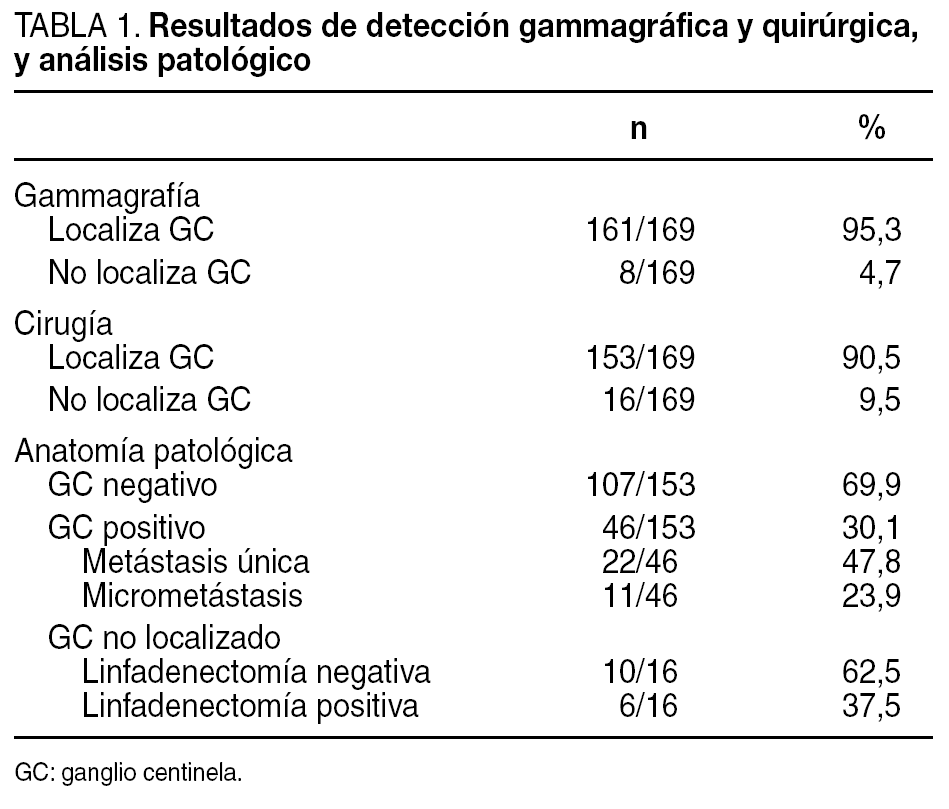
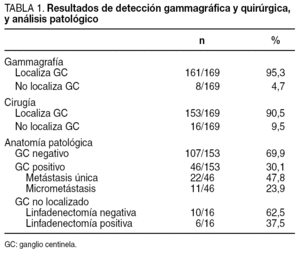
La linfogammagrafía identificó al menos un ganglio centinela (GC) en 161 (95,3%) de los 169 casos. Observamos migración a axila homolateral en 160 pacientes y a cadena mamaria interna en 12 (7,4%), sólo una paciente sin GC axilar simultáneo. La gammagrafía fue negativa en 8 (4,7%) de las 169 pacientes (tabla 1). La eficacia de la detección quirúrgica axilar del GC fue del 90,5% (153/169), y se había identificado el ganglio en la imagen gammagráfica previa en 151 casos. Se extirpó 1,1 GC por paciente (rango, 1-4). No se consiguió, por tanto, la exéresis quirúrgica del GC en 16 (9,5%) de los 169 casos; en 6 la gammagrafía tampoco había sido diagnóstica, mientras que en 10 hubo visualización previa del GC (tabla 2).
El GC fue negativo para metástasis en 107 (69,9%) de los 153 casos localizados, con lo que ahí terminaba el procedimiento quirúrgico de las pacientes (tabla 1). En el 30,1% (46/153) restante, el GC resultó infiltrado, por lo que se realizó vaciamiento axilar, que no mostró otros ganglios afectados en 22 (47,8%). El 23,9% (11/46) de los GC positivos presentaban sólo micrometástasis, lo cual supuso la reestadificación del 9,3% (11/118) de las pacientes; en ninguna de ellas el vaciamiento mostró otros ganglios patológicos.
La linfadenectomía realizada en los 16 casos en los que no se pudo identificar el GC objetivó metástasis axilares en 6, mientras que en los 10 restantes todos los ganglios extirpados fueron normales (tabla 1).
Si comparamos la detección gammagráfica y quirúrgica con el análisis histopatológico del GC o bien de la axila en los casos no localizados (tabla 2), observamos que fueron negativos para metástasis el 70,2% de los GC identificados tanto en la linfogammagrafía como en la cirugía. Por el contrario, en 4 (66,7%) de los 6 casos en los que no se localizó el GC por gammagrafía o en el acto quirúrgico, el vaciamiento axilar obtuvo ganglios positivos. Sin embargo, sólo en 2 (20%) de las 10 pacientes en las que no se halló en la cirugía un ganglio previamente marcado, se encontraron metástasis en la axila.
El seguimiento medio de las pacientes incluidas en nuestra serie es de 20,4 (rango, 3-49) meses, sin que por el momento haya aparecido ninguna recidiva clínica axilar. Por tanto, tampoco se han objetivado casos falsos negativos (FN) entre las pacientes con GC negativo.
Si consideramos la población total de estudio, la tasa de enfermedad recurrente en el momento actual es del 2,3% (4/168). Sólo una paciente con GC normal ha presentado enfermedad posterior; se trata de una mujer de 51 años con un carcinoma ductal in situ de 1,5 cm, con microinfiltración, que ha desarrollado metástasis en el cerebro y el canal medular, sin que se haya demostrado recurrencia mamaria ni ganglionar. Los otros 3 casos corresponden a pacientes con carcinoma ductal infiltrante y afección axilar; en una no se halló el GC y el vaciamiento demostró varios ganglios positivos (3/8), en la segunda el GC estaba infiltrado, como casi todos los ganglios axilares resecados (8/9), y en la última se halló una micrometástasis en el GC, único afectado. Las dos primeras han desarrollado posteriormente metástasis óseas, y la tercera, múltiple afección hepática, cerebral, pulmonar y cutánea. Sólo en la segunda paciente se pudo constatar una recidiva mamaria concomitante; además es la única fallecida de todo el grupo.
Discusión
El factor pronóstico más importante en el cáncer de mama temprano es el estado de los ganglios axilares. Después de una experiencia de casi 15 años desde la introducción de la BSGC para la estadificación inicial del cáncer de mama1, la seguridad del procedimiento parece avalada por los buenos resultados de múltiples grupos y por un único estudio aleatorizado que ha comparado el vaciamiento axilar convencional y el realizado sólo en los casos con GC positivo6, y que ha sido recientemente actualizado7. A la espera aún de los largos ensayos de supervivencia, que comparen la BSGC con la cirugía axilar tradicional3, esta técnica ha reemplazado a la linfadenectomía sistemática en el manejo quirúrgico inicial del cáncer de mama temprano, con la intención de lograr una correcta estadificación, y para establecer el pronóstico, así como la terapia adyuvante indicada.
Las múltiples publicaciones, revisiones bibliográficas8,9, recomendaciones de asociaciones profesionales y reuniones de consenso10 no han conseguido una uniformidad metodológica. De hecho persiste un amplio abanico de procedimientos que se consideran aceptables siempre que ofrezcan buenos resultados en su fase de validación, sobre todo en cuanto a eficacia técnica y tasa de FN, que deben mantenerse en la aplicación clínica de la BSGC. Continúan vigentes muchos aspectos controvertidos, sobre todo la elección de la vía óptima de inyección11-17, el tipo de radiocoloide18, la intervención de cadenas linfáticas extraaxilares19, la inclusión de pacientes con cirugía mamaria previa20 o tras tratamiento neoadyuvante21,22, etc.
En nuestro caso, la eficacia de la linfogammagrafía para identificar el GC ha experimentado una notable mejoría, en comparación con la fase inicial de validación5; se logró la visualización del GC en el 95,3% de las pacientes. Nos parece un buen resultado, si tenemos en cuenta que empleamos una partícula coloidal de tamaño relativamente grande y además hemos realizado en algunas pacientes inyección intratumoral, generalmente con la intención de practicar simultáneamente cirugía radiodirigida de la lesión primaria23. Como sabemos, ambos factores suelen aportar tasas de detección inferiores que la inyección superficial de pequeñas partículas nanocoloidales, más ampliamente difundidas18,24. Probablemente la mayor experiencia adquirida, así como la introducción progresiva de distintas mejoras para depurar la técnica, ha contribuido a este progreso en la eficacia de detección gammagráfica. Entre ellas cabe destacar la preparación del radiotrazador con bajo volumen de dilución, que implica alta concentración específica del coloide25 o la adquisición de distintas imágenes que facilitan la localización del GC. Por ejemplo, la proyección lateral y la oblicua anterior en decúbito permiten no sólo la aproximación del detector a la axila, sino también la máxima distancia entre el GC axilar y los puntos de inyección, lo cual evita artefactos por solapamiento. Además, en algunas pacientes realizamos inyección periareolar, "de refuerzo", tras una primera administración profunda dudosa o fallida26,27.
El porcentaje de migración a mamaria interna ha sido del 7,5%, inferior que el de la mayoría de las series publicadas19. Seguramente, este aspecto está relacionado con el uso de la vía de inyección subdérmica periareolar en la mayoría de las pacientes, que se eligió con la intención fundamental de evitar linfadenectomías axilares innecesarias13, y con el respaldo del comité de mama, que asumió una probable subestimación de los drenajes extraaxilares28, cuya relevancia real e impacto clínico nos parecen discutibles29.
En lo que se refiere a la eficacia quirúrgica, es ligeramente superior a la que obtuvimos en la etapa previa de validación, considerando en aquélla sólo la detección radiodirigida, sin el empleo del colorante. Se consiguió la exéresis de uno o más GC en el 90,5% (153/169) de los casos. Casi la totalidad de los GC extirpados se los había visualizado en la imagen previa, lo cual facilitó considerablemente su detección intraoperatoria30. Esto nos lleva a pensar que la realización de linfogammagrafía prequirúrgica es imprescindible, como señalan muchos autores9 y parece indiscutible en la actualidad10.
La afectación tumoral axilar suele relacionarse con la ausencia de detección gammagráfica y quirúrgica del GC30, debido a la ocupación de los canales linfáticos31. En nuestro caso, sólo se hallaron metástasis axilares en 6 de las 16 pacientes en las que durante la cirugía no se halló el GC. En las otras 10 en las que no se localizó el GC en el acto quirúrgico, la linfadenectomía no mostró afectación tumoral, es decir, habría sido innecesaria18; además en 8 de ellas la gammagrafía previa sí había identificado el GC: en total, en 10 pacientes no se localizó en el acto quirúrgico un GC previamente visualizado, lo cual explica la diferencia entre los porcentajes de detección gammagráfica y quirúrgica. En nuestra opinión, el factor más relacionado con el fracaso en la identificación intraoperatoria de un GC marcado no fueron las metástasis axilares (2/10 casos), sino la propia secuencia temporal de la técnica. Al realizar el procedimiento en 2 días, quizá sea insuficiente la actividad detectable en el GC 16-20 h después de la inyección18,28, teniendo en cuenta el decay del radioisótopo32, y a pesar de haber empleado dosis relativamente altas. Nos parece menos probable que exista un "lavado" efectivo de la partícula, teniendo en cuenta su tamaño. Otra causa puede ser que haya demasiado scatter o radiación de fondo en el lecho axilar que impidan la detección de un ganglio marcado32, aunque la inyección periareolar pretende evitar este inconveniente en el caso de tumores en cuadrantes externos. No creemos que haya influido la incorporación de cirujanos en formación, ya que en nuestro grupo fue siempre con supervisión24.
En cuanto a los casos localizados, el GC fue negativo para metástasis en el 69,9% (107) y positivo en el 30,1% (46). Se mantienen, por tanto, los porcentajes que obtuvimos previamente y que se esperan en un grupo de pacientes con cáncer de mama en estadios I y II. Probablemente este dato en sí mismo sustenta que la técnica sigue siendo correctamente aplicada.
Las pacientes con GC infiltrado se sometieron a vaciamiento axilar, que no halló afectación de otros ganglios en el 47,8% (22/46), también congruente con los estadios de enfermedad incluidos33. El GC presentó únicamente micrometástasis en el 23,9% (11/46), lo que supuso la reestadificación de un número no despreciable de pacientes (9,3%); en ninguna de ellas se demostró afectación de otros ganglios. Persiste el debate sobre la necesidad de linfadenectomía axilar en estos casos que puede llevar a un sobretratamiento de las pacientes34, ya que la relevancia real de las micrometástasis se pone en duda actualmente35,36, y se está evaluando de hecho en varios ensayos en marcha. Incluso se han publicado series de pacientes con GC positivo no sometidas a linfadenectomía, en las que la tasa de recurrencia no es superior a la observada en los casos con GC negativo37-39. El interés se centra ahora en definir factores de riesgo que permitan identificar a las pacientes con mayor probabilidad de afectación de ganglios no centinela; entre dichos factores se encuentra precisamente el tamaño de la metástasis del GC40-42.
Lo más interesante de nuestro estudio es el seguimiento del grupo de 107 pacientes con GC negativo en las que se puede determinar el verdadero impacto clínico de la técnica, ya que se les ha evitado un vaciamiento axilar innecesario. Del mismo modo que en la etapa previa de validación5, en la serie actual no ha aparecido ningún FN clínicamente demostrable38. De hecho, no hemos observado hasta el momento ninguna recurrencia axilar en todo el grupo de 168 pacientes, como han comunicado otros autores24, y a pesar de que el seguimiento es aún relativamente corto, 20 meses de promedio.
La tasa de FN31,33 probablemente es el factor más importante a la hora de valorar la seguridad de la BSGC, ya que supone un fracaso del procedimiento que puede conducir a establecer un incorrecto estadio de la enfermedad, no realizar el tratamiento adecuado y consecuente recaída axilar o FN clínico8. La tasa de recurrencia axilar desde que se realiza la BSGC31,34,37,39,43,44, según la literatura médica, es del 0-0,8%, y es por tanto inferior que la que presenta la linfadenectomía convencional4,8,37,39, que se sitúa en el 2-3%. Probablemente esa diferencia se explica porque la BSGC se aplica a una población de bajo riesgo, por la eficacia de los tratamientos adyuvantes y porque la evaluación más exhaustiva de un único ganglio permite identificar afectación microscópica, con el consiguiente cambio del estadio33 y de la terapia posterior.
Más aún, amplias casuísticas demuestran que la tasa de recurrencia axilar tras BSGC es también sensiblemente menor que la esperada si se aplican los porcentajes de FN que se obtuvieron durante la fase de validación34. Este hecho parece demostrar el valor de la experiencia adquirida durante la etapa de aprendizaje4,44, e indica una probable mejora en el control local de la enfermedad, que puede estar relacionada con la efectividad de los tratamientos adyuvantes24,34,44. Además pone en cuestión la relevancia real de la enfermedad subclínica33, ya que quizá no todos los pacientes con ganglios positivos no extirpados desarrollarán metástasis clínicas, y probablemente es un error asumir que la ausencia de enfermedad clínica equivale a ganglios libres de enfermedad24. Quizá esta menor incidencia de recurrencias desde la aplicación de la BSGC por el momento sólo se debe a un seguimiento corto24,33,44, a pesar de que la mayoría de las recidivas axilares suceden en los primeros 2 años tras la cirugía, y grupos con seguimientos más largos mantienen similares resultados7,37,39.
Creemos que en nuestro caso el examen minucioso del lecho, con la consiguiente exéresis de cualquier ganglio dudoso, ha podido contribuir a que no hubiera recidivas locales8,31, así como la cuidada aplicación de los criterios de exclusión de los pacientes y el exhaustivo análisis anatomopatológico de los ganglios45, como ya sucediera en la fase previa de validación5.
En el seguimiento de todas las mujeres incluidas en este estudio sólo ha aparecido enfermedad relacionada con el cáncer de mama en 4, tasa (2,3%) similar a lo que se recoge en la literatura34,43. Nos parece interesante señalar que una de esas mujeres presentó un carcinoma in situ con microinfiltración y GC negativo; posteriormente desarrolló una metástasis cerebral y otra en canal medular, en ausencia de recidiva mamaria o axilar. En este caso nos cuestionamos la supuesta escasa agresividad de este tipo de tumores, en los que el tratamiento locorregional se considera prácticamente curativo.
Las otras 3 pacientes presentaban un carcinoma ductal infiltrante, con GC positivo en 2 de ellas (uno por micrometástasis) y GC no localizado en la tercera, en la que se extirparon múltiples ganglios afectados en el vaciamiento axilar. La paciente con micrometástasis actualmente presenta enfermedad a distancia multiorgánica; las otras dos desarrollaron metástasis óseas, una con recidiva mamaria concomitante, posteriormente, falleció.
En conclusión, estimamos que la BSGC sigue siendo realizada con precisión y eficacia, una vez instaurada como técnica sistemática en nuestro medio, y mantiene, al menos por el momento, el control local de la enfermedad. Además es un procedimiento factible aunque el servicio de medicina nuclear sea externo, como en nuestro caso46,47.
Correspondencia: Dra. I. Blanco Saiz.
Clínica de Medicina Nuclear Géminis.
Carlos Marx, 22, bajo. 33207 Gijón. Asturias. España.
Correo electrónico: isablanco15@hotmail.com
Manuscrito recibido el 5-6-2007 y aceptado el 29-8-2007.