El pie de Charcot (PC) consiste en un progresivo deterioro de los huesos y articulaciones, sobre todo en pacientes diabéticos afectos de neuropatía grave. El gran problema es que se puede confundir con otros procesos, retrasando el diagnóstico y tratamiento adecuados. El objetivo es analizar los casos de PC diagnosticados en nuestro hospital y, sobre todo, resaltar el papel del cirujano general.
Material y métodosEstudio retrospectivo donde se registran los casos diagnosticados de PC entre la población diabética de nuestro Departamento de Salud y se hace una revisión de la literatura.
ResultadosDesde 2008 hasta 2012 se han diagnosticado 7 casos de PC (prevalencia de 1:710). Dos de los pacientes fueron diagnosticados erróneamente de celulitis. El tiempo medio de demora en el diagnóstico ha sido de 10 semanas (mínimo 1, máximo 24). El tratamiento inicial fue inmovilización de la extremidad. Una vez desapareció el edema, se colocó ortesis de descarga según el tipo anatómico de la clasificación de Sanders. La evolución ha sido favorable en 5 pacientes, un paciente precisó amputación transmetatarsiana y otro fue exitus por enfermedad cardíaca aguda.
ConclusionesEl PC es una enfermedad más frecuente de lo que creemos. El cirujano general es el pilar fundamental en el diagnóstico y tratamiento inicial. Ante la presencia de inflamación y edema del pie en un paciente con diabetes y neuropatía severa, una vez descartadas fundamentalmente la celulitis, la osteomielitis y la trombosis venosa profunda (TVP), se debe pensar en una neuroartropatía de Charcot.
The Charcot foot (CF) consists of a progressive deterioration of the bones and joints, most common in diabetic patients with advanced neuropathy. The great problem is that can be confused with other processes, delaying the diagnosis and specific treatment. The aim is to analyze the cases of CF diagnosed in our hospital and especially to highlight the role of the general surgeon.
Material and methodsRetrospective study of all registered cases diagnosed of CF between the diabetic population of our Department of Health. A review of the literature was performed.
ResultsFrom 2008 to 2012, there 7 cases of CF were diagnosed (prevalence 1:710). Two of the patients were diagnosed erroneously of cellulitis. The average time of delay in the diagnosis was 10 weeks (minimum 1, maximum 24). The initial treatment was immobilization of the extremity. Once the edema was eliminated, an offload orthesis was placed according to Sanders's anatomical classification. Evolution was favorable in 5 patients, 1 patient needed amputation, and other one died of acute cardiac pathology.
ConclusionsThe CF is a more frequent pathology than we believe. The general surgeon is the fundamental prop in the diagnosis and initial treatment. Before the presence of inflammation and edema of the foot in a patient with diabetes and severe neuropathy, once cellulitis, osteomyelitis, and TVP are ruled out, Charcot neuroarthropathy should be considered.
La neuroartropatía de Charcot (NC) o el pie de Charcot (PC) consiste en un progresivo deterioro de los huesos y articulaciones, principalmente tobillo y pie, en pacientes afectos de neuropatía grave. La diabetes mellitus (DM) constituye en la actualidad la causa más frecuente de artropatía neuropática1. El gran problema es que se puede confundir con otros procesos, retrasando el diagnóstico y tratamiento adecuados. Todo ello nos animó a realizar un estudio retrospectivo donde se registran los casos diagnosticados de PC entre la población diabética, y a resaltar la gran importancia del papel del cirujano general en la detección precoz y el tratamiento inicial.
Material y métodosSe trata de un estudio retrospectivo donde se registran los casos diagnosticados de PC entre la población diabética de nuestro Departamento de Salud y se hace una revisión de la literatura. Recogimos datos de edad, sexo, antecedentes médicos, tipo de diabetes, antecedentes quirúrgicos y enfermedad previa del pie enfermo, síntomas, tiempo medio de evolución, exploración física, constantes, pruebas complementarias, forma radiológica, clasificación anatómica, tratamiento aplicado, estancia hospitalaria y evolución.
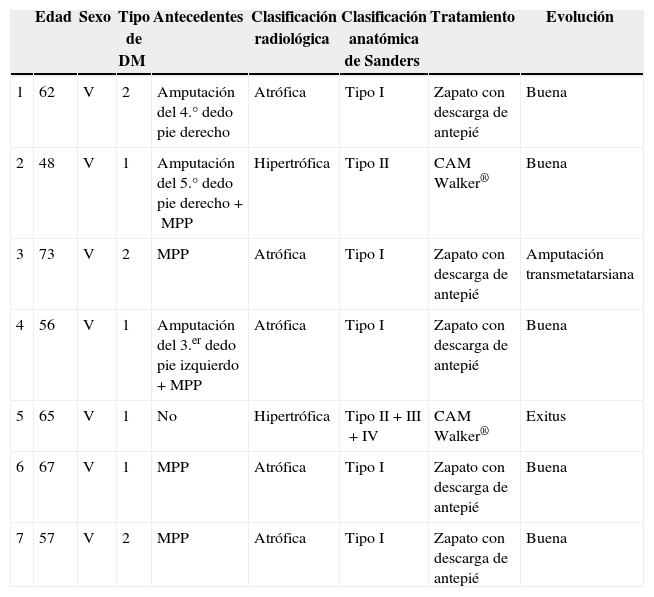
ResultadosDesde enero de 2008 hasta diciembre de 2012, han sido atendidos en el Servicio de Urgencias un total de 4.965 pacientes con el diagnóstico de pie diabético. En este periodo se han diagnosticado 7 casos de PC (tabla 1), lo que supone una prevalencia de 1:710. La edad media de los pacientes fue 61,1 años (mínima 48, máxima 73). En cuanto al sexo el 100% de los pacientes fueron varones. Todos los pacientes padecían DM de más de 10 años de evolución, 4 pacientes tipo I y 3 tipo II. Además, 4 pacientes tenían HTA, EPOC, cardiopatía y dislipidemia. En todos los casos estaba afectado el pie derecho, excepto en un paciente (el pie izquierdo). Tres pacientes tenían antecedentes quirúrgicos de amputación por gangrena de un dedo del pie y 6 de ellos también padecían o habían padecido mal perforante plantar (MPP). El 100% de los pacientes acudió a Urgencias. Los síntomas por los que consultaron todos los pacientes fueron dolor leve y tumefacción del pie. En la exploración clínica, 4 pacientes presentaban edema y eritema del pie. En 3 pacientes se objetivaba además gran deformidad del pie o los dedos junto con MPP. Todos presentaban signos de neuropatía grave en miembros inferiores. Dos de los pacientes ya fueron atendidos en Urgencias un mes antes, siendo diagnosticados erróneamente de celutitis y tratados con antiinflamatorios, antibiótico y reposo de la extremidad. El tiempo medio de demora en el diagnóstico ha sido de 10 semanas (mínimo 1, máximo 24). A todos los pacientes se les realizó en Urgencias una radiografía simple (Rx) del pie en 2 proyecciones, analítica y toma de constantes. En la analítica, ningún paciente tenía leucocitosis ni neutrofilia, ni tampoco fiebre. Una vez ingresado, se realizaba resonancia magnética (RM) y analítica. Ninguno tenía alterados los parámetros proteína C reactiva ni la velocidad de sedimentación globular. La hemoglobina glucosilada (HbA1c) estaba aumentada en el 100% de pacientes, siendo la media de 10,8% (mínima 7,9%; máxima 13,2%). Se consultó a Endocrinología para ajustar glucemia y a Ortopedia para consensuar el tipo de ortesis. La forma radiológica más frecuente fue la atrófica (5 pacientes) y después la hipertrófica (2 pacientes). La clasificación anatómica se registró según la clasificación de Sanders: 5 pacientes tipo I, un paciente tipo II y un caso que afectaba simultáneamente a las zonas II, III y IV. El tratamiento inicial fue reposo en cama con la extremidad elevada e inmovilización de la extremidad mediante férula de Brown. Para levantarse, el paciente se ayudaba de unas muletas o una silla de ruedas. Una vez disminuyó el edema del pie, se pautó un método de descarga según el tipo anatómico. En los PC tipo I de Sanders se colocó un zapato ortopédico con descarga en el antepié, y para el resto de pacientes (PC tipos II, III o IV de Sanders) una ortesis tipo controlled ankle movement (CAM) Walker®. Para compensar, se colocó en el pie contralateral un zapato adaptado y también una muleta que facilitara la deambulación. La estancia media fue de 14,8 días (mínimo 7, máximo 33). El tiempo medio de seguimiento fue de 30 meses (mínimo 3, máximo 54). En la consulta se realizó exploración física, toma de la temperatura de los pies con termómetro y se solicitaron periódicamente radiografías o RM para confirmar la consolidación ósea de la articulación. La evolución ha sido favorable en 5 pacientes, con consolidación de la articulación y manteniendo la estabilidad del pie con zapatos ortopédicos; un paciente precisó amputación transmetatarsiana por mala evolución y otro fue exitus por enfermedad cardíaca aguda.
Casos de pie de Charcot diagnosticados de enero de 2008 a diciembre de 2012.
| Edad | Sexo | Tipo de DM | Antecedentes | Clasificación radiológica | Clasificación anatómica de Sanders | Tratamiento | Evolución | |
|---|---|---|---|---|---|---|---|---|
| 1 | 62 | V | 2 | Amputación del 4.° dedo pie derecho | Atrófica | Tipo I | Zapato con descarga de antepié | Buena |
| 2 | 48 | V | 1 | Amputación del 5.° dedo pie derecho+MPP | Hipertrófica | Tipo II | CAM Walker® | Buena |
| 3 | 73 | V | 2 | MPP | Atrófica | Tipo I | Zapato con descarga de antepié | Amputación transmetatarsiana |
| 4 | 56 | V | 1 | Amputación del 3.er dedo pie izquierdo+MPP | Atrófica | Tipo I | Zapato con descarga de antepié | Buena |
| 5 | 65 | V | 1 | No | Hipertrófica | Tipo II+III+IV | CAM Walker® | Exitus |
| 6 | 67 | V | 1 | MPP | Atrófica | Tipo I | Zapato con descarga de antepié | Buena |
| 7 | 57 | V | 2 | MPP | Atrófica | Tipo I | Zapato con descarga de antepié | Buena |
DM: diabetes mellitus; MPP: mal perforante plantar; V: varón.
El PC lo describió por primera vez Charcot2 en pacientes con tabes dorsal por neurosífilis, pero la asociación de PC y diabetes la hizo Jordan3, siendo hoy la causa más frecuente, si bien, puede verse en otros procesos neurológicos como siringomielia, lepra, depósito de metales pesados o traumatismo de nervios periféricos4. El pie diabético y sus complicaciones, como el PC, es una enfermedad multidisciplinar que debe ser manejada por diferentes especialistas, pero en la que el cirujano general juega un papel muy importante, ya que cuando el paciente tiene cualquier problema acude la mayoría de las veces a Urgencias, donde es el cirujano general el que valora y debe sospechar el diagnóstico para tratarlo de forma precoz antes de que se produzcan complicaciones irreversibles que conlleven una amputación del miembro. De hecho hay autores que definen el PC como una «urgencia médica»5. Revisando la literatura, nos llamó la atención que las publicaciones de PC se realizan en revistas de diabetes, Reumatología, Rehabilitación, Traumatología, Cirugía Vascular, etcétera, pero en ninguna de Cirugía General. Todo esto nos animó a realizar un estudio retrospectivo de todos los pacientes diagnosticados de PC en nuestro hospital en los últimos 5 años, y sobre todo, a intentar difundirlo en publicaciones de Cirugía General.
Aunque la incidencia y prevalencia del PC es desconocida porque los pacientes son diagnosticados errónea o tardíamente, se estima que afecta a un 0,8-8% de pacientes diabéticos. La incidencia es de 3 a 11,7/1.000 pacientes al año6. De 2008 a 2012 se han diagnosticado en nuestro centro 7 casos, lo que supone una prevalencia de 1/710, aproximado a la literatura. Hasta en un 25% de los casos es bilateral7; en nuestra serie el 100% es unilateral. Es más frecuente en pacientes diabéticos tipo I en la 5.ª-6.ª década de la vida y con DM de más de 10 años de evolución6,7. En nuestro estudio la edad media de los pacientes fue de 61,1 años; 4 padecían DM tipo I y 3 DM tipo II. La patogenia es desconocida pero probablemente sea una combinación de factores traumáticos y vasculares debidos a la neuropatía periférica. Existen 2 hipótesis: neurovascular (francesa) y neurotraumática (alemana) que, aunque difieren en la causa inicial, coinciden en que se producen cambios en la estructura ósea y esto determina una distribución anómala de la carga que favorece la aparición de úlceras, fracturas y callosidades. Recientemente se han involucrado citocinas inflamatorias que estimulan la formación de osteoclastos1,6–9. En cuanto al sexo, no hay diferencias entre hombre y mujer6,10, aunque en nuestra serie todos eran varones. Revisando la literatura, algunos pacientes acudieron a Urgencias4,11, otros a consultas por otro motivo12 y, en la mayoría, no consta10,13–15. Todos nuestros pacientes acudieron a Urgencias, ninguno acudió a consulta, con lo cual todos los pacientes fueron valorados por el cirujano general de guardia.
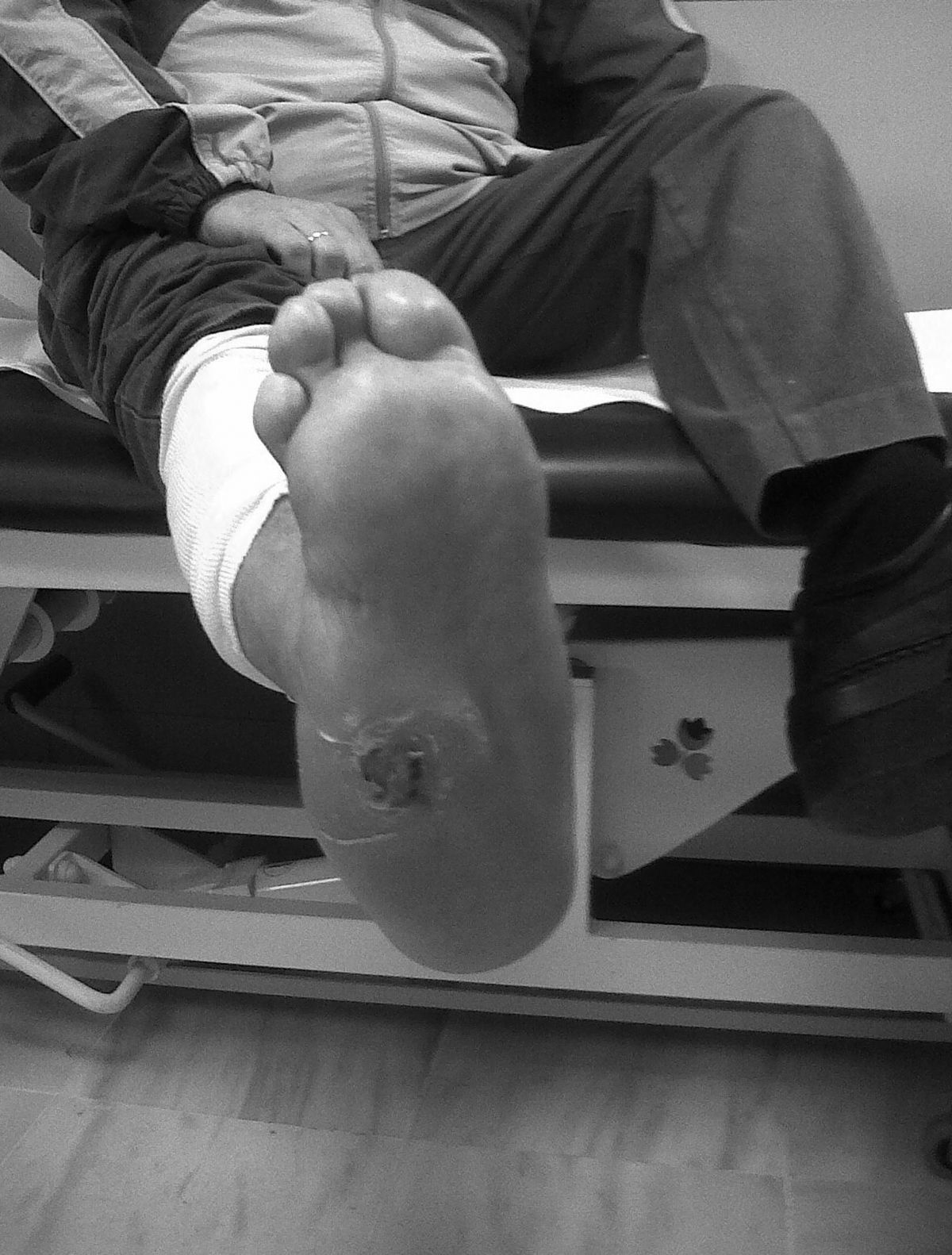
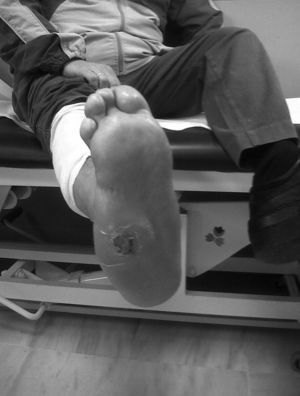
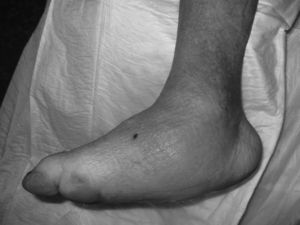
La clínica del PC en fase aguda se caracteriza por «pie caliente», con eritema, edema y dolor leve sobre una base neuropática. La temperatura de la piel está elevada 2-6 grados en comparación con la contralateral4,6,7,16. En la fase crónica el eritema y la temperatura elevada desaparecen y se desarrollan deformidades6. En nuestra serie todos fueron diagnosticados en fase aguda. La sospecha de PC debe establecerse ante un paciente diabético de larga evolución con edema, calor y rubor unilateral del pie, con ausencia o dolor leve y deformidad e inestabilidad de la articulación (fig. 1). Dos de nuestros pacientes fueron diagnosticados erróneamente de celulitis. El tiempo medio de demora en el diagnóstico en nuestra serie ha sido de 10 semanas (mínimo 1, máximo 24). En un estudio de Pakarinen17 el diagnóstico se retrasó una media de 29 semanas.
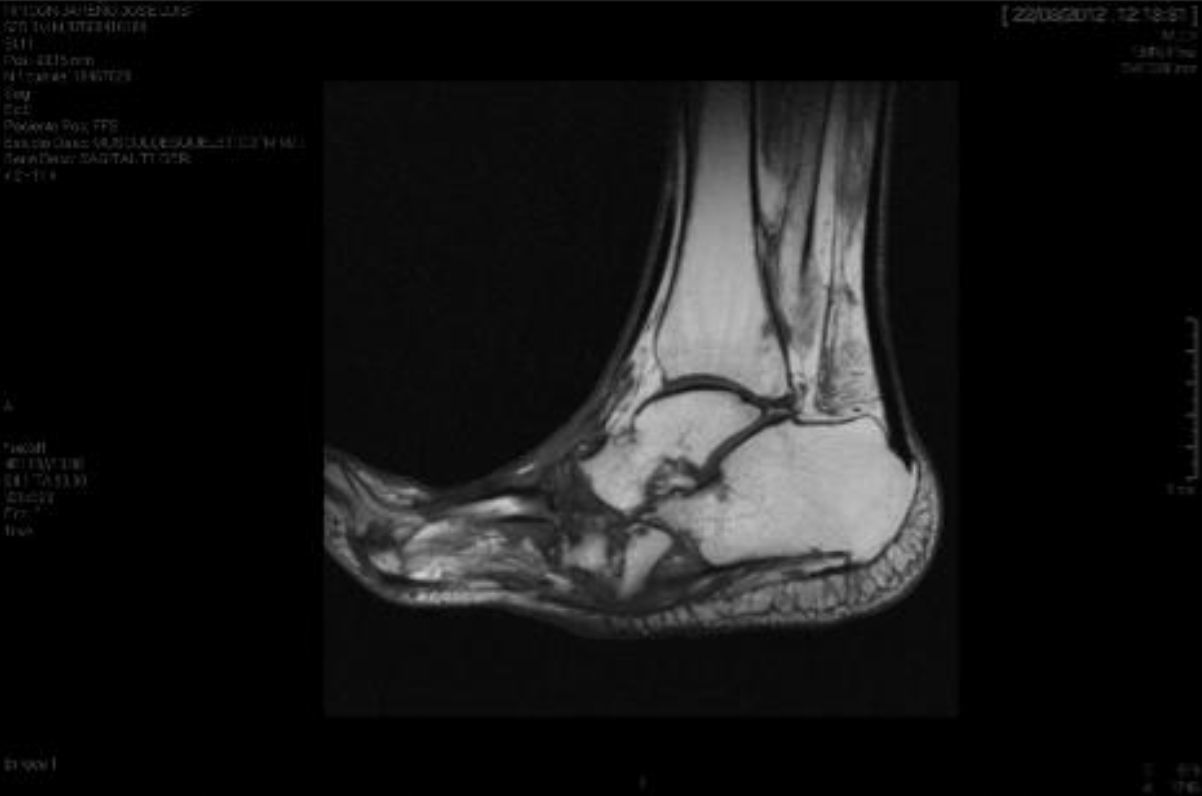
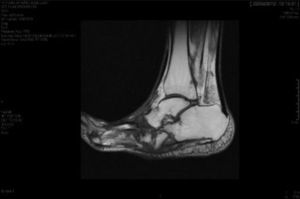
El diagnóstico del PC es fundamentalmente clínico18; debe hacerse un diagnóstico diferencial sobre todo con celulitis, osteomielitis, TVP, gota y artritis4,6,7,11,16. Brodsky4,19,20 describió un procedimiento que consiste en elevar el miembro afecto durante 10 min con el paciente en decúbito; en el caso de un PC desaparece el edema y eritema, en cambio en el proceso infeccioso permanece. Los análisis de laboratorio no son diagnósticos de PC pero pueden ayudar a diferenciarlo de procesos infecciosos11,17. En nuestro estudio todos tenían los leucocitos, la proteína C reactiva y la velocidad de sedimentación globular normales. En fases iniciales, la Rx puede ser normal6,11,21. Conforme la enfermedad progresa van apareciendo hallazgos radiográficos. Los cambios óseos asociados a la neuroartropatía se clasifican radiográficamente en atróficos e hipertróficos. La forma hipertrófica es la más frecuente: ocurre en el mediopié, retropié y tobillo, y se caracteriza por fragmentación, destrucción de articulaciones, luxaciones óseas, fracturas y osteofitos. La forma atrófica no es tan frecuente; se localiza en el antepié y se caracteriza por resorción ósea y pequeñas líneas de fractura. Los metatarsianos presentan una imagen radiográfica que se asemeja a una «punta de lápiz» o «caña de azúcar chupada»6,7,14,20. En nuestros pacientes, la forma atrófica fue la más frecuente (5 casos) y la hipertrófica se dio en 2 pacientes. La RM puede detectar cambios en estadios precoces y es la prueba que cada vez está siendo más utilizada, además es útil para diferenciarla de la osteomielitis6,11. En el PC la lesión ósea generalmente es múltiple, no hay compromiso cortical y la lesión se autolimita. En cambio, en la osteomielitis, es generalmente única, existe compromiso cortical y la lesión no se autolimita22. No existe una prueba diagnóstica definitiva para distinguir la NC de la osteomielitis, sin embargo la gammagrafía ósea de 3 fases con Tc-99m, seguida de In-111 con leucocitos marcados ha mostrado una alta sensibilidad y especificidad6,8. La PET-TAC también es muy fiable para diferenciar el PC de la osteomielitis1,8,11. En nuestro centro tenemos disponible la RM, el resto de las pruebas las tenemos que solicitar al centro hospitalario de referencia, por lo que resulta más dificultoso.
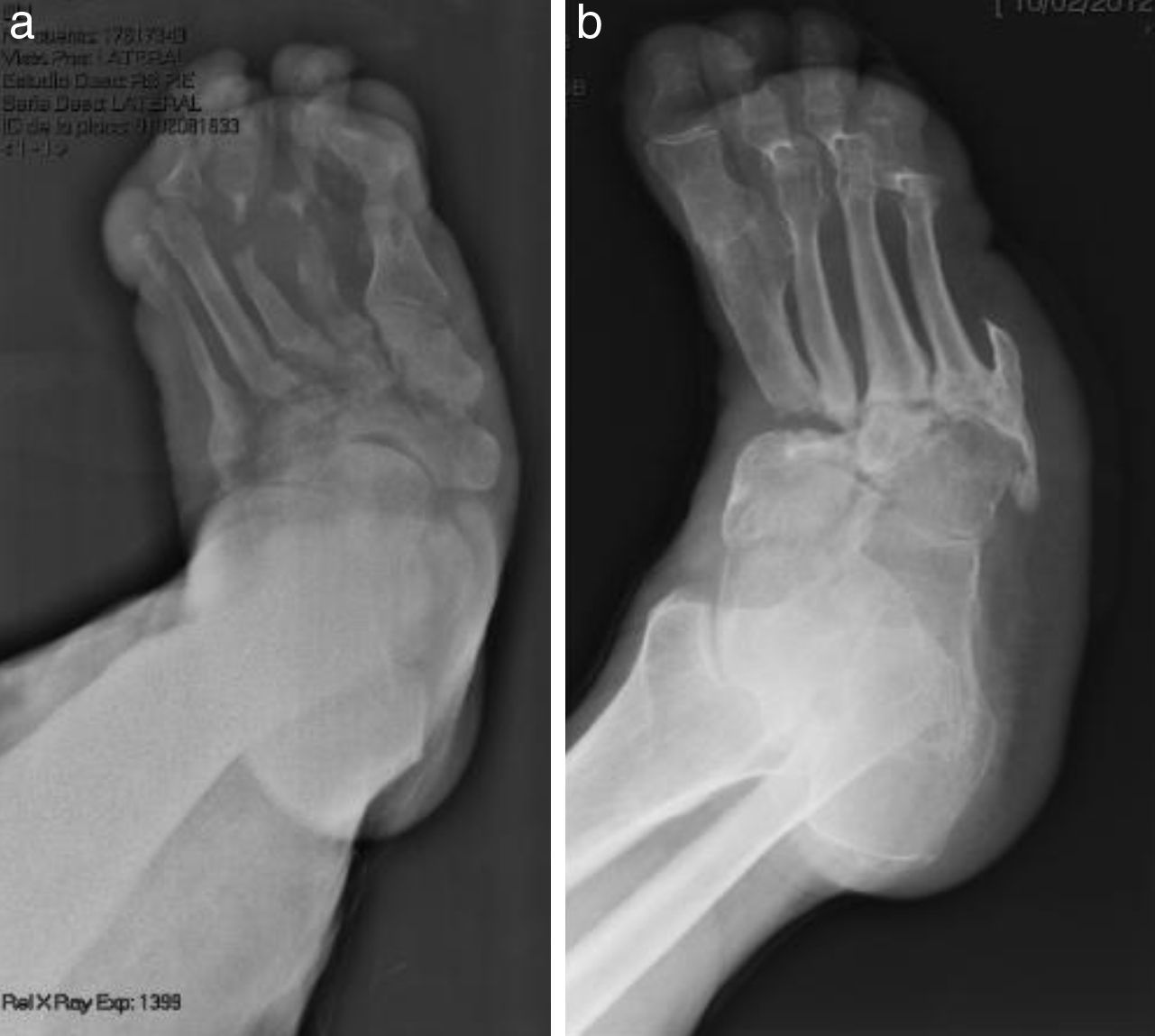
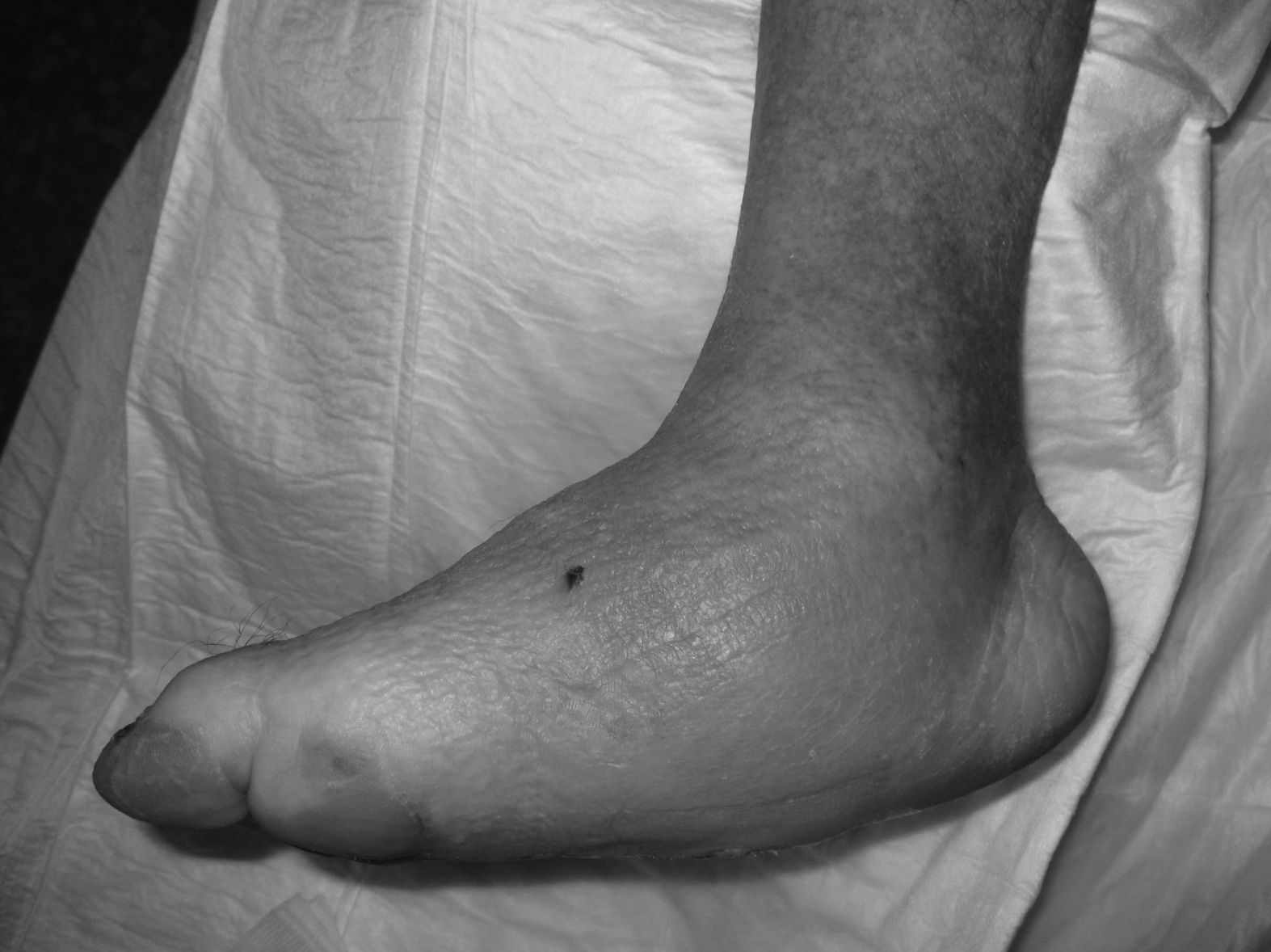
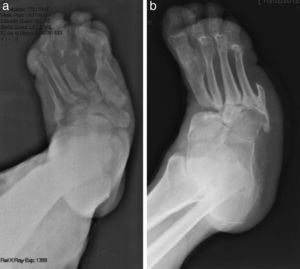
La evolución de la NC sigue por lo general un patrón clínico-radiológico que fue descrito por Eichenholtz en 3 etapas: fragmentación, coalescencia y reconstrucción. Hay una etapa previa (etapa 0) descrita por otros autores11,20,23, que se caracteriza por «pie caliente» con hallazgos radiológicos normales, que pueden confundirse con procesos infecciosos. En la etapa I se produce también «pie caliente», pero en la Rx se objetiva osteopenia, fragmentación periarticular, fracturas y subluxaciones. La etapa II está caracterizada por disminución del edema y el calor, y radiográficamente se observa resorción ósea, fusión de fragmentos óseos y esclerosis. En la etapa III hay ausencia de inflamación y un pie más estable, aunque a menudo deformado; radiológicamente se observan osteofitos, esclerosis subcondral y disminución del espacio articular6,10,11,16,17,20. Todos los pacientes de nuestra serie se diagnosticaron en la etapa I. Sanders y Frikberg24 realizaron una clasificación del PC en función de la zona anatómica afectada: el tipo I afecta al antepié, es decir, a las articulaciones metatarso-falángicas e interfalángicas, y se puede confundir con osteomielitis u osteoartritis (fig. 2A). El tipo II afecta a la articulación de Lisfranc, que es la articulación más frecuentemente afectada en esta enfermedad (fig. 2B). El tipo III afecta a la articulación de Chopart y puede producirse, al igual que el tipo II, el típico «pie en mecedora» por hundimiento del medio pie, el cual puede predisponer a ulceraciones (figs. 3 y 4). El tipo IV afecta al tobillo y el tipo V afecta al calcáneo6,10,17,24,25. En cuanto a nuestros pacientes, el más frecuente fue el tipo I (5 pacientes), un paciente presentó el tipo II y otro tenía afectadas a varias zonas a la vez (tipos II, III y IV).
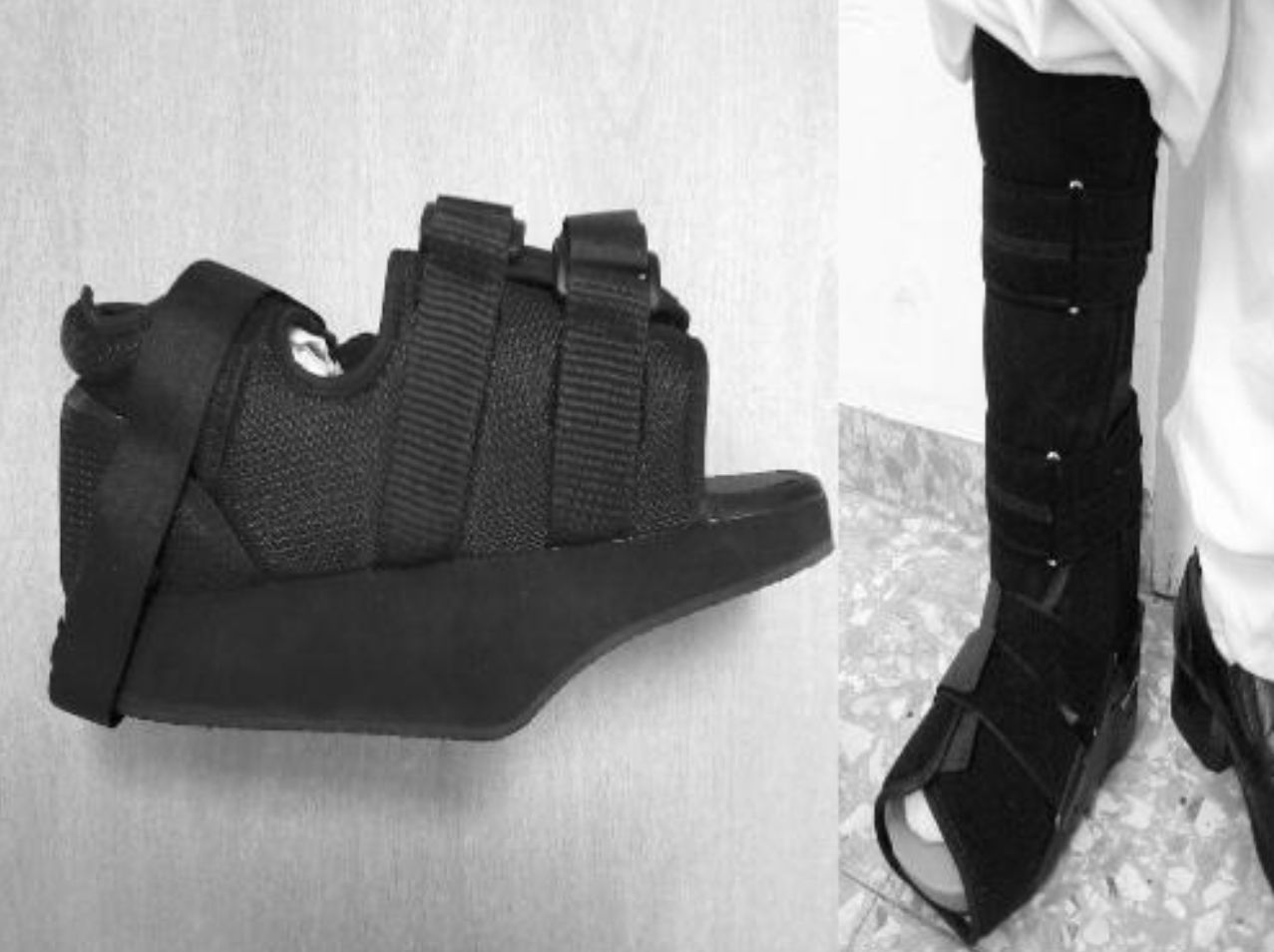
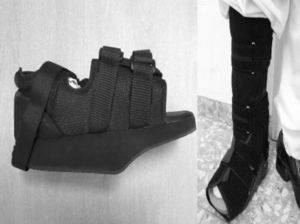
El tratamiento inicial del PC en fase aguda (etapas 0 y I) es la inmovilización y descarga del miembro afectado para evitar que la enfermedad progrese y se produzcan deformidades. El yeso de contacto total (total contact cast [TCC]) es el gold standard para el tratamiento inicial de descarga del pie1,4,6,7,10,11,16,20. Este se irá cambiando conforme vaya disminuyendo el edema de la pierna hasta que desaparezca y se objetiven cambios radiológicos de coalescencia. Una desventaja es que requiere de personal especializado para confeccionarlo y colocarlo, por lo que actualmente se están buscando alternativas como ortesis de descarga neumáticas que permiten mayor movilidad, higiene y su retirada por la noche20. En nuestro centro no se tiene experiencia con el TCC por lo que se optó por reposo de la extremidad en cama con férula de Brown y, una vez disminuía el edema, se colocaba una ortesis de descarga en función del tipo anatómico. En los PC tipo I (5 pacientes), se colocó un zapato ortopédico con descarga en el antepié (fig. 5A), y para el resto de pacientes con PC tipos II, III o IV (2 pacientes) una ortesis tipo CAM (Controlled Ankle Movement) Walker® (fig. 5B). Hay que proteger la extremidad contralateral con muleta o zapato adaptado para que no se resienta la extremidad sana6. Se ha ensayado con bifosfosfonatos intravenosos en la fase aguda: aunque mejora la clínica, no hay beneficio en tiempo de inmovilización total18,26,27. Una vez el paciente se encuentre en la etapa II, se sustituirá el TCC por una ortesis tipo Charcot restraint orthotic walker (CROW) o similar durante un periodo de meses que dependerá de la localización y la extensión de la destrucción. Llegados a la fase III, al paciente se le colocará un zapato ortopédico para la deambulación4,6,10,11,16,20,28. El tratamiento quirúrgico estará indicado cuando exista una afectación de partes blandas, el pie sea inestable, o no sea posible su adecuación al calzado. Hay diversas opciones como exostectomía, sección del tendón de Aquiles y artrodesis. Cuando han fracasado todas las opciones de tratamiento o existen complicaciones, se debe optar por una amputación infracondílea6,10,28,29,30.
ConclusionesEl PC es una enfermedad más frecuente de lo que creemos y debemos estar muy alerta para diagnosticarlo en fases tempranas y evitar fases irreversibles. Dentro del manejo multidisciplinario del PC, el cirujano general es el pilar fundamental en el diagnóstico y tratamiento inicial ya que es este el que la mayoría de las veces «se enfrenta» inicialmente al paciente. Por lo tanto, ante la presencia de inflamación y edema del pie en un paciente con diabetes y neuropatía severa, una vez descartadas fundamentalmente la celulitis, la osteomielitis y la TVP, se debe pensar en una NC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.