Introducción
La recurrencia de hidatidosis hepática (HH) después de la aplicación de diferentes tratamientos alcanza cifras de hasta un 19,4%1-4, por lo que el seguimiento de los pacientes tratados por HH es fundamental. Éste se puede realizar mediante controles clínicos, técnicas de imagen y de inmunodiagnóstico (ID)5, métodos estos últimos, válidos y confiables para la detección de anticuerpos anti Echinococcus granulosus6.
El diagnóstico temprano de una recurrencia puede representar una mejoría considerable en el tratamiento y el pronóstico. Lamentablemente, en la mayoría de los casos, las etapas tempranas de la reinfección, así como de la infección, son asintomáticas, lo que significa que la única forma de acceder a un diagnóstico oportuno es mediante la aplicación de un tamizado o cribado riguroso, a través del tiempo, de las personas que se han tratado de HH.
Para realizar un cribado en este tipo de situaciones, contamos con diversas técnicas de ID, entre las que destacan las determinaciones por inmunoprecipitación DD5 o arco 5.o de Capron, inmunoanálisis como ELISA (enzyme-linked immunosorbent assay) inmunoglobulina (Ig) E, y ELISA-IgG, pruebas de hemaglutinación y la inmunoelectrotransferencia o Western blott5-8.
Sin embargo, el hecho de que la respuesta inmunológica en la hidatidosis sea muy variable, comporta que los resultados obtenidos con ID dependan de una serie de factores, como la técnica de laboratorio utilizada, el estado evolutivo del o los quistes, su localización, el número, etc.5. Esto significa que todas las técnicas de ID disponibles en la actualidad se caracterizan por una precisión imperfecta, con sensibilidades, especificidades y porcentajes de clasificación correcta que en términos generales no superan el 90%7,8. De este modo se entiende que una prueba inmunológica ideal es la que permite detectar con una alta probabilidad de clasificación correcta nuevos casos y recidivas eventuales después de un tratamiento médico o quirúrgico9.
El objetivo de este trabajo ha sido determinar mediante la técnica de ELISA el comportamiento en el tiempo de los valores de IgG e IgE específicas para E. granulosus en individuos intervenidos quirúrgicamente por HH.
Material y método
Diseño
Cohorte concurrente.
Población
Individuos intervenidos quirúrgicamente por HH por el primer autor en el Servicio de Cirugía del Hospital Regional de Temuco (Chile). Se consideró para el estudio a pacientes operados tanto de forma electiva como de urgencia, independiente del número de quistes, tamaño, localización y existencia de complicaciones evolutivas de la enfermedad. Se realizó un muestreo no probabilístico por conveniencia de los pacientes con un seguimiento mínimo de 48 meses y que contase con al menos una determinación anual de ELISA-IgE y ELISA-IgG. Se excluyó a pacientes con: hidatidosis en otra localización, otras lesiones quísticas abdominales, enfermedades hepáticas crónicas o insuficiencia orgánica concomitante.
Protocolo de estudio
Los pacientes que participaron en el estudio forman parte de una cohorte de individuos intervenidos por hidatidosis abdominal a partir de 1995, que cumplen con un protocolo de seguimiento que contempla controles clínicos, bioquímicos, serológicos (ELISA-IgE y ELISA-IgG) y de imagen a los 12, 24, 36, 48 y 60 meses de la intervención quirúrgica10. Se tuvo en cuenta el tiempo cero o basal de cada medición, el momento en que se practicó la cirugía y, por lo tanto, el estándar de referencia para la confirmación diagnóstica de la enfermedad fue el estudio de anatomía patológica de los especímenes quirúrgicos7,8.
Diagnóstico serológico
Las muestras se procesaron en el laboratorio de inmunología del Hospital Regional de Temuco y las determinaciones ulteriores se realizaron del modo siguiente:
Para la determinación de ELISA-IgE, se utilizó como reactivo Rabbit anti-human IgE, diluido en amortiguador fosfato salino (PBS) (3 µl de conjugado + 100 µl de PBS), que se incubó a 4 °C durante 12 h. Se bloqueó la placa con PBS/suero albúmina de bovino (SAB) al 2% (PBS + SAB al 2%) durante 1 h a temperatura ambiente. Se diluyó las muestras con PBS/Tween al 0,05% en proporción de 1:1 (p. ej., 100 ul de suero + 100 ul de PBS/Tween al 0,05%). Se eliminó por centrifugado la solución PBS/SAB al 2% de la placa, y se agregaron 100 µl de las muestras y controles diluidos, lo que se incubó durante 3 h a una temperatura de 37 °C. Se lavó la placa 5 veces con PBS/Tween al 0,05%. Se preparó el conjugado con 1 µl de IgE + 1 ml de PBS/Tween al 0,05%, que se incubó durante 1,5 h a una temperatura de 37 °C. Se lavó la placa 5 veces con PBS/Tween al 0,05%. Se agregaron 100 µl de sustrato (TMB-DAKO) y se incubaron durante 10 min a temperatura ambiente. La reacción se detuvo con 100 µl de H2SO4 al 1 normal. Finalmente, se leyó la coloración en un lector de ELISA a 450 nm.
Para la determinación de ELISA-IgG, se preparó el antígeno IgG en un buffer coating (para 100 ml de amortiguador se mezclaron 0,159 g de Na2CO3 + 0,293 g de NaHCO3 + 0,020 g de ázida sódica, además se agregaron 100 ml de agua destilada) y luego se pegó en placas de poliestireno. Se mezclaron cuidadosamente los 100 ml de buffer coating más una porción de IgG hidatídico; se colocaron 100 µl en cada pocillo de la placa y se incubaron durante 12 h a una temperatura de 4 °C. Luego se bloqueó con PBS/SAB al 2% durante 1 h a temperatura ambiente y se eliminó por centrifugado. Una vez descongelada la placa, ésta se lavó y las muestras se diluyeron con PBS/Tween al µl 0,05% en 1:200. Posteriormente, 100 µl de muestra diluida se incubó durante 1 h a una temperatura de 37 °C y luego se lavó 5 veces con PBS/Tween al 0,05%. El conjugado se preparó con 5 µl de anti-human IgG de cabra + 2,5 ml de PBS/Tween al 0,05%. Posteriormente se agregaron 100 µl de conjugado, que se incubó a 37 °C durante 1 h. Luego, se lavó 5 veces con PBS/Tween al 0,05% y se agregaron 100 µl del sustrato TMB-DAKO (3,3', 5,5' tetramethylbenzidina + peroxidasa diluido en una solución de amortiguador) durante 10 min a temperatura ambiente y se detuvo la reacción con 100 µl de H2SO4 al 1 normal. Finalmente, se efectuó la lectura de la placa en un lector de ELISA a 450 nm.
Se consideraron positivas todas las muestras cuya lectura fuera igual o superior al punto de corte; éste se obtiene con la ecuación VC = Cneg N.o 1 + Cneg N.o 2 + 0,1 (VC: punto de corte; Cneg N.o 1: control negativo N.o 1; Cneg N.o 2: control negativo N.o 2)11.
Plan de análisis
Se realizó un análisis exploratorio de los datos y se aplicó estadística descriptiva con cálculo de porcentajes, medianas y valores extremos.
Resultados
Se estudió a 52 individuos, 38 (73,1%) mujeres y 14 (26,9%) varones, con una mediana de edad de 40 años (16-75 años).
Dieciséis (30,8%) pacientes habían desarrollado alguna complicación evolutiva de la enfermedad. Se verificó que la mayor parte de los pacientes tenía lesión única (34 casos, 65,4%); la mediana del diámetro de las lesiones fue de 12 cm (5-30 cm) y en 35 (67,3%) pacientes se verificaron comunicaciones biliares.
Se practicó quistectomía subtotal en 35 pacientes (67,3%), lobectomía en 9 pacientes (17,3%) y periquistectomía en 8 pacientes (15,4%). Con una mediana de seguimiento de 76 meses (49-125 meses) se constató una morbilidad de 13,4%. En la serie en evaluación no se verificó mortalidad ni recurrencia de la enfermedad.
Respecto al comportamiento de las determinaciones de ELISA-IgG y ELISA-IgE, se lograron evidenciar los hechos siguientes:
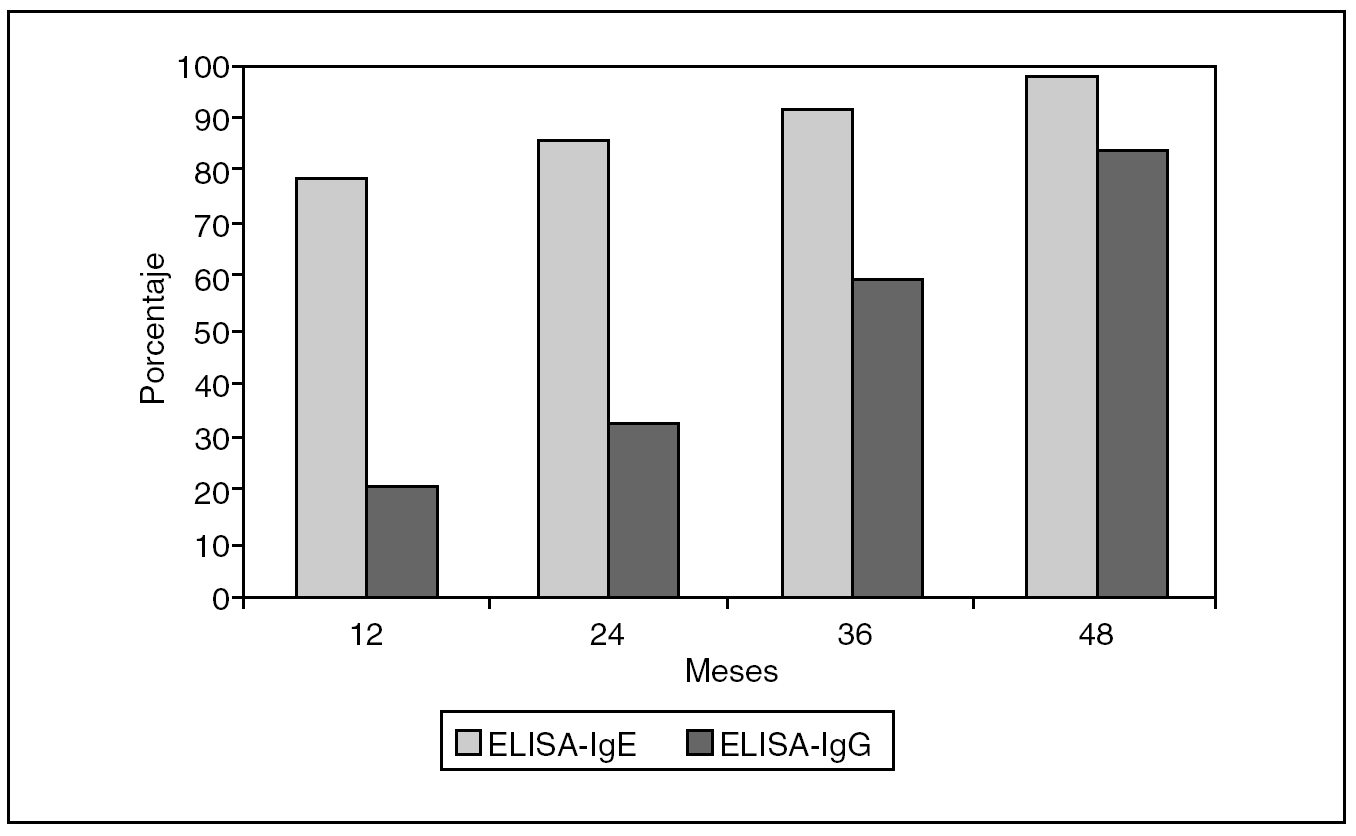
1. En el caso de ELISA-IgE, se observó una negativización progresiva, que se verificó en el 78% de los casos a partir del primer año, hasta superar el 98% al cuarto año de seguimiento (fig. 1).
Fig. 1. Comportamiento en el transcurso del tiempo de ELISA-IgE y ELISA-IgG en pacientes intervenidos quirúrgicamente por hidatidosis hepática. Se aprecia una negativización progresiva a medida que transcurren los controles, la cual se hace más evidente para ELISA-IgE, que supera el 98% al cuarto año de seguimiento frente a ELISA-IgG, que presentó una negativización más lenta y que sólo llegó a superar el 84% al cuarto año de seguimiento.
2. Respecto a ELISA-IgG, se verificó un comportamiento de negativización de tendencia más lenta, que comenzó a manifestarse al primer año en el 21% de los casos, para superar el 84% al cuarto año de seguimiento (fig. 1). Sin embargo, se constató positivización a partir del segundo año de seguimiento en algunos pacientes que en su determinación anterior habían sido negativos (casos en los que al repetir la medición se volvió a obtener un resultado positivo). En este sentido, se comprobó que un 11,5% de los pacientes (6 casos) cambió de negativo a positivo en ausencia de imágenes quísticas radiológicas o ecotomográficas en el tórax y abdomen. En la mitad de estos casos, las mediciones posteriores siguieron siendo positivas, sin una explicación plausible del fenómeno.
Discusión
Se ha informado acerca de cifras de sensibilidad y especificidad para ELISA-IgG de 81,6 a 100% y 95%, respectivamente12-14. Además, en un estudio recientemente publicado por nuestro grupo de trabajo, verificamos una sensibilidad y especificidad del 83 y del 87%, respectivamente, en nuestros pacientes8, en los que además observamos que ELISA-IgG tenía mayor rendimiento cuando había 2 o más quistes (el 90 frente a el 77% en individuos con quiste único); cuando los quistes eran de un diámetro superior a 15 cm (el 85 frente al 80% en pacientes con quistes de menos de 15 cm de diámetro), y en pacientes con quistes multivesiculares comparado con univesiculares (el 88 frente al 80%)8.
Force et al15 estudiaron varios métodos y buscaron el que permitiera llevar a cabo un seguimiento de los pacientes. Encontraron que el mayor problema que plantean los distintos métodos diagnósticos es el tiempo que tardan en negativizarse, hecho ya sugerido por Orduña et al16.
Cuando la IgE disminuye tras la cirugía indica buen pronóstico5,17, y se asocia un aumento de ésta a una progresión de la enfermedad. Pero esta disminución suele observarse a partir de los 6 meses, y en algunos casos puede llegar a varios años. Otro inconveniente de la IgE es su falta de especificidad, ya que aparece elevada en otras parasitosis distintas de la hidatidosis y en otro tipo de procesos no infecciosos, como cirrosis hepática y enfermedades malignas17.
La determinación de anticuerpos totales IgG parece bastante útil, ya que resulta sensible y específica. Sin embargo, en el ámbito del seguimiento de pacientes intervenidos quirúrgicamente, esto no parece ser así, dado el lento proceso de negativización y los resultados erráticos descritos (cambio de negativo a positivo y en algunos casos nuevamente de positivo a negativo); situaciones de difícil explicación que podrían derivarse de reacciones cruzadas con otras parasitosis, especialmente por otros cestodos taenidos, como Echinoccocous multilocularis y Taenia solium5,18. Por estas razones, algunos grupos han desarrollado algunas estrategias de laboratorio que han permitido avanzar en este ámbito, y es así como se ha determinado que algunas subclases de las inmunoglubulinas de tipo IgG podrían proporcionar información de mayor utilidad, en especial la subclase IgG1, de la que se ha informado que alcanza una gran sensibilidad y especificidad para el diagnóstico de HH, con la disminución de su sensibilidad y especificidad en la hidatidosis extrahepática5. Por su parte, la subclase IgG4 también aparece en otras parasitosis de larga duración, como equistosomiasis, filariasis y estrongiloidiasis crónica19, ya que la síntesis de IgG4 por los leucocitos de sangre periférica depende de la producción de interleucinas (IL)20,21. De este modo, Rigano et al22 propusieron a la IL-4 para el seguimiento de este tipo de pacientes y han encontrado que los que responden al tratamiento producen significativamente menos IL-4 que los que no responden (esto implica una menor producción de IgG4 y una menor producción de IgG). En otro estudio, Navarro-Zorraquino et al23 siguieron la evolución de pacientes con HH e hidatidosis pulmonar tras la cirugía, con la medición de los valores de IL-4, y encontraron resultados similares. La exposición antigénica continua a la que se encuentran sometidos los pacientes infectados por E. granulosus implica que la producción de IL-4 sea elevada y, por tanto, la IgG4 alcance valores mayores. Cuando el quiste desaparece o se calcifica, la producción de antígenos parasitarios desciende hasta valores indetectables, no hay producción de IL-4 y la IgG4 disminuye hasta valores negativos. En otro estudio, Ravinder et al6 midieron los valores de antígenos en suero de pacientes afectados y encontraron que tras someterlos a intervenciones quirúrgicas, las concentraciones de antígenos circulantes descendían gradualmente a partir del séptimo día, y desaparecían después del primer mes de la intervención y del sexto mes de tratamiento farmacológico (la subclase IgG4 se negativizaría si la evolución fuera favorable, se positivizaría en pacientes asintomáticos si éstos presentaran recaídas, y se mantendría constante si la cirugía no hubiera sido completa). Guerri et al24 demostraron que en los pacientes a los que se extirpó con éxito la lesión hidatídica, la subclase de IgG4 se negativizó tempranamente, a diferencia de los pacientes en los que se produce recidiva de la enfermedad, en los cuales se ha verificado que los títulos de IgG4 se mantienen elevados21,25,26. Por las consideraciones antes expuestas, parece razonable sostener que la IgG4 podría ser un marcador efectivo para llevar a cabo un seguimiento de pacientes con HH, y que, junto a la subclase IgG1, podría ser útil en el diagnóstico de esta afección, pero tendrían el inconveniente de su escasa disponibilidad en el mercado.
Otros grupos han ensayado protocolos de seguimiento a partir de la realización de determinaciones con ELISA- IgE y ELISA-IgM específicas22,25,26, así como con la combinación de determinaciones IL-4 y de determinación de la expresión en el ARNm de citocinas mediante reacción en cadena de la polimerasa de transcripción inversa27, con lo que se obtienen resultados aceptables que sugieren que la detección de antígenos circulantes también es relevante como método de seguimiento posquirúrgico y de control de las dinámicas de crecimiento y/o la actividad de los quistes5,21,28.
En conclusión, se constató un alto porcentaje de negativización de ELISA-IgE a corto plazo, aún cuando el 100% de ésta no se alcanzó en el tiempo estudiado. Se observó un comportamiento errático de ELISA-IgG, difícil de interpretar, que podría corresponder a falsos positivos.
Correspondencia: Dr. C. Manterola.
Departamento de Cirugía. Universidad de La Frontera.
Casilla 54-D. Temuco. Chile.
Correo electrónico: cmantero@ufro.cl
Manuscrito recibido el 16-3-2006 y aceptado el 18-7-2006.