El objetivo de este estudio fue evaluar qué prueba de imagen de las empleadas para medir el tamaño del cáncer de mama primario preoperatorio (mamografía, ecografía o resonancia magnética [RM]) se correlacionó mejor con el tamaño del tumor en la pieza quirúrgica postoperatoria.
MétodosAnálisis retrospectivo de mujeres con diagnóstico de cáncer de mama y con indicación de tratamiento quirúrgico primario operadas desde enero del 2014 hasta diciembre del 2016. Se recogieron variables sociodemográficas, vinculadas a técnicas de imagen e histológicas. Los resultados se presentaron según edad, tamaño tumoral y tipo histológico.
ResultadosSe estudió a 224 mujeres. Al comparar el tamaño mamográfico y de la RM con el histológico final no se encontraron diferencias significativas, tanto de forma global como teniendo en cuenta el grupo histológico o la edad, sin embargo, ambas infraestimaron significativamente los tumores grandes y sobrestimaron significativamente los pequeños. La ecografía infraestimó significativamente el tamaño del tumor, especialmente en tumores grandes, pacientes mayores y en los grupos de carcinoma ductal infiltrante (CDI) y CDI con carcinoma ductal in situ asociado (CDI+CDIS). La RM se correlacionó mejor con el tamaño tumoral histológico aunque sin diferencias estadísticamente significativas.
ConclusionesLa RM parece ser el mejor predictor del tamaño del tumor en el cáncer de mama. El grupo histológico y el tamaño del tumor fueron claves en la estimación de la medida del tumor, por lo que se deben tener en cuenta en la planificación de la cirugía. La variable edad no interfirió en la interpretación de las imágenes.
The objective of this study was to determine which image test used to measure the size of pre-operative primary breast cancer (mammography, ultrasound or magnetic resonance imaging [MRI]) correlated best with the size of the tumor in the postoperative surgical specimen.
MethodsA retrospective analysis was conducted of women diagnosed with breast cancer for which primary surgical treatment was indicated and who underwent surgical intervention between January 2014 and December 2016. Sociodemographic, imaging and histological variables were collected. The results are presented by age group, tumor size and histological type.
ResultsIn the 224 women studied, mammography and MRI tumor sizes were compared with pathology study tumor measurements, revealing no significant differences, both overall and based on histologic type or age. However, both significantly underestimated large tumors and significantly overestimated small tumors. Ultrasound significantly underestimated tumor size, especially in large tumors, older patients and in infiltrating ductal carcinoma (IDC) and infiltrating ductal carcinoma with associated ductal carcinoma in situ (IDC+DCIS). MRI correlated best with histological tumor size, although with no statistically significant differences.
ConclusionsMRI is the best predictor of tumor size in breast cancer. Histologic type and tumor size are key parameters when estimating tumor size and should be taken into account when planning surgery. Patient age does not interfere with the interpretation of imaging tests.
El tamaño del cáncer de mama es uno de los principales indicadores pronósticos y un factor determinante para la planificación del tratamiento quirúrgico. Por lo tanto, la predicción precisa del tamaño del tumor en el momento del diagnóstico, evaluada mediante pruebas de imagen, es esencial para planificar un manejo adecuado. Los resultados de las pruebas de imagen se clasificaron utilizando la clasificación Breast Imaging Reporting and data System (BI-RADS)1,2.
El tratamiento quirúrgico del cáncer de mama ha evolucionado mucho en las últimas décadas, cada vez más se ofrece la posibilidad de realizar un manejo conservador, lo que depende significativamente de la relación entre el tamaño del tumor y de la mama. Además, la indicación para el tratamiento sistémico primario se realiza, entre otras cosas, a partir del tamaño tumoral.
En este escenario la RM se ha convertido en una gran herramienta para la evaluación adicional de la extensión tumoral y los tumores sincrónicos; si bien ofrece la ventaja de una alta sensibilidad, presenta también desventajas como son los falsos positivos que requieren la realización de biopsias adicionales, angustia del paciente, prolongación del tiempo hasta la cirugía, costo y la posibilidad de sobrestimar el tamaño del tumor3-5.
El objetivo de este estudio fue analizar cuál de los métodos de imagen actuales es el más preciso en la definición del tamaño tumoral preterapéutico en el cáncer de mama primario utilizando el tamaño histológico como el gold standard en pacientes con cáncer de mama recién diagnosticado.
La precisión de las pruebas de imagen también se analizó teniendo en cuenta los diferentes tamaños de tumores, subgrupos histológicos y edad de las pacientes.
MétodosRevisión retrospectiva de una serie de casos de mujeres con diagnóstico de cáncer de mama (infiltrante e in situ) con indicación de tratamiento quirúrgico primario, operadas desde enero del 2014 hasta diciembre del 2016.
Todas las pacientes cumplieron los siguientes criterios de inclusión: mujeres con cáncer de mama primario, no quimioterapia neoadyuvante, indicación de tratamiento quirúrgico primario e información de histología final, estadio Tis-T3, con diagnóstico realizado por pruebas de imagen en el mismo centro y siempre que se les hubiese realizado RM. La referencia de tamaño que se eligió en cada caso fue el diámetro mayor del tumor.
La información se recogió de la historia clínica electrónica, informes de los servicio de Radiología y de Anatomía patológica.
La mamografía se realizó con un sistema de mamografía y tomosíntesis digital de alta definición de campo completo (Selenia Dimensions, Hologic GmbH, Bélgica, Alemania).
La ecografía se realizó utilizando un transductor lineal de alta definición con un ancho de 60mm y una frecuencia de 15MHz. Se utilizó el modelo Logiq E9, GE Healthcare, Waunatosa, WI, EE. UU. La medición del tamaño del tumor tuvo en cuenta el centro hipoecogénico de la lesión y el halo ecogénico en aquellos casos en los que fue visible.
La RM se realizó con un sistema 1.5 Tesla (Aera, Siemens, Múnich, Alemania). Se usó una secuencia de eco gradiente dinámica ponderada en T1 (T1w-FFE eco de campo rápido) con una serie basal y 4 poscontraste posterior. Se inyectó por vía intravenosa un bolo de 0,20 mmol de gadolinio por kilogramo de peso corporal seguido de 20ml de solución salina. El procesamiento posterior de la imagen incluyó la generación de series de sustracción y la reconstrucción de una proyección de intensidad máxima (MIP). El análisis de imágenes se llevó a cabo utilizando los datos digitales con la ayuda de una estación de trabajo adecuada (SYNGO Via, Siemens, Múnich, Alemania).
Todas estas técnicas de imagen se realizaron por radiólogos especializados en diagnóstico mamario.
Análisis estadísticoLas variables cualitativas se expresaron como porcentajes y las variables cuantitativas como media (desviación estándar [DE]).
La diferencia de medias entre el tamaño de la imagen (RM, mamografía y ecografía) y los resultados histológicos se calculó mediante la prueba t pareada y se relacionó con el intervalo en el que se encontraron el 95% de las diferencias calculadas. La prueba t pareada también se usó para comparar el tamaño del tumor agrupado por grupo de tumores (CDI, CDIS, CLI, CDI+CDIS), tamaño (≤ 20mm y> 20mm) y edad (≤ 40 años y> 40 años).
Se calcularon los coeficientes de correlación de Pearson en forma de pares entre la medida histológica y la RM, la mamografía y la ecografía, respectivamente.
El nivel de significación se definió como un valor de p <0,05. El análisis estadístico se realizó con SPSS® para Windows (versión 15.0; IBM, Chicago, EE. UU.).
No hubo objeciones contra el estudio por parte de los Comité de Investigación y Ético de la institución.
ResultadosDescripción de población a estudio y hallazgos de las pruebas de imagenSe estudió a 224 mujeres con diagnóstico de cáncer de mama, con una media (DE) de edad de 56,4 (11,7) años. El grupo histológico mayoritario fue el CDI+CDIS (46%) y el 66% de los tumores presentaban un fenotipo inmunohistoquímico de luminal (algo más frecuente el luminal A) (tabla 1).
Características clínico-epidemiológicas
| Variables | N.° (%) |
|---|---|
| Nulíparas | 26 (12,3) |
| Menopáusicas | 140 (62,5) |
| Con antecedentes familiares | 32 (14,3) |
| Con AP patología mamaria maligna | 4 (1,8) |
| Unilateral | 222 (99,1) |
| Tipo histológico final | |
| CDI | 62 (27,7) |
| CDIS | 27 (12,1) |
| CDI+CDIS | 103 (46) |
| CLI | 29 (12,9) |
| Benigno | 3 (1,3) |
| Grado | |
| 1 | 52 (23,4) |
| 2 | 123 (55,4) |
| 3 | 47 (21,2) |
| Inmunohistoquímica | |
| Luminal A | 88 (39,5) |
| Luminal B | 59 (26,5) |
| RRHH+, Her2 positivo | 3 (1,3) |
| RRHH–, Her2 positivo | 22 (9,9) |
| Triple negativo | 10 (4,5) |
| CDIS, RRHH+ | 33 (14,8) |
| CDIS, RRHH– | 7 (3,1) |
| Tamaño histológico (mm)a | 21,1 (13) |
| Edad al diagnósticoa | 56,4 (11,7) |
AP: antecedentes personales; CDI: carcinoma ductal infiltrante; CDIS: carcinoma ductal in situ; CLI: carcinoma lobulillar infiltrante; CLIS: carcinoma lobulillar in situ; RRHH: receptores hormonales
La mayor parte de las pacientes fueron tratadas de forma conservadora (31,3% mastectomías). Y solo precisaron nueva cirugía de ampliación de márgenes el 7,6% de ellas, demostrándose persistencia del tumor en 5 pacientes.
En lo que respecta a las pruebas diagnósticas, se realizó mamografía en el 99,5% de las pacientes, ecografía en el 96,4% y RM en el 100%.
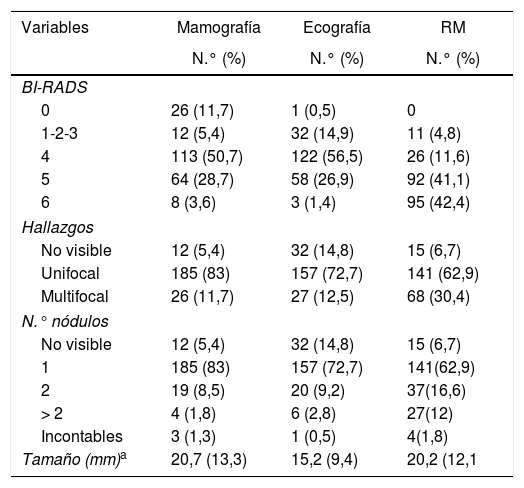
En la tabla 2 objetivamos cómo hasta en un 11,7% de los casos la mamografía fue considerada una evaluación incompleta y no visualizó el cáncer de mama en 12 casos (5,4%). La ecografía fue considerada benigna o muy probablemente benigna en el 14,9% de la población a estudio, y no visualizó el cáncer en 32 casos (14,8%). Tanto en la mamografía como en la ecografía, la unifocalidad fue el hallazgo más común. En la RM el tumor no fue visible en 15 casos (6,7%) y la multifocalidad se observó con más frecuencia, lo que apoya la teoría de que la RM detecta mayor número de nódulos accesorios, tanto en mama ipsolateral como en contralateral.
Pruebas de imagen
| Variables | Mamografía | Ecografía | RM |
|---|---|---|---|
| N.° (%) | N.° (%) | N.° (%) | |
| BI-RADS | |||
| 0 | 26 (11,7) | 1 (0,5) | 0 |
| 1-2-3 | 12 (5,4) | 32 (14,9) | 11 (4,8) |
| 4 | 113 (50,7) | 122 (56,5) | 26 (11,6) |
| 5 | 64 (28,7) | 58 (26,9) | 92 (41,1) |
| 6 | 8 (3,6) | 3 (1,4) | 95 (42,4) |
| Hallazgos | |||
| No visible | 12 (5,4) | 32 (14,8) | 15 (6,7) |
| Unifocal | 185 (83) | 157 (72,7) | 141 (62,9) |
| Multifocal | 26 (11,7) | 27 (12,5) | 68 (30,4) |
| N.° nódulos | |||
| No visible | 12 (5,4) | 32 (14,8) | 15 (6,7) |
| 1 | 185 (83) | 157 (72,7) | 141(62,9) |
| 2 | 19 (8,5) | 20 (9,2) | 37(16,6) |
| > 2 | 4 (1,8) | 6 (2,8) | 27(12) |
| Incontables | 3 (1,3) | 1 (0,5) | 4(1,8) |
| Tamaño (mm)a | 20,7 (13,3) | 15,2 (9,4) | 20,2 (12,1 |
La evaluación de malignidad por imágenes se realizó según el sistema de clasificación BI-RADS1, donde el 84,8% de los resultados ecográficos, el 83% de los mamográficos y el 95,1% de la RM se clasificaron preintervención como BI-RADS 4 o superior (tabla 2). La RM hasta en un 42,4% de los casos se categorizó como BI-RADS 6, dado que se realizó como estudio complementario en pacientes ya diagnosticadas de cáncer de mama.
La medición del tamaño tumoral no se especificó por igual en las diferentes técnicas de imagen, estando disponible en el 38,9% de las mamografías, en el 95,6% de las ecografías y en el 88,4% de las RM.
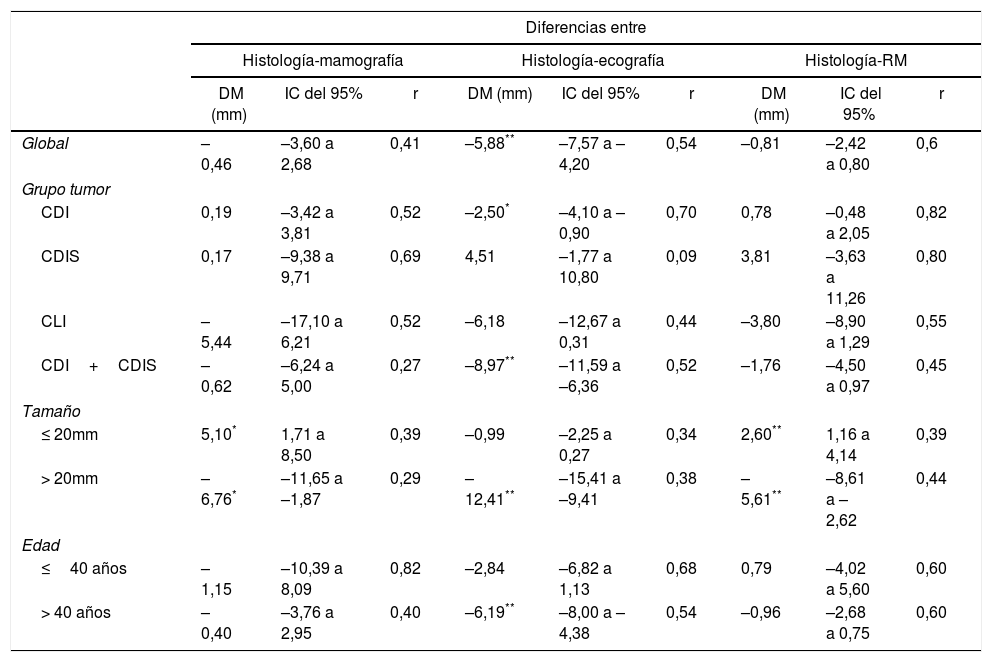
Correlación del tamaño histológico con el ecográfico, mamográfico y de resonancia magnéticaLa tabla 3 recoge la comparación de los tamaños de las diferentes pruebas de imagen con respecto al histológico.
Correlación del tamaño de las pruebas de imagen con el tamaño del tumor histológico
| Diferencias entre | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Histología-mamografía | Histología-ecografía | Histología-RM | |||||||
| DM (mm) | IC del 95% | r | DM (mm) | IC del 95% | r | DM (mm) | IC del 95% | r | |
| Global | –0,46 | –3,60 a 2,68 | 0,41 | –5,88** | –7,57 a –4,20 | 0,54 | –0,81 | –2,42 a 0,80 | 0,6 |
| Grupo tumor | |||||||||
| CDI | 0,19 | –3,42 a 3,81 | 0,52 | –2,50* | –4,10 a –0,90 | 0,70 | 0,78 | –0,48 a 2,05 | 0,82 |
| CDIS | 0,17 | –9,38 a 9,71 | 0,69 | 4,51 | –1,77 a 10,80 | 0,09 | 3,81 | –3,63 a 11,26 | 0,80 |
| CLI | –5,44 | –17,10 a 6,21 | 0,52 | –6,18 | –12,67 a 0,31 | 0,44 | –3,80 | –8,90 a 1,29 | 0,55 |
| CDI+CDIS | –0,62 | –6,24 a 5,00 | 0,27 | –8,97** | –11,59 a –6,36 | 0,52 | –1,76 | –4,50 a 0,97 | 0,45 |
| Tamaño | |||||||||
| ≤ 20mm | 5,10* | 1,71 a 8,50 | 0,39 | –0,99 | –2,25 a 0,27 | 0,34 | 2,60** | 1,16 a 4,14 | 0,39 |
| > 20mm | –6,76* | –11,65 a –1,87 | 0,29 | –12,41** | –15,41 a –9,41 | 0,38 | –5,61** | –8,61 a –2,62 | 0,44 |
| Edad | |||||||||
| ≤40 años | –1,15 | –10,39 a 8,09 | 0,82 | –2,84 | –6,82 a 1,13 | 0,68 | 0,79 | –4,02 a 5,60 | 0,60 |
| > 40 años | –0,40 | –3,76 a 2,95 | 0,40 | –6,19** | –8,00 a –4,38 | 0,54 | –0,96 | –2,68 a 0,75 | 0,60 |
DM: diferencia de medias; IC: intervalo de confianza; r: coeficiente de correlación; RM: resonancia magnética.
La mamografía y la RM infraestimaron el tamaño tumoral de forma global en 0,46mm y 0,81mm, respectivamente. Ambas técnicas sobrestimaron de manera significativa los tumores pequeños e infraestimaron también significativamente los de mayor tamaño. No se objetivaron diferencias significativas en función del grupo tumoral o la edad de la paciente.
La ecografía infraestimó significativamente el tamaño tumoral de forma global (5,88mm) y también en mujeres mayores de 40 años, en tumores mayores de 20mm y en los grupos tumorales CDI y CDI+CDIS.
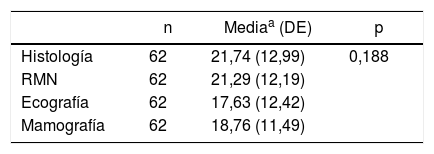
Si comparamos, de forma global, las medias del tamaño de las 3 pruebas de imagen con la del tamaño histológico (tabla 4), incluyendo en este cálculo únicamente a aquellas pacientes que disponen de datos para las 3 pruebas diagnósticas (62 pacientes); no se encontraron diferencias estadísticamente significativas, aunque sí parece clínicamente relevante la aproximación de la RM y la histología. No obstante, el tamaño muestral es pequeño.
Comparación de medias del tamaño tumoral en las pruebas de imagen y el tamaño del tumor histológico
| n | Mediaa (DE) | p | |
|---|---|---|---|
| Histología | 62 | 21,74 (12,99) | 0,188 |
| RMN | 62 | 21,29 (12,19) | |
| Ecografía | 62 | 17,63 (12,42) | |
| Mamografía | 62 | 18,76 (11,49) |
| n | Mediaa (DE) | p | |
|---|---|---|---|
| Histología | 169 | 21,07 (13,12) | <0,0001 |
| RMN | 169 | 19,17 (10,63) | |
| Ecografía | 169 | 15,30 (9,54) |
Si excluimos de esta comparación la mamografía, y tenemos en cuenta a las 169 pacientes que tienen información completa del tamaño histológico, ecográfico y en RM, objetivamos que la RM se mantiene similar a la histología, encontrando diferencias significativas de ambas medidas con respecto a la ecografía.
DiscusiónPara planificar de forma correcta el manejo quirúrgico adecuado de las pacientes con diagnóstico de cáncer de mama es fundamental realizar una predicción exacta del tamaño del tumor en el momento del diagnóstico, evaluado mediante pruebas de imagen. Es por ello que son muchos los estudios que han intentado valorar el grado de correlación de las pruebas de imagen con la histología final con resultados diversos.
En nuestro estudio, la mamografía infraestimó el tamaño tumoral, aunque no de forma significativa. Este hallazgo coincide con el estudio de Hieken et al.6, que también mostró una subestimación del tamaño medido con la mamografía y que atribuyó a la alta compresión de la mama durante el examen.
Debemos tener en cuenta que la medida del tamaño exacto de los tumores por esta técnica puede verse afectada de forma negativa por el aumento de la densidad del tejido mamario7-9. Esta mayor densidad mamaria se presenta, por lo general, en gente de menor edad y por eso incluimos la variable edad a la hora de interpretar nuestros resultados, comprobando que la estimación del tamaño mamográfico no se ve negativamente afectada por la edad de la paciente y, por tanto, por la densidad mamaria, algo que coincide con lo detectado por Leddy et al.10. Si bien debemos tener en cuenta que estos resultados pueden estar limitados por el bajo porcentaje de especificación de la medida del tamaño del tumor por parte de la mamografía (38,9%). Hung-Wen et al.11 atribuyeron este bajo reporte (18,9%) a la alta densidad mamaria que dificulta la detección y la medida del tamaño del tumor. Por tanto, la misma densidad mamaria podría estar afectando a nuestro bajo número de mediciones y, por ende, estar artefactando nuestros resultados.
Si tenemos en cuenta el grupo histológico, en lo que respecta a la mamografía, no se objetivaron diferencias significativas en la exactitud de la medida del tumor, coincidiendo con Gruber et al.12. Aunque sí debemos señalar que la mamografía infraestima de forma más notable el grupo de CLI sin llegar a ser significativo; estos resultados van en la misma dirección que lo publicado por Leddy et al.10, donde esta infraestimación sí llegó a ser significativa. La falta de significación en nuestro estudio probablemente sea debida al pequeño tamaño muestral en este grupo.
En cuanto al tamaño tumoral, podemos aportar, frente a lo publicado previamente, la gran importancia de considerarlo al interpretar las imágenes mamográficas, puesto que objetivamos que la mamografía infraestima significativamente el tamaño de los tumores mayores a 20mm y sobrestima los de tamaño inferior a este.
Si analizamos los resultados referidos a la ecografía, podemos señalar que infraestima de manera muy significativa el tamaño tumoral. Esta infraestimación fue mayor en la medición de tumores de mayor tamaño o en pacientes de más edad. Bosch et al.13 relacionaron la subestimación en tumores de gran tamaño con a dificultades técnicas, puesto que en muchos casos la imagen excede, lo que es técnicamente posible medir con el transductor. El tamaño de la sonda del dispositivo ecográfico, que generalmente tiene un ancho de menos de 5cm, es demasiado pequeña para estimar con precisión tumores T3 o más grandes. Por ello, para tumores de mayores dimensiones que T2 algunos autores recomiendan11 la RM y la mamografía.
La infraestimación ecográfica también fue más patente en los subgrupos CDI y CDI+CDIS. Este hallazgo coincide con lo publicado en estudios previos6,11-14. Hieken et al.6 lo atribuyeron a que la ecografía no objetiva unos márgenes precisos en los grupos tumorales con componentes intraductales in situ extensos. En otros trabajos15-17, como el publicado por Soo et al.17, se objetivó que en tipos histológicos como el CDIS, o en algunos casos de CDI, que se presentan con microcalcificaciones, estas son difícilmente identificables y medibles por ecografía. Una diferencia con respecto a los estudios publicados es que mientras que en Gruber et al.12. y Print et al.18 observaron la máxima infraestimación para el grupo CLI, atribuyéndolo a su difícil medida debido al patrón de crecimiento difuso e infiltrante19. Nosotros objetivamos esa máxima infraestimación para el grupo CDI+CDIS, justificando nuestros resultados en lo planteado previamente (son lesiones menos identificables y con unos márgenes menos precisos en la ecografía).
Según los resultados de nuestro estudio, la RM infraestima el tamaño tumoral de forma global, sin llegar a ser significativo. Este hallazgo no coincide con lo publicado previamente20, por ejemplo, Gruber et al.12 y Leddy et al.10 describieron una sobrestimación del tamaño del tumor por parte de la RM.
Si clasificamos a las pacientes según el tamaño tumoral objetivamos que la RM sobrestima de manera significativa los tumores de tamaño menor de 20mm, pero por el contrario infraestima, también de forma significativa, los tumores mayores a 20mm. Estos resultados no coinciden con los publicados por Onesti et al.20, que describieron una sobrestimación significativa especialmente para tumores > 2cm. En general, la RM ha demostrado tener mayores tasas de concordancia para tumores pequeños que para tumores grandes11,21. Serían necesarios más estudios para determinar la exactitud de la medida de la RM en función del tamaño tumoral.
En cuanto al tipo tumoral, podemos afirmar que la RM no ha demostrado tener diferencias significativas en la medida del tumor, aunque si bien es cierto parece sobrestimar de manera no significativa el tamaño de los CDIS y CDI, algo también demostrado en Hung-We t al.11; y si la comparamos con las otras técnicas de imagen resulta ser la que mide de forma más precisa los CLI, como lo muestran Rodenko et al.22, Leddy et al.10 y Hung-We et al.11. Además, este tipo de tumores tienden a la multifocalidad debido a la formación de focos satélites peritumorales, lo que se visualiza de forma más precisa con la RM, por tanto, en estos casos la RM es justificable para la planificación quirúrgica.
Para terminar, los estudios que analizaron comparativamente la precisión de la medición diagnóstica de la mamografía, la ecografía y la RM llegaron a conclusiones diversas10,12,23,24, si bien es cierto que la mayor parte de ellos coinciden con nuestros resultados25-29, objetivando una mejor correlación de la RM con el tamaño del tumor histológico con respecto al resto de pruebas diagnósticas.
Por tanto, podemos concluir que, según nuestros resultados, la RM es el mejor predictor del tamaño del tumor en el cáncer de mama y que es muy importante individualizar cada caso y tener en cuenta las características del tumor, dado que tanto el subtipo histológico como el tamaño tumoral pueden variar la precisión de la estimación del tamaño del tumor en cada una de las pruebas de imagen y, por tanto, deben tenerse en cuenta a la hora de planificar el mejor tratamiento para el paciente. Por el contrario, la variable edad no parece interferir en la precisión de la medida del tumor. Estos resultados deben tomarse con prudencia, dado que necesitamos más estudios prospectivos con series más amplias.
Conflicto de interesesNinguno.