En 1980, Sackett y Guyatt desarrollaron el concepto de medicina basada en la evidencia (BME) definido como: «The conscientious, explicit and judicious use of current best evidence in making decisions about treating individual patients»1. La MBE se centra: 1) en el paciente como individuo, con sus características específicas; 2) en la búsqueda de la información más actualizada en términos de eficacia, resultados o coste, y 3) en el juicio y la experiencia del cirujano que aplicará esta información de acuerdo con las características del paciente. El objetivo fundamental de la MBE es justificar con bases lo más científicas posible cualquier actuación médica. La MBE ha sido extrapolada a la cirugía, acuñándose el término «cirugía basada en la evidencia» (CBS)2,3.
Metodología de la obtención de información basada en evidenciasCuando pretendemos aplicar el concepto de MBE es preciso obtener la información de la forma más estructurada y objetiva posible Los instrumentos más importantes son el concepto PICO:
- –
P: Patient or population: motivo del estudio.
- –
I: Intervention: procedimiento a investigar.
- –
C: Comparison intervention: procedimiento con el que se compara.
- –
O: Outcomes: resultado a evaluar.
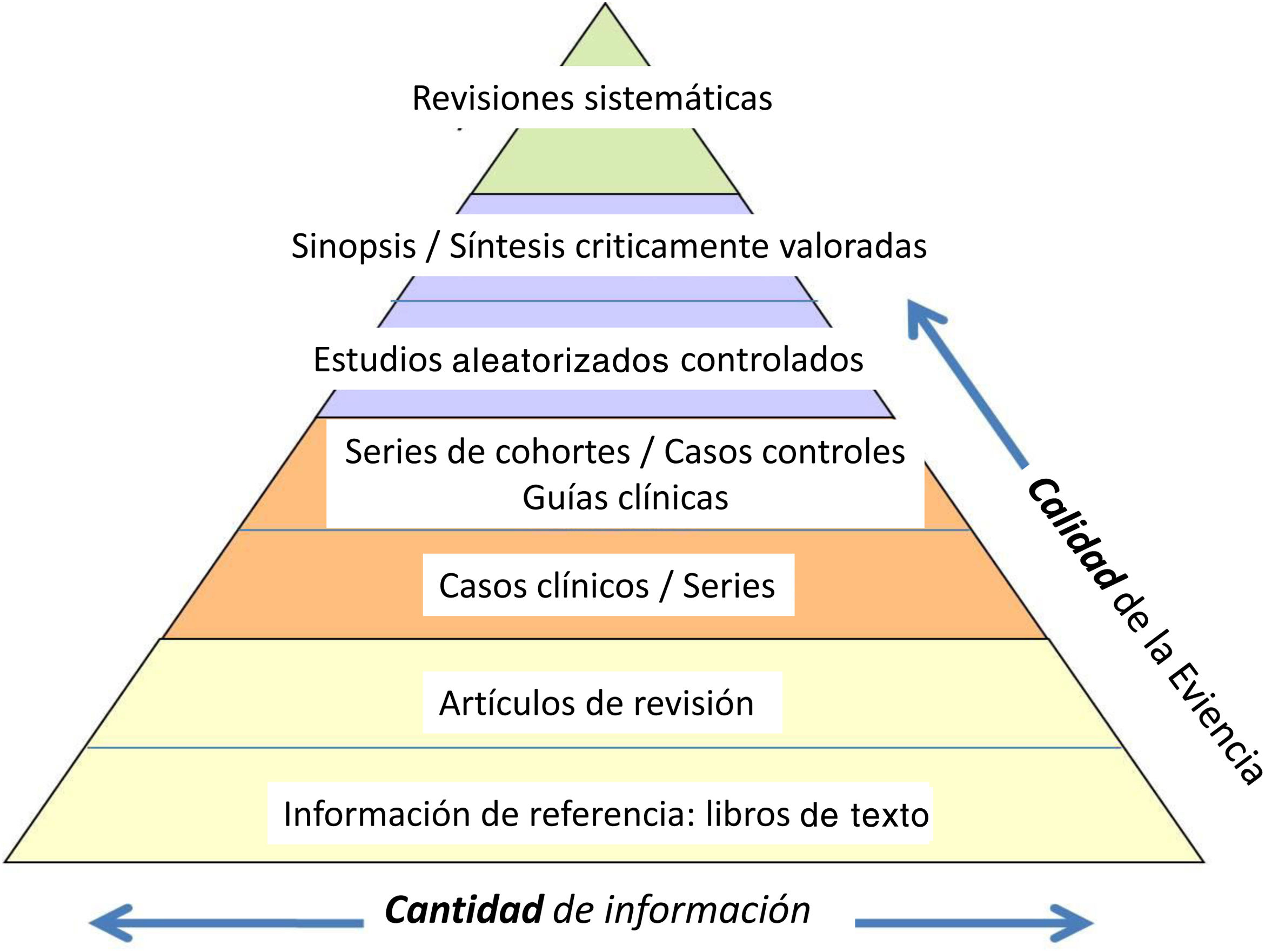
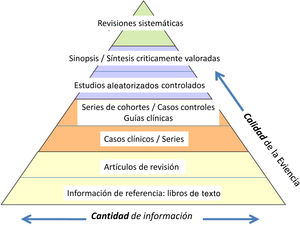
Y la clasificación «jerarquizada» de la información en función de su calidad científica (fig. 1). Esta oscila entre el concepto de más baja credibilidad como es la opinión de un experto, hasta el metaanálisis de estudios prospectivos aleatorizados (EPR) metodológicamente correctos.
Jerarquía de la evidencia.
Adaptado de Targarona et al.8.
En los últimos años se han desarrollado diversas iniciativas dirigidas a la protocolización en la obtención de información y la metodología de publicación En www.equator-network.org, se resumen los protocolos y checklist normalizados para cualquier tipo de estudio científico. Su objetivo es favorecer la publicación de resultados de una forma trasparente y exacta, e incrementar la credibilidad de las publicaciones biomédicas4.
La sistemática metodológica mejor asimilada es CONSORT (Consolidated Standards of Reporting Trials), recomendado para el reporte de EPR. Su checklist incluye todos los ítems que se deben incluir en su publicación. Existen otros protocolos para otro tipo de estudios: Transparent Reporting of Evaluations with Nonrandomized Designs (TREND) o Standard Protocol Items: Recommendations for Interventional Trials (SPIRIT). Se considera que cualquier EPR debe ser de conocimiento público, y para ello existe una base de datos especifica (Clinical Trial.gov [U.S. National Library of Medicine]).
Un concepto especialmente útil en MBE es la revisión sistemática y el metaanálisis. El metaanálisis puede contener muchísimos sesgos y por ello se ha descrito una sistemática muy exigente (Preferred Reporting Items for Systematic Reviews and Meta-Analyses [PRISMA]). Su registro específico es International Prospective Register of Systematic Reviews (PROSPER).
Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) es el checklist para reportar estudios observacionales y la metodología de su metaanálisis se resume en Meta-analysis of Observational Studies in Epidemiology (MOOSE).
En el supuesto de que no exista suficiente información disponible, puede ser de utilidad la opinión de expertos siguiendo un consenso tipo DELPHI.
El objetivo final de una búsqueda bibliográfica sistematizada puede ser el desarrollo de protocolos o guías clínicas. Appraisal of Guidelines for REsearch & Evaluation (AGREE) es un instrumento diseñado para normalizar la variabilidad cualitativa de las guías clínicas
Recursos para la obtención de información basada en evidenciasEl desarrollo informático ha facilitado el almacenamiento de información biomédica. Este tema está ampliamente recogido en otra carta metodológica (Fernandez-Ananin et al.).
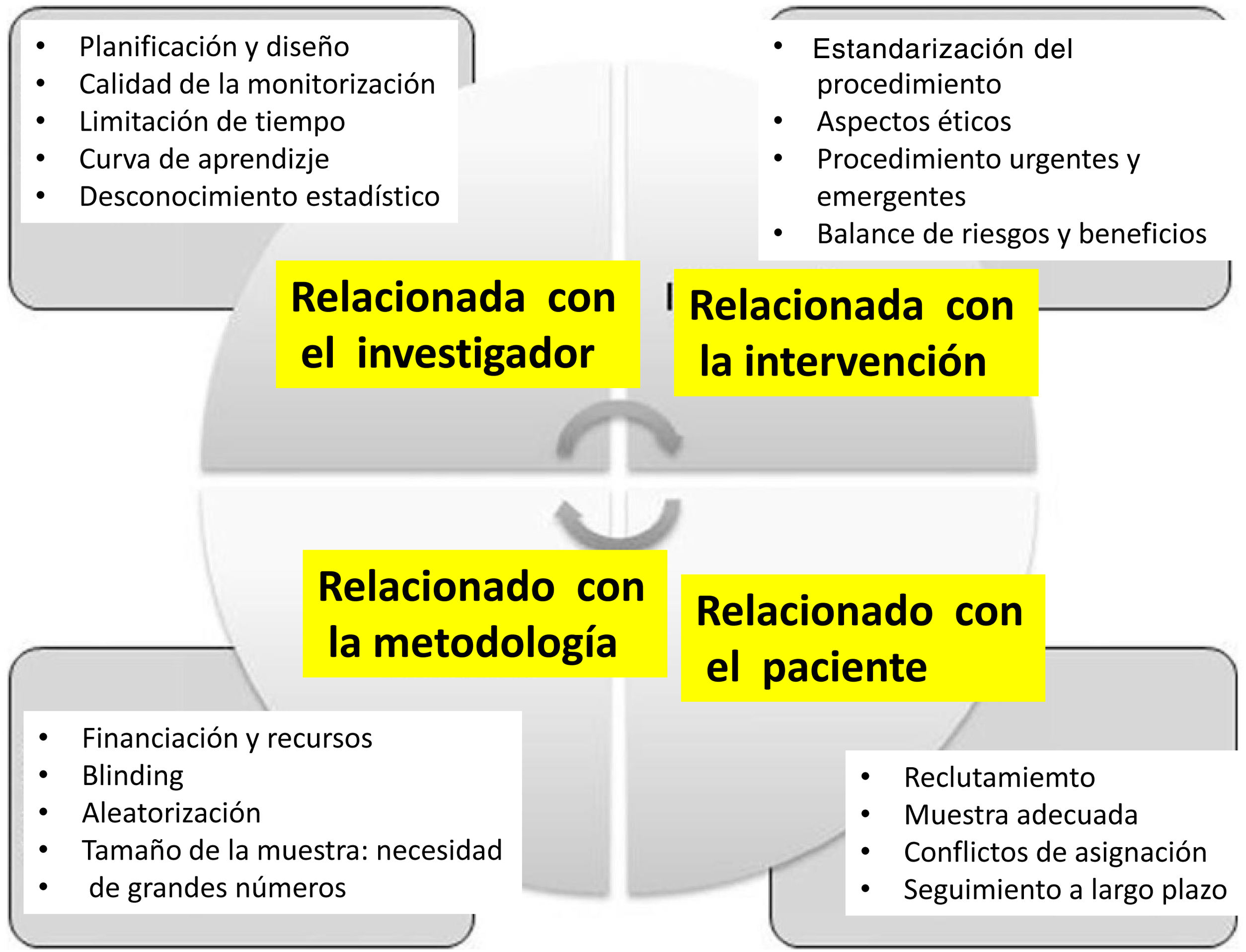
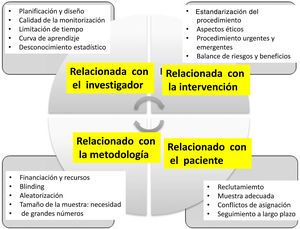
Dificultad en la obtención y aplicación de la cirugía basada en la evidenciaEl EPR en cirugía plantea diferencias esenciales con el estudio de tipo médico y las dificultades para su desarrollo son numerosas (fig. 2): a)dominio de la técnica: el cirujano que desarrolla una nueva técnica no quiere que sus pacientes se traten de forma tradicional; otra dificultad es la aleatorización ya que una vez el paciente conoce ambas opciones, prefiere una de ellas; b)dificultad para obtener resultados absolutamente objetivos, ya que es más difícil la aleatorización de forma ciega; c) otro aspecto es la duración del estudio, ya que en función del tipo de intervención, el estudio puede ser irrealizable, o la implantación del procedimiento ya se ha producido, y d) un aspecto añadido es la falta de cultura de investigación del colectivo quirúrgico.
Dificultades en la realización de estudios aleatorizados en Cirugía.
Adaptado de Targarona et al.8.
En los últimos 30 años se ha comprobado la dificultad en la validación y diseminación controlada de nuevas técnicas quirúrgicas o instrumentos. En el desarrollo y la evaluación de medicamentos, la investigación está perfectamente regulada por Agencia del Medicamento. El desarrollo de nuevas técnicas quirúrgicas no tiene un método de validación propio. En el 2007, un grupo de epidemiólogos liderados por Barkun y McCulloch desarrollaron una serie de recomendaciones sobre la forma segura de aplicar la innovación en cirugía5. IDEAL es el acrónimo de I: Idea, D: Development, E: Exploration, A: Assesment y L: Long term study, que corresponden a la historia natural de una innovación quirúrgica.
- –
Idea: estadio i. ¿Cuál es el concepto del nuevo tratamiento y por qué es necesario?
- –
Development: estadio iia. ¿La nueva intervención está suficientemente desarrollada para ser reproducida por otros?
- –
Exploration: estadio iib. ¿Se han valorado los aspectos que pueden favorecer el desarrollo de un EPR?
- –
Assesment: estadio iii. ¿Cómo se compara la nueva intervención con los resultados habituales en la práctica clínica?
- –
Long term study: estadio iv. ¿Hay resultados no previstos a largo plazo?
En el estadio i, Idea. First in humans: se deberían cumplir una serie de criterios con la máxima trasparencia. Se deben reportar los criterios de selección de pacientes, así como el número que acepta o rechaza. Se debe conocer la técnica con detalle, y los resultados a corto plazo y en términos de seguridad. Esta fase incluye múltiples requerimientos éticos, por lo que es obligada la autorización por parte de la comisión de investigación del hospital.
Durante el estadio iia, Development, Toward stabilization of the tecnique: se refina el procedimiento en manos de pocos autores. Aquí el estudio corresponde a una cohorte prospectiva. Es de interés el análisis tipo CUSUM6 para establecer la curva de aprendizaje. El desarrollo de esta fase, con resultados seguros, permite su reproducción en otros centros.
En el estadio iib, Exploration, Bridge to a pivotal trial: se plantea la necesidad de un EPR. El instrumento ideal en esta fase es la serie multicéntrica y el diseño de un posible EPR. Se pueden valorar otros tipos de estudio (casos controles). Los requerimientos éticos en cuanto a trasparencia, entrenamiento y seguimiento son importantes.
Estadio iii,Assesment: estudio clave/EPR: en esta fase debería realizarse el EPR definitivo, inmediatamente después de que la técnica se considere estable y antes de su amplia diseminación. El objetivo es comparar con la intervención mejor establecida y validar la eficiencia del nuevo procedimiento.
En el estadio iv,Long term study IV: el objetivo es identificar resultados no previstos a largo plazo. Esta es la fase para desarrollar registros y bases de datos. Los conflictos de interés derivados de los registros clínicos están en función de quien dependen, los explota y la definición de autoría.
Registros ybig dataLa obtención de información objetiva también se ha basado en el desarrollo de registros clínicos. La evolución digital ha facilitado la realización de grandes bases de datos que incluyen miles de registros clínicos, permitiendo su análisis en prácticamente tiempo real. El mejor ejemplo ha sido el NSQUIP (The American College of Surgeons National Surgical Quality Improvement Program (ACS NSQIP®)7,8. Permite comparar los resultados clínicos entre diferentes hospitales (benchmarking) pero permite obtener información clínica7: a) evaluación de los resultados de un tratamiento; b) identificación de factores de riesgo y desarrollo de modelos de predicción de riesgo; c) comparar resultados entre diferentes intervenciones, y d) evaluar variaciones en el uso de los recursos de salud. La evolución del mundo digital se orienta a la aplicación de la inteligencia artificial (IA) en el manejo de la información generada por el big data de origen clínico, favoreciendo una medicina personalizada. Ambas formas de manejo de la información, CBE y IA son convergentes y serán complementarias en el futuro8-10.