Cualquier procedimiento quirúrgico se asocia, en mayor o menor grado, al posible desarrollo de complicaciones tromboembólicas.
La utilización de la heparina como profilaxis farmacológica redujo de forma importante su incidencia pero, por contra, se produjo un aumento de los episodios hemorrágicos intra y postoperatorios.
En los años ochenta se investigaron y desarrollaron derivados fraccionados de la heparina que fueron denominados, por su tamaño, heparinas de bajo peso molecular (HBPM), y que por su estructura química, poseen una farmacocinética diferente a la de la heparina convencional. Su biodisponibilidad plasmática, aun administrada por vía subcutánea y a dosis reducidas, es superior y más homogénea y, por tanto, la respuesta anticoagulante en relación con la dosis empleada es más predecible.
Numerosos ensayos clínicos en el campo de la profilaxis tromboembólica han demostrado en la última década que las HBPM tienen una eficacia similar y una mayor seguridad que la heparina no fraccionada.
No obstante, y aunque con características genéricas comunes, los distintos procedimientos empleados para su obtención hacen que las HBPM sean diferentes entre sí y, por tanto, no constituyen un grupo homogéneo para su utilización clínica.
Así, en el campo de la cirugía, junto a la valoración de los factores de riesgo tromboembólico de cada paciente y de cada tipo de intervención, deberemos tener en cuenta las características de cada HBPM para establecer el grado de recomendación y sus pautas de administración, y conseguir la mayor eficacia antitrombótica con el menor riesgo hemorrágico.
Every surgical procedure is associated, to a greater or lesser extent, with the possible development of thromboembolic complications.
The use of heparin as prophylaxis reduced its incidence considerably but was responsible for an increase in the frequency of intraoperative and postoperative hemorrhage.
The 80's saw the investigation and development of fractionated derivatives of heparin that, given their size, were referred to as low molecular weight heparins (LMWH). Because of their chemical structure, their pharmacokinetic characteristics are different from those of conventional heparin. Their bioavailability in plasma, even when administered subcuta neously and in low doses, is greater and more homogeneous and, thus, the anticoagulant response to a given dose is more predictable.
Over the past decade, a number of clinical studies in the field of thromboembolic prophylaxis have shown that the efficacy of LMWH is similar to that of unfractionated heparin and that they are safer.
However, although the LMWH present common generic features, the various procedures employed to obtain them create differences among them and, therefore, they do not constitute a homogeneous family of drugs for clinical use.
Thus, in the field of surgery, together with the assessment of the thromboembolic risk factors of each patient and type of surgical procedure, it is necessary to take into account the characteristics of each LMWH for the purpose of establishing its suitability and its protocol for administration, to achieve the maximum antithrombotic effect with the minimum risk of hemorrhage.
Introducción
La cirugía por sí misma y las circunstancias que la rodean se asocian al posible desarrollo de complicaciones tromboembólicas1,2. Aunque en menor grado que la cirugía ortopédica, también la cirugía general presenta un importante riesgo de estas complicaciones. En el análisis de los resultados de numerosos ensayos clínicos, realizados en los últimos 20 años, con distintos métodos profilácticos se ha observado una incidencia del 19 al 25% de trombosis venosa profunda (TVP) poscirugía y del 0,9 al 1,9% de embolismo pulmonar, fatal o no fatal, en el grupo sin profilaxis3-10.
La introducción de la heparina en bajas dosis como profilaxis operatoria redujo al 8% la incidencia de TVP, y un 50% la de embolismo pulmonar4,11,12, pero este efecto positivo, por contra, presentaba un aumento de los episodios hemorrágicos, que podía ser de hasta un 15%13. Era necesario, pues, obtener un compuesto con la misma eficacia antitrombótica de la heparina clásica pero con menor efecto hemorrágico.
En los años ochenta, los avances en el conocimiento molecular de los mecanismos bioquímicos de la cascada de la coagulación y de la estructura elemental de la heparina relacionada con su acción anticoagulante fueron la base para la investigación y producción, por parte de diferentes laboratorios, de fragmentos de heparina que conservaban su acción antitrombótica pero ejercían menor acción hemorrágica14,15.
Estos productos derivados de la heparina, a los que se denominó, por su tamaño, heparinas de bajo peso molecular (HBPM), se han introducido en el campo de la profilaxis tromboembólica y han desbancado a la heparina clásica o no fraccionada (HNF)6,9.
Estructura química y farmacocinética de las heparinas de bajo peso molecular
Como ocurre con cualquier otro fármaco, es necesario conocer la estructura de las HBPM para entender su cinética y, por tanto, las acciones biológicas positivas o negativas que se pueden derivar de su empleo.
En el caso de las HBPM, sus distintos métodos de obtención introducen cambios estucturales en sus moléculas que hacen que, aun teniendo unas características generales comunes como grupo, presenten diferencias en algunas de las propiedades en las que se basa su acción anticoagulante y, por consiguiente, también en su eficacia clínica antitrombótica.
Estructura química
Al igual que la heparina estándar, las HBPM son glucosaminoglucanos constituidos por residuos alternativos de D-glucosamina y ácido urónico, glucurónico o idurónico16,17.
La heparina clásica es una mezcla heterogénea de cadenas de estos polisacáridos, con 45-50 azúcares por unidad y cuyo peso molecular oscila entre 3.000 y 30.000 Da, con un Pm medio de 12.000-15.000 Da.
Su depolimerización química o enzimática da lugar a fragmentos de 13 a 22 azúcares por cadena, con un peso molecular entre 4.000-6.500 Da: son las denominadas heparinas fraccionadas o de bajo peso molecular.
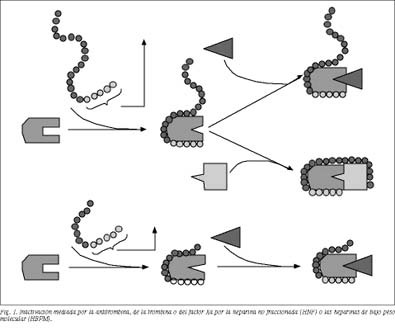
La principal acción anticoagulante de ambos tipos de heparinas se debe a su unión a través de un pentasacárido, distribuido al azar entre sus cadenas, a la antitrombina III (AT III), que hace aumentar 1.000 veces su capacidad de inhibir a las serin-proteasas procoagulantes factor IIa (trombina), IXa, Xa, XIa y XIIa18, pero existen diferencias en la unión de la AT III con estos factores activados. Para la unión e inhibición de la trombina se forma un complejo ternario heparina, trombina y ATIII y la cadena heparínica tiene que tener al menos 18 sacáridos19, mientras que la unión con el resto de los factores activados se puede realizar sólo con la secuencia elemental pentasacárida (fig. 1).
Así pues, la primera diferencia genérica entre la HNF y heparinas fraccionadas se deriva del tamaño de sus cadenas, ya que el pentasacárido de unión está en un tercio de la primera y sólo en el 15-20% de las segundas20.
La heparina clásica, con cadenas de 18 o más sacáridos, tiene una capacidad similar para inactivar el factor IIa y el Xa u otras serinproteasas procoagulantes. La relación o ratio entre ambas actividades, anti-Xa/IIa, es de 1; en cambio, en las HBPM, al tener las cadenas cortas, predomina la acción anti-Xa sobre la anti-IIa, y la ratio es mayor de 1,5.
En principio, y aunque todavía no está clara la importancia antitrombótica de ambas actividades, biológicamente se atribuye a la anti-Xa una mayor acción preventiva y a la anti-IIa una mayor acción curativa y un superior efecto hemorrágico.
La propia estructura de sacáridos sulfatados confiere a las heparinas una gran carga aniónica que les hace interaccionar, entre otras superficies, con las células del endotelio vascular, produciendo la liberación del inhibidor de la vía extrínseca de la coagulación o inhibidor del factor tisular, TFPI (Tissue Factor Pathway Inhibitor), lo que potencia de manera notable su acción anticoagulante21. El TFPI es un potente inhibidor de la vía extrínseca de la coagulación, acción que ejerce inactivando directamente el factor Xa y, principalmente, el complejo factor tisular-factor VIIa en presencia del factor Xa22.
La cinética de liberación del TFPI es diferente de la generación de la actividad anti-Xa, es más rápida, desaparece antes de la circulación23 y está relacionada con la longitud y carga iónica de sus fragmentos sacáridos24, lo que contribuye a la diferenciación inicial del potencial anticoagulante de cada heparina25. Éste será más predecible si existe menos dispersión entre los tamaños de las cadenas heparínicas, lo que ocurre en las HBPM de ratio mayor de seis. El primer representante de este grupo, las denominadas heparinas de muy bajo peso molecular o de segunda generación, es la bemiparina26,27. Tiene un peso molecular medio de 3.600 Da, pero con una proporción muy grande de sus fragmentos (75-80%) en la banda de 2.000-6.000 Da, tamaño crítico antitrombótico28. De esta estructura química, bastante homogénea, se deriva una acción predominante anti-Xa con una ratio anti-Xa/anti-IIa de ocho, y un perfil cinético específico con una liberación inmediata de TFPI, que alcanza un pico máximo a las 2 h de su administración por vía subcutánea, lo que condicionaría una acción profiláctica antitrombótica característica dentro de las HBPM29.
Éstas son las características principales que como anticoagulantes presentan ambos tipos de heparinas sólo por el distinto tamaño de sus cadenas y, por consiguiente, de su carga iónica. Sin embargo, el propio método de fraccionamiento puede producir otros cambios estructurales en los sacáridos terminales grado de sulfatación de éstos, formación de epóxidos así como cambios en las secuencias de sacáridos con carga homogénea, que al introducir diferencias bioquímicas entre las HBPM pueden condicionar distintas acciones biológicas.
Algunos de estos cambios, fundamentalmente el último, pueden modular excepto en las HBPM de muy pequeño peso molecular las interacciones de las HBPM con proteínas plasmáticas endógenas, exógenas y plaquetarias (cofactor II de la heparina, activador tisular del plasminógeno, protamina, heparinasa o factor plaquetario 4), de las que se derivaría un perfil bioquímico distinto entre ellas que podría ser responsable de sus diferencias clínicas30.
Farmacocinética
El pequeño tamaño y carga aniónica de las HBPM hace que su unión a las proteínas plasmáticas endógenas, a las células endoteliales y a los macrófagos sea menor que en el caso de la heparina estándar y que, por tanto, su biodisponibilidad plasmática sea mayor y más homogénea. Esto hace que, aun por vía subcutánea y en bajas dosis, las concentraciones plasmáticas de actividad anti-Xa sean casi del 100% y la respuesta anticoagulante esté relacionada con la dosis administrada.
Así mismo, por su reducida unión a los macrófagos y a las células endoteliales, su aclaramiento plasmático es predominantemente renal y, por el menor tamaño de sus cadenas, más lento que el de la HNF, lo que da lugar a una vida media plasmática de dos a cuatro veces mayor31 que la de ésta, y que en la bemiparina, de muy bajo peso molecular, es superior a 5 h32.
No obstante, como las diferentes HBPM tienen distintas distribuciones en el tamaño de sus cadenas, con mayor o menor proporción de cadenas largas con actividad anti-IIa y actividad anti-Xa y cadenas cortas sólo con actividad anti-Xa, su aclaramiento será diferente, y también lo serán su vida media y el tiempo en que se alcanza el máximo de actividad anti-Xa, lo que hay que tener en cuenta a la hora de utilizarlas.
Otras propiedades derivadas del menor tamaño de las cadenas de las HBPM son la menor incidencia de osteoporosis en tratamientos prolongados33 y de trombopenias inducidas por anticuerpos frente al complejo heparina-factor plaquetario 434. No obstante, en este último caso no hay que olvidar la existencia de respuesta inmunológica cruzada entre las distintas heparinas por lo que, en caso de trombocitopenia inducida por alguna de ellas, no se debe cambiar a otra sino a otro tipo de anti coagulante.
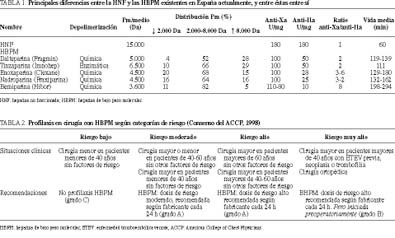
En la tabla 1 se exponen las distintas características de las HBPM utilizadas en España.
Utilización de las heparinas de bajo peso molecular en la profilaxis tromboembólica en cirugía general
Valoración de los factores de riesgo tromboembólico
Aunque, como hemos indicado al inicio de este artículo, la cirugía general tiene un riesgo tromboembólico moderado, éste puede transformarse en elevado si a los factores de riesgo propios del acto quirúrgico se añaden los de índole general del paciente.
Entre los factores relacionados con el acto quirúrgico figura la entidad nosológica que se interviene. Así, en la enfermedad neoplásica, que constituye el 60% de las afecciones que se intervienen en un servicio de cirugía general, aumenta notablemente el riesgo trombótico venoso35.
Por la atrición tisular que conlleva el abordaje quirúrgico, así como por la contaminación y por la posición del paciente, es mayor el riesgo de la cirugía abdominopelviana que el de la torácica36.
Es también importante la duración del acto quirúrgico (inferior a 30 min o superior a 1 h), por el tiempo de inmovilización que supone. Y también existen diferencias entre la cirugía programada y la de urgencia, en donde el componente sucio, con la implicación infecciosa que supone, es mayor37.
Entre los factores generales de riesgo tromboembólico figuran la edad (mayor de 40 años), un exceso de peso de un 20-30% respecto al peso ideal, la inmovilización superior a 3 días (que si es superior a una semana aumenta seis veces el riesgo), antecedentes de enfermedad tromboembólica venosa (ETEV), varices y existencia de trombofilia congénita o adquirida38.
Valorando estos dos aspectos el acto quirúrgico en sí y los factores generales, se puede estratificar a los pacientes en diferentes categorías de riesgo, lo que permite adaptar las pautas de los distintos tipos de profilaxis, mecánica y/o farmacológica, y dentro de esta última, la que utiliza HBPM.
En este sentido son muy importantes los consensos sobre pautas antitrombóticas que valoran, en los distintos metaanálisis, la eficacia y la seguridad clínicas de las medidas profilácticas. El American College of Chest Physicians (ACCP) realizó el primero en 198639, con revisiones cada 3 años; en la última actualización, de 199840, se analizan los niveles de evidencia clínica de eficacia y seguridad de los distintos estudios (del I al V), estableciéndose en consecuencia los grados de recomendaciones para cada tipo de profilaxis (del A al C ).
En la tabla 2 se recogen las categorías de riesgo en cirugía y las recomendaciones en cuanto a profilaxis con HBPM.
Pauta de profilaxis
En toda profilaxis farmacológica hay que establecer la dosis del fármaco, el momento de iniciar la profilaxis y la duración óptima.
En el caso de las HBPM, la dosis y pauta de administración estará en relación con la ratio de actividad anti-Xa/anti-IIa, con la vida media de cada una de ellas (que oscila entre 2 y 4 h) y con el pico de actividad máxima anti-Xa, que se alcanza a las 3-4 h de la inyección por vía subcutánea, persistiendo todavía a las 12 h el 50% de esta actividad.
Como se trata de profilaxis quirúrgica, habrá que establecer un equilibrio entre la acción antitrombótica y el riesgo hemorrágico, por lo que la actividad anti-Xa deberá ser menor de 0,4 U/ml41, y se tendrá en cuenta la actividad anti-IIa, que es mínima en las HBPM de ratio mayor de seis, pero que puede ser importante en las de ratio 1,5-2.
Todas las casas comerciales tienen presentaciones y pautas para profilaxis de bajo, moderado y alto riesgo tromboembólico, con el fin de alcanzar un pico máximo de actividad anti-Xa de 0,1 a 0,2 U/ml, que ha demostrado ser eficaz y segura en distintos estudios clínicos42.
En Europa, donde se ha generalizado más el empleo de las HBPM, en las situaciones de riesgo moderado se administra la dosis preoperatoria de bajo riesgo recomendada por cada casa comercial 2 o 3 h antes de la intervención para prevenir la formación de trombos venosos durante ésta43. Cuando la intervención es de alto riesgo tromboembólico, se emplean así mismo las dosis anti-Xa recomendadas por cada fabricante; la dosis preoperatoria se debe administrar entre 10 y 12 h antes de la intervención para evitar el riesgo de hemorragia. En el caso de la bemiparina, por la homogeneidad de su estructura y la cinética de su acción biológica, está indicada su administración 2 h antes de la intervención en estas situaciones de riesgo tromboembólico alto29.
Si no existen contraindicaciones clínicas, la dosis postoperatoria se administrará entre 12 y 24 h después de finalizada la intervención, con las dosis ajustadas a cada tipo de riesgo, continuándose cada 24 h, hasta la movilización activa del paciente (7 días como término medio).
La existencia de algún factor de riesgo sobreañadido, como inmovilización prolongada, trombofilia o alta precoz, debe hacernos valorar la necesidad de prolongar la profilaxis tromboembólica fuera del hospital. Numerosos estudios han mostrado que el riesgo de ETEV permanece hasta el día 21-28 del postoperatorio44 y en algunos casos, como el de la cirugía de neoplasias, hasta un mes después45.
Potencial hemorrágico de las heparinas de bajo peso molecular
En cirugía es importante establecer el potencial hemorrágico de cualquier fármaco que se vaya a utilizar en el período peroperatorio.
En principio, y también por el menor tamaño de sus cadenas y cargas aniónicas, las HBPM tienen una escasa unión a las células endoteliales y a los multímeros de factor Von Willebrand, lo que haría que interfiriesen menos que la HNF en la hemostasia primaria46.
Estudios en animales muestran que con las HBPM se da una menor intensidad y frecuencia de episodios hemorrágicos47, y los estudios en humanos muestran una menor incidencia de reintervenciones por estos problemas48.
No obstante, desde los trabajos de Cruz et al en los años sesenta49, con un modelo experimental para la determinación de la actividad hemorrágica de un anticoagulante, se sabe que gran parte del efecto antihemostático de la heparina es independiente de la interacción plaquetas-endotelio, y se debe a su unión con la miosina de las fibras musculares lisas de la pared vascular. La heparina unida compite con la miosín-ATPasa, inhibiéndose la hidrólisis del ATP, por lo que no se pueden contraer las fibras musculares de la pared vascular y se prolonga el tiempo de hemorragia.
La estructura mínima para esta unión de la heparina es un disacárido con un sulfato en el C-6 de la hexosamina50,51. La presencia de este residuo en mayor o menor cantidad establecerá también diferencias en la tendencia hemorrágica de las distintas HBPM.
Control y neutralización
Debido a que las HBPM tienen una mejor biodisponibilidad plasmática que la de la HNF, presentan una respuesta anticoagulante más predecible en su utilización clínica, lo que hace que no sea preciso control de laboratorio, sobre todo cuando se utilizan en dosis profilácticas. Existen métodos coagulativos y amidolíticos para determinar tanto la actividad anti-Xa como la anti-IIa.
Su distinta estructura hace que también sea diferente la neutralización. En concentraciones equimoleculares el sulfato de protamina neutraliza sólo la actividad anti-IIa, dependiente de las cadenas de polisacáridos de gran tamaño y mayor número de cargas aniónicas, cuya proporción es escasa en las HBPM. Es importante tener en cuenta los estudios in vitro y ex vivo que realicen los distintos fabricantes para establecer en cada heparina los valores de inhibición de la actividad anti-Xa y anti-IIa que se consiguen con sulfato de protamina. Tomando como ejemplo los estudios con dos HBPM de ratios muy distintas, tenemos que en el de tinzaparina, cuya ratio es de 2,1 mg de protamina por cada 100 U anti-Xa de HBPM, neutraliza el 90% de la actividad anti-IIa (trombina) y sólo el 60% de la anti-Xa52; en el estudio con bemiparina, cuya ratio es de 8, 0,02 mg/ml de protamina neutralizan ex vivo el 30% de la actividad anti-Xa53. Esta capacidad parcial está determinada por el menor tamaño de sus cadenas y, en consecuencia, por la mayor afinidad por su unión a la ATIII que a la protamina, como se ha señalado en otras HBPM54,55, sin que esté claro cuál sería el efecto del Xa residual sobre la hemorragia.
La neutralización de las HBPM es más efectiva con ATP y ADP en bajas concentraciones (10-5 M), bloqueando su capacidad de inhibir competitivamente la hidrólisis del ATP en los receptores de la miosina en la pared vascular y produciendo vasoconstricción. Algunos trabajos indican la mayor eficacia de esta medida sobre la protamina en la disminución de manifestaciones hemorrágicas en intervenciones de bypass cardiopulmonar56.
Especial consideración merecen dos aspectos relacionados con la cirugía y que pueden interferir y condicinar una modificación de las pautas habituales de profilaxis tromboembólica. Uno de ellos es la anestesia regional por bloqueo nervioso, epidural o subaracnoideo y, otro, los procedimientos asociados a las nuevas técnicas de abordaje laparoscópico.
Anestesia regional por bloqueo nervioso
Como es sabido, la anestesia general, al reducir el flujo sanguíneo de las extremidades inferiores, produce áreas de hipoxia en el endotelio venoso y su consiguiente lesión, factores ambos de la tríada de Virchow para la formación de trombos.
En cambio, la anestesia regional que se consigue por el bloqueo nervioso, bien epidural o subaracnoideo, al reducir estos problemas disminuye la predisposición a la hipercoagulabilidad que se da en la anestesia general y, por tanto, es más aconsejable para los pacientes con alto riesgo tromboembólico si no existen otras contraindicaciones57.
Uno de los problemas más importantes al asociar este tipo de anestesia con la profilaxis heparínica es que aumente la incidencia de su complicación más grave: el hematoma espinal. No está clara su incidencia, ni si los factores de riesgo para su aparición se deben más a la propia técnica de la anestesia (calibre de la aguja, realización de punciones múltiples, colocación y retirada de catéteres, dificultad anatómica, aspiración de sangre en la punción) o son derivados de la anticoagulación que supone la profilaxis con heparina58.
Berqvist et al59, en su revisión sobre 9.000 pacientes con profilaxis con HBPM y este tipo de anestesia, raramente observaron complicaciones neurológicas. No se emplearon dosis preoperatorias en la profilaxis ni catéteres epidurales para la anestesia. Lindgren corroboró posteriormente lo mismo en sus trabajos60.
Dada la mayor eficacia de las HBPM en la prevención de ETEV cuando se administra la dosis preoperatoria, puede haber riesgo de hemorragia si se emplea este tipo de anestesia, siendo la aparición de hematoma espinal más frecuente en la epidural, por la existencia de un plexo nervioso más importante, que en la subaracnoidea.
En una reciente revisión42, Horlocker et al proponen una serie de recomendaciones para disminuir el riesgo de hematoma espinal en este caso:
1. Si se administra dosis preoperatoria, realizar la anestesia a las 10-12 h de la última dosis, evitar las punciones múltiples y tener especial cuidado si aparece sangre aspirada en la aguja de punción.
2. En el postoperatorio la administración de la dosis de HBPM se retrasará 12 h desde la terminación del acto quirúrgico. La retirada del catéter epidural o espinal para la analgesia postoperatoria deberá realizarse 10-12 h después de la última dosis de HBPM y no se administrará la dosis siguiente hasta 2 h después de la movilización del catéter61.
En términos generales, se deberá evitar este tipo de anestesia en pacientes con trastornos hemorrágicos o que estén en tratamiento con fármacos que alteren la hemostasia (antiagregantes, anticoagulantes, antiinflamatorios no esteroides). Todo ello podrá reducir al mínimo el riesgo que supone la asociación de la profilaxis heparínica con este tipo de técnicas de anestesia.
Cirugía laparoscópica
Desde los años ochenta el número de procedimientos laparoscópicos ha ido en aumento. El más frecuentemente utilizado es la colecistectomía laparoscópica, pero a ella se han unido otros como el tratamiento del reflujo gastroesofágico, coledocolitiasis, úlcera duodenal, la afección del intestino delgado y colon, hígado y bazo, cirugía ginecológica y urológica e incluso las intervenciones de urgencia, algunos de los cuales entrañan una importante manipulación quirúrgica.
En principio esta técnica quirúrgica reduce el dolor y, por tanto, permite una más rápida movilización y recuperación del paciente. Sin embargo, este tipo de abordaje necesita una fácil visualización de las vísceras, para lo cual se instaura en muchos casos un neumoperitoneo abdominal con una presión abdominal de 14 mmHg, así como una posición del paciente en Trendelenburg invertido, produciéndose una estasis venosa en las extremidades inferiores que puede predisponer a la aparición de hipercoagulabilidad sanguínea62,63.
Existen estudios, en general con un número de pacientes reducido, que señalan la aparición de complicaciones tromboembólicas en esta cirugía, pero siempre con una incidencia menor que la que se da en cirugía abierta64,65.
Algún trabajo en el que se utiliza profilaxis mecánica y/o farmacológica con HNF refiere una incidencia alta de TVP en el grupo sin profilaxis66.
Otros estudios no sólo señalan menor incidencia que en la cirugía abierta sino que, en aquellos que han valorado marcadores biológicos de activación de la hemostasia sanguínea para detectar la existencia de hipercoagulabilidad, no se ha hallado ningún aumento de éstos e incluso algunos muestran aumento de la fibrinólisis, lo que podría compensar la hipercoagulabilidad que podría inducir la estasis sanguínea67-69.
Se necesitan estudios comparativos con mayor número de pacientes para establecer qué tipo de profilaxis es la adecuada en este tipo de cirugía, en la que la experiencia del cirujano desempeña un papel muy importante.
En principio parece conveniente diferenciar a los pacientes según sus factores generales de riesgo tromboembólico y según el tipo de afección a intervenir. Si se trata de una simple laparoscopia diagnóstica o de cirugía abdominal no oncológica, la mayor parte de las veces no será necesaria la profilaxis farmacológica; si se trata de cirugía oncológica y/o con algún factor de riesgo añadido, se considerará la instauración de profilaxis tromboembólica farmacológica con HBPM con dosis preoperatoria 2-4 h antes de la intervención y continuada cada 24 h hasta la movilización del paciente, que suele ser más rápida que en la cirugía abierta.
Conclusiones
1. En profilaxis quirúrgica las HBPM han demostrado tanta eficacia como la HNF y una menor incidencia de trastornos hemorrágicos.
2. Su excelente biodisponibilidad por vía subcutánea, su mayor vida media plasmática y la homogénea relación dosis/acción biológica hacen que su empleo sea más cómodo y más aceptable para el paciente, que no se precise control analítico y que puedan, por tanto, ser utilizadas extrahospitalariamente, lo que equilibra el mayor gasto económico que suponen estos fármacos.
3. Aunque sus características genéricas son comunes, las HBPM presentan diferencias no sólo con respecto a la heparina clásica sino también entre sí. Esto implica que, en cuanto a su utilización clínica, no constituyen un grupo homogéneo y, por tanto, no son intercambiables. Habrá que establecer siempre su indicación específica de acuerdo con sus características.
4. Las heparinas de muy bajo peso molecular, como la bemiparina, por el menor tamaño de sus cadenas (mayor acción anti-Xa y menor efecto sobre la hemostasia primaria) y su distribución más homogénea (farmacocinética más previsible), proporcionarían una mayor seguridad en la administración preoperatoria a pacientes de alto riesgo tromboembólico.