ntroducción
El tumor papilar mucinoso intraductal del páncreas (TPMI) ha merecido, en estos últimos años, una especial atención por su creciente frecuencia y, por su variada presentación tanto clínica como patológica1-3. La Organización Mundial de la Salud la define como una neoplasia intraductal productora de mucina que se origina en el conducto principal (TPMI-CD) o en sus ramas (TPMI-R). El TPMI ha sido dividido en 4 categorías según el grado de atipia celular: a) adenoma; b) indefinido (border-line); c) carcinoma in situ, y d) carcinoma invasivo. La frecuencia de carcinoma invasivo oscila entre un 25 y un 45%.
La presentación clínica más frecuente3 es con dolor abdominal (49-82%), pancreatitis aguda (13-64%) y pérdida de peso (29-50%). Otras alteraciones clínicas incluyen la aparición brusca de diabetes mellitus (11-72%), la ictericia (9-18%) y la insuficiencia exocrina (7-17%).
Que tengan carcinoma invasivo o no lo tengan es el factor más importante para el pronóstico en estos pacientes con TPMI, por lo que todos los tumores, independientemente de su tamaño, deben ser sometidos a un estudio anatomopatológico. La cirugía debe ser la primera opción en el tratamiento de estos pacientes debido a la dificultad para distinguir entre las formas de TPMI invasivo y no invasivo4.
El TPMI-CD es una lesión difusa del páncreas y requiere desde una pancreatectomía extensa a una pancreatectomía total. El TPMI-R suele asociarse con tumores más pequeños y con menor probabilidad de lesión maligna invasiva que el TPMI-CD, cuya localización preferente está en la cabeza del páncreas, sobre todo en el área del proceso uncinado. La duodenopancreatectomía cefálica tipo Whipple o con preservación pilórica es la técnica utilizada más frecuentemente5,6. Sin embargo, estas características de la TPMI-R permitirían que esta neoplasia pudiera ser tratada con una cirugía conservadora. Entre estas últimas se encuentran la resección parcial de la cabeza pancreática con preservación duodenal (técnica de Beger7), la resección parcial de la cabeza pancreática con extirpación del páncreas ventral y preservación duodenal (técnica de Pedrazzoli et al8), y la resección total de la cabeza pancreática con duodenectomía segmentaria (técnica de Nakao9). Estas técnicas necesitan preservar una adecuada vascularización a distintos niveles del duodeno y del conducto biliar, por lo que podrían tener complicaciones de tipo isquémico.
El propósito de este trabajo es evaluar los resultados de la cirugía conservadora de la región duodenopancreática en pacientes con TPMI-R. También se analizan los resultados de la intervención de Whipple en pacientes con TPMI.
Pacientes y método
Desde enero de 1995 a enero de 2006, se ha intervenido a 34 pacientes (20 varones y 14 mujeres) con TPMI, con una media de edad de 65 años (intervalo, 48-78 años). La enfermedad estaba localizada en 21 pacientes (14 varones y 7 mujeres) en la cabeza del páncreas; en 7 pacientes, en el cuerpo-cola del páncreas, y en 6 pacientes había también un tumor quístico en la cabeza del páncreas y dilatación difusa del conducto de Wirsung.
El grupo de análisis en este trabajo corresponde al subgrupo de 21 pacientes con tumores localizados en la cabeza pancreática. La media de edad era de 68 años (intervalo, 50-78 años). La presentación clínica fue un dolor abdominal (el 100% de los pacientes), pancreatitis recurrente (60%), pérdida de peso (30%), ictericia (30%). La tomografía computarizada (TC) y la colangiorresonancia magnética (CRM) pusieron de manifiesto un TPMI-R en 8 pacientes (tumor quístico entre 3-4 cm, en comunicación con el conducto de Wirsung) y una combinación de TPMI-CP y TPMI-R en 13 pacientes (dilatación del conducto pancreático > 5 mm en todos los casos y junto con nódulos intramurales de un tamaño > 30 mm en 4 pacientes).
La duodenopancreatectomía cefálica según la técnica de Whipple se realizó en el grupo de 13 pacientes por presentar ictericia, identificar en la ecoendoscopia PAAF la presencia de atipias (5 pacientes) o nódulos intramurales de un tamaño > 30 mm (4 pacientes).
La cirugía conservadora de la región duodenopancreática se realizó en 8 pacientes con TPMI-R. En 4 pacientes se efectuó una resección parcial de la cabeza pancreática con preservación duodenal, según la técnica de Pedrazzoli et al8 (RPCP-PD), y en 4 pacientes, una resección total de la cabeza pancreática con duodenectomía (segunda porción duodenal) segmentaria, según la técnica de Nakao9 (RTCP-DS) (figs. 1 y 2).
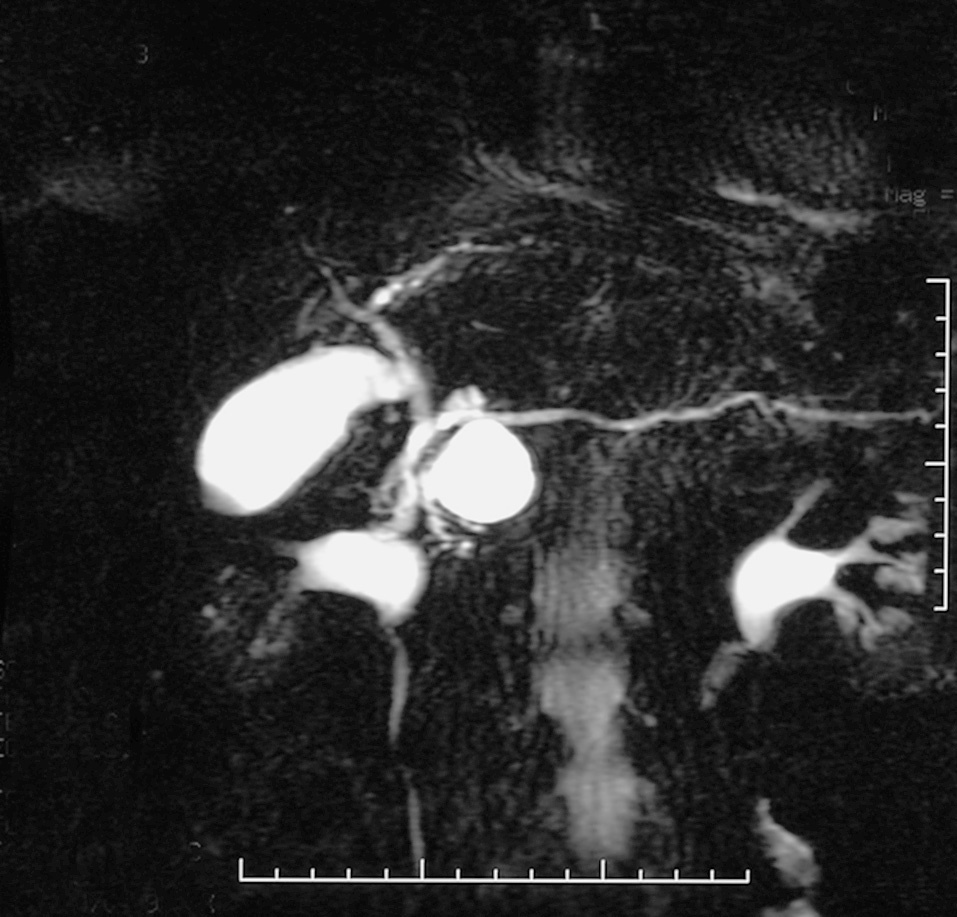
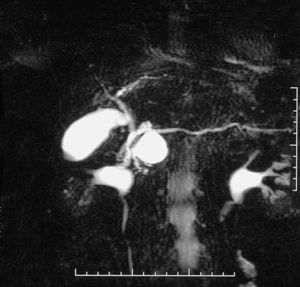
Fig. 1. Colangiorresonancia magnética que muestra tumoración quística en la cabeza del páncreas. Este caso fue tratado con una resección parcial de la cabeza del páncreas con preservación duodenal.
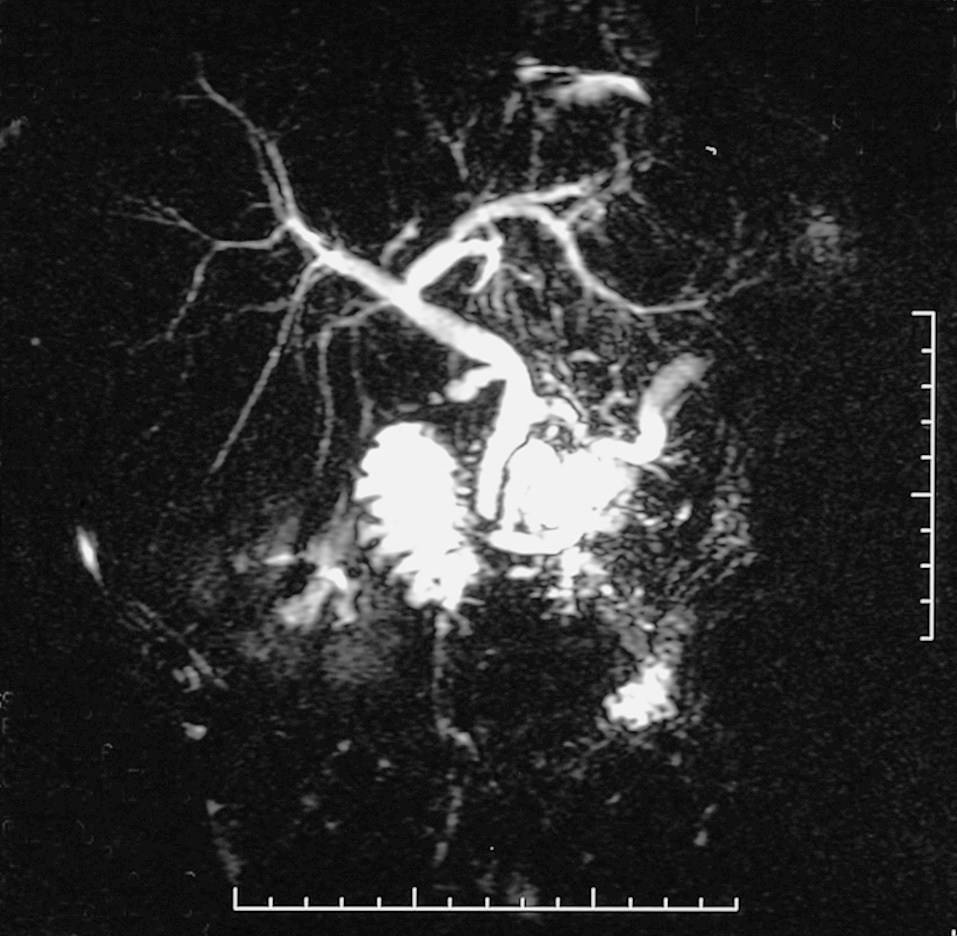
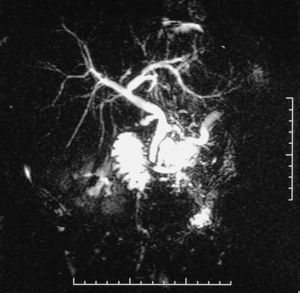
Fig. 2. Colangiorresonancia magnética que muestra tumoración quística en la cabeza del páncreas. Este caso fue tratado con una resección total de la cabeza pancreática con duodenectomía segmentaria.
La técnica de RPCP-PD se desarrolló en los siguientes tiempos quirúrgicos:
1. Disección de la arteria hepática común y localización de la arteria gastroduodenal.
2. Preservación de la arteria gastroduodenal y sus ramas, la arteria pancreaticoduodenal posterosuperior y la arteria pancreaticoduodenal anterosuperior.
3. Se moviliza y libera la cabeza pancreática del eje mesentérico-portal.
4. Se secciona el cuello del páncreas y se retrae la cabeza del páncreas hacia la derecha.
5. Se localiza el tronco de la arteria pancreaticoduodenal inferior. Se liga la arteria pancreaticoduodenal inferoposterior manteniendo la integridad de la arteria pancreaticoduodenal inferoanterior que irriga la segunda y la tercera porción del duodeno.
6. Se localiza el colédoco en su entrada a la cabeza del páncreas.
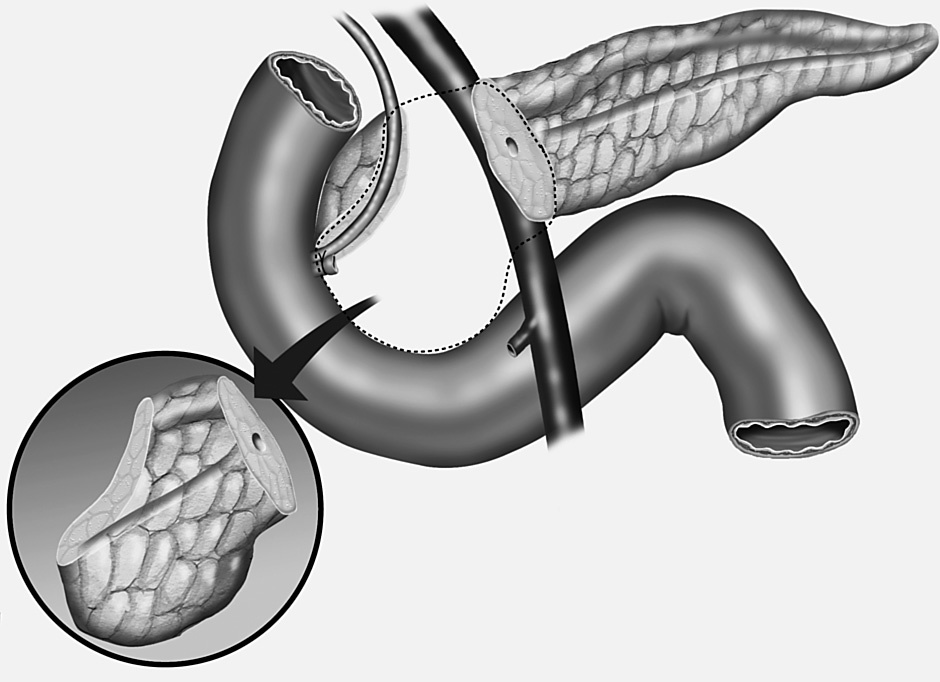
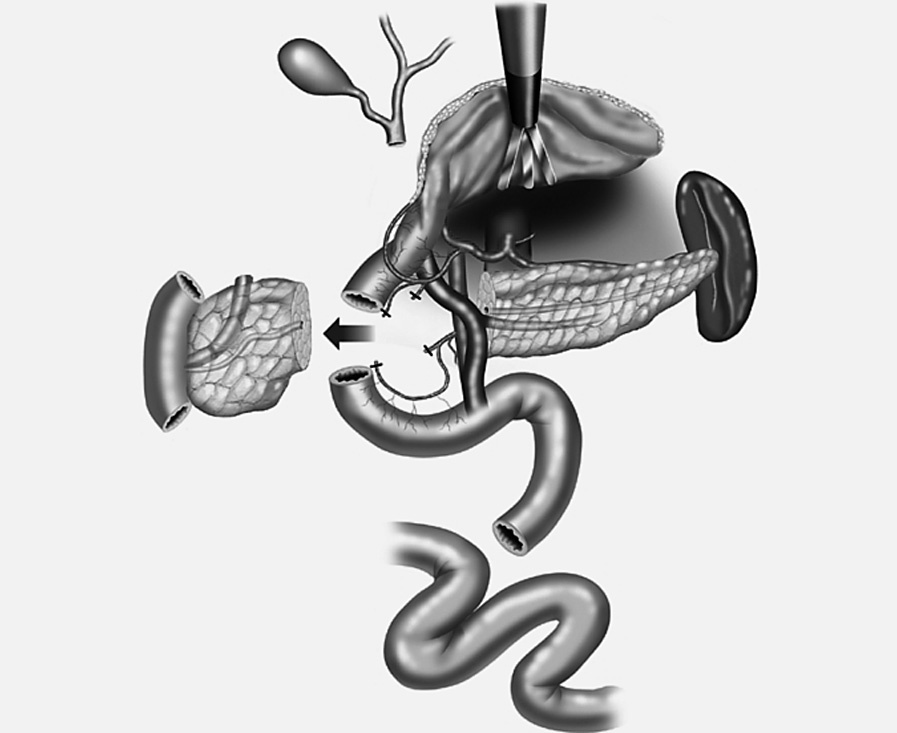
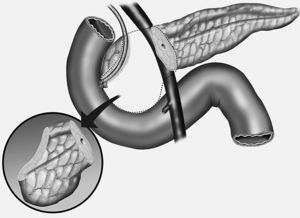
7. Se reseca la cabeza del páncreas desde el cuello hasta el borde derecho del conducto biliar dejando un segmento de tejido pancreático (5-10 mm) adherido al duodeno. Se liga el conducto de Wirsung en su unión con el conducto biliar (fig. 3). El segmento pancreático inferior a la papila de Vater se reseca en su totalidad.
Fig. 3. Técnica de resección parcial de la cabeza pancreática con preservación duodenal. Extirpación total del segmento pancreático de la cabeza inferior a la papila de Vater.
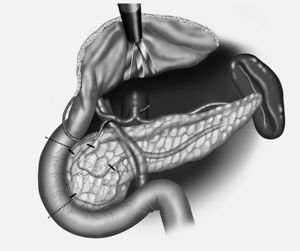
8. Reconstrucción, mediante anastomosis entre el cuerpo-cola del páncreas al yeyuno término-lateral (ducto-yeyunal) en un asa desfuncionalizada en Y de Roux (se deja un stent transanastomótico de Silastic de 3 mm).
La técnica de RTCP-DS se fundamenta en preservar la irrigación de los 4-5 cm de la primera porción duodenal y la tercera porción duodenal, con resección en bloque de la cabeza pancreática en su totalidad y de la segunda porción duodenal. Los tiempos quirúrgicos 1, 2, 3 y 4 en el desarrollo de la técnica son idénticos a los descritos en la técnica de RPCP-PD a excepción de que se ligan las arterias pancreaticoduodenales posterosuperior y anterosuperior.
5. El siguiente paso es la ligadura y sección del colédoco en su entrada en el páncreas.
6. Sección del extremo distal de la primera porción duodenal y sección del duodeno en la unión de la segunda (por debajo de la papila de Vater) y tercera porción duodenal.
7. Linfadenectomía del territorio retroportal.
8. La vesícula biliar se deja in situ y se conserva 2 cm del colédoco.
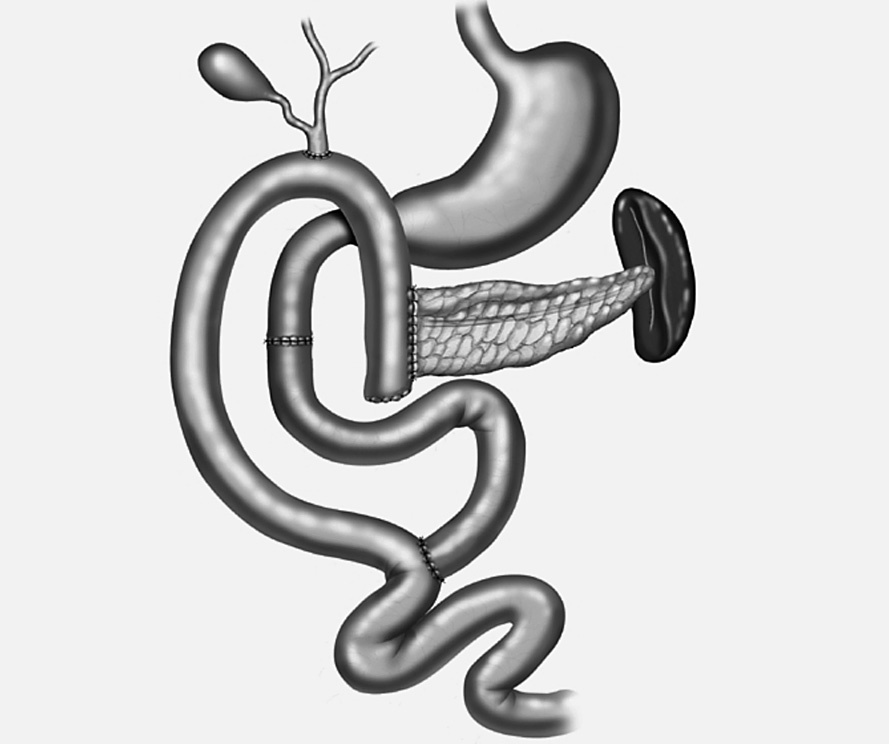
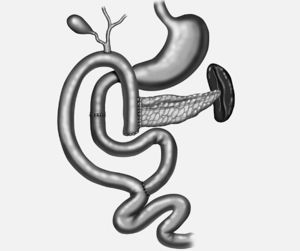
9. En un asa desfuncionalizada en Y de Roux se realiza la reconstrucción mediante una anastomosis pancreático-yeyunal término-lateral (ducto-yeyunal) dejando un stent de Silastic de 3 mm transanastomótico, y anastómosis colédoco-yeyunal término-lateral (figs. 4-6).
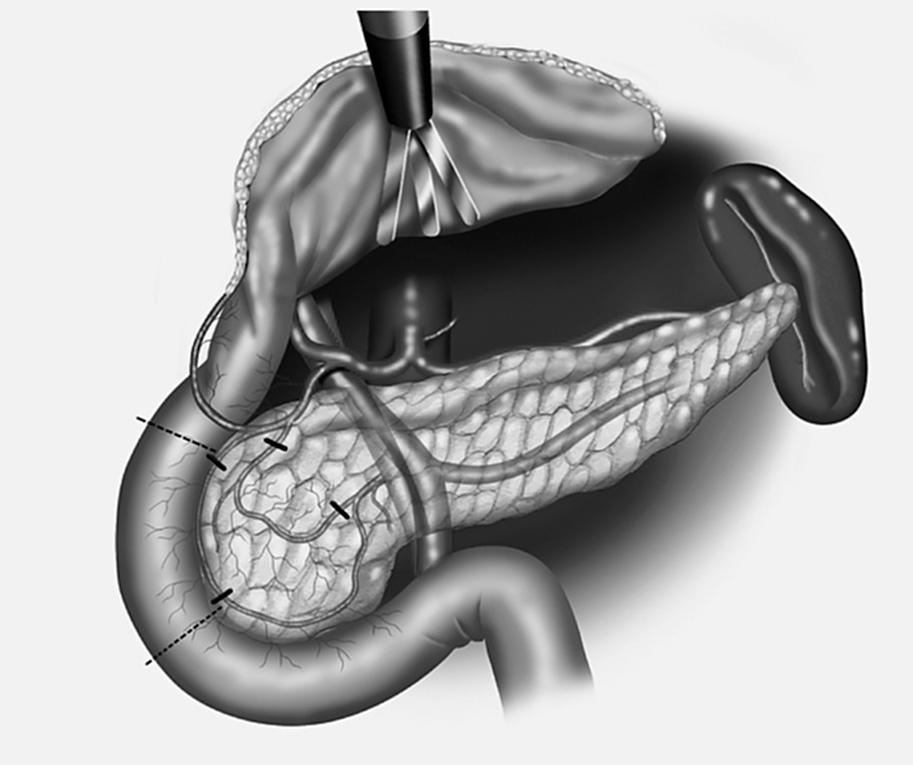
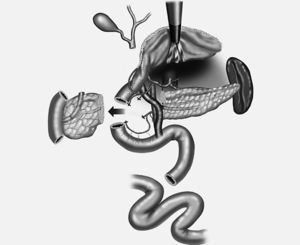
Fig. 4. Técnica de resección total de la cabeza pancreática con duodenectomía segmentaria. Se preserva la arteria gastroduodenal y sus ramas duodenales y la arteria gastroepiploica derecha y sus ramas duodenales y se ligan las ramas pancreaticoduodenales posterosuperior y anterosuperior para mantener vascularizados los 4-5 cm de la primera porción duodenal. Preservación de la arteria pancreaticoduodenal inferior y de su rama, la arteria pancreaticoduodenal inferoanterior, ligando la rama pancreaticoduodenal inferoposterior, para mantener vascularizada la tercera porción duodenal.
Fig. 5. Resección en bloque de la cabeza pancreática y la segunda porción duodenal incluyendo las papilas mayor y menor.
Fig. 6. Reconstrucción mediante una duodeno-duodenostomía y en un asa desfuncionalizada en Y de Roux, anastomosis pancreaticoyeyunal término-lateral y coledocoyeyunal término-lateral.
Se analizaron factores intraoperatorios y postoperatorios. Entre los primeros, la duración de la intervención quirúrgica y las pérdidas sanguíneas (necesidad de transfusión de sangre o no). Entre los factores postoperatorios, las complicaciones generales y locales y la estancia media hospitalaria. Por último, se realizó un estudio anatomopatológico de las piezas quirúrgicas. El seguimiento clínico fue variable. Desde 1995 hasta 2000, la técnica de Whipple fue la técnica de elección. Desde 2000 incorporamos la técnica de RPCP-PD, y la técnica de RTCP-DS desde noviembre de 2005 hasta la actualidad.
Resultados
En el grupo de pacientes que sufrieron una duodenopancreatectomía cefálica, la duración media de la intervención quirúrgica fue de 330 min (intervalo, 240-360 min). Ningún paciente necesitó de una transfusión sanguínea. En el 38% aparecieron complicaciones postoperatorias, entre las que destacan 1 atelectasia, 2 fístulas pancreáticas de bajo débito (< 100 ml) y 1 infección parcial de la herida quirúrgica. La estancia media hospitalaria fue de 22 días (intervalo, 16-25 días). El estudio anatomopatológico demostró: carcinoma invasivo en 5 pacientes, adenoma en 5 pacientes y carcinoma in situ en 3 pacientes. En el grupo de pacientes sometidos a RPCP-PD, técnica de Pedrazzoli8, la duración media de la intervención fue de 260 min (intervalo, 200-290 min). Ningún paciente necesitó de una transfusión sanguínea. Entre las complicaciones postoperatorias, un paciente presentó una fístula pancreática de bajo débito (< 100 ml), que fue tratada de modo conservador. Todos los pacientes presentaron un retraso del vaciamiento gástrico que hizo mantener el tratamiento con alimentación parenteral durante un período superior a las 3 semanas . La estancia hospitalaria media fue de 27 días (intervalo, 24-30 días). El estudio anatomopatológico demostró en 3 pacientes un adenoma y en 1 paciente un carcinoma in situ. En el grupo de pacientes a los que se sometió a la RTCP-DS, el tiempo medio de intervención fue de 260 min (intervalo, 190-290 min). En ningún caso fue necesaria una transfusión sanguínea. Entre las complicaciones postoperatorias, tan sólo un paciente presentó una fístula pancreática de bajo débito (< 100 ml), tratada de modo conservador (tabla 1). La estancia media hospitalaria fue de 16 días (intervalo, 15-17 días). La lesión anatomopatológica en todos los casos fue en 3 pacientes un adenoma y en 1 paciente un carcinoma in situ.
El seguimiento medio de estos pacientes fue variable, de 22 meses (intervalo, 6-36 meses) con la técnica de RPCP-PD que introdujimos en nuestra práctica en 2000 y de 4 meses (intervalo, 2-6 meses) con la técnica RTCP-DS. En este seguimiento a corto plazo no se ha observado recidiva tumoral. En el grupo de pacientes con la intervención de Whipple, el seguimiento medio fue 52 meses (intervalo, 6-120 meses). En este grupo tan sólo un paciente con TPMI invasivo falleció a los 5 años de la cirugía con enfermedad metastásica.
Discusión
La dificultad más importante en la elección del tratamiento del TPMI es conocer si el tumor es invasivo o no. Por los estudios radiológicos mediante TC o CRM se puede sospechar las lesiones malignas cuando el tumor invade el duodeno o el conducto biliar y también por la presencia de nódulos intramurales o la dilatación del conducto pancreático10-12.
De gran utilidad es la CRM en la distinción entre TPMI-CD y TPMI-R13-18. En una de las series con mayor número de pacientes con TPMI, Sohn et al19 encontraron que el TPMI no invasivo se encontró en el 53% de la variedad TPMI-R, el 22% en el TPMI-CD y el 25% cuando estaban presentes ambas variedades patológicas. En este estudio el TPMI invasivo sólo se encontró en el 25% de TPMI-R, en el 35% de TPMI-CD y en el 25% cuando se encontraba ambas lesiones. Estas observaciones también han sido confirmadas en las publicaciones de Bernard et al17 y Doi et al20, que señalan a la variedad TPMI-R como la que con menor frecuencia presenta un adenocarcinoma infiltrante cuando se la compara con el TPMI-CD.
La ecoendoscopia combinada con PAAF permite no sólo confirmar los datos de las exploraciones radiológicas, sino establecer la sospecha de malignidad por el estudio de la arquitectura celular del tumor. La colangiografía endoscópica retrógrada es utilizada por los cirujanos japoneses para el estudio de las células malignas en el jugo pancreático13.
La resección quirúrgica es el tratamiento de elección para la mayoría de los pacientes con TPMI. La supervivencia a los 5 años después de la cirugía está entre el 77 y el 100% de los casos en que el tumor no es invasivo3. En un 25-45% de los casos, el TPMI es concomitante a un adenocarcinoma infiltrante3. En esos casos, la cirugía oncológica, la duodenopancreatectomía cefálica para tumores de la cabeza (Whipple o con preservación pilórica), la pancreatectomía corpóreo-distal para tumores del páncreas izquierdo y la pancreatectomía total para lesiones difusas, combinada con una linfadenectomía regional, consiguen una supervivencia a los 5 años entre el 27 y el 60%3. Esta supervivencia es notablemente superior a la que se consigue con una cirugía oncológica para los pacientes con un adenocarcinoma ductal del páncreas21.
La cirugía conservadora sería la indicada para los pacientes con TPMI-R localizados en la cabeza pancreática y con lesiones patológicas tales como adenoma, border line y adenocarcinoma in situ. Se ha descrito una serie de técnicas conservadoras que incluyen la resección parcial de la cabeza pancreática con preservación duodenal según la técnica de Beger7, resección parcial de la porción superior de la cabeza pancreática con preservación duodenal junto con resección total de la porción inferior de la cabeza pancreática según la técnica de Pedrazzoli8, la resección aislada del páncreas ventral de la cabeza22,23, la resección total de la cabeza pancreática con duodenectomía segmentaria según la técnica de Nakao9 y la técnica de Nakao modificada por Isaji et al24. A excepción de esta última técnica, todas las anteriormente mencionadas de resección parcial de la cabeza pancreática con preservación duodenal tienen como problema principal que no aseguran una extirpación del TPMI debido a la particular difusión del tumor al conducto principal y sus ramas. En esos casos, el riesgo de la recidiva tumoral podría tener una gran importancia biológica si el TPMI se combinara con un adenocarcinoma infiltrante.
No menos importantes que las críticas en la aplicación de las técnicas de resección parcial de la cabeza con preservación duodenal son las posibles complicaciones isquémicas en el duodeno y el conducto biliar que estas técnicas pueden tener. El cirujano, en un intento de resecar la mayor proporción de tejido pancreático de la cabeza pancreática preservando el conducto biliar para evitar la recidiva tumoral, puede lesionar las ramas de la arteria pancreaticoduodenal posterosuperior que discurren en el segmento pancreático entre el conducto biliar y el duodeno hasta alcanzar la papila de Vater25. Si ocurre esta eventualidad, las lesiones isquémicas pueden aparecer en el conducto biliar, el duodeno o la papila de Vater26. Recientemente, Hirano et al27 realizaron la técnica de Beger en 13 pacientes con TPMI. El tiempo medio de la intervención fue de 430 min. Ningún paciente necesitó una transfusión sanguínea. La mortalidad fue del 15% (2 pacientes). Entre las complicaciones postoperatorias se observó: fístula pancreática en 3 (23%) pacientes, perforación del conducto biliar en 1 (8%) y hemorragia intraperitoneal en 2 (15%). En ese trabajo la mortalidad y la morbilidad de la aplicación de esta técnica por el tratamiento de TPMI son notablemente mayores que las publicadas en el tratamiento de los pacientes con pancreatitis crónica tumoral de la cabeza pancreática28. Pedrazzoli8 realizó la técnica de RPCP-PD en 6 pacientes con tumores benignos de la cabeza pancreática (ningún paciente presentaba TPMI) y 4 de ellos presentaron complicaciones postoperatorias, colecciones intraabdominales (2), fístula pancreática (2) y fístula biliar (2).
En el análisis de nuestra experiencia, hay que señalar que las técnicas conservadoras de la región duodenopancreática tuvieron un tiempo operatorio medio menor que con la técnica de Whipple. Sin embargo, la técnica de RPCP-PD conllevó con mayor frecuencia (el 100% de los casos) un retraso del vaciamiento gástrico, por lo que la estancia hospitalaria media fue en estos pacientes incluso superior a la del grupo de pacientes después de la intervención de Whipple. En recientes trabajos, un 20-30% de los pacientes después de duodenopancreatectomía cefálica presenta un retraso del vaciamiento gástrico. Entre los factores que se señalan como posibles causantes de esta complicación están las alteraciones de la motilidad gástrica en los casos de fístulas anastomóticas o abscesos, atonía gástrica por resección del pacemaker duodenal y atonía gástrica por disminución la motilina circulante. De interés fue la observación de Murakami et al29 de que el 25% de los pacientes a los que se realizó una RTCP-DS con la reconstrucción pancreaticogástrica presentó un retraso del vaciamiento gástrico. En nuestra serie ninguno de los pacientes a los que se realizó la RTCP-DS con la reconstrucción pancreaticointestinal presentó esta complicación, lo que permitió una estancia hospitalaria más corta que en los otros grupos. A pesar de que nuestra serie es reducida en el número de casos, creemos que el mantenimiento del tránsito gastroduodenal y la técnica de reconstrucción mediante la pancreatoyeyunostomía pueden evitar el retraso al vaciamiento gástrico. Además, las secreciones pancreáticas y biliares se derivan a un asa desfuncionalizada en Y de Roux, por lo que, a una eventual fístula de la duodeno-duodenostomía, la repercusión clínica sería de menos trascendencia que la que tendría lugar con la reconstrucción tipo Nakao con la anastomosis pancreaticogástrica y coledocoduodenal. En nuestra técnica de RTCP-DS se mantiene la vesícula biliar in situ, descartada la presencia de cálculos.
La frecuencia de fístula pancreática fue similar en los 3 grupos. En todos los casos fueron fístulas de bajo débito, controladas con tratamiento conservador. La posibilidad de esta complicación debe tenerse en cuenta, por lo que es aconsejable dejar los tubos de drenaje uno por encima y otro por debajo de la anastomosis pancreático-yeyunal.
El estudio anatomopatológico de las piezas extirpadas después de la utilización de técnicas de resección conservadoras de la región pancreático-duodenal demostró en todos los casos la ausencia de un carcinoma invasivo. El seguimiento medio de estos pacientes fue variable, de 22 meses (intervalo, 6-36 meses) con la técnica de RPCP-PD que introdujimos en nuestra práctica en 2000 y de 4 meses (intervalo, 2-6 meses) con la técnica RTCP-DS. En este seguimiento a corto plazo no se ha observado recidiva tumoral. En el grupo de pacientes con la intervención de Whipple el seguimiento medio fue 52 meses (intervalo, 6-120 meses). En este grupo tan sólo un paciente con TPMI invasivo falleció a los 5 años de la cirugía con enfermedad metastásica.
Conclusiones
La duodenopancreatectomía cefálica es la técnica de elección en los casos de TPMI con sospecha de lesión maligna. La cirugía conservadora en los pacientes con TPMI-R localizada predominantemente en la cabeza pancreática está justificada por la elevada frecuencia de lesiones benignas. La resección total de la cabeza pancreática con duodenectomía segmentaria, en casos seleccionados, tiene como ventajas sobre las técnicas de resección parcial de la cabeza pancreática con preservación duodenal que es una intervención más anatómica, se reseca por completo la cabeza pancreática donde se localiza el tumor y tiene la posibilidad de efectuar una linfadenectomía del área retroportal. La RTCP-DS tuvo una menor morbilidad postoperatoria y una estancia hospitalaria más corta.
Departamento de Cirugía. ICMD. Hospital Clínic de Barcelona. Universidad de Barcelona. Barcelona. España.
Correspondencia: Prof. L. Fernández-Cruz.
Departamento de Cirugía. Hospital Clínic.
Universidad de Barcelona.
Villarroel, 170. Escalera 6, 4.a planta. 08036 Barcelona. España.
Correo electrónico: lfcruz@clinic.ub.es
Manuscrito recibido el 27-4-2006 y aceptado el 4-7-2006.