Introducción. El virus C de la hepatitis permanece en el organismo después del trasplante hepático y produce hepatitis del injerto en un alto porcentaje de pacientes. Sin embargo, su papel sobre la supervivencia a largo plazo de los pacientes e injertos sigue siendo un tema importante de discusión.
Objetivos. Conocer la repercusión de la infección por virus C sobre la histología de los injertos trasplantados y la supervivencia de los mismos y la de los pacientes.
Pacientes y métodos. Se estudia la evolución de los primeros 174 trasplantes efectuados en 161 pacientes infectados por el virus C (31,5% de los 551 realizados entre junio de 1989 y noviembre de 1999 por nuestro grupo), mediante el estudio histológico de los injertos y el análisis de supervivencia de injertos y pacientes.
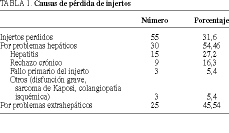
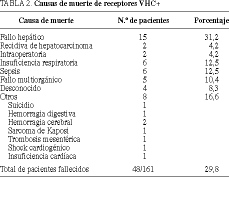
Resultados. Cincuenta y cinco injertos (31,6%) se perdieron, 30 (54,4%) por problemas primarios hepáticos: 15 (27,2%) por hepatitis, nueve por rechazo crónico, tres por fallo primario del injerto y tres por otras razones. En 101 injertos (58,0%) se observó hepatitis, 24 con precirrosis o cirrosis (f de Scheuer > 2). En injertos funcionantes con biopsia posterior, a los 3 meses del trasplante hubo un 85,2% de hepatitis. Cuarenta y ocho pacientes (29,8%) fallecieron, 17 de ellos por causas hepáticas. La supervivencia actuarial de pacientes e injertos fue similar a un grupo sincrónico de trasplantados por enfermedad parenquimatosa no infectados por el virus C de la hepatitis.
Conclusiones. La infección por el virus C de la hepatitis afecta de forma adversa el injerto hepático, conduciendo a una hepatitis de rápida progresión en un alto porcentaje de pacientes. En nuestra experiencia, casi un tercio de los injertos que se perdieron lo fueron por hepatitis. Sin embargo, durante el tiempo de seguimiento estudiado no hubo diferencias significativas de supervivencia de injertos y pacientes entre los infectados y no infectados por el virus C.
Introduction. Hepatitis C virus remains in the organism after liver transplantation, producing hepatitis in the graft in a high percentage of patients. However, its effect on the long-term survival of patients and grafts continues to be an important subject for discussion.
Objectives. To determine the impact of hepatitis C virus infection on the histological findings in liver transplants, on graft survival and on that of the recipients.
Patients and methods. We studied the outcome of the first 174 transplants performed in 161 patients infected with hepatitis C virus (31.5% of the 551 carried out by our team between June 1989 and November 1999). The assessment was based on the histological study of the grafts and analysis of graft and patient survival.
Results. Fifty-five (31.6%) of the grafts were lost, 30 of them (54.4%) because of primary liver-related problems: 15 (27.2%) due to hepatitis, 9 due to chronic rejection, 3 due to primary graft failure and 3 due to other causes. One hundred one grafts (58.0%) presented hepatitis, 24 showed precirrhotic lesions or cirrhosis (Scheuer grade > 2). Hepatitis was detected in 85.2% of the functioning grafts subjected to biopsy more than three months after transplantation. Forty-eight patients (29.8%) died, 17 of them due to liver-related problems. The actuarial survival of patients and grafts was similar to that of a matching group of patients without hepatitis C virus infection, undergoing liver transplantation to treat parenchymal disease during the same interval of time.
Conclusions. Hepatitis C virus infection has an adverse effect on the liver graft, leading to a rapidly progressing hepatitis in a large percentage of patients. In our experience, nearly a third of the grafts lost were attributed to hepatitis. However, over the study period, there were no significant differences between infected and noninfected recipients in terms of graft and patient survival.
Introducción
En la actualidad, la cirrosis hepática en relación con el virus de la hepatitis C (VHC) es la indicación más frecuente de trasplante hepático en muchos centros. En una encuesta realizada en 1992 en España a centros con unidades de trasplante hepático1, se observó que el 46% de los receptores presentaban anticuerpos contra el VHC (anti-VHC) (detectados mediante ELISA II) o ARN del virus en suero (ARN-VHC +) por reacción en cadena de la polimerasa (PCR).
La infección se puede adquirir también en el peritrasplante2-4, a través del órgano trasplantado o los hemoderivados transfundidos. La infección por el virus persiste tras el trasplante hepático en la inmensa mayoría de los pacientes2,5,6, haciéndose crónica; se comprueba la viremia de forma temprana, persistente con valores altos. Sin embargo, no en todos los pacientes se demuestra hepatitis en el injerto, variando ampliamente el porcentaje de afectación según las publicaciones4,7,8, aunque bien es cierto que las últimas referencias apuntan a una prevalencia cada vez más alta (88-90%)9,10. La evolución histológica que se ha comprobado parece progresar desde hepatitis lobulillar aguda a hepatitis crónica con agregados linfoides en la mayoría de los pacientes11, con fibrosis importante en un tercio y hepatopatía terminal en el 16%11. Se observa un incremento del índice de actividad histológica de la hepatitis, desde la primera biopsia disponible hasta la última, estadísticamente significativo4.
El curso clínico de la enfermedad es benigno en la mayoría de los pacientes, tras un seguimiento corto, con una lenta progresión2,12. En un reducido porcentaje de enfermos, cercano al 10%, se ha descrito una evolución agresiva, con pérdida del injerto en semanas o pocos meses13,14.
Aun cuando la afectación del injerto por el virus es tan frecuente, hasta la actualidad la mayoría de los autores no han encontrado una disminución significativa de la supervivencia de injertos o pacientes en relación con otros grupos etiológicos, salvo excepciones15.
El objetivo de este trabajo es exponer nuestra experiencia con los pacientes con infección por el virus C, describiendo los hallazgos histológicos de los injertos y las consecuencias sobre la supervivencia de éstos y de los sujetos afectados.
Pacientes y métodos
Pacientes
Consideramos todos los pacientes adultos trasplantados con infección por el virus de la hepatitis C desde junio de 1989 hasta noviembre de 1999. Para el diagnóstico de infección se hizo necesaria la presencia de ARN-VHC en suero.
Cirugía del trasplante
Ha sido descrita previamente16. Hasta noviembre de 1989 se utilizó la bomba de bypass venovenoso en adultos, para posteriormente hacer clampaje total de vena cava inferior (VCI) sin bomba hasta noviembre de 1992, fecha a partir de la cual empleamos la preservación de VCI o piggy-back de forma sistemática.
Inmunosupresión
La inmunosupresión inicial fue triple terapia con ciclosporina, azatioprina y esteroides. La azatioprina se intentó retirar a los 3 meses del trasplante, y los esteroides alrededor del año de la intervención. La aparición de la ciclosporina Neoral hizo que todos los pacientes tratados con la ciclosporina anterior pasaran progresivamente a la nueva formulación, y todos los pacientes nuevos comenzaran directamente con neoral. El tacrolimus con esteroides se utilizó a partir de 1993 dentro de un ensayo clínico, y de forma regular desde 1997, tras la autorización en España.
Serología y determinación de ARN-VHC
La determinación de anticuerpos del VHC se hizo mediante la prueba de ELISA de segunda generación (Ortho Diagnostics, Raritan, NJ). Ésta se llevó a cabo antes del trasplante y cada 6 meses en el seguimiento. El estudio de ARN-VHC en suero se realizó con extracción con método de guanidin tiocianato-fenol-cloroformo y transcripción inversa a cADN. La PCR se realizó como reacción en dos etapas con dos pares de nested primers correspondientes al fragmento de la región 5' no traducida3,4. Los productos de amplificación se sometieron a electroforesis en gel de agarosa al 2% (Nusieve, FMC, Bioproducts, Rockland, ME), se tiñeron con bromuro de etidio y se fotografiaron con luz ultravioleta.
Anatomía patológica
Se obtuvo una biopsia hepática cada vez que estuvo clínicamente indicada, sobre todo en relación con alteración del perfil hepático bioquímico. Las biopsias fueron estudiadas por dos patólogos.
Se consideró hepatitis del injerto la presencia de necrosis hepatocitaria e infiltración portal o lobulillar por células mononucleares. La clasificación en hepatitis crónica persistente, crónica activa y lobulillar se hizo según descripciones previas17. El diagnóstico de rechazo agudo y crónico se ajustó a las definiciones internacionalmente aceptadas18.
Análisis estadístico
La supervivencia actuarial de injertos, pacientes y la tasa de hepatitis acumulada se calcularon mediante el método de Kaplan-Meier, utilizándose la prueba de Mantel-Haenszel para determinar el grado de significación de la diferencia estadística.
Resultados
Entre junio de 1989 y noviembre de 1999 realizamos 174 trasplantes hepáticos en 161 pacientes (106 varones y 55 mujeres) con ARN-VHC+, lo que supone un 31,5% de los 551 trasplantes hepáticos del período considerado. El bypass venovenoso sólo se usó en el primero de los pacientes del grupo de estudio, en 46 trasplantes hepáticos se utilizó clampaje total y en 127 la técnica de preservación de VCI. Casi todos los injertos utilizados fueron totales, menos dos reducidos y uno consistente en un lóbulo derecho de un compartido (split).
En la mayoría de los pacientes, la indicación primaria de trasplante hepático fue el deterioro progresivo de la función hepática por la cirrosis asociada al VHC (148 pacientes). En 4 pacientes, la indicación primaria fue la presencia de hepatocarcioma sobre cirrosis, en cinco una hepatopatía colestásica con sobreinfección por VHC, en tres metabolopatía (2 hemocromatosis, una enfermedad de Wilson) junto con infección viral y en uno hiperplasia nodular regenerativa difusa e infección por VHC. En 37 pacientes se asoció ingestión abusiva de alcohol. Tres pacientes asociaron infección por virus B de hepatitis.
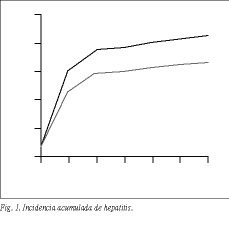
En el 58,0% (101/174) de los injertos se observó hepatitis. Si nos ceñimos a los injertos funcionantes, esta proporción ascendió al 65,5% (78/119). Si además tenemos tan sólo en cuenta aquellos injertos funcionantes con biopsia posterior al mes del trasplante hepático, el porcentaje de los que desarrollaron hepatitis fue del 83,8% (78/93), y en aquellos con biopsia posterior a los 3 meses del 85,2% (69/81). Si representamos gráficamente la incidencia acumulada de hepatitis en el tiempo obtenemos las curvas de la figura 1, en la que se representan, por un lado, todos los injertos funcionantes, y por otro, aquellos con biopsia posterior al día 30 postrasplante hepático.
Atendiendo a la gravedad de la hepatitis, se observó que en 26 injertos perdidos con diagnóstico previo de hepatitis, la causa final de pérdida del mismo fue hepatitis en 16 (61,5%), rechazo crónico en cuatro y otras en seis. Se observaron cambios cirróticos o precirróticos en 24 injertos, lo que equivale a un grado de fibrosis mayor de 2 en la gradación de Scheuer. Quince de estos órganos seguían funcionantes en el momento del análisis, y siete de los que se perdieron lo fueron por fallo hepático.
La supervivencia global de injertos fue del 68,3% (119/174), perdiéndose un 31,6% de injertos por diversas causas. Más de la mitad de ellos se perdieron por problemas hepáticos (54,4%) (tabla 1), y más de la cuarta parte (27,2%) por hepatitis.
La mortalidad global afectó a 48 pacientes (29,8%), falleciendo más de un tercio de ellos (17/35,4%) por causa hepática. En la tabla 2 se representan los distintos grupos de causa de muerte.
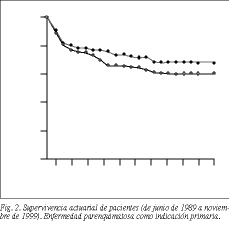
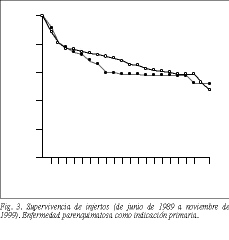
Para depurar el efecto del VHC sobre la supervivencia de los pacientes y los injertos se eliminaron de las curvas aquellos pacientes cuyo motivo de trasplante primario no fuera la propia enfermedad parenquimatosa (tumores, otras etiologías asociadas, etc.) o estuvieran infectados por el virus de la hepatitis B, resultando así 141 pacientes. Se compararon con un grupo de trasplantados adultos numéricamente similar (160 pacientes) de la misma época sin infección por virus C o B, y cuya indicación primaria fue también enfermedad parenquimatosa. Se observó que no había diferencias estadísticamente significativas entre las supervivencias de pacientes y de injertos de ambos grupos (figs. 2 y 3). La supervivencia esperada del injerto al año y a los 5 años fue del 74,5 y del 59,8% para los pacientes VHC+, y del 77,2 y del 66,0% para los VHC. La de los pacientes fue de 80,1 y del 65,2% para infectados y del 80,7 y del 72,0% para no infectados.
Discusión
Casi ningún paciente es capaz de eliminar de su organismo el VHC después del trasplante hepático. Cuando tan sólo se tenían en cuenta los anti-VHC como parámetro de presencia del virus, se llegó a creer que la infección por VHC no era un factor de riesgo de hepatitis postrasplante19. La utilización de la PCR ayudó a demostrar que la infección por VHC pretrasplante estaba en clara asociación con la viremia y la aparición de hepatitis postrasplante2. La infección del injerto por el virus presente antes del trasplante hepático se ha demostrado por la secuenciación de nucleótidos del dominio hipervariable de la región E2/NS1 del virus20. La infección postrasplante hepático se hace crónica, con viremia temprana, persistente y con valores altos.
Como se ha mencionado, se ha comprobado que la presencia de hepatitis en los injertos es elevadísima. En el estudio multicéntrico realizado en España sobre los pacientes trasplantados en 19921, el 66% de los pacientes con anti-VHC pretrasplante hepático (68/113) presentaron hepatitis tras el trasplante hepático. En el estudio multicéntrico europeo sobre 652 pacientes anti-VHC trasplantados entre 1984 y 199521, el 61% de los sujetos biopsiados (312/513) tenían hepatitis del injerto. Estas incidencias son similares a la de nuestra serie, si bien algo menores, lo cual es explicable por ser datos procedentes de diversas instituciones, donde los criterios de biopsia postrasplante hepático son distintos. Además, en el estudio multicéntrico español, el tiempo de seguimiento fue menor, por lo que la incidencia esperada de hepatitis aumentaría con el tiempo. Así, en el estudio europeo se comprobó que la incidencia actuarial de hepatitis aumentaba del 68% a los 3 años a 80% a los 5 años. Se comprueba que la evolución de la hepatitis por VHC es más rápida en el sujeto trasplantado por el efecto de la inmunosupresión. Así, en el estudio multicéntrico europeo se observó que había cirrosis o fibrosis severa en un 5% de pacientes a una media de 2 años del trasplante hepático (en 3 pacientes durante lo primeros 3 meses). Además, la tasa actuarial de cirrosis a 3 y 5 años fue del 5 y 10%, y a los 8 años del ¡24%! (pero sólo el 10% de los pacientes tenían biopsias más allá de 5 años postrasplante hepático). Estos datos concuerdan con el 13,8% (24/174) de injertos con cambios precirróticos o cirrosis en nuestra serie.
Los resultados de supervivencia actuarial para pacientes e injertos en nuestra serie son desfavorables para los casos con infección por VHC, pero sin llegar a poner de manifiesto una diferencia significativa, aun cuando son de un 6,8% para pacientes y un 6,2% a los 5 años a favor de los no infectados. En el estudio multicéntrico español, la supervivencia actuarial de pacientes e injertos fue mejor en el grupo de infectados, con diferencia estadística para los injertos (p = 0,04), pero los datos eran referentes a 6, 12 y 24 meses. En el estudio multicéntrico europeo se comprobó que el único factor que influía en la supervivencia de injertos y pacientes era la asociación de hepatocarcinoma.
Todo esto hace pensar que, dado que los injertos de pacientes infectados por VHC tienen una alta probabilidad de sufrir hepatitis, y que en un porcentaje nada desdeñable ésta es de rápida evolución a cirrosis, aun cuando en las experiencias comunicadas hasta la fecha no sea habitual comprobar una influencia significativa en la supervivencia de pacientes e injertos, un tiempo mayor de seguimiento casi con toda probabilidad demostrará el impacto negativo de la infección.
Concluyendo, podemos afirmar que, en nuestra experiencia, la infección por VHC afecta negativamente al injerto hepáti co, produciendo hepatitis en un alto porcentaje de pacientes (el 83,8% de los injertos funcionantes con biopsia posterior a los 30 días del trasplante hepático presentaron hepatitis), siendo ésta de rápida progresión. Así, casi un tercio de los injertos que se perdieron lo fueron debido a hepatitis y el 61,5% de los injertos perdidos con hepatitis demostrada lo hicieron por progresión de la enfermedad.
Sin embargo, con el seguimiento considerado, la supervivencia de los pacientes e injertos con infección por VHC fue similar al del trasplante hepático en pacientes sin infección viral con enfermedad parenquimatosa como indicación primaria.