Introducción. Este trabajo estudia el comportamiento del ácido hialurónico de membrana en los procesos mamarios benignos y malignos, así como su posible asociación con determinados parámetros clinicobiológicos que pueden incidir directamente en el comportamiento posterior de estos últimos.
Pacientes y métodos. Hemos determinado las concentraciones de ácido hialurónico en la membrana celular de 45 tejidos mamarios normales, 21 fibroadenomas, 174 carcinomas ductales infiltrantes y 16 carcinomas lobulillares infiltrantes, comparando los resultados con otros parámetros clínicos y biológicos habitualmente determinados en nuestro laboratorio.
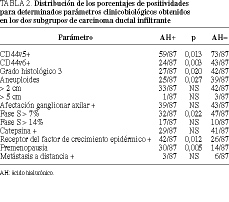
Resultados. En los carcinomas ductales infiltrantes, las concentraciones de ácido hialurónico oscilaron entre 49 y 6.843 ng/mg, con una mediana de 1.463 ng/mg de proteína), no difiriendo de las constatadas en los tejidos normales y carcinomas lobulillares infiltrantes (i = 208-5.246; mediana 1.589 ng/mg de proteína), pero siendo inferiores a los de los fibroadenomas (p = 0,00069). Los casos de carcinomas ductales infiltrantes positivos para ácido hialurónico (> 1.463 ng/mg de proteína, mediana del grupo global) se dieron preferentemente en mujeres premenopáusicas (p = 0,005), presentaron mayores porcentajes de positividades (p = 0,010) para el receptor del factor de crecimiento epidérmico y fueron menos frecuentemente CD44v5+ (p = 0,013), CD44v6+ (p = 0,003), grado histoló gico 3 (p = 0,020), aneuploides (p = 0,027) y proliferativos (fase S > 7%; p = 0,022).
Conclusiones. Los resultados anteriores sugieren que la concentración de ácido hialurónico de membrana se asocia a determinadas propiedades clinicobiológicas de los carcinomas ductales infiltrantes de mama, que pueden incidir en su comportamiento posterior. Asimismo, nuestros hallazgos pueden ayudar a comprender las discrepancias descritas en la bibliografía acerca de la utilidad clínica de las diferentes isoformas variantes del CD44 en los carcinomas mamarios.
Introduction. We studied the differences in the cell surface content of hyaluronic acid (HA), a proteoglycan of the extracellular matrix involved in certain biological functions, observed in benign and malignant breast disease, as well as their possible association with specific clinico-biological parameters that can influence the clinical outcome of infiltrating ductal carcinomas (IDC).
Patients and methods. We analyzed the cell surface HA levels in 45 samples of normal breast tissue, 21 fibroadenomas, 174 IDC and 16 infiltrating lobular carcinomas, correlating the results with other standard clinical and biological parameters determined in our laboratory.
Results. In IDC, the levels of HA ranged between 49 and 6,843 ng/mg protein (median: 1,463 ng/mg protein) and were similar to those observed in normal tissue (range: 50 to 12,860 ng/mg protein; median: 1,178 ng/mg protein) and in infiltrating lobular carcinoma (range: 208 to 5,246 ng/mg protein; median: 1,589 ng/mg protein), but lower (p = 0.00069) than those detected in fibroadenoma (range: 314 to 21,630 ng/mg protein; median 2,752 ng/mg protein). When IDC were characterized in terms of positivity for HA (> 1,463 ng/mg protein, the overall median for this group), we observed that HA-positive tumors were more frequently positive for EGFr (p = 0.010) and were associated with premenopausal patients (p = 0.005), whereas HA-negative IDC showed a higher frequency of CD44v5 positivity (p = 0.013), CD44v6 positivity (p = 0.003), histological grade 3 (p = 0.020), aneuploidy (p = 0.027) and proliferating cells (S phase > 7%; p = 0.022).
Conclusions. Our results suggest that cell surface HA levels correlate with certain clinico-biological properties of IDC that can influence the outcome of these lesions. Likewise, our findings may help us to understand the disagreement reported in the literature regarding the clinical value of some of the isoforms of CD44 in breast cancer.
Introducción
El ácido hialurónico es un proteoglicano de la matriz extracelular que estimula el desanclaje y motilidad de las células epiteliales, siendo más abundante en los tejidos fetales y en aquellos con un rápido crecimiento1. Desde el punto de vista oncológico, se han observado mayores concentraciones de ácido hialurónico en los tumores que en el tejido sano adyacente, así como en la periferia en relación con las zonas centrales tumorales2. Está ligado a la transformación maligna mamaria3, metástasis4-6 y la respuesta angiogénica tumoral que favorece la progresión7, sirviendo como posible diana de terapias antiproliferativas en los tumores de origen mamario8. Se ha comprobado también, que una matriz extracelular rica en ácido hialurónico favorece el anclaje de células tumorales mamarias y ováricas en el mesenterio vía el CD44, su receptor9; asimismo, los fibroblastos de los cánceres mamarios producen ácido hialurónico en respuesta al factor de crecimiento tumoral beta (TGF ß ), fenómeno totalmente opuesto a lo que sucede en condiciones normales1. También, la interleucina 8 (IL-8) induce la motilidad de las células de la leucemia linfática crónica sobre el ácido hialurónico, lo cual favorece la invasión de los ganglios linfáticos10.
El RHAMM es una proteína del ácido hialurónico intracelular11 y su expresión se correlaciona con el oncogén ras y la ERK (proteincinasa regulada por señales extracelulares), y está involucrada en la invasión ganglionar, resultando un útil factor pronóstico indicador de la progresión de los carcinomas mamarios12. Otro receptor para el ácido hialurónico es el CD44, miembro de una nueva familia de moléculas de adhesión localizadas en la membrana celular, y del que se han descrito una forma estándar (CD44s) y otras variantes (CD44v), cuyo comportamiento clínico depende del tipo de tumor y de la forma analizada. El CD44 desempeña un papel importante en la adhesión, migración e invasión de las células tumorales, epiteliales o no13, y su expresión está regulada por la vía de la fosfolipasa D y la proteincinasa C14. Asimismo, el CD44 se une y degrada el ácido hialurónico, hecho que se correlaciona con la cantidad del receptor y el potencial invasivo celular15. También el CD44 sirve de anclaje a ciertas metaloproteasas (MMP9), lo cual favorece la diseminación16 y promueve la supervivencia de las células tumorales, de modo que la supresión del receptor induce la apoptosis celular, posiblemente por disminución de su habilidad para penetrar en las barreras del ácido hialurónico del huésped.
El interés biológico del ácido hialurónico nos ha inducido a estudiar su comportamiento en las membranas celulares de los procesos mamarios benignos y malignos y valorar si se asociaba a determinados parámetros clinicobiológicos que pueden incidir directamente en el comportamiento posterior de estos últimos.
Pacientes y métodos
El grupo de estudio incluyó 256 muestras tisulares correspondientes a 45 tejidos normales procedentes de mamas sometidas a exéresis de fibroadenomas o reducción del volumen, 21 fibroadenomas, 174 carcinomas ductales infiltrantes y 16 carcinomas lobulillares infiltrantes de mama.
Las muestras tisulares fueron limpiadas de sus componentes grasos, congeladas y almacenadas en nitrógeno líquido hasta su homogenización. Ésta se realizó en un tampón (TRIS 0,1 mol/l, EDTA Na2 0,015 mol/l, glicerol al 10%, monotioglicerol al 0,01%, pH 7,5) y en frío mediante un microhomogenizador (OMNI 1000, Waterbury, CT, EE.UU.), siendo después centrifugadas a 1.500 rpm durante 10 min y, posteriormente, el sobrenadante se sometió a una ultracentrifugación a 100.000 g durante 1 h a 4 °C. El nuevo sobrenadante (citosol) fue utilizado para la determinación de los receptores de estrógenos (RE; EIA, Abbot, EE.UU.), de progesterona (RP; EIA, Abbot, EE.UU.), pS2 (IRMA, CIS Biointernacional, Francia), catepsina D (CAT-D; IRMA. CIS Biointernacional, Francia) y activador del plasminógeno tipo tisular (t-AP; EIA, Boehringer Mannheim, Alemania). El precipitado (pellet) fue empleado para determinar el receptor del factor de crecimiento epidérmico (EGFR, RLG, Viennalab, Austria), proteína oncogénica erbB2/neu (EIA, Oncogene, EE.UU.), ácido hialurónico (AH, RIA, Pharmacia, Suecia), CD44v5 (EIA, Bender Med-System, Austria) y CD44v6 (EIA, Bender Med-System, Austria). La ploidía y fase de síntesis (fase S) fueron medidas por citometría de flujo (Bencton Dickinson Fascam) a partir de muestras en fresco. Asimismo, se tuvo presente el tamaño, la afectación ganglionar axilar, el grado histológico y el estado menopáusico. Los resultados fueron expresados por mg de proteína, determinada mediante el método de Bradford. Los dinteles de positividad para los diferentes parámetros fueron, basándonos en nuestra experiencia, los siguientes: 10 fmol/mg de proteína para los receptores de estrógenos y la progesterona; 5 ng/mg de proteína para la pS2; 50 pmol/mg de proteína para la catepsina D; 4,5 fmol/mg de proteína para el EGFR; 6.000 NHI/mg de proteína para la proteína oncogénica erbB2/neu de membrana; 3 ng/mg de proteína para el CD44v5; 5 ng/mg de proteína para el Cd44v6, y un 7 y un 14% para la fase de síntesis celular. El estudio estadístico fue realizado mediante el programa BMDP3; como los diferentes parámetros biológicos no siguieron una distribución normal, hemos empleado pruebas no paramétricas, así como el test de la * 2. Por ello, los resultados se han expresado mediante el intervalo y los percentiles 25, 50 y 75. Se consideró estadística una diferencia cuando el valor de p < 0,05.
Resultados
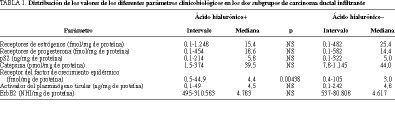
En el tejido mamario normal, las concentraciones de ácido hialurónico oscilaron entre 50 y 12.860, siendo la mediana de 1.178 ng/mg de proteína, y se correlacionaron estadística (p < 0,05) y positivamente con los receptores de estrógenos (r = 0,80559), pero no con los receptores de progesterona, pS2, ca
tepsina D y activador del plasminógeno tipo tisular. Las mujeres premenopáusicas (20 casos) presentaron mayores concentraciones que las posmenopáusicas (i = 50-12.860; mediana 1.753 frente a i = 50-3.370, mediana 653 ng/de proteína; p = 0,00133).En los fibroadenomas, las concentraciones de ácido hialurónico estuvieron comprendidas entre 314 y 21.630, con una mediana de 2.752 ng/mg de proteína, siendo superiores (p = 0,00097) a las detectadas en los tejidos mamarios normales. En estos procesos, el ácido hialurónico se correlacionó estadística (p < 0,05), positiva y exclusivamente con la pS2 (r = 0,58391).
En los carcinomas ductales infiltrantes, las concentraciones de ácido hialurónico oscilaron entre 49 y 6.843, mediana 1.463 ng/mg de proteína, no difiriendo de las constatadas en los tejidos normales y en los carcinomas lobulillares infiltrantes (i = 208-5.246; mediana 1.589 ng/mg de proteína), pero siendo inferiores a las de los fibroadenomas (p = 0,00069). En los dos tipos de tumores malignos, el ácido hialurónico no se correlacionó estadísticamente con los receptores de estrógenos, de progesterona, pS2, catepsina D y t-AP. Como se observa en las tablas 1 y 2, los casos de carcinomas ductales infiltrantes positivos para carcinomas ductales infiltrantes (> 1.463 ng/mg de proteína, mediana del grupo global) se presentaron preferentemente en mujeres premenopáusicas (p = 0,005) y mostraron mayores concentraciones globales (p = 0,004) y porcentaje de positividades (p = 0,010) para el EGFR, siendo menos frecuentemente CD44v5+ (p = 0,013), CD44v6+ (p = 0,003), grado histológico 3 (p = 0,020), aneuploides (p = 0,027) y proliferativos (fase S > 7%; p = 0,022).
Discusión
El ácido hialurónico, proteoglicano de la matriz extracelular, está involucrado en numerosos fenómenos relacionados con la génesis, proliferación e invasión de los carcinomas mamarios. En sus efectos intervienen, además, sus receptores, siendo el CD44 el más conocido y estudiado. Sin embargo, los resultados obtenidos con las diferentes isoformas del mismo no son concordantes y dependen del tipo de tumor y de la isoforma analizada. Se sabe que el CD44 se une y degrada el ácido hialurónico, fenómeno que se correlaciona con el potencial invasivo de las células tumorales15. De ello podemos deducir la posibilidad de que el efecto final no dependa sólo del receptor, sino también de su ligando. Si esto fuera cierto, se podrían explicar muchas de las discordancias descritas en la bibliografía acerca del interés y valor de las diferentes isoformas del CD44. En un estudio reciente16, pudimos demostrar que, efectivamente, las concentraciones de ácido hialurónico de membrana eran capaces de modular ciertas propiedades clinicobiológicas de los carcinomas ductales infiltrantes de mama CD44v5+, de modo que los casos con una pequeña concentración de ácido hialurónico presentaban con más frecuencia grado histológico 3, aneuploidía y altas concentraciones de catepsina D, hechos que se asocian con un posible peor comportamiento. Este hecho nos indujo a estudiar si el ácido hialurónico de membrana podía asociarse a otros parámetros clinicobiológicos habitualmente analizados en nuestro laboratorio.
En los tejidos mamarios normales, las concentraciones de ácido hialurónico fueron mayores en las mujeres pre que en las posmenopáusicas, lo cual puede ser consecuencia de una mayor actividad funcional (¿proliferativa?) de la glándula y a la alta correlación (r = 0,80559) existente entre las concentraciones del proteoglicano y los receptores esteroideos. En los fibroadenomas se constataron mayores concentraciones del proteoglicano y éstas se correlacionaron positiva y estadísticamente con las de pS2 (r = 0,58391), pero no con las de los receptores de progesterona, precisamente los más abundantes en estos procesos mamarios17, lo que nos sugiere una posible acción moduladora a través de factores de crecimiento y no vía receptores esteroideos.
En los carcinomas ductales infiltrantes las concentraciones del ácido hialurónico fueron superiores a las del tejido normal, rozando la significación estadística, inferiores a las de los fibroadenomas y similares a las constatadas en los carcinomas lobulillares infiltrantes de mama, no correlacionándose con la vía hormonal estrogénica ni sus proteínas asociadas (pS2, catepsina D, activador del plasminógeno tipo tisular). Esto nos sugiere que en los tumores malignos, la síntesis del proteoglicano es favorecida por ciertos factores de crecimiento o señales bioquímicas relacionadas con la proliferación, como demostraron Smith et al1. Al clasificar los tumores en función del umbral de positividad para el ácido hialurónico (1.463 ng/mg de proteína, valor que representa la mediana del grupo global), pudimos observar que los casos positivos de ácido hialurónico mostraron mayores porcentajes de positividades para el EGFR, siendo menos frecuentemente CD44v5+, CD44v6+, grado histológico 3, aneuploides y proliferativos (fase S > 7%).
El receptor del factor de crecimiento epidérmico (EGFR) es una molécula de membrana cuya expresión se correlaciona inversamente con los receptores de estrógenos18. Su valor como factor pronóstico en los carcinomas mamarios está sometido a ciertas controversias19,20, lo cual ha inducido a resaltar la relación entre el EGFR del tumor y del tejido vecino18. Es interesante resaltar también el diferente comportamiento del ARNm y la proteína en tumores y tejidos sanos21, así como el hecho de que su expresión es alta en células mamarias inmaduras, estando aquella regulada negativamente en las células diferenciadas funcionales y positivamente en las células apoptóticas y diferencias a término. Es decir, el receptor no es necesario para mantener la diferenciación funcional, pero sí para el crecimiento y diferenciación de las células inmaduras y para la supervivencia de las células diferenciadas a término. Esto nos induce a considerar, unido a los otros hallazgos que luego comentaremos, que la mayor expresión del EGFR en los carcinomas ductales infiltrantes positivos para el ácido hialurónico no es un indicador de hormonoindependencia o de mal pronóstico, sino una consecuencia de la supervivencia de células tumorales diferenciadas, o bien de un estadio previo a la hormonoindependencia tumoral, asociadas ambas a un mejor pronóstico.
La isoforma v5 del CD44 (CD44v5) se correlaciona con los RP y un tamaño > 2 cm22-24, y su expresión se incrementa en las metástasis ganglionares en relación al tumor primitivo. Las mayores positividades constatadas en los tumores con ácido hialurónico de membrana creemos que no son reflejo de un mejor comportamiento, sino de la degradación del proteoglicano y de su consiguiente mayor capacidad invasiva15. Apoya nuestra hipótesis el hecho de que en los gliomas malignos, la expresión de CD44 no se corresponde con la capacidad de adhesión, siendo los glucosaminoglicanos unidos a la célula los que influyen en la adhesión de las células al ácido hialurónico extracelular25. Otra isoforma estudiada con frecuencia en los carcinomas mamarios es la v6 (CD44v6), involucrada en la motilidad, invasión y capacidad metastática de las células tumorales13. En los carcinomas mamarios, Tempfer et al26 constatan una mayor supervivencia e intervalo libre de enfermedad en los casos positivos, pero la expresión careció también de valor pronóstico tras un análisis multivariante; Foekens et al27 consideran que es un factor de buen pronóstico en los casos sin afectación ganglionar axilar. Por el contrario, Sinn et al28 observan una correlación positiva entre la positividad para la isoforma y un mayor grado histológico, y Kaufmmann et al29 describen una mayor supervivencia en los casos CD44v6 negativos, siendo factores pronósticos independientes con el grado histológico, los receptores de progesterona, la afectación ganglionar axilar y el tamaño tumoral. Nuestros resultados, unidos al interés biológico de la degradación del ácido hialurónico por el CD44, apoyan lo descrito por estos dos últimos autores y confieren mayor valor a la relación CD44-ligando que a la expresión exclusiva del receptor.
El grado histológico, a pesar de las discordancias interobservador, sigue siendo de gran utilidad pronóstica30, superando incluso a modernos factores recientemente introducidos en la clínica diaria. En general, se correlaciona de manera directa con un peor comportamiento y evolución, siendo en nuestra experiencia un factor pronóstico independiente de la afectación ganglionar axilar en tumores T1, junto al Ki67 y el CD44s31. La ploidía suele asociarse también a un peor comportamiento, si bien su valor práctico es inferior al de la proliferación, asociándose ésta a una peor evolución, tanto en los tumores considerados globalmente como en aquellos sin afectación axilar. Como indicadores de la proliferación puede emplearse la prueba de la timidina tritiada, la fase S por citometría o ciertos anticuerpos (Ki67, KS2), que pueden reflejar no sólo la fracción de células en síntesis, sino también todas las del ciclo celular32-38, poseyendo todos ellos una gran importancia pronóstica práctica.
Los resultados anteriores confirman nuestros hallazgos previos39 y nos sugieren que la concentración del ácido hialurónico de membrana se asocia a determinadas propiedades clínicobiológicas de los carcinomas ductales infiltrantes de mama que pueden incidir en su comportamiento ulterior. Asimismo, nuestros hallazgos pueden ayudar a comprender las discrepancias descritas en la bibliografía acerca de la utilidad clínica de las diferentes isoformas variantes del CD44 en los carcinomas mamarios.