El síndrome del ducto pancreático desconectado (SDPD) o desconexión del ducto pancreático consiste en la existencia de una discontinuidad entre una porción de páncreas viable y el tracto gastrointestinal, causada por una necrosis ductal tras una pancreatitis grave o tras un traumatismo pancreático. Fue descrito por primera vez en 1991 por Kozarek1, y aparece cuando el segmento pancreático aislado continúa teniendo su función exocrina, produciendo con ello colecciones recurrentes o fístulas pancreáticas. Ocurre predominantemente en la región del cuello pancreático, lo que permite que el remante del cuerpo o cola del páncreas secreten jugo pancreático al retroperitoneo. El diagnóstico generalmente se realiza mediante tomografía computarizada, que demuestra una zona no perfundida del cuello, cuerpo o cola del páncreas, aunque se recomienda la realización de una colangiopancreatografía retrógrada endoscópica (CPRE) para demostrar la discontinuidad del ducto o la extravasación de contraste2, o resonancia magnética nuclear. Esta última evita el riesgo potencial de infección de la necrosis pancreática3. Sin embargo, a pesar de las pruebas de imagen, el diagnóstico con frecuencia es tardío, y debe diferenciarse de los pacientes con pseudoquistes pancreáticos. En cuanto al tratamiento, la opción óptima es tema de controversia4.
Presentamos el caso de un paciente hombre de 45 años, exalcohólico, con antecedentes de pancreatitis crónica enólica con varios episodios de reagudización, colecistectomizado, que consulta por dolor invalidante en hemiabdomen izquierdo que se irradia a la pierna. Como antecedente de interés, el paciente presentaba varias colecciones retroperitoneales de origen pancreático que habían sido tratadas mediante drenajes percutáneos en los últimos 2 años.
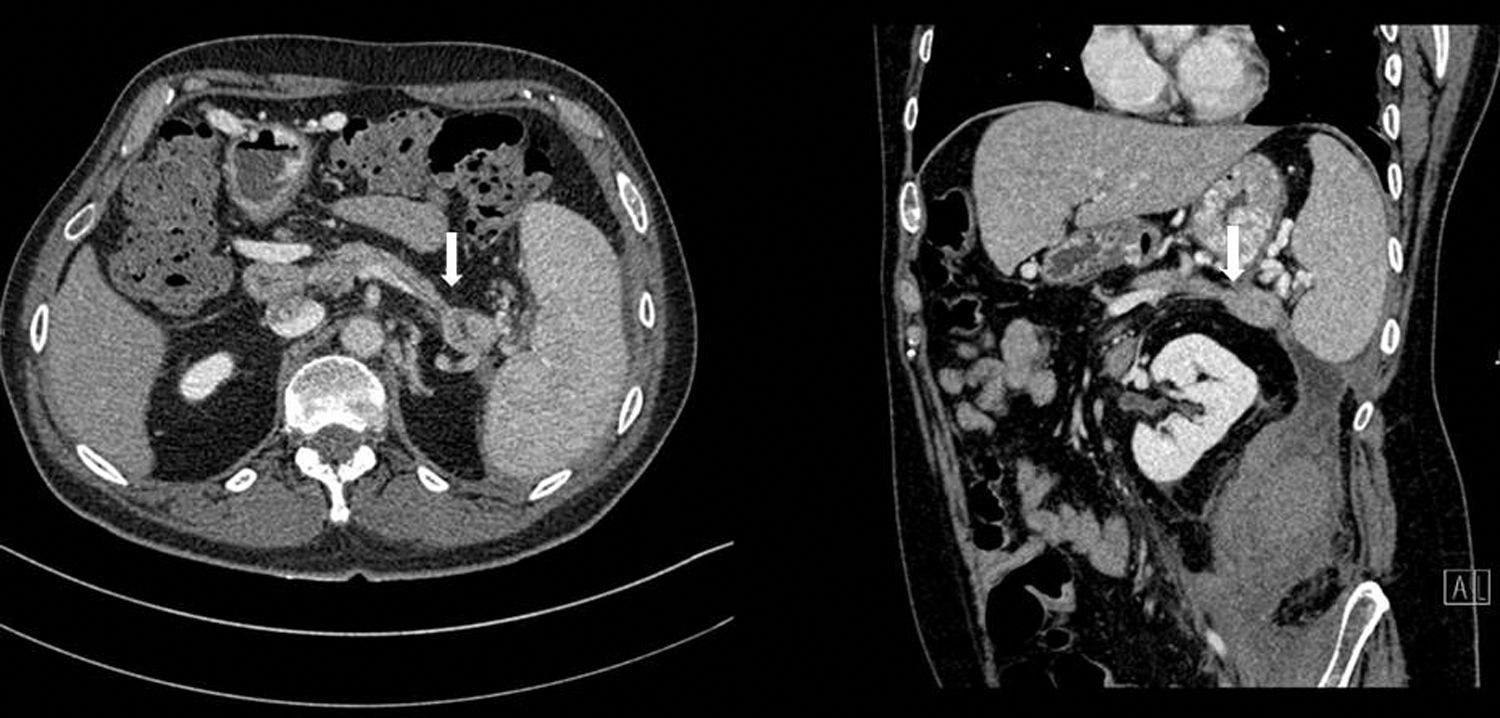
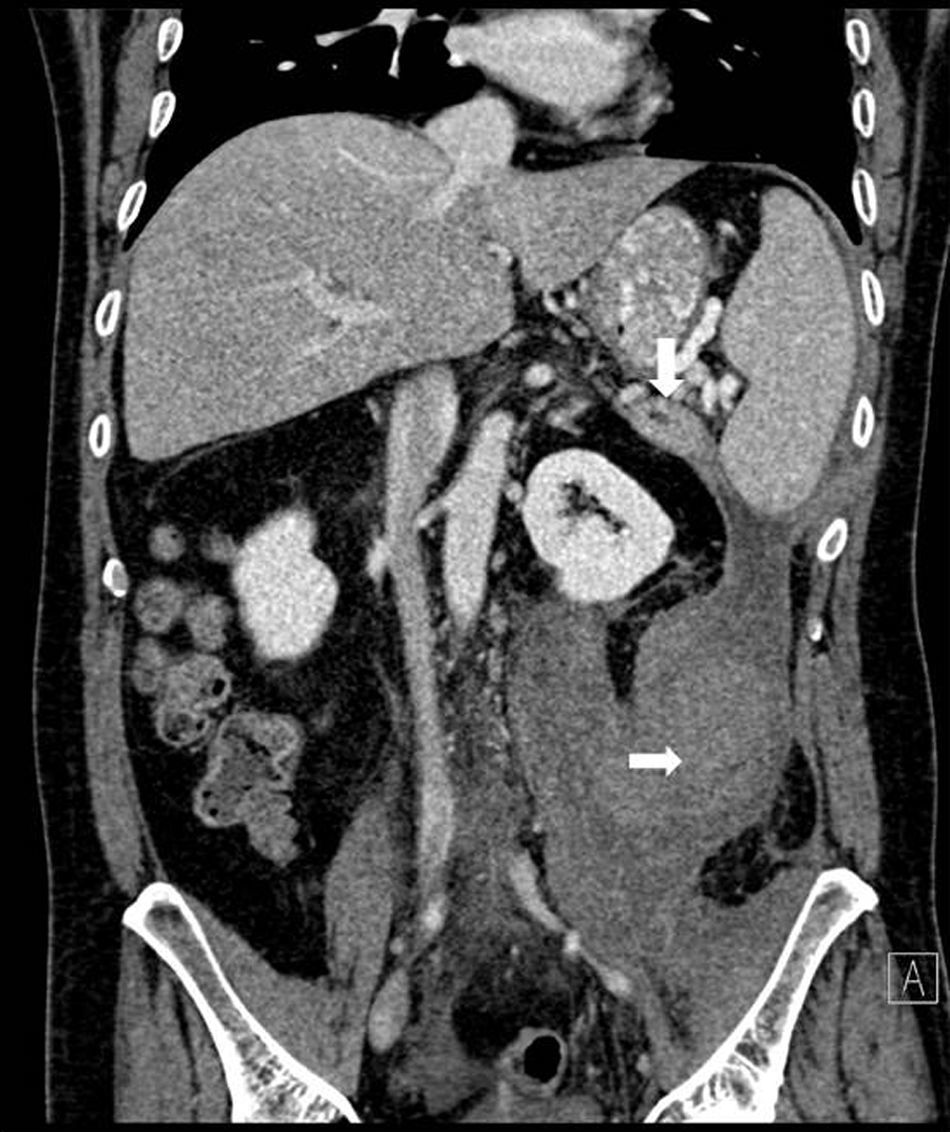
Se realizó TAC abdominal, que evidenciaba nuevamente una colección retroperitoneal de 9,6×7×20cm que se originaba en la cola del páncreas y se extendía caudalmente sobre el psoas (fig. 1), desplazando medialmente el riñón izquierdo. El páncreas presentaba una atrofia difusa, sin dilatación del conducto hasta la zona distal de la cola, con una zona de 2cm existente en la cola previamente a la dilatación donde el ducto no era visible (fig. 2).
Inicialmente se realizó tratamiento médico y drenaje percutáneo de la colección, que solo se redujo de forma parcial. Tras ello, se propuso tratamiento asociado con endoprótesis pancreática, que no fue factible por encontrarse el conducto no dilatado y desconectado distalmente, por lo que al final se realizó esplenopancreatectomía distal y limpieza de la cavidad retroperitoneal mediante cirugía abierta. Tras ello, el postoperatorio transcurrió con normalidad, y fue dado de alta sin incidencias al séptimo día.
El SDPD es una entidad clínica en la que existe una ausencia de continuidad entre el tejido pancreático viable y el tubo digestivo, que cursa con la parición de una colección o de una fístula pancreática externa, ya que el segmento pancreático aislado continúa con su función exocrina. No existen datos claros sobre su incidencia, aunque se estima que entre un 10 y un 30% de las pancreatitis graves desarrollan un SDPD5. Es fundamental el diagnóstico y debe diferenciarse (mediante TAC, resonancia magnética y la CPRE) del pseudoquiste pancreático, la disrupción ductal parcial, la necrosis pancreática tabicada y otros síndromes relacionados. La localización más frecuente es en el cuello, especialmente en las pancreatitis litiásicas y en los traumatismos pancreáticos, debido a que esta zona solo se encuentra irrigada por la arteria pancreática dorsal, mientras que otras regiones se encuentran irrigadas por más de una arteria. Debe sospecharse cuando existe una colección o fístula pancreática tras una necrosectomía que no se solventa, aunque los criterios actualmente propuestos para el diagnóstico son la existencia de una colección o necrosis de al menos 2cm evidenciada por TAC en cuello o cuerpo con tejido pancreático viable distal, o un ducto pancreático que entra en la colección con un ángulo de 90°6, o cuando aparece extravasación de contraste inyectado o si hay desconexión completa del ducto en el remante distal6, y debe sospecharse siempre tras la existencia de una colección o fístula pancreática externa tras un drenaje que no se resuelve en un tiempo prudencial, ante la aparición de colecciones pancreáticas recurrentes, ascitis o pseudoanerismas7 con hemorragias asociadas. Los pacientes con SDPD tienen mayor probabilidad de diabetes mellitus, problemas metabólicos y nutricionales por la pérdida de proteínas y electrólitos, y de hipertensión portal.
Aunque no existen algoritmos de tratamiento claramente definidos, sí está recomendado y aceptado por muchos autores la espera de al menos 6 semanas desde el diagnóstico para intervenir al paciente quirúrgicamente con la intención de que exista menor inflamación y mayor estabilización de la fístula externa pancreática6,8.
El tratamiento puede ser endoscópico mediante CPRE y colocación de prótesis o por drenaje interno guiado con ecoendoscopia, pero estas técnicas presentan a largo plazo un éxito inferior a la cirugía, aunque tienen menor morbimortalidad. La tasa de recidiva es cercana al 50%, y es posible repetir el procedimiento8. Por otro lado, aunque la resección quirúrgica presenta mayor morbimortalidad, tiene mayor éxito a largo plazo. Entre las posibilidades quirúrgicas se encuentran las resecciones del tejido pancreático desconectado con o sin esplenectomía y la derivación al intestino delgado o al estómago7. No existen algoritmos universalmente aceptados, pero la tendencia actual es el tratamiento endoscópico y, si fracasa o no es posible, la resección o la derivación quirúrgica.
Autoría/colaboradoresTodos los autores han contribuido a la redacción del artículo, revisión crítica y aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.