El síndrome hipoglucémico por hiperinsulinismo endógeno (SHHE) puede estar originado por un insulinoma o, menos frecuentemente, por la nesidioblastosis en niños, conocida en la población adulta con el nombre de síndrome hipoglucémico pancreático no insulinoma (SHPNI). El objetivo de este trabajo es mostrar la estrategia para el tratamiento quirúrgico del SHHE.
Material y métodoSe incluyó a un total de 19 pacientes con diagnóstico final de insulinoma o SHPNI que fueron tratados quirúrgicamente desde enero del 2007 hasta junio del 2012. Se describió la forma de presentación clínica y estudios preoperatorios. Se hizo hincapié en la técnica quirúrgica, las complicaciones y el seguimiento a largo plazo de los pacientes.
ResultadosTodos los pacientes en estudio tuvieron un test de ayuno positivo. Las lesiones que originaron el SHHE pudieron ser localizadas preoperatoriamente en el 89,4% de los casos. La cirugía más frecuente fue la pancreatectomía distal con preservación de bazo (9 casos). Tres pacientes con diagnóstico de insulinoma se presentaron con metástasis sincrónicas, que fueron tratadas con cirugía simultánea. No tuvimos mortalidad perioperatoria y la morbilidad fue del 52,6%. El análisis histolo¿gico revelo¿ que 13 pacientes (68,4%) presentaban insulinoma benigno, 3 insulinoma maligno con metástasis hepáticas y 3 con diagnóstico final de SHPNI. La mediana de seguimiento fue de 20 meses. Todos los pacientes con diagnóstico de insulinoma benigno o SHPNI resolvieron el síndrome de SHHE.
ConclusiónEl tratamiento quirúrgico del SHHE logra excelentes resultados a largo plazo en el control de los síntomas de hipoglucemia.
The endogenous hyperinsulinemic hypoglicemia syndrome (EHHS) can be caused by an insulinoma, or less frequently, by nesidioblastosis in the pediatric population, also known as non insulinoma pancreatic hypoglycemic syndrome (NIPHS) in adults.
The aim of this paper is to show the strategy for the surgical treatment of ehhs.
Material and methodsA total of 19 patients with a final diagnosis of insulinoma or NIPHS who were treated surgically from january 2007 until june 2012 were included. We describe the clinical presentation and preoperative work-up. Emphasis is placed on the surgical technique, complications and long-term follow-up.
ResultsAll patients had a positive fasting plasma glucose test. Preoperative localization of the lesions was possible in 89.4% of cases. The most frequent surgery was distal pancreatectomy with spleen preservation (9 cases). Three patients with insulinoma presented with synchronous metastases, which were treated with simultaneous surgery. There was no perioperative mortality and morbidity was 52.6%. Histological analysis revealed that 13 patients (68.4%) had benign insulinoma, 3 malignant insulinoma with liver metastases and 3 with a final diagnosis of SHPNI. Median follow-up was 20 months. All patients diagnosed with benign insulinoma or NIPHS had symptom resolution.
ConclusionThe surgical treatment of EHHS achieves excellent long-term results in the control of hypoglucemic symptoms.
El síndrome hipoglucémico por hiperinsulinismo endógeno (SHHE) suele tener su traducción clínica con alteraciones neuropsiquiátricas, tales como: confusión, afectación visual, temblor, palpitaciones, ansiedad, amnesia y convulsiones, que pueden llevar al paciente a la pérdida de la conciencia, incluso al coma1. Existen 2 situaciones patológicas que pueden generar este síndrome. El más frecuente está dado por tumores pancreáticos, conocidos como insulinomas y, en segunda instancia, la hiperplasia de las células B de los islotes pancreáticos, comúnmente definida como nesidioblastosis en niños y como síndrome hipoglucémico pancreático no insulinoma en adultos (SHPNI).
Los insulinomas representan los tumores neuroendocrinos pancreáticos funcionantes más frecuentes. La incidencia en la población general está estimada en 1-4 por 1.000.000 anual2. Las variantes extrapancreáticas son extremadamente raras. La forma más usual de presentación es como un tumor pequeño (< 2cm), hipervascularizado, solitario, con un comportamiento benigno y de presentación esporádica. Raramente pueden estar asociados a síndromes de neoplasia endocrina múltiple de tipo 1 (NEM-1). Las variantes múltiples y de estirpe maligna son poco frecuentes (< 10%)3. La localización preoperatoria a través de métodos por imágenes resulta útil para la planificación quirúrgica. El tratamiento médico puede controlar los síntomas asociados a la hipoglucemia en aproximadamente el 50% de los pacientes. Sin embargo, la cirugía representa el tratamiento de elección para este tipo de neoplasias.
La nesidioblastosis representa un trastorno congénito, que afecta más comúnmente a niños, caracterizado anatomopatológicamente por una hiperplasia e hipertrofia de los islotes pancreáticos con síntomas precoces en los infantes. La forma del adulto representa un síndrome poco frecuente de hipoglucemia, caracterizada por una hiperfunción difusa de las células beta del páncreas, con manifestación clínica de neuroglucopenia posprandial con un test de ayuno que puede resultar tanto positivo como negativo a las 72 h4. El diagnóstico topográfico puede ser llevado a cabo a través del test de estimulación selectiva con calcio5.
El objetivo de este trabajo es mostrar la estrategia para el diagnóstico y el tratamiento quirúrgico del SHHE.
Material y métodosSe realizó un estudio descriptivo retrospectivo que incluyó un grupo de 19 pacientes consecutivos operados en el Hospital Italiano de Buenos Aires (HIBA) durante el período de enero del 2007 hasta junio del 2012, con diagnóstico final de insulinoma o SHPNI.
Estudios preoperatoriosLa sospecha clínica de SHHE se originó en todos los casos a partir de episodios de hipoglucemia severa. El diagnóstico definitivo se realizó a partir del test de ayuno realizado de manera parcial o completa. Se realizaron determinaciones plasmáticas de glucemia, insulina, péptido C circulante de manera basal y hormonas contrainsulares (HGH, cortisol). Durante el estudio, los pacientes eran autorizados a la ingesta oral de líquidos acalóricos. Se tomaron muestras de sangre periférica (para dosaje de glucemia, insulina y péptido C) cada 4-6 h o cuando el paciente presentaba síntomas. El test fue dado por finalizado ante la caída de glucemia por debajo de los 45mg/dl o la presencia de síntomas. La presencia de síntomas de hipoglucemia con los siguientes criterios fue diagnóstica de SHHE: niveles de glucemia ≤ 45mg/l, nivel de insulina>3μU/ml.
Los métodos por imágenes que se utilizaron para localizar este tipo de tumores de manera preoperatoria fueron: TAC multipista y la angiografía combinada con test de estimulación selectiva con gluconato de calcio o Doppman6.
La confirmación y localización operatoria fue llevada a cabo a través de ecografía intraoperatoria tanto para el abordaje abierto como laparoscópico.
Técnica quirúrgica y complicacionesLa resección de parénquima pancreático (esplenopancreatectomía con o sin preservación de bazo) fue realizada en los casos en que no se pudo efectuar una enucleación segura, por riesgo de lesión del conducto pancreático principal, lesiones no palpables o identificables bajo ecografía intraoperatoria o ante sospecha de malignidad.
Para los casos de secundarismo hepático se planteó la posibilidad de resección simultánea si los pacientes presentaban los siguientes criterios:
- 1.
Riesgo quirúrgico aceptable
- 2.
Ausencia de enfermedad extrahepática
- 3.
Posibilidad de resecar más del 90% de la carga tumoral
- 4.
Remanente hepático>30%
Utilizamos la clasificación de Dindo-Clavien para estratificar las complicaciones y mortalidad postoperatoria dentro de los primeros 30 días luego de la cirugía7.
Definimos fístula pancreática y su respectiva estratificación, de acuerdo a los criterios elaborados por el grupo internacional de estudio de fístula pancreática8.
Anatomía patológicaTodas los piezas quirúrgicas fueron analizadas, certificando el diagnóstico final histopatológico de insulinoma o SHPNI, complementado a través de técnicas de inmunohistoquímica y con determinación de Ki-67 (Ki-67 ≤ 2%=benigno o bajo grado de agresividad; Ki-67 de 2-20%=grado intermedio de agresividad y Ki-67>20%=alto grado de agresividad)9. Los insulinomas fueron clasificados en benignos o malignos basados en la clasificación de la Organización Mundial de la Salud respecto a tumores neuroendocrinos del páncreas10.
El diagnóstico final de SHPNI fue elaborado en función de los criterios mayores y menores previamente publicados11.
SeguimientoEl seguimiento fue realizado a través de controles médicos periódicos cada 3 meses durante el primer año, evaluando glucemia e insulinemia en ayuno de 16 h y en aquellos pacientes con metástasis hepáticas con TAC multipista.
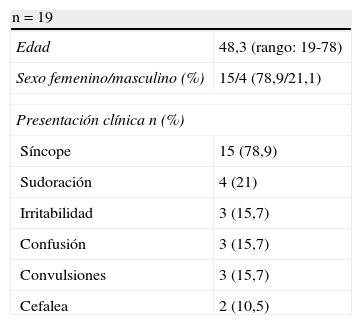
ResultadosPoblación de pacientes y síntomasDiecinueve pacientes fueron tratados quirúrgicamente con diagnóstico de SHHE en el HIBA, durante el período señalado. La tabla 1 resume las características demográficas de los pacientes y los síntomas de presentación: 16 pacientes con diagnóstico de insulinoma (84,2%) y 3 pacientes con diagnóstico de SHPNI (15,8%). De los insulinomas, ninguno presentó antecedentes de NEM-1. La edad promedio de presentación fue de 48,3 años, con un predominio en el sexo femenino (79%).
El síncope (78,9%), la sudoración (15,7%), la confusión (15,7%), la irritabilidad (16,6%) y las convulsiones (15,7%) fueron los síntomas más frecuentes de presentación.
El diagnóstico de SHHE se basó en la positividad del test de ayuno a las 72 h en el 100% de los pacientes.
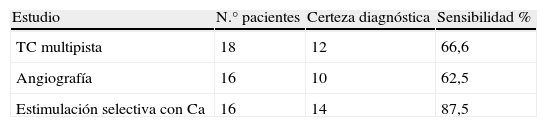
Métodos preoperatorios por imágenesLa localización preoperatoria con métodos no invasivos e invasivos fue posible en el 89,4% (17/19) de los casos (tabla 2).
De los métodos no invasivos, el más frecuentemente utilizado fue la TAC (94,7%), con una sensibilidad del 66,6%.
La angiografía sola se realizó en 16 pacientes con una sensibilidad para localizar el tumor del 62,5%. El test de estimulación selectiva con calcio fue indicada en 16 pacientes (84,2%), con una sensibilidad del 87,5%, siendo el estudio más sensible para localizar o regionalizar la enfermedad de manera preoperatoria. Dos pacientes (12,5%) fueron positivos en más de un territorio vascular (arteria gastroduodenal y arteria esplénica), siendo su diagnóstico patológico final SHPNI. Tres pacientes no realizaron este estudio por sospecha de secundarismo hepático.
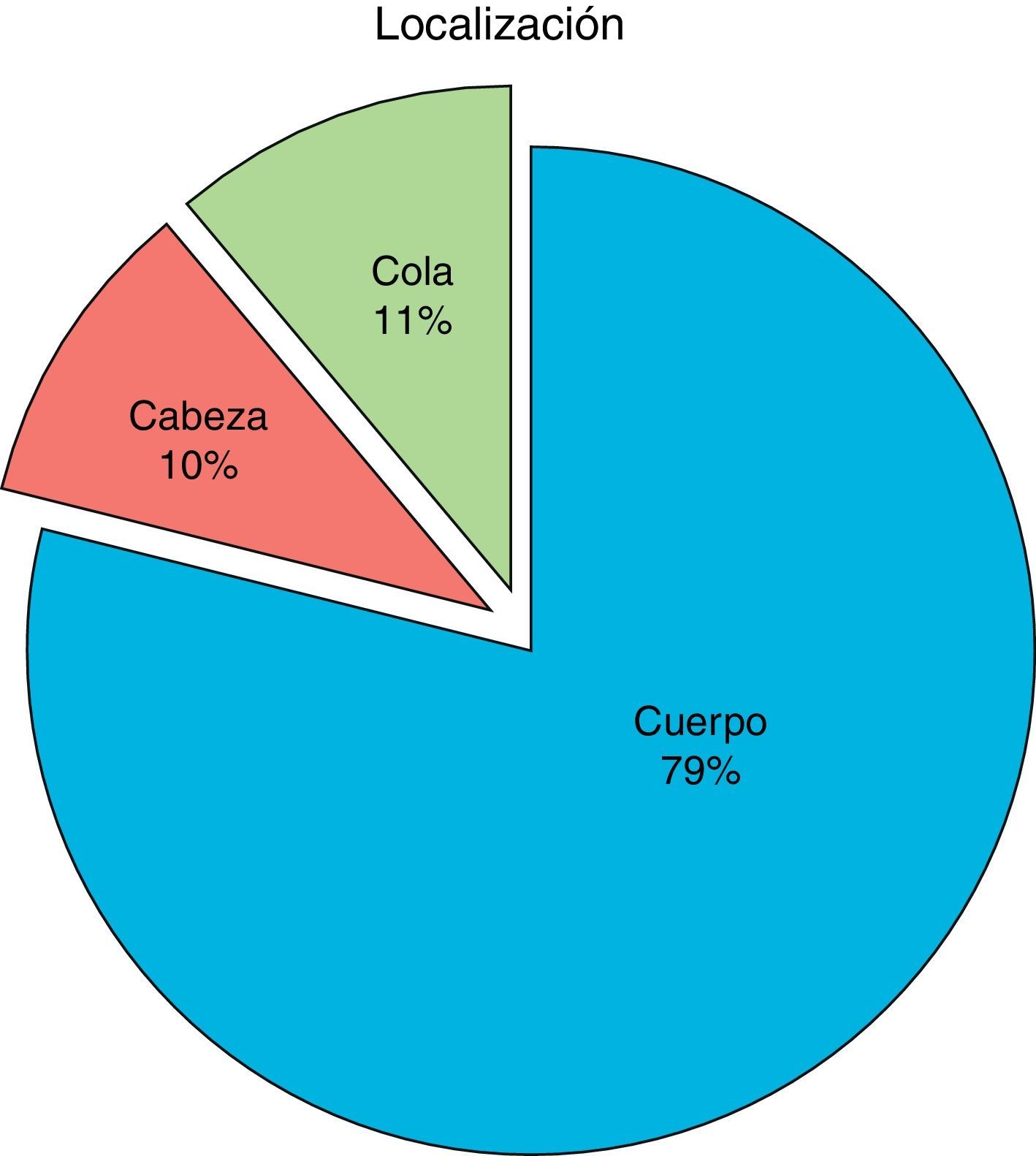
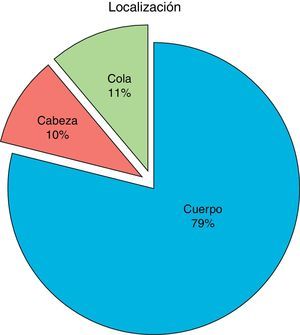
Hallazgos intraoperatorios, procedimientos y complicacionesLa distribución de las lesiones sobre el parénquima pancreático se resume en la figura 1. Para el abordaje convencional y mano-asistido la maniobra palpatoria detectó tumor en el 92%. Esta maniobra siempre fue complementada a través de una ecografía intraoperatoria (100% de los pacientes), con una sensibilidad del 94,7% para ambos abordajes (convencional y laparoscópico). Permitió también establecer la relación del tumor con el conducto pancreático principal en el 92% de los pacientes y así determinar el tipo de cirugía a efectuar.
La exploración por vía convencional fue efectuada en 11 casos (57,9%). La vía laparoscópica en los restantes 8 (42,1%), con una efectividad del 88,8% (un solo paciente convertido). Hubo un solo caso en que se empleó cirugía laparoscópica mano-asistida.
El procedimiento quirúrgico más comúnmente efectuado fue la pancreatectomía con preservación de bazo (9 casos), seguida por la esplenopancreatectomía corporocaudal (7 casos) y 3 enucleaciones pancreáticas. Tuvimos un paciente con test de ayuno positivo, estudios preoperatorios negativos y ecografía intraoperatoria negativa, en el que se realizó una pancreatectomía distal a ciegas (5%). La histopatología confirmó SHPNI.
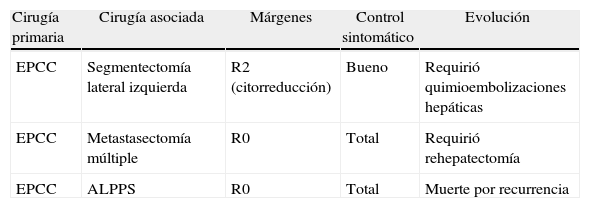
Tres pacientes se presentaron con metástasis hepáticas sincrónicas (15,7%), con criterios de selección para realizar resecciones simultáneas (tabla 3).
Resecciones simultáneas hepáticas
| Cirugía primaria | Cirugía asociada | Márgenes | Control sintomático | Evolución |
| EPCC | Segmentectomía lateral izquierda | R2 (citorreducción) | Bueno | Requirió quimioembolizaciones hepáticas |
| EPCC | Metastasectomía múltiple | R0 | Total | Requirió rehepatectomía |
| EPCC | ALPPS | R0 | Total | Muerte por recurrencia |
ALPPS: partición hepática derecha y oclusión portal en hepatectomía diferida; EPCC: esplenopancreatectomía corporo-caudal.
El tiempo operatorio tuvo un promedio de 168 min (rango: 120-240 min). La mediana de internación fue de 7 días (rango: 4-80 días).
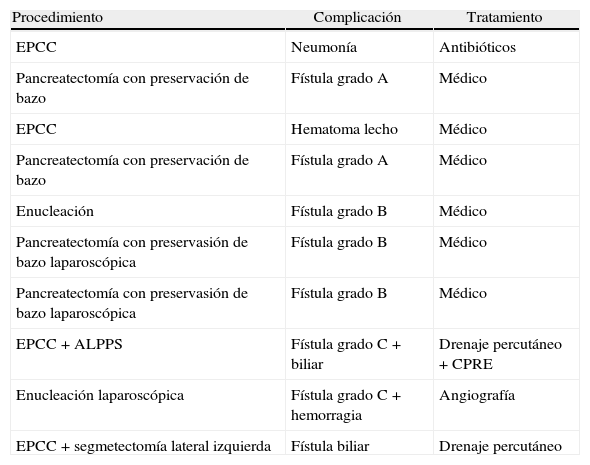
En esta serie no hubo mortalidad perioperatoria. En total 10 pacientes presentaron complicaciones (52,6%) (tabla 4). El porcentaje de fístula pancreática fue de 36%, de estas: 2 fueron grado A, 3 grado B y 2 grado C.
Complicaciones y tratamiento
| Procedimiento | Complicación | Tratamiento |
| EPCC | Neumonía | Antibióticos |
| Pancreatectomía con preservación de bazo | Fístula grado A | Médico |
| EPCC | Hematoma lecho | Médico |
| Pancreatectomía con preservación de bazo | Fístula grado A | Médico |
| Enucleación | Fístula grado B | Médico |
| Pancreatectomía con preservasión de bazo laparoscópica | Fístula grado B | Médico |
| Pancreatectomía con preservasión de bazo laparoscópica | Fístula grado B | Médico |
| EPCC+ALPPS | Fístula grado C+biliar | Drenaje percutáneo+CPRE |
| Enucleación laparoscópica | Fístula grado C+hemorragia | Angiografía |
| EPCC+segmetectomía lateral izquierda | Fístula biliar | Drenaje percutáneo |
ALPPS: partición hepática derecha y oclusión portal en hepatectomía diferida; CPRE: colangiografía pancreática retrógrada endoscópica; EPCC: esplenopancreatectomía corporo-caudal.
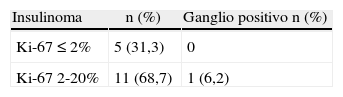
El análisis histolo¿gico revelo¿ que 13 pacientes (68,4%) presentaban insulinoma benigno, y 3 (15,7%) eran portadores de insulinoma maligno, con metástasis hepáticas. La tabla 5 resume los resultados del análisis del Ki-67 para insulinoma. Todos los pacientes con metástasis hepáticas presentaron un Ki-67>2%. Dos pacientes presentaron con tumores múltiples (10,5%). Se comprobó el diagnóstico final de SHPNI en 3 pacientes (15,7%). En 18 pacientes el margen quirúrgico fue R0 y un solo paciente, R2.
SeguimientoLa mediana de seguimiento de este estudio fue de 20 meses (rango: 1-70 meses). Todos los pacientes con diagnóstico de insulinoma benigno o SHPNI resolvieron el síndrome de SHHE, sin presentar recurrencias. Respecto a los pacientes con diagnóstico de insulinoma maligno, uno de ellos falleció a los 6 meses por recurrencia de la enfermedad tumoral. Los otros 2 pacientes continúan vivos. Uno presentó recurrencia hepática a los 11 meses de la primera cirugía. El otro, que había sido intervenido mediante una cirugía hepática citorreductiva, presentaba buen control de los síntomas de hipoglucemia y recibió una quimioembolización hepática.
DiscusiónExisten numerosos artículos respecto del manejo del SHHE. Sin embargo, la mayoría de estos reportes se basan en poblaciones pequeñas de pacientes, debido a la baja incidencia de estas enfermedades. Las recomendaciones acerca de la forma de estudio de estos pacientes, la técnica quirúrgica más apropiada y los factores pronósticos presentan un bajo nivel de evidencia científica. Nuestro trabajo analiza una población pequeña de pacientes en comparación con otras series12,13. Sin embargo, a diferencia de estas experiencias desarrolladas en largos lapsos de tiempo (25 años), nuestro trabajo abarca un periodo corto de tiempo (5 años), utilizando los mismos protocolos diagnósticos y terapéuticos.
El método por excelencia para realizar el diagnóstico definitivo del SHHE está dado por la positividad del test de ayuno a las 72 h14,15. El SHPNI representa un desafío clínico para su diferenciación respecto al insulinoma, ya que los signos y síntomas de presentación en ambas entidades suelen ser similares.
La localización o regionalización preoperatoria con métodos no invasivos e invasivos fue posible en el 89,4% de los casos presentados en esta serie. La TC multipista permite una correlación directa entre el tumor y el resto del parénquima pancreático. Al ser un estudio no invasivo puede ser considerado de primera línea para la caracterización morfológica de este tipo de entidades patológicas, con una sensibilidad superior al 80%12,13. Existen otros métodos como la resonancia magnética o la ecoendoscopia con sensibilidades y especificidades cercanas al 100%16.
El test de estimulación selectiva con gluconato de calcio fue el estudio más sensible (87,5%) para localizar o regionalizar la enfermedad de manera preoperatoria. Este estudio permite identificar aquellas regiones del páncreas con hiperactividad de las células beta5, sirviendo de guía para la resección quirúrgica de aquellas regiones del páncreas que demuestren mayor actividad17. Llamativamente 2 pacientes (12,5%) fueron positivos en más de un territorio vascular (arteria gastroduodenal y arteria esplénica), siendo su diagnóstico final el de SHPNI.
En todos los pacientes se aplicó ecografía intraoperatoria, con una certeza diagnóstica del 94%. Este método sirvió además para definir la estrategia quirúrgica a seguir (enucleación versus pancreatectomía), ya que permite establecer la relación entre el tumor y el conducto pancreático principal.
Un gran dilema se puede presentar cuando no se puede precisar la localización intraoperatoria del tumor. En la serie, tuvimos un caso con test de ayuno positivo y estudios preoperatorios negativos. La ecografía intraoperatoria no pudo definir la lesión, de manera que realizamos una esplenopancreatectomía a ciegas. El diagnóstico final confirmó SHPNI. Hay reportes de resecciones a ciegas con una frecuencia del 5%18.
La vía de abordaje más comúnmente utilizada fue la forma convencional (58%), pero en los últimos años, a medida que fuimos adquiriendo más experiencia con el abordaje laparoscópico, hubo una tendencia por esta técnica, con un solo paciente convertido en toda la serie.
En la literatura no está bien establecido cuál es la mejor cirugía para este tipo de tumores. En el caso de los insulinomas, la enucleación suele ser el procedimiento más frecuentemente utilizado (34-74%)12,18,19. El porcentaje de las lesiones que se sitúan en la cabeza del páncreas puede alcanzar hasta el 40%20. Sin embargo, en nuestra serie solo 2 pacientes (10%) presentaron esta localización, los cuales pudieron ser enucleados, evitando una duodenopancreatectomía cefálica.
En esta serie debido a la relación del tumor con el conducto pancreático principal la pancreatectomía con o sin preservación de bazo fue el procedimiento más comúnmente empleado. Existieron otra causas que nos obligaron a realizar una cirugía más radical, como la presencia de metástasis hepáticas asociadas al tumor primario o lesiones múltiples. Para el caso del SHPNI el procedimiento de elección fue la pancreatectomía distal al igual que en otras publicaciones13,15 debido a que se trata de una enfermedad difusa que se ubica más comúnmente en la porción distal de la glándula.
La resolución de los síntomas del SHHE fue alcanzada en el 100% de los pacientes con enfermedad benigna (insulinoma benigno o SHPNI) a través del tratamiento quirúrgico.
Tuvimos 3 pacientes que presentaron sincrónicamente metástasis hepáticas, los cuales fueron sometidos a resección del primario y de las metástasis hepáticas (resección simultánea). Uno de ellos presentaba en la evaluación ecográfica intraoperatoria una enfermedad hepática más extensa que la advertida en los estudios preoperatorios (con un remanente hepático < 30%), por lo cual se optó por realizar una partición hepática derecha in situ con ligadura portal para evitar la insuficiencia hepática postoperatoria21.
En toda la serie no tuvimos mortalidad perioperatoria. La morbilidad general fue del 52%, con una incidencia de fístulas pancreáticas del 36,8%, de las cuales solo el 26% correspondieron a fístulas grado B y C según la clasificación propuesta por Bassi et al.8.
El estudio inmunohistoqui¿mico de los insulinomas permitió caracterizar mejor estas neoplasias. Fue interesante observar que aquellos insulinomas con metástasis hepáticas tuvieron un Ki-67 > 2%.
Los resultados histológicos para definir el SHPNI están dados por la presencia de islotes pancreáticos de distinto tamaño, caracterizados por acúmulos de células neuroendocrinas dentro del parénquima acinar, habitualmente en contacto con pequeños o largos conductos (complejos ductoinsulares). La baja incidencia de esta entidad patológica requiere de patólogos entrenados y familiarizados con el estudio de enfermedades pancreáticas.
Debido a las características morfológicas y funcionales de este tipo de tumores, el diagnóstico, localización y tratamiento de estos pacientes puede ser muchas veces demandante. El manejo multidisciplinario (cirujano, radiólogo intervencionista y endocrinólogo) resulta fundamental para obtener los mejores resultados en este tipo de pacientes.
Conflicto de interésNinguno de los autores recibió apoyo económico para la realización de este trabajo.