El transplante hepático es el único tratamiento efectivo existente para las enfermedades hepáticas en fase terminal. La desproporción entre la demanda y la oferta de órganos constituye su principal limitación y plantea la necesidad de buscar alternativas al trasplante hepático.
El trasplante celular hepático o trasplante de hepatocitos humanos constituye, en el momento actual, la mejor opción terapéutica sustitutiva. Consiste en trasplantar hepatocitos humanos totalmente diferenciados a un órgano receptor, en cantidad suficiente para que estos sobrevivan y restauren la función hepática normal, basándose en la capacidad de regeneración hepática. Este tratamiento está en fase clinicoexperimental, y se ha realizado en pacientes con errores congénitos del metabolismo, fallo hepático fulminante y fallo hepático agudo o crónico como puente al trasplante convencional.
En el Hospital La Fe de Valencia hemos puesto en marcha y llevado a cabo el primer trasplante celular hepático en España, por tanto, esto abre una nueva línea de trabajo dentro del Programa de Trasplante Hepático.
Liver transplantation has been remarkably effective in the treatment in patients with end-stage liver disease. However, disparity between solid-organ supply and increased demand is the greatest limitation, resulting in longer waiting times and increase in mortality of transplant recipients. This situation creates the need to seek alternatives to orthotopic liver transplantation.Hepatocyte transplantation or liver cell transplantation has been proposed as the best method to support patients.
The procedure consists of transplanting individual cells to a recipient organ in sufficient quantity to survive and restore the function. The capacity of hepatic regeneration is the biological basis of hepatocyte transplantation. This therapeutic option is an experimental procedure in some patients with inborn errors of metabolism, fulminant hepatic failure and acute and chronic liver failure, as a bridge to orthotopic liver transplantation.
In the Hospital La Fe of Valencia, we performed the first hepatocyte trasplantation in Spain creating a new research work on transplant program.
El tratamiento de elección de las enfermedades hepáticas en estadio terminal es el trasplante hepático (TH). Su principal limitación reside en el desequilibrio entre pacientes que precisan un órgano y el número de órganos disponibles, lo que origina una significativa lista de espera, situación en la que se produce la mayor morbimortalidad. Esto plantea la necesidad de encontrar estrategias que permitan ser una alternativa parcial o total al TH.
Entre estos métodos, el más prometedor por los resultados obtenidos es el trasplante celular hepático (TCH) o trasplante de hepatocitos humanos. Los resultados de este tratamiento indican que puede ser una técnica muy útil, en la medida que dispongamos de hepatocitos humanos de calidad, viables y metabólicamente funcionales1–31.
La reciente irrupción del concepto de «medicina regenerativa» abre un nuevo marco de actuación terapéutica para enfermedades cuya causa es el deterioro celular de un órgano y para las que no es factible el transplante del órgano entero.
El tratamiento celular considera el hepatocito como principal célula deficitaria; utiliza células totalmente diferenciadas, los hepatocitos, capaces de desarrollar las funciones hepáticas, basándose en la capacidad regenerativa del hígado32–34.
Su utilidad como alternativa al TH convencional se ha investigado durante los últimos 30 años. Los primeros trabajos realizados por Howard en 196735, en modelos animales con enfermedades metabólicas hepáticas, constataron una mejoría bioquímica tras el TCH36. Posteriormente, hay descritos modelos experimentales de insuficiencia hepática aguda37–39, crónica40,41 y metabolopatías hepáticas42,43. Clínicamente se ha realizado en pacientes con fallo hepático fulminante (FHF)1,7,9,11,22–24,44,45 o hepatopatía aguda o crónica como puente al TH5,7,16,23,25 y niños con errores congénitos del metabolismo4,6,8,10,12,13,17–21.
Trasplante celular hepático como alternativa terapéutica al trasplante hepático convencionalPese a ampliar los criterios de selección de donantes, no se ha conseguido resolver el problema de la escasez de órganos, y es necesario buscar otras opciones. Entre estas se encuentran los sistemas de soporte artificial hepático, el xenotransplante, el tratamiento génico ex vivo o in vivo, la ingeniería de tejidos y el TCH.
En el momento actual, el TCH constituye la mejor alternativa al TH ortotópico (THO), dado los resultados obtenidos.
Las alternativas al TH deben tener como finalidad tratar de evitarlo, mediante la disminución del número de pacientes en la lista de espera; mantener la función hepática hasta el TH, y en los casos de FHF, conservar la función del hepatocito el tiempo suficiente para permitir la regeneración hepática y para lograr la recuperación de la función del hígado sin llegar al TH2,7,44.
El TCH se lleva a cabo en la Unidad de Terapia Celular Hepática del Hospital La Fe de Valencia cuyo objetivo primordial es trasladar la investigación básica a la clínica. Esta Unidad tiene acreditadas sus instalaciones conforme a la normativa europea EN-ISO 14644 sobre salas limpias y locales anexos. Su actividad clínica se concentra en los pacientes subsidiarios del TCH, obtiene los injertos descartados para TH, gracias a la estrecha colaboración con la Organización Nacional de Transplantes. La preparación de células en gran escala se realiza bajo condiciones de buena práctica de producción (good manufacturing practices).
Trasplante celular hepático. Concepto y objetivosEl TCH consiste en trasplantar hepatocitos humanos totalmente diferenciados a un órgano receptor, en cantidad suficiente para que estos sobrevivan y restauren la función normal.
El TCH tiene como objetivo recuperar y mantener las funciones hepáticas hasta disponer de un injerto adecuado, sustituir temporalmente la función hepatocitaria y, en los casos de enfermedades metabólicas, suplir el déficit enzimático causante de la enfermedad, bien como puente al TH o bien hasta lograr la recuperación suficiente de la función enzimática.
La base del TCH reside en la extraordinaria capacidad de regeneración que presenta el hígado en respuesta al daño celular de cualquier índole. El hígado se encuentra en condiciones normales en estado de reposo proliferativo y mantiene su capacidad de división en respuesta a cualquier tipo de agresión tóxica, vírica o resección quirúrgica. La hepatectomía parcial es el modelo experimental más evidente de regeneración hepática que no se acompaña de lesión hepatocelular46.
Si la intención del transplante celular es la regeneración hepática, la célula inicialmente implicada debe ser el hepatocito maduro, ya que gracias a su capacidad replicativa es capaz de restaurar con rapidez la población celular perdida.
La regeneración hepática no depende de las células progenitoras, sino que se origina por proliferación de células maduras46.
Básicamente la realización del TCH consta de 3 fases: el aislamiento de los hepatocitos, seguido de la preparación de las suspensiones celulares y finalmente su implante en el receptor. Tras el aislamiento, las células pueden congelarse y almacenarse para infundirse posteriormente.
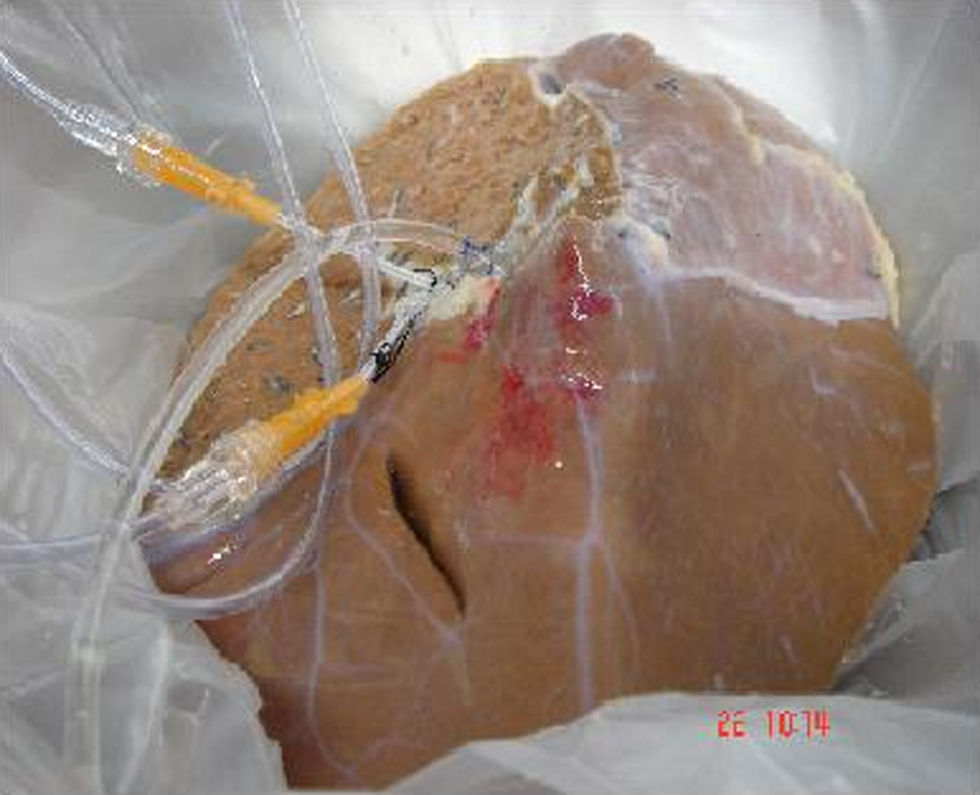
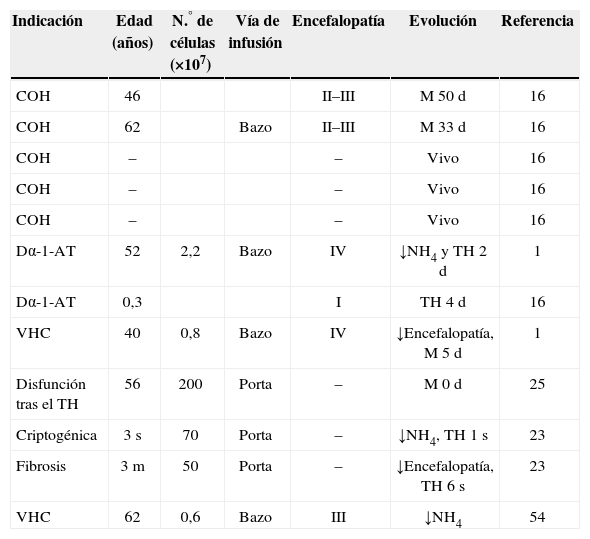
Los hepatocitos se obtienen a partir de órganos de donantes cadáver desechados para transplante por distintas causas1,8–11. El aislamiento de los hepatocitos se realiza mediante la perfusión del hígado con colagenasa37,47,48 (fig. 1). Se trasplanta aproximadamente un 5–10% de la masa celular hepática, mediante infusión por vía portal o esplénica de células en fresco o criopreservadas, con una viabilidad igual o superior al 50% y se precisa un número variable de infusiones1–5.
Indicaciones y resultados del trasplante celular hepáticoLos errores congénitos del metabolismo constituyen la principal indicación del TCH en el momento actual. Otras indicaciones incluyen el tratamiento de pacientes con FHF como puente al trasplante de órgano sólido, pacientes con hepatopatía crónica en lista de espera de TH que presentan descompensación grave, como tratamiento sintomático hasta el trasplante y en insuficiencia hepática grave tras resección hepática mayor1–30 (tabla 1).
Indicaciones del trasplante celular hepático
| Desórdenes genéticos que cursan con disfunción hepática |
|
| Déficits enzimáticos que cursan con disfunción hepática curables |
|
| Alteraciones de la coagulación: hemofilia A y B, déficit de proteína C y S, y déficit de factor vii |
| Alteraciones inmunológicas: angioedema hereditario |
| Insuficiencia hepática tras resección hepática mayor |
| Fallo hepático agudo/fulminante |
| Cirrosis aguda o crónica descompensada |
En nuestra unidad los niños con metabolopatías congénitas se clasifican de acuerdo a si existe o no indicación de TH, situación clínica de la enfermedad, respuesta al tratamiento y calidad de vida.
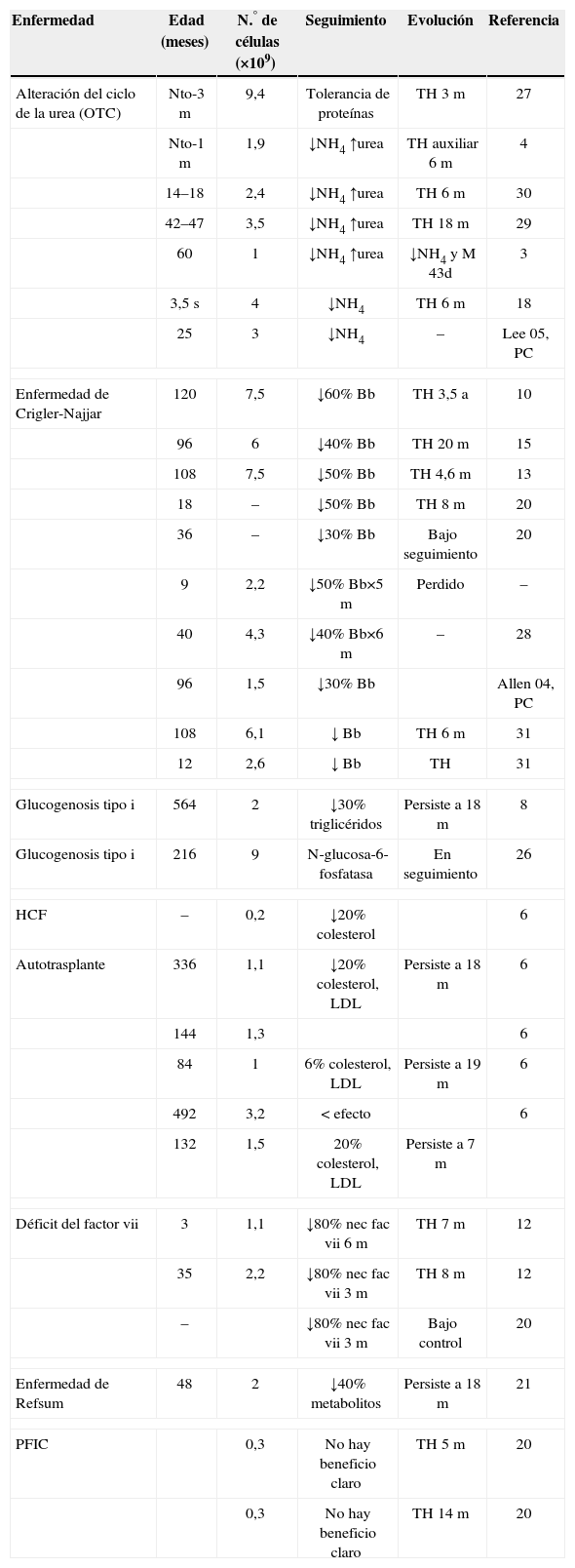
Errores congénitos del metabolismoConstituye la enfermedad en la que el TCH ha obtenido mayor éxito clínico1,4,6,8,10,12,13,17–21,31 (tabla 2).
Trasplante celular hepático en metabolopatías congénitas
| Enfermedad | Edad (meses) | N.° de células (×109) | Seguimiento | Evolución | Referencia |
| Alteración del ciclo de la urea (OTC) | Nto-3 m | 9,4 | Tolerancia de proteínas | TH 3m | 27 |
| Nto-1 m | 1,9 | ↓NH4 ↑urea | TH auxiliar 6m | 4 | |
| 14–18 | 2,4 | ↓NH4 ↑urea | TH 6m | 30 | |
| 42–47 | 3,5 | ↓NH4 ↑urea | TH 18m | 29 | |
| 60 | 1 | ↓NH4 ↑urea | ↓NH4 y M 43d | 3 | |
| 3,5 s | 4 | ↓NH4 | TH 6m | 18 | |
| 25 | 3 | ↓NH4 | – | Lee 05, PC | |
| Enfermedad de Crigler-Najjar | 120 | 7,5 | ↓60% Bb | TH 3,5 a | 10 |
| 96 | 6 | ↓40% Bb | TH 20m | 15 | |
| 108 | 7,5 | ↓50% Bb | TH 4,6m | 13 | |
| 18 | – | ↓50% Bb | TH 8m | 20 | |
| 36 | – | ↓30% Bb | Bajo seguimiento | 20 | |
| 9 | 2,2 | ↓50% Bb×5m | Perdido | – | |
| 40 | 4,3 | ↓40% Bb×6m | – | 28 | |
| 96 | 1,5 | ↓30% Bb | Allen 04, PC | ||
| 108 | 6,1 | ↓ Bb | TH 6m | 31 | |
| 12 | 2,6 | ↓ Bb | TH | 31 | |
| Glucogenosis tipo i | 564 | 2 | ↓30% triglicéridos | Persiste a 18m | 8 |
| Glucogenosis tipo i | 216 | 9 | N-glucosa-6-fosfatasa | En seguimiento | 26 |
| HCF | – | 0,2 | ↓20% colesterol | 6 | |
| Autotrasplante | 336 | 1,1 | ↓20% colesterol, LDL | Persiste a 18m | 6 |
| 144 | 1,3 | 6 | |||
| 84 | 1 | 6% colesterol, LDL | Persiste a 19m | 6 | |
| 492 | 3,2 | < efecto | 6 | ||
| 132 | 1,5 | 20% colesterol, LDL | Persiste a 7m | ||
| Déficit del factor vii | 3 | 1,1 | ↓80% nec fac vii 6m | TH 7m | 12 |
| 35 | 2,2 | ↓80% nec fac vii 3m | TH 8m | 12 | |
| – | ↓80% nec fac vii 3m | Bajo control | 20 | ||
| Enfermedad de Refsum | 48 | 2 | ↓40% metabolitos | Persiste a 18m | 21 |
| PFIC | 0,3 | No hay beneficio claro | TH 5m | 20 | |
| 0,3 | No hay beneficio claro | TH 14m | 20 | ||
↓: disminución; <: menor; a: años; Bb: bilirrubina; fac: factor; HCF: hipercolesterolemia familiar; LDL: lipoproteínas de baja densidad; m: meses; M: muerte tras el trasplante; nec: necesidades; NH4: amonio; Nto: nacimiento; OTC: déficit de ornitín-transcarbamilasa; PC: comunicación personal; PFIC: colostasis familiar progresiva intrahepática; s: semanas; TH: trasplante hepático.
Strom et al en la Universidad de Pittsburgh revisaron los resultados en 30 pacientes de 6 centros y comunicaron un total de 20 niños a los que se les realizó un TCH por esta enfermedad (tabla 2): en 11 de estos se indicó como puente al trasplante definitivo, 10 de estos recibieron un THO y uno de estos recibió un trasplante auxiliar1,13,16,18,19.
Uno de los primeros TCH se realizó en 199810 a una niña de 10 años con enfermedad de Crigler-Najjar y 9 meses después del TCH mantenía una actividad enzimática estable; recibió posteriormente un THO. Otra niña de 8 años con la misma metabolopatía recibió 9 infusiones de hepatocitos y disminuyeron los niveles séricos de bilirrubina (Bb) y la necesidad de fototerapia; se le realizó un trasplante 20 meses después15. En otro caso de Crigler-Najjar13 los niveles de Bb total descendieron tras el TCH y recibió un injerto hepático a los 146 días del TCH. Recientemente han publicado 2 nuevos casos de TCH en síndrome de Crigler Najjar tipo i31.
Las alteraciones en el ciclo de la urea (OTC) constituyen una de las indicaciones más frecuentes del TCH. A 5 de los 7 pacientes recogidos en la literatura médica con esta metabolopatía que han recibido un TCH se les realizó posteriormente un THO.
Sokal et al, en Bélgica, realizaron el TCH en 2 niños con alteración del ciclo de la urea y consiguieron la disminución de los niveles de amonio y la estabilización metabólica con mejoría psicomotora hasta el TH meses después17,21.
En el King's Collage se realizó TCH en 2 pacientes con déficit del factor vii con resultado satisfactorio, que permitió disminuir en un 80% los requerimientos del factor viia exógeno. En ambos pacientes se realizó un THO a los 7 y a los 8 meses, respectivamente12,20. En este mismo centro, el TCH realizado a 2 niños afectados de colestasis familiar intrahepática progresiva no presentó un resultado favorable, por la presencia de fibrosis, y se realizó finalmente un TH20.
Dos pacientes con glucogenosis tipo i han evolucionado satisfactoriamente tras el TCH (tabla 2) y se aprecia una corrección enzimática parcial, una corrección significativa de las hipoglucemias y una disminución de los triglicéridos en un 30–40%8,26.
En el Hospital La Fe de Valencia el 20 de mayo de 2008 realizamos el primer TCH a una niña de 12 años con un déficit del ciclo de la urea, con alteración neurológica y déficit cognitivo, importante restricción dietética, y múltiples episodios de descompensación, que en los 3 meses previos al TCH motivaron reiterados ingresos hospitalarios. Se realizaron 2 infusiones portales de células criopreservadas, con intervalo de una semana, de un injerto descartado para trasplante por isquemia, a través de Port-a-Cath colocado en rama de vena mesentérica inferior.
Se administró 5,2×108 y 3,5×108 células criopreservadas en la primera y en la segunda infusión con viabilidad del 74 y del 73%, respectivamente, tras la descongelación. Inicialmente se constató una disminución de los niveles de amonio y un aumento del índice de Quick. Se restauró la ingesta de proteínas a 1mg/kg/día. La paciente inició un cuadro febril que motivó una descompensación clínica con un nuevo aumento del amonio y un deterioro de la función hepática. Los hemocultivos detectaron presencia de Aspergillus, que no respondió al tratamiento antibiótico y causó la muerte de la paciente por una aspergilosis masiva a los 15 días del TCH.
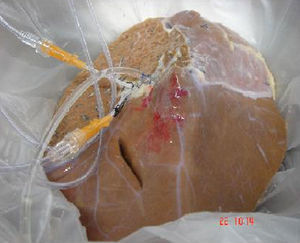
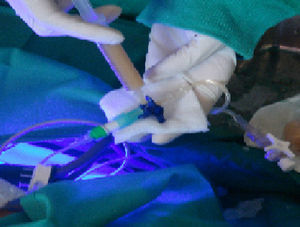
El segundo paciente al que hemos realizado un TCH es una niña de 9 meses, con enfermedad de Crigler-Najjar tipo i con fototerapia domiciliaria contínua. Se colocó un Port-a-Cath por laparoscopia para la infusión celular en una rama de la vena mesentérica superior. Se han realizado hasta la fecha 7 infusiones celulares portales durante 3 meses, un total de 26,63×108 células criopreservadas. Las infusiones, de distintos donantes isogrupo, con viabilidad entre el 47–75% tras la descongelación, permitió observar un descenso de la Bb sérica de 28-15mg/dl (fig. 2).
En ambos casos se realizó profilaxis antibiótica previa a la infusión y durante esta se administró un bolo de corticoides. La frecuencia cardiaca, la presión arterial y la temperatura permanecieron dentro de la normalidad. La eco Doppler hepática antes, durante y al final de la infusión no detectó alteraciones en la presión portal y en ambos tras la infusión celular se inició inmunosupresión con tacrolimus. En ningún caso se han detectado complicaciones tras el TCH. Sólo en la primera paciente se presentó un rash cutáneo que cedió con la administración de un tratamiento farmacológico.
Actualmente estamos efectuando el TCH en una niña de 6 años con glucogenosis tipo i, que presenta frecuentes episodios de hipoglucemia con ingreso hospitalario y niveles muy elevados de triglicéridos, colesterol y acido úrico.
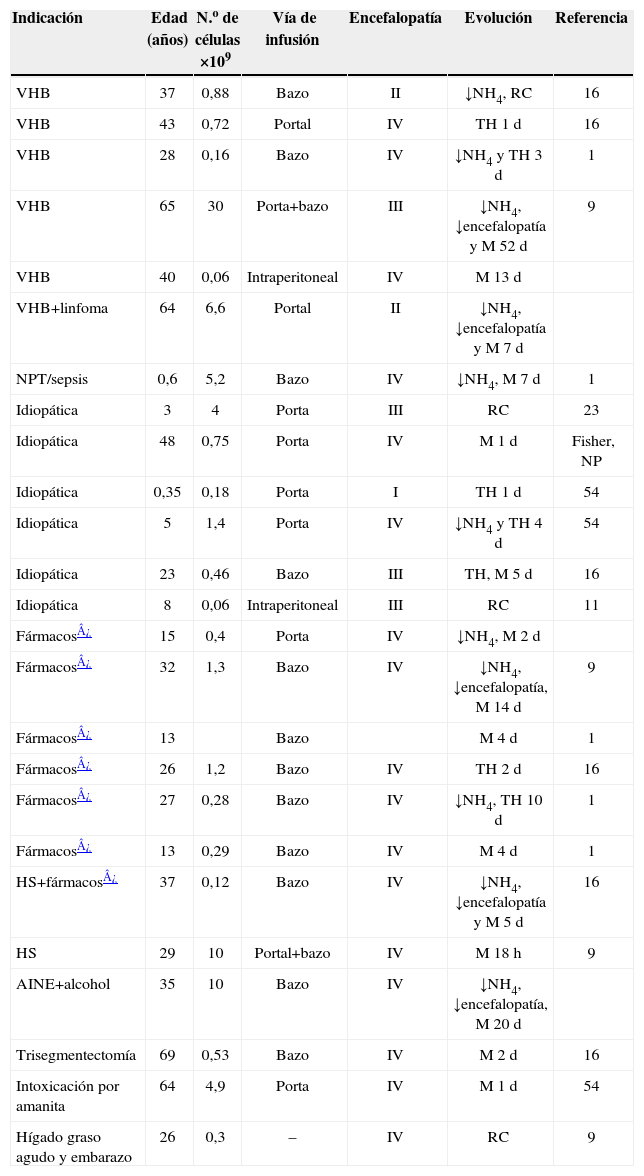
Fallo hepático fulminantePese a la priorización en la lista de TH, estos pacientes presentan un porcentaje de mortalidad elevado. En esta situación el TCH se plantea como puente al trasplante convencional y permite la supervivencia del paciente hasta disponer de un órgano o hasta conseguir la regeneración hepática1,2,9,44,49 (tabla 3).
Trasplante celular hepático en fallo hepático fulminante
| Indicación | Edad (años) | N.o de células ×109 | Vía de infusión | Encefalopatía | Evolución | Referencia |
| VHB | 37 | 0,88 | Bazo | II | ↓NH4, RC | 16 |
| VHB | 43 | 0,72 | Portal | IV | TH 1d | 16 |
| VHB | 28 | 0,16 | Bazo | IV | ↓NH4 y TH 3d | 1 |
| VHB | 65 | 30 | Porta+bazo | III | ↓NH4, ↓encefalopatía y M 52d | 9 |
| VHB | 40 | 0,06 | Intraperitoneal | IV | M 13d | |
| VHB+linfoma | 64 | 6,6 | Portal | II | ↓NH4, ↓encefalopatía y M 7d | |
| NPT/sepsis | 0,6 | 5,2 | Bazo | IV | ↓NH4, M 7d | 1 |
| Idiopática | 3 | 4 | Porta | III | RC | 23 |
| Idiopática | 48 | 0,75 | Porta | IV | M 1d | Fisher, NP |
| Idiopática | 0,35 | 0,18 | Porta | I | TH 1d | 54 |
| Idiopática | 5 | 1,4 | Porta | IV | ↓NH4 y TH 4d | 54 |
| Idiopática | 23 | 0,46 | Bazo | III | TH, M 5d | 16 |
| Idiopática | 8 | 0,06 | Intraperitoneal | III | RC | 11 |
| Fármacos¿ | 15 | 0,4 | Porta | IV | ↓NH4, M 2d | |
| Fármacos¿ | 32 | 1,3 | Bazo | IV | ↓NH4, ↓encefalopatía, M 14d | 9 |
| Fármacos¿ | 13 | Bazo | M 4d | 1 | ||
| Fármacos¿ | 26 | 1,2 | Bazo | IV | TH 2d | 16 |
| Fármacos¿ | 27 | 0,28 | Bazo | IV | ↓NH4, TH 10d | 1 |
| Fármacos¿ | 13 | 0,29 | Bazo | IV | M 4d | 1 |
| HS+fármacos¿ | 37 | 0,12 | Bazo | IV | ↓NH4, ↓encefalopatía y M 5d | 16 |
| HS | 29 | 10 | Portal+bazo | IV | M 18h | 9 |
| AINE+alcohol | 35 | 10 | Bazo | IV | ↓NH4, ↓encefalopatía, M 20d | |
| Trisegmentectomía | 69 | 0,53 | Bazo | IV | M 2d | 16 |
| Intoxicación por amanita | 64 | 4,9 | Porta | IV | M 1d | 54 |
| Hígado graso agudo y embarazo | 26 | 0,3 | – | IV | RC | 9 |
↓: disminución; AINE: antiinflamatorio no esteroideo; d: días; h: horas; HS: herpes simple; M: muerte tras el trasplante; NH4: amonio; NP: no publicado; NPT: nutrición parenteral total; RC: recuperación completa; TH: trasplante hepático; VHB: virus de la hepatitis B.
El beneficio del TCH en estos pacientes es difícil de demostrar, dados los múltiples parámetros que influyen en la evolución de la función hepática, el número reducido de casos y la rápida realización del THO. El TCH parece mejorar la supervivencia, el grado de encefalopatía y los niveles de amonio1,9,11,15,16.
Tres pacientes con FHF presentaron tras la realización del TCH una recuperación espontánea y no fue necesario el TH, aunque esta podría atribuirse a una remisión de la enfermedad. A través de la arteria esplénica al bazo o de la vena porta al hígado1,9 se infunde entre el 1–5% de la masa hepática del paciente, entre 107–1010 hepatocitos.
En el primer caso de TCH en FHF, con encefalopatía grado iii-iv, Habibullah infunde 6×107 hepatocitos fetales en la cavidad peritoneal y confirma mejoría de la supervivencia comparada con un grupo control (el 48 versus el 33%). La encefalopatía mejoró a las 48h tras el TCH y disminuyó paralelamente los niveles de amonio y de Bb11.
Bilir realiza el TCH en 5 pacientes con fallo hepático agudo, con encefalopatía de grado iii y iv, sin indicación de TH. Infunde entre el 1–10% de la masa hepática en 3 pacientes de etiología tóxica y 2 pacientes de etiología vírica a nivel esplénico o hepático. Tras el TCH 3 pacientes mejoraron el grado de encefalopatía, los niveles de amonio y el tiempo de protrombina.
Strom realiza el TCH en 4 pacientes con FHF (tabla 3) con encefalopatía de grado iv y fallo de algún órgano, esto sirve como puente para el TH1.
En la mayoría de las publicaciones, la principal razón de la baja eficiencia de los hepatocitos trasplantados reside en el reducido número de células infundidas. Por otra parte, en el FHF la necrosis hepática origina sustancias tóxicas capaces de inhibir la regeneración de los hepatocitos trasplantados.
Enfermedad hepática aguda o crónica y cirrosis descompensadaEl fallo hepático agudo y crónico es más frecuente en adultos que en niños; en ambos casos, el TCH se plantea como puente al THO. En la cirrosis descompensada podría mejorar la función residual y la calidad de vida, y podría aumentar la supervivencia16 (tabla 4).
Cirrosis aguda o crónica descompensada
| Indicación | Edad (años) | N.° de células (×107) | Vía de infusión | Encefalopatía | Evolución | Referencia |
| COH | 46 | II–III | M 50d | 16 | ||
| COH | 62 | Bazo | II–III | M 33d | 16 | |
| COH | – | – | Vivo | 16 | ||
| COH | – | – | Vivo | 16 | ||
| COH | – | – | Vivo | 16 | ||
| Dα-1-AT | 52 | 2,2 | Bazo | IV | ↓NH4 y TH 2d | 1 |
| Dα-1-AT | 0,3 | I | TH 4d | 16 | ||
| VHC | 40 | 0,8 | Bazo | IV | ↓Encefalopatía, M 5d | 1 |
| Disfunción tras el TH | 56 | 200 | Porta | – | M 0d | 25 |
| Criptogénica | 3 s | 70 | Porta | – | ↓NH4, TH 1s | 23 |
| Fibrosis | 3m | 50 | Porta | – | ↓Encefalopatía, TH 6s | 23 |
| VHC | 62 | 0,6 | Bazo | III | ↓NH4 | 54 |
↓: disminución; COH: cirrosis alcohólica; d: días; Dα-1-AT: déficit de alfa-1-antitripsina; m: meses; M: muerte tras el trasplante; NH4: amonio; s: semanas; TH: trasplante hepático; VHC: virus de la hepatitis C.
En 1993, en 10 pacientes con cirrosis hepática, Mito realizó el primer TCH con hepatocitos autógenos infundidos en el bazo y empleó para el aislamiento celular el segmento lateral izquierdo del receptor50,51.
Las enfermedades hepáticas crónicas implican pérdida del parénquima hepático sin que exista proliferación compensatoria y este se reemplaza por tejido fibroso, acúmulos de grasa y cirrosis. En estas condiciones, el TCH presenta limitaciones: los hepatocitos implantados, al encontrarse en ambiente adverso, no son capaces de regenerar el parénquima y es necesario buscar lugares de implante alternativos, como el bazo1,9,16,23,24.
El TCH en Estados Unidos5,16 en estos pacientes, realizaba la infusión de hepatocitos, en fresco o tras criopreservación, por arteria esplénica o vena porta; se infundía entre 107–1010 células hasta un máximo de un 5% del volumen hepático normal. Los resultados demuestran que en 8 casos sirvió como puente al THO, 2 pacientes presentaron una recuperación completa sin necesidad de TH y 16 pacientes murieron. Cuando se indicó el TCH se apreció una mejoría en los pacientes cirróticos con normalización de la encefalopatía y la anuria4,16.
El TCH llevado a cabo en 3 niños de 3 semanas, de 3 y de 6 meses, con cirrosis hepática idiopática, criptogénica23 y séptica1, respectivamente, originó en los 2 primeros disminución de las cifras de amonio y mejora de la encefalopatía con recuperación completa tras el THO a los 6 y a los 7 días, respectivamente, y la muerte en el tercero al 7.o día del TCH.
En 2 pacientes con déficit de alfa-1-antitripsina se constató una recuperación de la enzima deficitaria con normalización de su actividad plasmática, lo que podría indicar la existencia de una repoblación hepática por los hepatocitos transplantados. Uno de estos pacientes recibió un THO a los 3 días del TCH1.
En el Hospital La Fe realizamos un TCH a un varón de 47 años en lista de espera para re-TH por recidiva del virus C en el injerto, con ingreso hospitalario por descompensación brusca durante la espera y por encefalopatía de grado iv que obligó a respiración asistida. Se realizaron 4 infusiones de células criopreservadas en la arteria esplénica, de un injerto descartado para trasplante por isquemia, mediante acceso percutáneo a través de la arteria femoral para implante en el bazo. Se administraron un total de 22,2×108 con viabilidad entre el 51–68% tras la descongelación (fig. 2). Se realizó profilaxis antibiótica previa a la infusión y durante esta se administró un bolo de corticoides. Se administró pauta de inmunosupresión con corticoides y tacrolimus.
La evolución clínica y analítica fue favorable, se constató una mejoría significativa de la encefalopatía y se extubó al paciente, así como una disminución de las cifras de urea, creatinina, Bb y niveles de amonio, y se consiguió iniciar la ingesta oral del paciente. No se obtuvo durante este tiempo un donante compatible y el paciente presentó una hemorragia digestiva alta secundaria a rotura de várices esofágicas que causó la muerte fulminante a los 15 días del TCH.
Valoración clínica de los pacientes tras el trasplante celular hepáticoLos distintos grupos de trabajo relatan una mejoría clínica y analítica observada por la disminución de los niveles de amonio y el tiempo de protrombina, una mejora de la encefalopatía y un aumento de la enzima deficitaria en los pacientes con metabolopatías1,2,4,9,10,12,13,16–19.
Sin embargo, no está claro si esta mejoría es resultado del TCH, teniendo en cuenta que el número de hepatocitos trasplantados en muchos de los pacientes es bajo. Tampoco existe un conocimiento exacto de la duración de la eficacia del procedimiento y la evolución clínica del paciente es la que indica la necesidad de nuevas infusiones celulares. También hay que tener en cuenta que la capacidad de injertarse los hepatocitos del donante en el receptor es baja (debajo del 10%) y puede resultar insuficiente para conseguir un beneficio claro2.
La técnica más utilizada para determinar la supervivencia de los hepatocitos en el hígado receptor es la biopsia hepática postransplante: permite la detección de los hepatocitos procedentes del donante o un incremento de la actividad enzimática deficitaria9–11,13, y es difícil obtener una evidencia histológica.
Se ha observado la presencia de hepatocitos transplantados en el hígado y en el bazo al realizar la autopsia9. Otros autores propugnan el empleo de técnicas de medicina nuclear para la detección de los hepatocitos infundidos.
Transcurridos 3–6 meses tras la infusión, se describe un debilitamiento de la mejoría metabólica obtenida, que puede considerarse como rechazo o muerte tardía de las células trasplantadas; esta pérdida de función se podría prever mediante la repetición de infusiones celulares.
Compatibilidad e inmunosupresiónAl igual que en el trasplante convencional, se debe respetar la compatibilidad ABO y es necesario un régimen inmunosupresor para combatir el rechazo, ya que los hepatocitos pueden rechazarse al igual que otros órganos trasplantados52.
En el TCH es necesaria la infusión de bolos de esteroides, así como el empleo de fármacos inmunosupresores, y la pauta más frecuentemente empleada es el doble tratamiento con inhibidores de la calcineurina y corticoides en dosis similares a las utilizadas en el TH.
Sin embargo, es difícil la detección del rechazo celular, ya que los marcadores que se emplean en el TH para la valoración del rechazo del injerto no son útiles en el TCH.
En los 3 pacientes a los que se les ha realizado el trasplante de hepatocitos, se han administrado bolos de corticoides (un bolo por paciente), con cada una de las infusiones realizadas y posteriormente en todos los casos se inició tratamiento inmunosupresor con tacrolimus.
Ventajas del trasplante celular hepáticoLa principal ventaja frente al TH es que no es un proceso quirúrgico mayor, con menor morbimortalidad y coste, y que es un tratamiento mucho menos invasivo2,5,8.
Ofrece la posibilidad de utilizar células de un único donante para varios receptores mediante la maximización de los recursos de donación.
Ofrece la posiblilidad de efectuar el procedimiento de manera semiprogramada al poder criopreservar las células8,19,20.
En el TCH las células transplantadas son funcionantes, capaces de mantener las funciones hepáticas hasta la obtención de un órgano; en determinados casos, al facilitar la regeneración hepática, sería posible la curación y constituir una alternativa al TH.
Los resultados publicados por los diferentes grupos de trabajo respecto a su aplicación en determinadas metabolopatías congénitas indican que se trata de un procedimiento eficaz como tratamiento «puente» e incluso como alternativa al THO2,18,20,21,25.
Limitaciones del trasplante celular hepáticoLa principal limitación del TCH reside en la falta de fuentes adecuadas para la obtención de hepatocitos viables. Actualmente las únicas fuentes disponibles de hepatocitos son los órganos descartados para implante, el tejido resultante de reducciones hepáticas y el tejido procedente del split. La esteatosis, principal motivo de desestimación del injerto para THO, no constituye una fuente óptima para el aislamiento de hepatocitos47,53,54.
Otro de los obstáculos en el TCH reside en la rápida eliminación de los hepatocitos trasplantados por los macrófagos del receptor. El control del hepatocito trasplantado plantea problemas ante el desconocimiento de los mecanismos que permiten la integración de los hepatocitos infundidos en el hígado o en el bazo y su supervivencia. No existen estudios en pacientes que valoren la respuesta inmunitaria que desencadenan los hepatocitos trasplantados, la repoblación de estos en el receptor, las causas que ocasionan la pérdida de viabilidad de los injertos o su rechazo, ni sabemos qué fármacos emplear para evitarlo. Además, desconocemos con exactitud la eficacia clínica del TCH.
La mayoría de los artículos publicados son casos clínicos aislados y no existen ensayos clínicos controlados en humanos, por lo que la evidencia científica de los trabajos es baja.
La utilización de métodos que potencien la capacidad de regeneración de los hepatocitos trasplantados, como el empleo de factores de crecimiento epitelial, las hormonas, como la insulina o la T3, y las células ovales, constituyen nuevas líneas de investigación.
Complicaciones del trasplante celular hepáticoLas complicaciones del TCH son menores que las del TH y las más frecuentes son la infección o la trombosis23,25.
Tras realizar las primeras infusiones celulares se ha descrito un aumento de la presión portal, que retorna a la normalidad. Puede producirse trombosis portal, hipertensión portal e incluso embolia pulmonar49.
La infiltración en la arteria esplénica puede causar infección, embolia y, en ocasiones, complicaciones pulmonares12. Los pacientes con fallo hepático agudo o crónico pueden presentar sepsis, viremia y fallo multiorgánico, aunque no está definida su relación con el TCH9.
La necesidad de inmunosupresión continuada plantea problemas para mantener los niveles dentro del rango terapéutico13.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.