El carcinoma hepatocelular (CHC) es la tercera causa de cáncer en el mundo y constituye el 90% de las neoplasias malignas primarias del hígado. Su incidencia varía notablemente de unos países a otros. En nuestro medio tiene una incidencia intermedia, con 6 a 8 casos por 100.000 habitantes y año1,2, y es más frecuente en los varones que en las mujeres (relación, 3-8/1). En Europa, la edad de aparición del tumor se sitúa en torno a los 6070 años.
Los factores etiológicos del CHC son: la cirrosis hepática, la hepatitis crónica por virus B y C, las hepatopatías de origen metabólico y algunos agentes carcinogénicos (por ejemplo, aflatoxina y thorotrast). La cirrosis hepática, fundamentalmente con relación a la infección crónica por virus de la hepatitis B o C y por la desestructuración histológica que conlleva, tiene una alta prevalencia de CHC, ya que el 95% de estos tumores aparecen en hígados con esta enfermedad de base; con una incidencia anual del 2-8% si la hepatopatía es por virus C (como causa más frecuente de cirrosis en nuestro entorno), y el 5070% de estos pacientes fallecen por el tumor3.
Starzl et al4, en el nacimiento del trasplante hepático (TH), creyeron que este tratamiento sería la indicación primaria y la panacea para la cura de los tumores hepáticos. Se trasplantó a sujetos con lesiones de gran tamaño, múltiples, o con afectación de estructuras vasculares mayores. Con este grupo de candidatos, los resultados fueron muy desfavorables, con supervivencias globales y libres de enfermedad muy cortas. Años después Pichlmayr5 afirmó que los resultados del TH para esta etiología eran tan pobres que una técnica tan compleja y cara no debería ser indicada para este tipo de sujetos.
Más tarde, Penn recogió la casuística mundial publicada sobre TH en pacientes con CHC, y comprobó los malos resultados de este procedimiento, a excepción de los sujetos con CHC del tipo fibrolamelar y tumores incidentales (tumores diagnosticados en el hígado explantado), que presentaban resultados similares a los trasplantados por afección benigna6,7. Posteriormente, durante los años noventa empezaron a aparecer publicaciones sobre TH en individuos seleccionados con CHC, con resultados ex-celentes8-10.
Actualmente, sobre todo, debido al número limitado de órganos de los que disponemos, se sigue indicando el TH por CHC a sujetos en estadios precoces de su enfermedad para así obtener las máximas probabilidades de supervivencia.
Aspectos generalesEl CHC es un tumor que crece a partir de las células hepáticas. Por su aspecto macroscópico los CHC pueden ser clasificados en expansivos, extensivos y multifocales. Los expansivos o nodulares se caracterizan por ser lesiones ocupantes de espacio que claramente se diferencian del tejido hepático no tumoral, son los que habitualmente se indican para el TH. Los extensivos o masivos, que infiltran el parénquima vecino sin clara delimitación, y los multifocales o difusos, que se manifiestan como múltiples nódulos que afectan a gran parte del hígado, no son subsidiarios del TH.
Existe evidencia científica de nivel I (tabla 1)11 para que los sujetos con alguno de los factores de riesgo conocidos deban ser incluidos en programas de detección precoz, para ello se realizan ecografías de hígado cada 6-12 meses12 y determinaciones periódicas de alfafetoproteína (AFP), aunque ésta no ha demostrado ser una herramienta sensible y eficiente en las pruebas de vigilancia13, ya que aparecen valores normales en un 20-30% de los pacientes con CHC. Pero si los valores superan los 200 ng/ml hay un alto valor predictivo positivo de coexistencia de CHC14, e igualmente si persisten a lo largo del tiempo los valores elevados de AFP15.
TABLA 1. Guía del Comité de la AASLD sobre evidencia científica11
La evolución natural del CHC sobre cirrosis no tratado conlleva una supervivencia media de 17 meses y acumulada a 1, 3 y 5 años del 54, el 40 y el 28%, respectivamente16.
DiagnósticoLa mayoría de los pacientes estudiados para un TH están asintomáticos, y el tumor se descubre durante los controles periódicos. La ecografía hepática suele mostrar la lesión ocupante de espacio (LOE), tiene una sensibilidad baja para confirmar el CHC, pero si se acompaña de valores mayores a 200 ng/ml de la AFP, en un hígado cirrótico, es muy indicativo de CHC, y tiene una especificidad del 99,4%14.
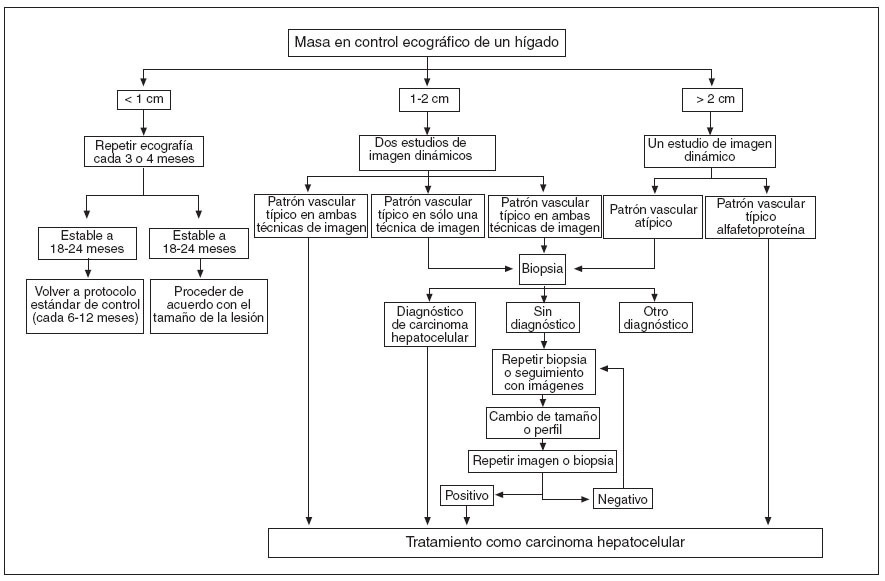
El CHC tiene un comportamiento específico en los estudios de imagen dinámicos con contraste, como ecografía con contraste, tomografía computarizada (TC) helicoidal y resonancia magnética (RM). Es así como en la TC se puede observar captación rápida del contraste en fase arterial y lavado precoz o tardío en fase venosa, quedando un halo hiperdenso peritumoral. Desde la reunión del año 2000 de la EASL (European Association for the Study of the Liver) se han adoptado unos criterios con relación al tamaño del tumor17. Está establecido que, en tumores mayores a 2 cm, una prueba de imagen típica de CHC es suficiente para efectuar el diagnóstico. Si no es así, es evidente que se debe recurrir a la biopsia (nivel de evidencia II). En los tumores de 1-2 cm es necesario confirmar el diagnóstico con 2 pruebas de imagen; si no son típicas, nuevamente, en esta situación está indicada la biopsia (nivel de evidencia II). Cuando el nódulo es menor de 1 cm, el comportamiento imagenológico no es específico y la biopsia es difícil de realizar, en estos casos la actitud adecuada es la observación, con repetición de ecografía cada 3 o 4 meses. Si no se observa crecimiento durante 2 años, se considera como tumor benigno, y se debe seguir con los controles habituales de vigilancia de pacientes de alto riesgo (nivel de evidencia III)13 (fig. 1).
Fig. 1. Algoritmo de estudio de nódulos hepáticos en ecografía de control de pacientes cirróticos. Se propone para investigar un nódulo hepático hallado en control ecográfico o durante la evolución del sujeto. Nótese que los nódulos que inicialmente son menores de 1 cm y que crecen con el tiempo pueden ser investigados mediante uno de los dos algoritmos señalados según el tamaño final del nódulo. El patrón vascular típico se refiere a que la lesión es hipervascular en fase arterial y con lavado rápido en fase portal/venosa. Los otros patrones son considerados atípicos13.
Las pruebas de imagen, como ecografía, TC y RM, 3 meses antes del TH para detectar la lesión principal tienen una sensibilidad del 79, el 81 y el 89%, respectivamente. La sensibilidad es menor para nódulos pequeños o lesiones múltiples18 y se reduce al 44% (TC y RM) cuando el intervalo hasta el TH supera los 6 meses19.En general, las imágenes en fase pre-TH subestiman el estadio en un 16% y lo sobrestiman en un 9%, como se ha objetivado con los estudios histopatológicos20.
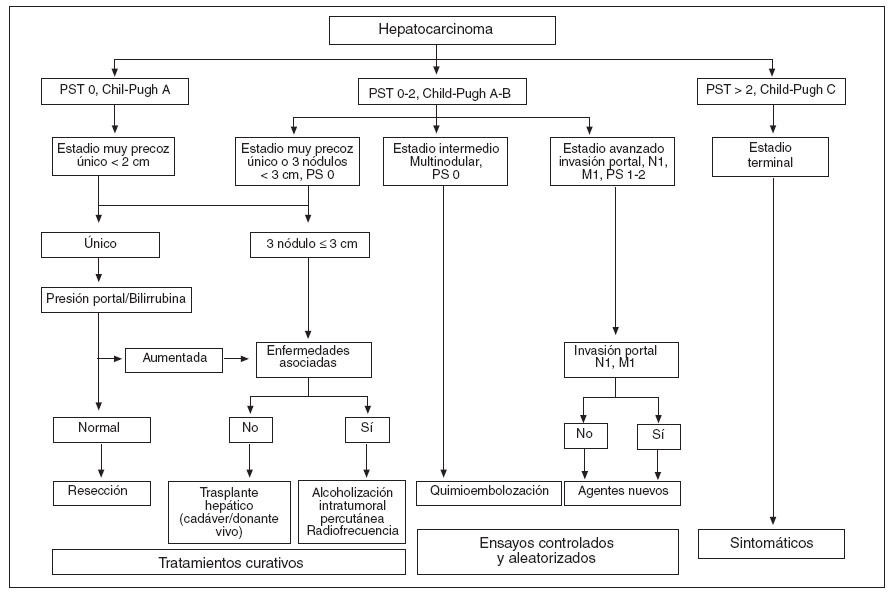
PronósticoEl pronóstico se basa en el estadio tumoral, el sistema TNM es el más ampliamente utilizado, pero esta clasificación se ha demostrado ineficaz en este tipo de tu-mores21,22. La función hepática subyacente también incide en la supervivencia posterior, por lo que se ha buscado un sistema que contemple ambos aspectos; así el sistema propuesto por el grupo del hospital de la Beaujon mezcla el TNM y la presencia de cirrosis o no, aunque este sistema sólo ha sido validado para la resección hepática23. La clasificación de Child-Pugh y el MELD sólo valoran el estadio funcional del hígado, por lo que tampoco son válidos. El sistema de clasificación del Hospital Clínic de Barcelona (BCLC, Barcelona-Clí-nic-Liver-Cancer) parece cumplir ambos requisitos, ya que incluye aspectos como el estado físico y los síntomas relativos al tumor24. Esta última clasificación ha sido validada en Estados Unidos e Italia25,26 y nos permite correlacionar el estadio y la expectativa de vida con las aptitudes terapéuticas (nivel de evidencia II-2)13 (fig. 2).
Fig. 2. Estrategia para clasificar y tratar a los pacientes con diagnóstico de carcinoma hepatocelular según el BCLC13.
Clasificación en lista de esperaLos sujetos con indicación de TH por CHC, en algunos centros, eran incluidos en lista de espera de forma preferente, por lo que recibían el trasplante mucho antes que aquellos con enfermedades benignas. En otros centros se realizaba el trasplante por fecha de inclusión en lista de espera, lo que ocasionaba que saliera de lista, por progresión de la enfermedad, hasta un 40% al año.
La United Network for Organ Sharing (UNOS) introdujo en Estados Unidos desde el año 2002 un nuevo sistema de priorización en lista de espera llamado Model for Endstage Liver Disease (MELD), que posteriormente fue validado para afección benigna27,28. Para los pacientes con CHC hubo que crear reglas de corrección, ya que la mayoría de estos sujetos no hubieran sido trasplantados por progresión de la enfermedad. Así la UNOS creó una clasificación pronóstica basada en los criterios de Milán (tabla 2)29, de tal modo que a los tumores menores de 2 cm (T1) se les asignó 24 puntos, con expectativas de muerte a 3 meses del 15%, y los CHC solitarios (mayores de 2 cm y hasta 5 cm) o 2-3 nódulos, todos menores de 3 cm (T2), se les dio 29 puntos, con una mortalidad esperada del 30% a 3 meses. Además, cada 3 meses en lista de espera se les aumentaba un 10% el MELD. Posteriormente, se ha vuelto a reclasificar a estos pacientes, así a aquellos con CHC T1 no se les añade nada y a los T2 se les aplica 22 puntos. Esto nos permite trasplantar al 86% de T1 y el 90,2% de los pacientes T2 en un período no mayor de 3 meses30. De todas maneras habrá que esperar los resultados a largo plazo para ver la utilidad de este proceder y ver si los protocolos, los datos por intención de tratamiento y los resultados clínicos apoyan esta política31.
TABLA 2. Clasificación en estadios de la UNOS (United Network for Organ Sharing) para el carcinoma hepatocelular
Cuando tenemos un sujeto en lista de espera de trasplante, debemos mantener una vigilancia periódica (cada 3 meses) para reconocer precozmente la aparición de un tumor o, si se conocía su existencia, comprobar que no ha evolucionado.
Con este sistema, la utilización de tratamientos locorregionales neoadyuvantes en estos pacientes constituye un factor de confusión para su manejo, ya que aunque teóricamente se reduciría la retirada de lista espera de los sujetos por progresión de la enfermedad, en la realidad esto es muy difícil de demostrar31.
TratamientoEl tratamiento con alcohol y radiofrecuencia está considerado potencialmente curativo en casos seleccionado32-34 .
Pero en el presente la mejor terapia curativa para los pacientes con CHC es la cirugía, pero ésta depende de dos factores:
–Características del tumor, que incluye tamaño, número, situación e invasión vascular y diseminación extrahepática.–Características del hígado, o sea, si hay cirrosis o no, y el grado de deterioro funcional.
Resección hepática
Está indicada en enfermos sin cirrosis o en aquellos con cirrosis, pero con estadios funcionales aceptables (Child-Pugh A); la supervivencia a los 5 años en casos seleccionados sin hipertensión portal llega al 70%35.
La mortalidad es del 3% y la supervivencia a los 5 años, del 50%36,37, pero el gran problema de este tratamiento es la recidiva, que puede alcanzar el 50-70% a 5 años35,37,38 por diseminación o tumores de novo39.
Trasplante hepático
El TH es un tratamiento potencialmente curativo que consiste en la extirpación radical del tumor y del hígado afecto de una enfermedad precancerosa, como es la cirrosis.
En Europa, desde 1988 hasta 2005, se ha trasplantado a más de 6.000 sujetos con CHC, lo que representa el 10,7% del total de TH. Esta alternativa terapéutica se indica a sujetos en estadio B o C de Child-Pugh; en los estadios A está en discusión, ya que muchos grupos consideraron inicialmente que eran candidatos a TH. En la actualidad, y como consecuencia de la escasez de órganos, la mayoría de los grupos opinan que el tratamiento inicial debe ser la resección hepática (RH). Un análisis de decisión comprobó que el coste-efectividad de la RH sobre el TH es mayor a partir de los 9 meses40, hecho corroborado con una cohorte real de pacientes, donde la supervivencia por intención de tratamiento descendió desde el 84% a los 2 meses hasta el 54% a los 6 meses en los sujetos en lista de espera de TH, lo que motivó que la supervivencia fuese mayor en los pacientes con RH que con TH35.
Con frecuencia, el TH no puede ser aplicable porque el CHC aparece en pacientes de edad avanzada y su diagnóstico se realiza cuando su tamaño es demasiado grande, es multifocal o hay extensión tumoral extrahepática.
Actualmente el tamaño y el número de nódulos tienen un importante papel en la indicación del trasplante. Los mejores resultados del TH en pacientes con cirrosis hepática se obtienen siguiendo los criterios de Milán, que son: un nódulo único menor de 5 cm. Si es múltiple, que sean menos de 3 nódulos y que el mayor no supere los 3 cm de diámetro y sin trombosis tumoral de la porta y venas suprahepáticas9.
El resultado a largo plazo del TH con los criterios de Milán, al igual que en los pacientes trasplantados con CHC incidental, es igual al obtenido con enfermedades benignas, con supervivencias que exceden el 70%10,13 e índices de recidiva que se sitúan en el 15% a 5 años41,42.
La disyuntiva ha surgido cuando se han publicado trabajos18,43 de sujetos trasplantados con un estadio neoplásico ligeramente más avanzado, como el presentado por Yao et al18 (tamaño tumoral hasta 6,5 cm si el tumor es único; hasta 3 nódulos, pero que el mayor sea de 5 cm y la suma tumoral total no supere los 8 cm), con resultados aceptables, en que se observa que los sujetos trasplantados sin invasión vascular y sin diseminación de la enfermedad muestran unos grados de supervivencia similares a los casos con criterios de Milán.
Esto ha ocasionado un debate internacional de si se deben ampliar los criterios de indicación de este procedimiento y así efectuar el TH en estos individuos44. Las opiniones en contra surgen cuando:
–Consideramos al conjunto de sujetos trasplantados con criterios ampliados, y se observa que la supervivencia a 5 años se sitúa alrededor del 50%, con índices de recurrencia del 20%18,43,45,46.
–Que hay que tener en cuenta que los criterios para ampliar las indicaciones se basan en los estudios histopatológicos, hecho que, como ya hemos comentado, no se corrobora con el diagnóstico antes del TH, esto último es fundamental para decidir de forma adecuada la actitud a tomar.
–Destacar, que si las listas de espera son amplias, la enfermedad tumoral progresa en el 40% de los pacientes, y hasta un 25% de los sujetos pueden salir de ellas a 1 año47, lo que representaría una supervivencia del 60% a 5 años por intención de tratamiento, resultados inferiores a los obtenidos con los criterios de Milán. Para intentar mejorar las perspectivas de estos sujetos, se ha aumentado la fuente de los donantes, y se obtenienen hígados de: donantes mayores, hígados esteatósicos, portadores de hepatitis por VHC, donantes a corazón parado, trasplantes dominó, split y, lo que está más en boga, hígados de donante vivo; que como se ha publicado, con un análisis de coste-efectividad, este tipo de trasplante es una buena opción cuando las listas de espera superan los 7 meses48.
– Tener en cuenta que tampoco hay estudios prospectivos aleatorizados y/o metaanálisis que apoyen la postura de la expansión de los criterios de TH para CHC, por lo que todavía no hay evidencia científica49.
Por tanto, no se puede adoptar criterios sólidos de actuación clínica en este sentido49.
De todas maneras, debemos aceptar que puede haber un pequeño grupo de pacientes con criterios ampliados que se pueden incluir para TH con resultados similares a los obtenidos con los criterios de Milán, pero tenemos que considerar dos aspectos fundamentales: a) definir los criterios de expansión en el momento de inclusión en lista de TH, y b) el impacto de estos criterios sobre el porcentaje de sujetos que salen de la lista de espera (dropout rates)y la supervivencia por intención de tratamiento49.
Tratamiento neoadyuvante
Otra posibilidad que se baraja en la literatura, y en la clínica diaria, es la utilización de procedimientos previos al TH para evitar la progresión de la neoplasia (downstanging), lo que significa reducción del estadio tumoral; con esto, los sujetos pueden cumplir con los criterios enunciados en Milán o los ampliados para indicar TH por CHC. Dentro de los procedimientos que se han demostrado útiles están:
Quimioembolización transarterial (QET).Consiste en la infusión por vía arterial en el hígado de una sustancia de contraste grasa, como lipiodol, mezclada con un quimioterápico, como adriamicina o cisplatino50. Esta disolución se distribuye por el hígado y se deposita en el tumor, ya que el CHC tiene mucha apetencia por ella. Luego se infunden unas partículas (gelfoam, fibrina, alcohol polivinílico, etc.) para cerrar las arterias que vascularizan la neoplasia, y se obtiene una necrosis de ésta. Las principales contraindicaciones de esta técnica son la trombosis portal y el estadio avanzado de la cirrosis (Child-Pugh C), por el riesgo de insuficiencia hepática y muerte.
Hay 4 grados de respuesta al tratamiento: a)completa, no hay tumor visible; o sea, cuando se produce una homogeneización de la captación del contraste (lipiodol) de más del 80% (que implica mayor grado de necrosis) en el tumor y/o si no hay captación del contraste por el tumor en las pruebas dinámicas de imagen y si se reduce más del 50% el tamaño del nódulo (TC, RM y ecografía); b) parcial, regresión del tumor en un 30%; c) enfermedad estable, no progresa el tumor, y d) enfermedad progresiva, la neoplasia crece al menos un 20%51.
Podemos obtener una total ausencia de retirada de lista de espera de TH (dropout) en 6 meses50, aunque la respuesta total sólo alcanza el 2-29%, mientras que la parcial llega al 16-67%50,52,53 y la supervivencia mejora entre un 20-60% a 2 años47; lo que nos permite utilizarla como procedimiento temporal de control de la neoplasia51, hecho confirmado por Llovet et al54 en un estudio controlado y aleatorizado. Se ha visto que el empleo de la QET en pacientes con bajo estadio tumoral (criterios de Milán) produce mejor respuesta que en aquellos con criterios ampliados, o aquellos con estadio tumoral más avanzado, que aunque respondan a la QET no tienen mejor supervivencia51.
Recientemente se ha utilizado la QET para predecir el comportamiento biológico del tumor, y se ha observado que los resultados del TH son mejores si ha habido respuesta a la QET antes de la intervención y si ésta permanece estable, independientemente de si la neoplasia se define por los criterios de Milán o los ampliados. Eso sí, aconsejan repeticiones cada 6 semanas de la QET hasta que se llega al TH55.
Técnicas ablativas percutáneas.Están indicadas cuando la previsión del TH sea mayor de 6 meses, a pesar del riesgo de diseminación tumoral en el trayecto de punción (0,6%)56, y se obtienen unos índices del 10% de dropout a los 12 meses. Recordemos que éstas se realizan con control ecográfico. Hay varios tipos, pero las más utilizadas son la alcoholización y la radiofrecuencia, la primera consiste en la infusión dentro del tumor por vía percutánea de alcohol absoluto; se precisan varias sesiones para obtener unos grados de necrosis del 90-100% en lesiones pequeñas (menor de 2 cm), y del 50% cuando las lesiones están entre 2 y 3 cm. Los CHC más grandes tienen escasa respuesta. La recidiva es la norma, aunque se han obtenido supervivencias del 50% a 5 años32.La radiofrecuencia consiste en la aplicación, también por vía percutánea, de ondas de radiofrecuencia a través de una sonda, lineal o en anzuelo, y se obtiene una necrosis de la zona tratada por calor generado por fricción iónica; esta técnica ocasiona mejores resultados que la alcoholización, sobre todo en lesiones de 2-5 cm, ya que produce mayores control local y supervivencia a largo plazo (nivel de evidencia I)33 e incluso índices muy bajos de recidiva34. Está contraindicada en casos de tumores subcapsulares (riesgo de diseminación) y cuando están adyacentes a la vesícula, el estómago, el intestino y grandes vasos o conductos biliares principales, así como cuando hay problemas médicos asociados, como función hepática muy deteriorada (Child-Pugh), arritmias cardíacas, ascitis intensa y graves problemas de coagulación. El índice de complicaciones mayores (hemorragia, perforaciones, descompensación hepática, etc.) es bajo (4%). La necrosis total puede ocurrir en el 70% de los sujetos. La supervivencia a 3 años tras el TH puede alcanzar el 76%, similar a la obtenida con enfermedad benigna34.
Resección antes del trasplante hepático. Actualmente existe la idea de que la RH y el TH puedan ser técnicas complementarias, por ese motivo ha surgido el concepto de la RH como puente al TH, o sea que se utiliza el TH como cirugía de rescate tras la RH en pacientes con CHC57. En un estudio preliminar se observó que para sujetos concretos las expectativas de vida eran similares con la política de rescate que indicando el TH primariamente58. Concepto no corroborado únicamente por el grupo del hospital Paul Brousse59, cuyos resultados no fueron buenos, con un índice de trasplantabilidad del 25%, pero con bajo índice de salvamento. Sin embargo, Belghiti et al60 aportaron muy buenos resultados e introdujeron el concepto del uso de la anatomía patológica para valorar el riesgo de recurrencia, indicando el TH a los pacientes con factores de mal pronóstico (invasión vascular microscópica y satelitismo).
El grupo del Hospital Clínic de Barcelona comparó a dos grupos de pacientes: aquellos con resección hepática y signos de mal pronóstico histológico (invasión vascular o multicéntrica) a quienes se trasplanta inmediatamente y sujetos con recidiva hepática tras la RH y que luego recibieron trasplante. En ambos grupos se obtuvieron índices de sobrevida similares (82%), con una media de seguimiento de 55 meses. La recidiva fue mayor en el grupo de mal pronóstico, 7/8 (87,5%) pacientes, mientras que en el grupo de buen pronóstico sólo 2/9 (22,2%) sujetos tuvieron recurrencias61.
Margarit et al62 confirman los buenos resultados de la RH como puente para el TH, al hacer más eficiente la utilización de los injertos, ya que afirman que, aproximadamente, un 15% de los sujetos que se someten a RH presentan recurrencia extrahepática (probablemente por tener extensión de la enfermedad tumoral antes de la cirugía) y, por tanto, estos pacientes no recibirán TH, lo que permite ahorrar ese porcentaje de injertos; eso sí, según los buenos resultados quirúrgicos de la RH, el diagnóstico temprano de la recidiva y la propuesta de salvamento con el TH, que sólo se puede ofrecer a un tercio de los sujetos, pero en éstos los resultados son similares a un trasplante de inicio.
La linfadenectomía no es una opción utilizada sistemáticamente por todos los grupos de TH. Los resultados obtenidos en grupos que no la realizan sistemáticamente, como en nuestra experiencia, confirman que no es una opción determinante. Pero una publicación reciente destaca la necesidad de realizar siempre linfadenectomias, sobre todo en los casos que se observen ganglios aumentados de tamaño en los estudios antes del TH (hecho frecuente en los sujetos portadores de una cirrosis biliar primaria y por VHC), ya que la posibilidad de invasión tumoral eleva la posibilidad de recidiva precoz, que aumenta más de 10 veces con relación a pacientes sin adenopatias tumorales, así como que se reduce la supervivencia a corto plazo por la posibilidad de recurrencia63.
ResultadosLa mortalidad operatoria se sitúa alrededor del 11%; la sepsis y las disfunciones primarias graves del injerto, que conllevan fallos multiorgánicos, son las causas fundamentales. La mortalidad tardía se relaciona con recidiva de la enfermedad tumoral o con insuficiencia hepática tras una recurrencia de la enfermedad de base, fundamentalmente las infecciones virales.
La recurrencia del CHC está entre el 6,4 y el 16%, con una mediana de tiempo de 9 meses64,65.
La supervivencia de los pacientes trasplantados por CHC es similar a la obtenida tras el TH por enfermedades no tumorales64. En el Registro Español de Trasplante Hepático (RETH), sobre una base de datos de 1.500 TH, la supervivencia a 1, 3 y 5 años es del 82, el 70 y el 60%, respectivamente; de igual manera, el Registro Europeo de Trasplante Hepático (ELTR), en 6.000 TH, presenta unas tasas del 82, el 70 y el 60%, y por último, el registro de la UNOS señala cifras del 86, el 70 y el 57%.
La cirrosis por el virus de la hepatitis C es la asociación más frecuente en nuestro medio e incide de manera muy importante en los resultados del TH66. En estos sujetos, con CHC sobre hepatitis C, la supervivencia a 1, 3 y 5 años es del 75, el 71 y el 55%, respectivamente65.
Factores pronósticos de recidiva y supervivenciaEl TNM de la UICC ha sido considerado un valor pronóstico, aunque tiene inconvenientes con relación al tamaño del tumor, el número de nódulos, la invasión vascular y la situación67. Considerando los criterios de Milán, la UNOS ha modificado el TNM y se ha visto que los pTNM estadio I tienen un buen pronóstico en relación con la supervivencia65. De igual forma, la QET neoadyuvante también ayuda en este sentido; se considera que una respuesta favorable puede ser discriminativa, independientemente del estadio tumoral55. Por el contrario un pTNM avanzado, la indicación del TH por un CHC conocido y la invasión vascular son factores de mal pronóstico para recidiva65.
Para muchos autores destaca la invasión microvascular o macrovascular como la variable de más alto riesgo para la supervivencia y la recurrencia41,61,67 y ésta se correlaciona con la diferenciación celular y el tamaño tumoral41,64, el cual también se correlaciona con la multifocalidad, por lo que el tamaño puede ser considerado un marcador biológico de recurrencia tumoral19,55.
Finalmente, también se ha comunicado que una AFP mayor que 300 ng/ml tiene valor predictivo para mayor mortalidad y mayor recurrencia19.
Correspondencia: Dr. A. Moya Herráiz. Unidad de Cirugía y Trasplante Hepático. Hospital Universitario La Fe. Avda. de Campanar, 21. 46009 Valencia. España. Correo electrónico: moya_ang@gva.es
Manuscrito recibido el 15-10-2007 y aceptado el 8-2-2008.