Introducción
El 50% de las mujeres con cáncer de mama metastásico presentan metástasis hepáticas (MH). Estas pacientes habitualmente presentan, además, depósitos tumorales en otras localizaciones, lo que supone una enfermedad en un estadio muy avanzado e implica una supervivencia muy corta1-4. Sin embargo, en un número reducido de pacientes (1 a 5%), las MH son el único lugar de diseminación regional2-4. Clásicamente las enfermas con cáncer de mama y MH han sido tratadas con medidas paliativas (hormono y quimioterapia).
La resección hepática ofrece la única posibilidad de curación en pacientes con MH de origen colorrectal (CCR) con una supervivencia cercana al 40% a los 5 años2,3,5. Cuando las MH son causadas por otras neoplasias, la resección obtiene supervivencias inferiores comparadas con las CCR, pero superiores a cualquier otro tratamiento, aunque siempre requiere una estricta selección de dichos pacientes4-6. Se han publicado un reducido número de series donde se ha realizado un tratamiento agresivo (resección hepática) de las MH de cáncer de mama1-5,7-14. En estas publicaciones se describe a unas 250 pacientes intervenidas en escasos centros especializados en cirugía hepática.
Actualmente los criterios de resección de MH por cáncer de mama aún no están claramente definidos y existe una serie de preguntas por responder: ¿debe hacerse la hepatectomía en enfermas con enfermedad extrahepática?, ¿qué régimen de quimioterapia pre y posresección hay que utilizar? y ¿cuál es el momento de indicar la resección hepática?1-4,7-14. Presentamos nuestra experiencia en la resección de MH en enfermas con cáncer de mama. Debatimos las indicaciones, las limitaciones y los resultados obtenidos
Pacientes y metódos
En el período de julio 2003 a marzo 2005, hemos realizado 5 hepatectomías por metástasis hepáticas de cáncer de mama. Los datos de estas pacientes se recogieron de forma prospectiva en una base de datos específica. Las premisas básicas para proponer la hepatectomía fueron: ausencia de enfermedad extrahepática en las pruebas diagnósticas preoperatorias, situación médica que permita realizar la hepatectomía y la posibilidad técnica de conseguir una resección R0. El intervalo libre de enfermedad, el TNM o los receptores hormonales no eran criterios para excluir a estas pacientes. A todas las pacientes se les practicó ecografía abdominal, tomografía computarizada (TC) toracoabdominal y tomografía por emisión de positrones (PET). En 2 casos se realizó también resonancia magnética (RM).
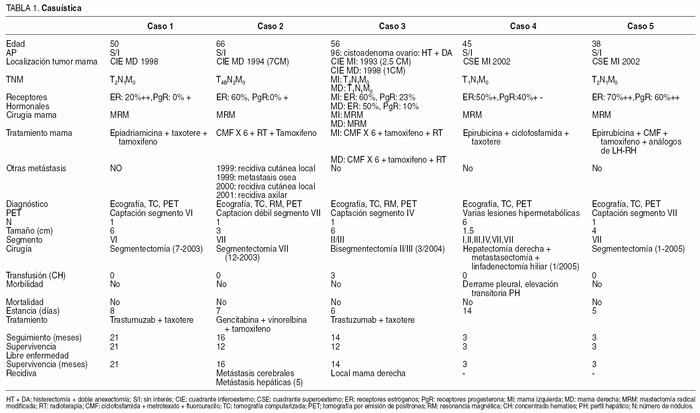
La edad media de las pacientes fue de 51 años (rango, 38-66). La localización del tumor en la mama fue: 3 en el cuadrante inferoexterno (CIE) de la mama izquierda y 2 en el cuadrante superoexterno (CSE) de la mama derecha. Una paciente presentó una segunda neoplasia en el CIE de la mama derecha a los 5 años de la primera mastectomía. La cirugía de mama practicada en todas las enfermas fue una mastectomía radical modificada. Todas las pacientes presentaron afectación ganglionar axilar. La distribución por TNM de los 6 neoplasias mamarias fue T4bN2M0 (1 caso), T2N1M0 (3 casos), T1N1M0 (2 casos). Los receptores hormonales presentaban amplia variabilidad (tabla 1). Cinco de las 6 neoplasias fueron tumores de pequeño tamaño (T1-2). Las pacientes recibieron diversas combinaciones terapéuticas de quimioterapia, hormonoterapia y radioterapia (tabla 1). Una de las pacientes presentó recidiva local, axilar y ósea en el seguimiento previamente a la aparición de la MH, pero el tratamiento adyuvante consiguió el control de la enfermedad metastásica y un período libre de enfermedad superior al año y la PET excluyó enfermedad extrahepática en el momento del diagnóstico de la MH, por lo que se aceptó para resección hepática.
El período libre de enfermedad entre la mastectomía y el diagnóstico de la MH fue de 61 meses (rango, 36-80). El número de MH fue de 1,83 (rango, 1-6) con una mediana de 1 MH. El tamaño medio fue de 4,1 cm (rango, 1,5-6). La PET descartó enfermedad extrahepática correctamente en 4 pacientes, pero no detectó unas adenopatías hiliares metastásicas.
En la cirugía de la MH, se realizó una exploración completa de la cavidad abdominal para excluir carcinomatosis o adenopatías locorregionales. Se realizó ecografía intraoperatoria en todos los casos. La resección se llevó a cabo con bisturí ultrasónico sin pinzamiento hiliar y coagulación bipolar.
El tratamiento de quimioterapia posthepatectomía fue administrado a todas las pacientes con distintos regímenes (tabla 1). El seguimiento se efectuó cada 3 meses en consultas externas.
Resultados
La cirugía practicada fue: segmentectomía (3 casos), bisegmentectomía (1 caso), hepatectomía derecha asociada a metasectomías aisladas del lóbulo izquierdo y linfadenectomía hiliar, ya que se observaron adenopatías hiliares en el momento de la laparotomía que fueron positivas en el estudio histológico (1 caso). La mortalidad operatoria fue del 0%. La morbilidad fue del 20% (1 caso) y consistió en derrame pleural y elevación transitoria de la aspartato aminotransferasa (AST) y la alanina aminotransferasa (ALT), acompañada de encefalopatía leve. La estancia media fue de 8 días (rango, 5-14).
Las 5 pacientes están vivas, con un seguimiento medio fue de 11,4 meses (rango, 3-21). La supervivencia media fue también de 11,4 meses (rango, 3-21). El período libre de enfermedad fue de 10,2 meses (rango, 3-21). Dos pacientes han presentado recidiva de la enfermedad, una a escala local (cicatriz de la mastectomía) que ha podido ser extirpada quirúrgicamente, y en otra a escala regional, con recidiva hepática y cerebral, y que declinó recibir tratamiento adyuvante. No se pudo realizar un estudio de los factores pronósticos ni de la supervivencia actuarial con el número de casos estudiados.
Discusión
El cáncer de mama con metástasis viscerales se considera una enfermedad diseminada con un pronóstico infausto2,3. Es infrecuente que se presenten MH de cáncer de mama como manifestación exclusiva de enfermedad regional, y más infrecuente aún que éstas sean únicas2. Clásicamente el tratamiento de estas enfermas era exclusivamente paliativo, pero los excelentes resultados obtenidos con la resección de MH de CCR han ampliado las indicaciones de hepatectomía para MH de otro origen5,6, como las MH de cáncer de mama2,5. Sin embargo, aún no existe consenso sobre la idoneidad de esta actitud terapéutica1, y el reducido número de publicaciones existentes en la actualidad presenta una gran hetereogeneidad que impide extraer conclusiones definitivas1-5,7-14.
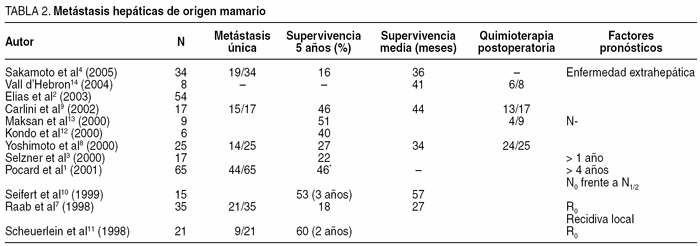
Si estudiamos las series publicadas (tabla 2) podemos comentar una serie de datos. La edad media de las pacientes intervenidas es aproximadamente de 50 años (rango, 47-57)1-4,12. Un 80% de estas MH son producidas por tumores pequeños (T1-2)1,4. La afectación ganglionar axilar varía entre el 55 y el 70%1,2. El porcentaje de pacientes con MH única es muy variable y oscila entre el 41 y el 79%1,4,8,9,11. La mediana de aparición de la MH varía de los 21 a los 60 meses posmastectomía1,2,4. Una tasa muy alta de mujeres (75-90%) ha recibido combinaciones de quimio y hormonoterapia antes de la aparición de la MH1,2. La tasa de operabilidad es variable (51-94,2%). La carcinomatosis peritoneal o la existencia de adenopatías hiliares fueron las causas más frecuentes de abstención terapéutica ya en la laparotomía1-3. La tasa de enfermedad extrahepática conocida en el momento de la hepatectomía oscila entre el 8 y el 32%, habitualmente metástasis óseas1,4,8,14. En la única serie con linfadenectomía hiliar sistemática existe un 33% de ganglios positivos2. Nuestra corta serie muestra datos similares a los citados.
La morbilidad descrita en la resección hepática por MH de cáncer de mama oscila entre el 0 y el 20%1,2,4,8-10,12. A la habitual de cualquier hepatectomía, se añade una específica provocada por la poliquimioterapia recibida que altera el parénquima hepático y dificulta técnicamente la hepatectomía. Además, la tasa de hepatectomías mayores de las series ha aumentado y oscila entre el 47,7 y el 66%1,2,8,12 debido a que con más frecuencia se acepta a pacientes con múltiples MH. En nuestra serie sólo a 1 paciente se le efectuó una hepatectomía mayor y presentó insuficiencia hepática postoperatoria leve. La insuficiencia hepática posresección ocurre en un 15% de estas pacientes8,12. A la morbilidad quirúrgica debemos añadir la producida por los tratamientos de quimioterapia (neumonitis intersticial fulminante)3. La mortalidad descrita oscila entre el 0 y el 7%1-4,8,9,12,13.
La supervivencia de las pacientes con MH sintomáticas de cáncer de mama tratadas exclusivamente con hormono y quimioterapia oscilaba, en la década de los ochenta, entre los 3 y los 6 meses4. Actualmente los taxoles y otros nuevos agentes quimioterápicos han mejorado levemente estos datos1-3. La resección hepática de las MH de cáncer de mama ha demostrado su eficacia en las series ya citadas1-4,7-14, ya que la supervivencia a los 5 años oscila entre el 22 y el 46%, con una mediana de 24 a 57 meses1-4,7-14. La disparidad en los resultados se justifica por los diferentes criterios de inclusión mantenidos en los diversos grupos.
Sin embargo, pese a la mejora en la supervivencia, el tiempo libre de enfermedad es bajo y el 75-80% de las pacientes presenta una recidiva hepática posthepatectomía (mediana, de 8 a 26 meses)1,3,8,14. Probablemente, más que nuevas metástasis, estas recidivas tempranas son causadas por micrometástasis y células neoplásicas presentes en el torrente sanguíneo, no detectadas en el momento de la hepatectomía1,3. Esta recidiva tan temprana nos obliga a intentar identificar qué factores se relacionan con la reaparición de la enfermedad metastásica, y así poder seleccionar a las pacientes que no se benefician de la hepatectomía, y también qué protocolo de adyuvancia postoperatoria puede ser el más adecuado, ya que si bien prácticamente el 100% de las enfermas recibe quimioterapia tras la hepatectomía, los esquemas empleados son muy variados1-3,8,14. Es de destacar que en la serie de Elias et al2, la utilización de quimioterapia intraarterial disminuye del 60 al 30% la tasa de recidiva hepática. La realización de una PET preoperatoria puede ayudar a descartar otros focos tumorales no detectados por los métodos tradicionales de imagen2,3, aunque en nuestra serie no identificó la afección ganglionar hiliar que presentaba una paciente. Con esta tasa de recidiva ya citada, la idea propugnada por Elias et al2 es que la resección hepática se debe entender como una cirugía de citorreducción incluida en un proceso terapéutico más amplio (quimioterapia, hormonoterapia...).
Entre los factores pronósticos existe una gran disparidad de resultados probablemente por el escaso número de pacientes de las series. Parecen importantes la presencia de enfermedad extrahepática si excluimos las metástasis óseas4, y el tiempo transcurrido entre la mastectomía y la aparición de la MH3,8,13, aunque no hay consenso sobre cuál es el punto de inflexión donde se produce la diferencia pronóstica (más o menos de 1 año, o de 4)3,8 y en otra serie carece de importancia pronóstica2. Hay discrepancias sobre si la afección ganglionar axilar3,13, la resección R02,11, la afección ganglionar del hilio hepático1,2,4 y los receptores hormonales1,2,4 son o no factores pronósticos. No parece influir en la supervivencia la edad2, la T del cáncer de mama2, el número y tamaño de las MH1,2,8, el tipo de resección efectuada (hepatectomía mayor frente a menor)1-3, el tratamiento posresección con trasplante de médula ósea, las altas dosis de quimioterapia3 y la enfermedad extrahepática ósea sincrónica1,8.
En conclusión, creemos que las MH de cáncer de mama pueden ser resecadas cuando técnicamente sea factible, se vaya a obtener una resección R0 y con un riesgo operatorio bajo. En los casos sincrónicos, es aconsejable una estabilización de la enfermedad con quimioterapia. Estas pacientes no deben tener otros focos de enfermedad metastásica extrahepática, aunque algunos autores piensen que la presencia de enfermedad extrahepática ósea única no contraindica de forma absoluta la realización de la hepatectomía. Técnicamente puede tratarse de hepatectomías complejas por el estado del parénquima hepático tras la quimioterapia recibida. La linfadenectomía hiliar sistemática puede ser interesante, ya que la tasa de ganglios positivos es alta, dato que tampoco excluye la resección. La recidiva hepática poscirugía es muy elevada y aún no se ha definido el régimen de quimioterapia recomendable. La supervivencia obtenida con la resección es mejor que con cualquier otra modalidad terapéutica, aunque el período libre de enfermedad es bajo.