Introducción
La peritonitis esclerosante encapsulante (PES) o cocoon abdominal es una rara enfermedad que se caracteriza por la formación de una membrana fibrocolagenosa que envuelve las asas de intestino delgado y llega a producir cuadros de obstrucción intestinal. Su etiología no está del todo clara. Se ha descrito su relación con la administración de bloqueadores beta, la sarcoidosis, la tuberculosis, los antecedentes de cirugía abdominal y el tratamiento prolongado con diálisis peritoneal (DP) en pacientes con insuficiencia renal crónica (IRC).
La PES, como afección secundaria a IRC en pacientes en DP y el papel de la cirugía en su tratamiento son poco conocidos en nuestro medio. Estudios japoneses describen incidencias de PES en DP del 0,7-7,5%. En nuestro centro hemos tenido 7 casos de sospecha clínica de PES de un total de 150 pacientes tratados con DP en los 14 años que lleva funcionando esta unidad.
Aunque el diagnóstico de certeza sólo puede realizarse con laparoscopia y/o laparotomía exploradora, existe una combinación de datos clínicos y radiológicos que puede ofrecer un diagnóstico de sospecha acertado.
La historia natural de la PES evoluciona hacia un cuadro oclusivo que puede derivar en perforación intestinal. Éste era el momento reservado clásicamente para el tratamiento quirúrgico de la enfermedad. En el seno de una complicación de esta gravedad, la realización de resección intestinal y anastomosis parecía una opción válida para resolver el cuadro obstructivo.
Publicaciones recientes en Japón1 comunican una morbimortalidad del 4% con un tratamiento quirúrgico precoz en el que únicamente se lleva a cabo la liberación de adherencias y la extirpación de la cápsula si es posible. Series anteriores describen mortalidades de hasta el 69% cuando se requieren resecciones y suturas intestinales2.
El objetivo de este artículo es describir los 3 casos que fueron subsidiarios de intervención quirúrgica en nuestro hospital y revisar la literatura con el fin de aclarar el papel actual de la cirugía en esta rara enfermedad.
Casos clínicos
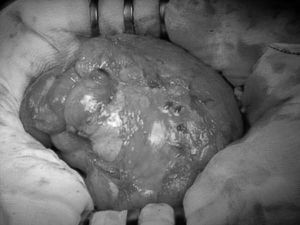
La paciente 1 es una mujer con IRC secundaria a glomerulonefritis a la que se realizaron 2 trasplantes renales sin éxito. A los 27 años fue incluida en un programa de DP y, tras un periodo de tratamiento de 147 meses, desarrolló de forma tardía 2 episodios de peritonitis bacteriana severa. En el curso de su enfermedad empezó con un cuadro caracterizado por persistencia de vómitos junto con dolor abdominal y fiebre de 38 °C, que se diagnosticó de obstrucción intestinal. A la exploración se apreciaba un abdomen distendido, doloroso de manera generalizada, con sensación de masa abdominal y disminución de ruidos intestinales. La tomografía computarizada (TC) abdominal mostró los hallazgos radiológicos descritos en la literatura como compatible con PES, y comunes también con los observados en los otros 2 casos que presentamos a continuación: dilatación de asas de intestino delgado, engrosamiento peritoneal, ascitis, agrupación central de asas y calcificaciones peritoneales. Se inició tratamiento conservador, con reposo intestinal y corticoterapia; el cuadro oclusivo remitió de manera paulatina, aunque sin llegar a solucionarse completamente. Se realizó laparotomía exploradora que puso de manifiesto la cápsula abdominal (fig. 1). Se realizó liberación de asas y extirpación de la cápsula. El estudio histopatológico de la cápsula peritoneal reveló tejido peritoneal con fibrosis y signos de hemorragia antigua y reciente. El curso postoperatorio transcurrió sin incidencias y con resolución del cuadro obstructivo. En el momento actual, después de 2 años de seguimiento, hemos encontrado una recidiva, con buena respuesta al tratamiento conservador con corticoterapia y reposo intestinal.
Fig. 1. Imagen macroscópica del encapsulamiento de las asas intestinales.
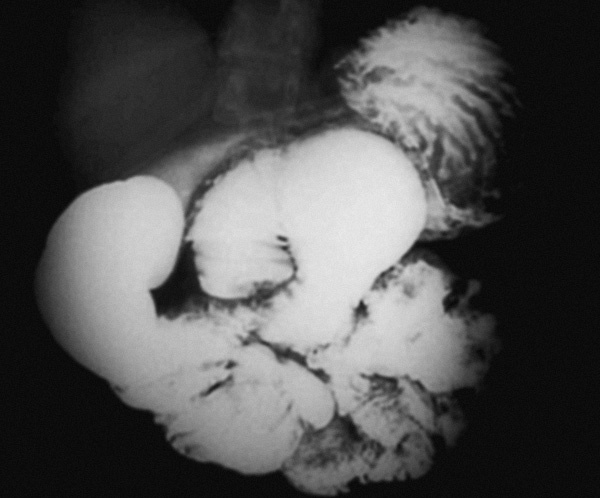
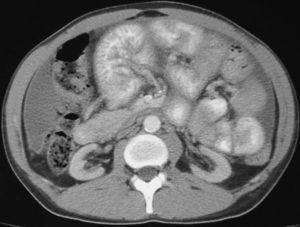
El paciente 2 es un varón de 41 años con IRC secundaria a nefropatía diabética. Se realizó un trasplante de páncreas y riñón, con rechazo posterior. En el periodo postimplante precisó de una segunda intervención quirúrgica por absceso en Douglas. El paciente recibió DP durante 24 meses, comenzando a la edad de 31 años. Durante ese tiempo tuvo 2 peritonitis bacterianas que obligaron al paso de diálisis peritoneal a hemodiálisis. Presentó 2 episodios de obstrucción intestinal que tuvieron buena respuesta al tratamiento conservador con reposo intestinal, corticoterapia y tamoxifeno. En la TC abdominal (fig. 2) se apreciaron hallazgos parecidos a los del caso anterior, excepto las calcificaciones, y el transito intestinal mostró el "signo de la coliflor" (fig. 3) debido a la centralización de las asas intestinales. En el curso de un tercer episodio se decidió practicar laparotomía exploradora, que evidenció de nuevo la cápsula abdominal, por lo que se realizó la misma técnica quirúrgica que en el caso anterior. El cuadro obstructivo se resolvió y en 3 años de seguimiento no ha presentado recidiva alguna.
Fig. 2. Agrupación central de las asas intestinales recubiertas de peritoneo engrosado.
Fig. 3. Centralización de asas en estudio radiológico con contraste.
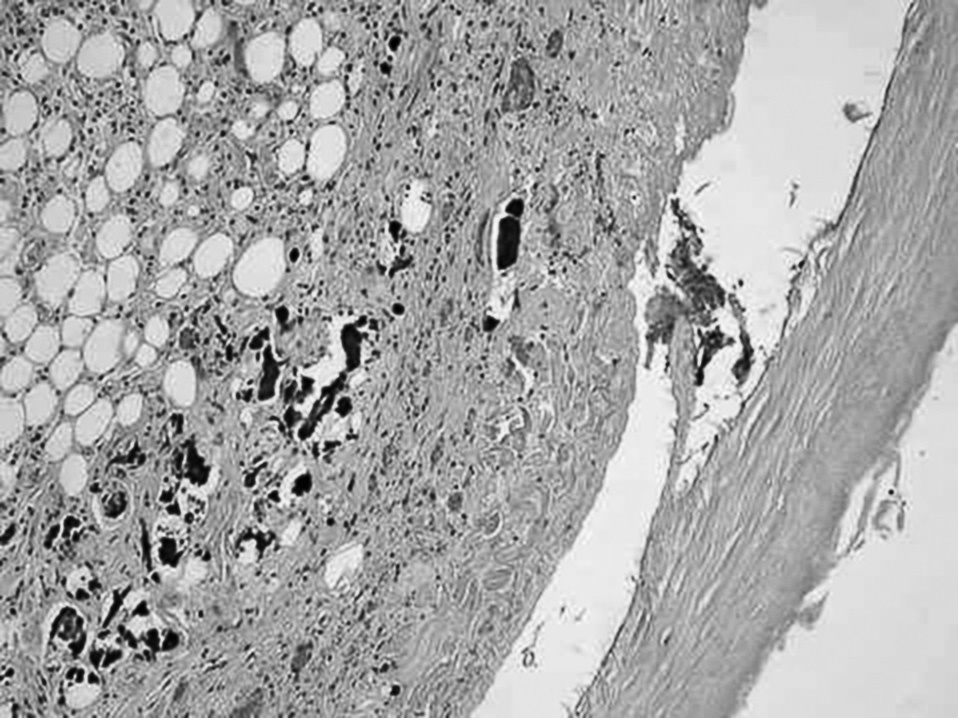
La paciente 3 es una mujer de 34 años con IRC secundaria a nefropatía lúpica. Al igual que los casos anteriores, tenía una historia de rechazo de 2 trasplantes renales. Recibió tratamiento sustitutivo durante un total de 78 meses, que se inició a la edad de 25 años. Durante ese tiempo presentó 2 episodios de peritonitis bacteriana. Tuvo un primer episodio oclusivo en el que se realizó una TC abdominal, con hallazgos similares a los de los casos precedentes. Se inició tratamiento conservador con corticoterapia, que resolvió el cuadro. Posteriormente presentó 2 nuevos episodios, que se resolvieron con tratamiento conservador al que se asociaron inmunosupresores (tamoxifeno) como en el caso 2. Ingresó una cuarta vez con un cuadro oclusivo acompañado de dolor abdominal, fiebre e importante alteración analítica. Se realizó una nueva TC abdominal, que mostró un absceso en mesogastrio-pelvis de 9 cm. Se realizó laparotomía exploradora, que encontró, además de la cápsula abdominal, una perforación intestinal en íleon con un absceso por obstrucción en asa cerrada. Se realizó liberación de las asas con drenaje del absceso y se practicó también resección ileal y anastomosis ileocecal. El estudio histopatológico mostró fibrosis en la serosa peritoneal con peritonitis plástica adherencial (fig. 4). La paciente sufrió al décimo día de la intervención evisceración contenida, y en la reintervención se halló hematoma intraabdominal y absceso en Douglas, que se drenó. Al tercer día tras la reintervención, apareció un cuadro de dolor brusco, fiebre y salida de contenido fecaloideo por la herida quirúrgica. Se indicó nueva intervención, en la que, tras confirmar dehiscencia de la anastomosis ileocecal, se practicó una ileostomía en fosa ilíaca derecha, cierre de polo cecal y laparostoma. El curso postoperatorio transcurrió de forma desfavorable, y la paciente murió un mes después de la última intervención.
Fig. 4. En la serosa hay una gruesa banda de esclerosis hialina, con depósitos de calcio y neovascularización capilar.
Discusión
El primer caso de PES fue descrito por Foo et al3 en 1978. Desde entonces se han comunicado 50 casos, aproximadamente. En 1992 Yip et al4 describieron cuatro signos cardinales para la sospecha preoperatoria de la PES: mujer joven sin causa clara que justifique el cuadro de obstrucción intestinal, historia de episodios similares que se resuelven de manera espontánea, masa abdominal palpable y presentación clínica con dolor abdominal y vómitos sin tener una obstrucción completa.
La causa y la patogenia de la enfermedad no están claras. En su desarrollo podrían influir una historia de cirugías abdominales previas, la administración de bloqueadores beta, enfermedad sistémica con repercusión peritoneal (tuberculosis, sarcoidosis, granulomatosis) y el tratamiento prolongado en DP.
Los primeros casos secundarios a DP fueron descritos en 1980 por Gandhi et al5 y Denis et al6. Con el correr de los años la PES se ha convertido en una temible complicación de la DP, dado el aumento de su incidencia y su evolución.
Estudios japoneses describen incidencias de PES en DP del 0,7-7,5%7,8. Parece haber una relación entre el tiempo de permanencia en DP y el aumento progresivo de la incidencia de PES, y hay series con incidencias del 19,4% tras 8 años de tratamiento sustitutivo8.
La DP causaría alteraciones en el peritoneo que darían lugar a un aumento de la incidencia de PES en estos pacientes, dado que no es una enfermedad exclusiva de los enfermos en diálisis. Avances recientes en biología molecular muestran el papel muy importante de la fibrosis peritoneal en la fisiopatología de la PES. El estímulo de las células mesoteliales del peritoneo por la exposición a las soluciones utilizadas en la diálisis peritoneal induciría la expresión de varios factores de crecimiento y citocinas que pondrían en marcha la neoangiogénesis y la proliferación de fibroblastos. Toda esta secuencia aumentaría la formación de colágeno y podría explicar el aumento de incidencia de PES en pacientes en DP9.
Kawanishi et al1 describen dos pilares básicos para el desarrollo de PES. En primer lugar, el deterioro del peritoneo producido por su exposición continuada a las soluciones utilizadas en la DP. En segundo lugar, la inflamación sobre este peritoneo debilitado en forma de peritonitis agudas o crónicas. Están descritos casos de PES fulminante tras peritonitis bacteriana10.
Según esta teoría, la PES puede ser clasificada en tres fases que nos permitirían orientar el diagnóstico y el tratamiento en función de la capacidad de respuesta peritoneal a este agente lesivo continuo:
En una primera fase, el peritoneo sufre una reacción inflamatoria aguda marcada, con aumento de los reactantes de fase aguda. En ese momento el uso de la corticoterapia adquiere importancia. El tratamiento oral o intravenoso depende del grado de inflamación y minimiza las posibilidades de evolucionar a la siguiente fase. Sin embargo, si no se usa corticoterapia en la fase inflamatoria, no se puede evitar el paso a la segunda fase y el desarrollo del encapsulamiento intestinal.
En la segunda fase empieza el proceso de encapsulamiento, que se acompaña de una disminución en el componente inflamatorio y el comienzo de los síntomas obstructivos. El enfoque terapéutico en esta fase debe estar dirigido al reposo intestinal con nutrición parenteral total. Al ser una fase en que la inflamación no es tan importante, las dosis de corticoterapia deben reducirse. No obstante, en el seno de una obstrucción intestinal y en su momento inicial, puede encontrarse una respuesta positiva a la corticoterapia al disminuir el edema de la pared intestinal asociado.
La progresión de la enfermedad nos llevaría a una tercera fase. En ésta, la característica principal serían los episodios de obstrucción intestinal recurrentes en los que apenas tendríamos inflamación. Éste es el momento en el que tendría que plantearse el tratamiento quirúrgico para solucionar el proceso con la extirpación de la cápsula peritoneal y la liberación de las adherencias.
Hay que sospechar PES en todo paciente en DP que presente signos de obstrucción intestinal. El comienzo del cuadro puede cursar con náuseas, vómitos, dolor y distensión abdominal. En un estado avanzado pueden presentarse anorexia y pérdida de peso paulatina, que pueden acompañarse de disminución de los ruidos intestinales y masa abdominal o pelviana a la palpación.
Aunque el diagnóstico de certeza sólo se consigue mediante la biopsia peritoneal por laparotomía/laparoscopia exploradora, la combinación de la clínica con imágenes radiológicas características puede aportarnos un diagnóstico de sospecha acertado11.
La radiología nos aporta imágenes que en el contexto del paciente adquieren una relevancia que no tendrían en otros cuadros de obstrucción intestinal. Estas imágenes son: a) el "signo de la coliflor", que muestra el fenómeno de centralización de las asas intestinales en el tránsito, descrito por Sieck et al12; b) las imágenes ofrecidas por la TC, que tiene una sensibilidad del 73-95%, para la búsqueda de hallazgos compatibles con obstrucción intestinal de intestino delgado13, ascitis14, centralización de las asas intestinales15, engrosamiento del peritoneo visceral en intestino delgado, formando una cápsula14,15, calcificaciones y adenopatías reactivas.
Nuestros pacientes cumplieron con la mayoría de los hallazgos. La paciente 1 fue la única que presentó calcificaciones en la TC abdominal, lo que hace pensar en lo evolucionado del cuadro. Esto plantea una situación diferente en el tratamiento quirúrgico. Al encontrarse calcificaciones en la membrana, el riesgo de microperforación en la disección aumentaría, y hay que plantearse una liberación de adherencias y sólo extirpación de cápsula en las zonas que pueda realizarse con seguridad para disminuir el riesgo de complicaciones por perforación tanto intraoperatoria como en su evolución posterior.
El tratamiento de la PES debería iniciarse tan pronto se establezca el diagnóstico de PES. La base del tratamiento conservador consiste en el reposo intestinal con nutrición parenteral total. La literatura parece centrar el tratamiento farmacológico en la corticoterapia16. En este sentido hay estudios que avalan el uso de la prednisona y la metilprednisolona en estadios iniciales de PES, basándose en su efecto inmunosupresor. Están descritos el uso de inmunosupresores como azatioprina, ciclosporina y tamoxifeno17,18; este último tiene efectos positivos en el tratamiento. Sin embargo, faltan estudios que confirmen la utilidad de estos fármacos en el tratamiento1, lo que confirma que el manejo del tratamiento conservador en esta enfermedad sigue sin tener un protocolo de actuación claro.
El papel de la cirugía en esta enfermedad ha estado ligado clásicamente al uso de las técnicas quirúrgicas habituales en la obstrucción intestinal; sin embargo, hay que plantearse la indicación quirúrgica en el momento en que el tratamiento conservador no solucione el cuadro obstructivo. Hay publicaciones de series con mortalidades quirúrgicas del 45-69%19, en la mayoría de los casos asociadas a resección intestinal y anastomosis primaria2.
En el momento actual, el conocimiento de la patogenia de la enfermedad y los resultados de estudios recientes1,20,21 hacen pensar que el tratamiento quirúrgico tiene un papel muy importante en la resolución del cuadro. Los resultados desfavorables van ligados principalmente a la lesión intestinal durante el acto quirúrgico y el intento de reparación en un tiempo. El deterioro peritoneal que acompaña a estos pacientes nos obliga a buscar una solución quirúrgica que disminuya al mínimo el riesgo de perforación, y la técnica que ofrece estos resultados en la actualidad es la extirpación de la cápsula peritoneal y la liberación de adherencias antes de llegar a los estadios finales de la enfermedad, en los que suele haber calcificaciones de la membrana.
En conclusión, los casos clínicos que presentamos ofrecen el ejemplo de lo descrito anteriormente, tanto en las características clínicas y diagnósticas como en los resultados tras la cirugía. La liberación de las asas en la paciente 1 sirvió de solución para los episodios de obstrucción frecuentes. La recidiva que sufrió posiblemente esté relacionada con la presencia de calcificaciones y el estado avanzado de la enfermedad. En el paciente 2 se consiguió una solución por ahora definitiva. La experiencia con la paciente 3 apoya la alta morbilidad asociada a una anastomosis en esta enfermedad y el riesgo vital de una intervención quirúrgica en el contexto de una perforación en el cuadro oclusivo.
Correspondencia: Dr. F.M. Bujalance Cabrera.
Servivio de Cirugía general. Hospital Severo Ochoa.
Avda. María Moliner, 26, portal 3, 4.o A. 28919 Leganés. Madrid. España.
Correo electrónico: franbujalance@hotmail.com
Manuscrito recibido el 20-6-2006 y aceptado el 26-9-2006.