El objetivo del estudio fue evaluar el número de amputaciones evitables en pacientes con sarcomas y melanomas localmente avanzados de las extremidades mediante la perfusión aislada de la extremidad (PAE) con melfalán y tumor necrosis factor α (PAE-MT) en condiciones de hipertermia.
Material y métodosSe revisó a todos los pacientes con sarcoma y melanoma localmente avanzados de la extremidad que fueron tratados en nuestro centro con PAE-MT durante el periodo comprendido entre noviembre de 2001 y febrero de 2010. Se evaluó el porcentaje de respuestas, las amputaciones evitadas, la toxicidad del tratamiento, las complicaciones, el intervalo libre de enfermedad y la supervivencia global.
ResultadosTreinta pacientes (19 mujeres y 11 varones), con una mediana de edad de 60 años (14–82), fueron tratados con esta técnica. Tras un seguimiento medio de 23 meses, el porcentaje de respuestas globales fue del 93,4% (completas, 46,7%; parciales 46,7%). La mediana de duración de la respuesta fue de 5 meses (0–62) y la mediana de supervivencia global de 13,5 meses (rango 1–62). Se evitó la amputación en el 86,7% de los casos. En la actualidad, once pacientes (5 sin enfermedad, 2 con enfermedad residual en tratamiento, 2 con progresión local y 2 con progresión sistémica) están vivos.
ConclusiónMediante la PAE hemos logrado evitar la amputación de 26 miembros afectos de melanoma y sarcoma localmente avanzados. La PAE es factible y segura en un entorno multidisciplinar.
The aim of the study is to evaluate the limb salvage rate achieved by treating locally advanced extremity sarcoma and melanoma by hyperthermic isolated limb perfusion with melphalan and TNF-α (ILP-MT).
Material and methodsA retrospective study was conducted on patients suffering from locally advanced soft tissue sarcoma and melanoma of the limb and treated by means of ILP-MT between November 2001 and February 2010. The response rate, toxicity, complications, disease free intervals, overall survival and limb salvage rate were evaluated.
ResultsA total of 30 patients (19 females and 11 males) with a median age of 60 years (14–82) were treated by this technique. The overall response rate was 93.4% (complete, 46.7%; partial 46.7%); the mean follow-up was 23 months. The median duration of response was 5 months (0–62), The median overall survival was 13.5 months (range 1 - 62). Limb salvage rate was 86.7%. Eleven patients are currently alive (5 without disease, 2 with residual disease on treatment, 2 with local progression and 2 with systemic progression).
ConclusionWith the use of ILP-MT we have avoided the amputation of 26 limbs affected by locally advanced sarcoma or melanoma. ILP-MT is feasible and safe in a multidisciplinary environment.
La perfusión aislada de la extremidad (PAE) es un procedimiento descrito originalmente por Creech et al.1 en 1958 que permite administrar de forma selectiva en una extremidad concentraciones de quimioterapia y agentes biológicos de 15 a 25 veces mayores de las que se podrían utilizar por vía sistémica2,3; de esta forma se evita la aparición de efectos sistémicos indeseables.
La PAE se realiza en condiciones de hipertermia que por sí misma es tóxica para las células tumorales3,4 y causa estasis y disminución del flujo en los vasos neoformados; todo ello induce daños intrínsecos en los tejidos tumorales2,4, aumenta la eficacia de los agentes antitumorales y, en consecuencia, incrementa la tasa de respuestas del tumor.
La PAE se puede utilizar en el melanoma y en los sarcomas de partes blandas localmente avanzados que se localizan en las extremidades —tumores voluminosos, irresecables, estadios IIIA-IIIC de melanoma según la clasificación del American Joint Committee on Cancer (AJCC)5— como tratamiento único o asociado a otras modalidades5–8 con el objetivo de salvar la extremidad y evitar su amputación. Es posible repetir la PAE, con una toxicidad aceptable, como opción para controlar la enfermedad locorregional.
La perfusión se puede utilizar también con pretensión paliativa para disminuir las complicaciones locales de la enfermedad no controlada (dolor, hemorragia, sobreinfección) y mejorar la calidad de vida de los pacientes con metástasis sistémicas.
Al tratarse de una terapia local no se observa un impacto sobre la supervivencia global del paciente, que depende fundamentalmente de los factores pronósticos de su enfermedad (grado tumoral, profundidad de infiltración de la lesión y tamaño, como los más relevantes). Los márgenes de resección positivos, la recurrencia local y la localización en miembros inferiores son también factores pronósticos desfavorables9–11.
El objetivo de este estudio es analizar la eficacia de la perfusión aislada de la extremidad en el control local de los sarcomas y melanomas localmente avanzados.
Material y métodosSe recogieron los datos clínicos de todos los pacientes tratados con perfusión aislada de la extremidad durante el periodo comprendido entre noviembre de 2001 y febrero de 2010 y que cumplían los siguientes criterios de inclusión: confirmación histopatológica de melanoma o sarcoma, ubicación en las extremidades, enfermedad localmente avanzada (tumores voluminosos, irresecables, estadios IIIA-IIIC de melanoma según la clasificación del AJCC5) y ausencia de metástasis sistémicas en aquellos casos en los que se planteó un tratamiento con intención curativa.
Se excluyeron del estudio retrospectivo aquellos pacientes con enfermedad cerebral no controlada (por la necesidad de anticoagulación), infiltración tumoral de los vasos principales de la extremidad que impedía su canulación, pacientes con alto riesgo quirúrgico y aquellos pacientes con una extremidad anulada funcionalmente por la afectación tumoral por lo que prefirieron su amputación.
Estudio de extensiónA todos los pacientes que fueron candidatos para esta técnica se les realizó una tomografía computarizada (TC) toraco-abdomino-pélvica para descartar metástasis sistémicas, angio-TAC de la extremidad afecta para confirmar la permeabilidad vascular y la extensión locorregional de la afectación ganglionar, resonancia magnética (RMN) cerebral para descartar metástasis a este nivel que contraindicase el procedimiento y PET-TC como estudio complementario de la extensión de la enfermedad.
Técnica de la perfusión aislada de la extremidadLa PAE se realiza en quirófano. La técnica se inicia con la disección de los vasos iliacos, femorales o poplíteos en el caso de que la lesión se localice en los miembros inferiores o con la disección de los vasos axilares cuando el tumor asienta en el miembro superior. Se realiza la ligadura de los vasos colaterales y se inserta una cánula dentro de la arteria (Bardic 16-18F) y otra en la vena (Portex 6-8mm). Ambas cánulas se conectan al circuito extracorpóreo con oxigenador (Performer; RAND). Se coloca un torniquete alrededor de la base de la extremidad para el completo aislamiento de la circulación sistémica8,12 y se inyecta 99Tc-albúmina micro-coloide (Vasculocis®)13 en el circuito de perfusión y en el sistema para monitorizar las posibles fugas.
Una vez comprobada la ausencia de fugas desde el circuito de la extremidad hacia la circulación sistémica mediante una sonda de detección gamma colocada en el precordio13 y conseguida la hipertermia moderada (38,5°C), controlada mediante los termómetros subcutáneos e intramuscular, se administran los fármacos. La dosis de TNF-α utilizada es de 3mg para la extremidad superior y 4mg para la extremidad inferior durante 30 minutos. Transcurridos los mismos se administra melfalán (13mg/L de volumen del miembro superior y 10mg/L de volumen del miembro inferior). Se mantiene la perfusión durante 60 minutos adicionales, salvo incidencias que obliguen a la interrupción del procedimiento.
La secuencia de administración potencia el efecto conjunto de ambos fármacos, aumentando la eficacia del melfalán por los cambios en la microcirculación de las lesiones tumorales inducidos por el TNF y la hipertermia4. Finalizada la perfusión, se infunde la extremidad con abundante suero fisiológico, se retiran el torniquete y las cánulas, se comprueba la hemostasia y se suturan los vasos sanguíneos.
Los pacientes permanecen en la Unidad de Cuidados Intensivos (UCI) durante las primeras 48 horas del periodo postoperatorio en donde se monitorizan las funciones vitales, el perímetro del miembro perfundido y la permeabilidad vascular mediante eco doppler y se realizan análisis seriados que incluyen la creatinfosfoquinasa14.
Evaluación de la toxicidadEl grado de toxicidad del miembro tratado se evaluó según la escala de toxicidad propuesta por Wieberdink15,16 (tabla 1) que va desde el grado 1 (sin efectos adversos) hasta el grado 5 (donde se evidencian alteraciones locales que requieren amputación).
Clasificación de toxicidad local según Wieberdink33
| 1. Sin efectos adversos |
| 2. Pequeño eritema o edema |
| 3. Considerable eritema o edema y aparición de ampollas. Pequeña alteración en la motilidad |
| 4. Epidermiolisis extensa o daño evidente de tejidos profundos que produce alteración funcional definitiva. Síndrome compartimental |
| 5. Alteraciones que requieren amputación |
La respuesta del tumor a los 3 meses se determinó siguiendo los criterios Response Evaluation Criteria in Solid Tumors (RECIST)17,18: respuesta completa: desaparición completa de la enfermedad; respuesta parcial: disminución al menos del 30% de la suma de los diámetros mayores; enfermedad estable: cuando no se puede hablar de respuesta pero tampoco cumple los criterios de progresión; progresión: aumento de al menos un 20% de la suma del diámetro mayor de la lesión medible más pequeña alcanzada en la respuesta o aparición de nuevas lesiones.
Se biopsiaron los lechos quirúrgicos de las lesiones dudosas.
SeguimientoEl seguimiento se realizó en consultas externas cada 3 meses con examen físico, analítico y TAC toraco-abdominal. Además de la respuesta, los parámetros utilizados para valorar la eficacia del tratamiento han sido la supervivencia e intervalo libre de enfermedad. Ambos se determinaron desde el día de la perfusión hasta el día de la defunción o progresión de la enfermedad respectivamente.
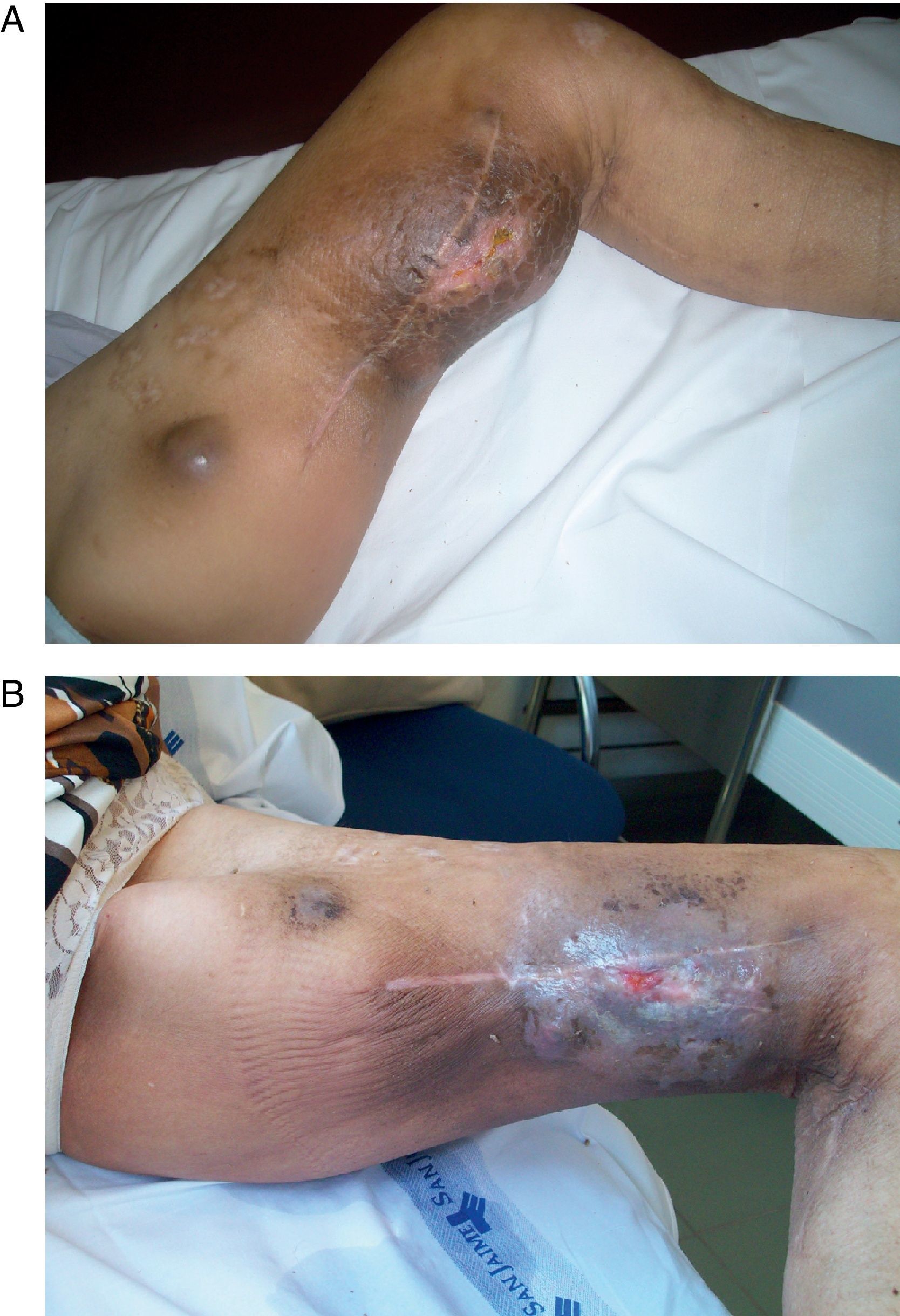
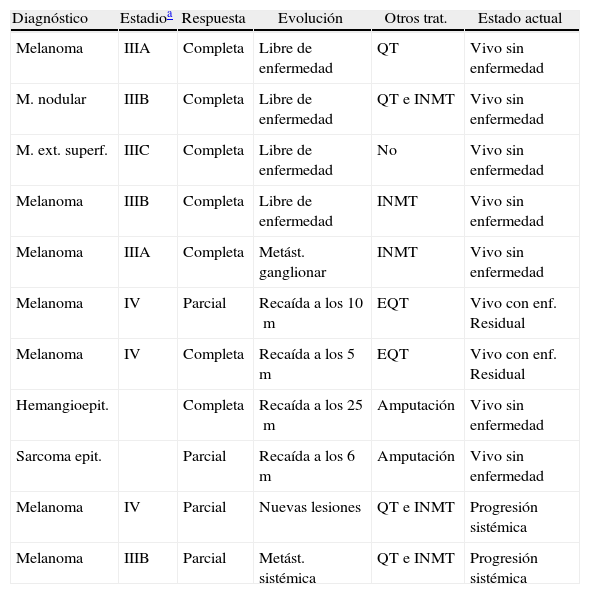
ResultadosTreinta pacientes (19 mujeres y 11 varones), con edades comprendidas entre 14 y 82 años (m=60), 25 de ellos con diagnóstico de melanoma (estadio IIIA=3, IIIB=4, IIIC= 11 y IV= 7 pacientes) y 5 con diagnóstico de sarcoma (Kaposi, hemangioendotelioma, osteosarcoma, neurofibrosarcoma y epiteloide) fueron tratados durante el periodo de estudio. En la mayoría de los casos la tumoración se localizaba en los miembros inferiores (9 en miembro inferior derecho y 18 en miembro inferior izquierdo) y en 3 casos el miembro afecto era el superior (2 miembro superior derecho y 1 miembro superior izquierdo) (figs. 1 y 2).
Paciente con melanoma de miembro inferior izquierdo. A) se observa la gran tumoración preoperatoria con una metástasis de menor tamaño en la parte superior. B) A los 3 meses de realizada la perfusión aislada de la extremidad con TNF, melfalán e hipertermia se aprecia la desaparición de las masas tumorales.
A la mayoría de los pacientes (87%) se les había realizado cirugía del tumor primario, el resto fueron diagnosticados mediante biopsias. Dieciséis pacientes (53%) fueron sometidos a una o varias intervenciones quirúrgicas de las recidivas previamente a la perfusión, incluyendo 2 extirpaciones de falange y a la mitad de ellos se les había realizado linfadenectomía.
Veintitrés pacientes (77%) habían recibido tratamiento con quimioterapia, radioterapia o inmunoterapia previa a la perfusión en su centro hospitalario de origen.
En total se realizaron 30 perfusiones, en 20 pacientes con intención curativa y en 10 con pretensión paliativa (7 melanomas y 3 sarcomas), por presencia de enfermedad diseminada.
Los procedimientos se completaron con éxito en 28 pacientes (93%). En dos casos (7%) se interrumpió la perfusión debido al alto porcentaje de fuga detectado. La mediana de fuga fue de 4%. En 14 pacientes (46,7%) la PAE se asoció a otro procedimiento (linfadenectomía, resección de masa tumoral, biopsias ganglionares).
En 27 pacientes (90%) se observó toxicidad grado II según la escala de Wieberdink (tabla 1). En los 3 restantes se observó grado III. Todas las toxicidades se resolvieron con medidas de soporte habitual.
Se aplicaron criterios clínicos para la evaluación de la respuesta y se biopsiaron los lechos quirúrgicos de las lesiones dudosas, según los criterios de respuesta RECIST. Se observaron respuestas en el 93,4% de los pacientes tratados: completas en 14 pacientes (46,7%); parciales en 14 (46,7%). No se observó respuesta en 2 pacientes (6,6%). La mediana de duración de la respuesta fue de 5 meses (0–62). Siete pacientes (23%) presentaron recidiva. A todos ellos se les pudo realizar exéresis de la misma. Se observó progresión local en 4 pacientes (13%), progresión sistémica en 7 (23%) y ambas en 1 (3,3%).
Durante el seguimiento se llevaron a cabo 4 amputaciones. En un primer caso por infección crónica provocada por el material de osteosíntesis colocado con anterioridad a la PAE, en un segundo caso por compromiso del paquete vásculo-nervioso de la extremidad por una masa tumoral de 20cm (pT0 tras la PAE); en un tercer caso por la aparición de una cuarta recidiva de un sarcoma epitelioide de la mano y, en un último caso, se realizó una desarticulación por recidiva en el glúteo.
A 3 pacientes se les asoció electroquimioterapia, en 2 casos por presentar lesiones fuera del área de perfusión y en otro caso por recidiva única inextirpable. Veintiún pacientes (70%) recibieron quimioterapia postoperatoria; en uno de ellos se asoció a radioterapia. Quince pacientes (50%) recibieron tratamiento de consolidación con linfocitos infiltrantes del tumor (células TIL).
En 9 años de seguimiento la mediana de duración de la respuesta es de 5 meses (0-62 meses) y la mediana de supervivencia es de 13,5 meses (1-62 meses). Se evitó la amputación en el 86,7% de los casos. Once pacientes están vivos (5 sin enfermedad, 2 con enfermedad residual proximal al área perfundida en tratamiento con electroquimioterapia, 2 con diagnósticos de hemangioendotelioma y sarcoma epiteliode presentaron progresión local y fueron amputados a los 25 y 6 meses postperfusión y 2 con progresión sistémica, actualmente en tratamiento con quimioterapia e inmunoterapia (tabla 2).
Pacientes vivos
| Diagnóstico | Estadioa | Respuesta | Evolución | Otros trat. | Estado actual |
| Melanoma | IIIA | Completa | Libre de enfermedad | QT | Vivo sin enfermedad |
| M. nodular | IIIB | Completa | Libre de enfermedad | QT e INMT | Vivo sin enfermedad |
| M. ext. superf. | IIIC | Completa | Libre de enfermedad | No | Vivo sin enfermedad |
| Melanoma | IIIB | Completa | Libre de enfermedad | INMT | Vivo sin enfermedad |
| Melanoma | IIIA | Completa | Metást. ganglionar | INMT | Vivo sin enfermedad |
| Melanoma | IV | Parcial | Recaída a los 10m | EQT | Vivo con enf. Residual |
| Melanoma | IV | Completa | Recaída a los 5m | EQT | Vivo con enf. Residual |
| Hemangioepit. | Completa | Recaída a los 25m | Amputación | Vivo sin enfermedad | |
| Sarcoma epit. | Parcial | Recaída a los 6m | Amputación | Vivo sin enfermedad | |
| Melanoma | IV | Parcial | Nuevas lesiones | QT e INMT | Progresión sistémica |
| Melanoma | IIIB | Parcial | Metást. sistémica | QT e INMT | Progresión sistémica |
EQT: electroquimioterapia; INMT: inmunoterapia; QT: quimioterapia
El tratamiento primario de los sarcomas de las extremidades (SE) es la escisión local amplia (margen de 2cm). El tipo de resección depende de la localización, el tamaño tumoral, de la profundidad de la invasión y de la afectación o no de las estructuras vecinas19.
El objetivo de la radioterapia en los SE es optimizar el control local. Se debe administrar como adyuvancia en los tumores de intermedio y alto grado independientemente del tamaño tumoral. La combinación de cirugía conservadora con radioterapia postoperatoria obtiene un alto porcentaje de control local19.
Los sarcomas incluyen subtipos histológicos con muy buena respuesta a la quimioterapia (rabdomiosarcoma, sarcoma de Ewing, osteosarcoma) y otros que son resistentes (leiomiosarcoma, liposarcoma, sarcoma sinovial) a los fármacos quimioterápicos actuales: doxorrubicina, dacarbazina e ifosfamida. Estos son responsables de una respuesta alrededor del 20-60%19,20.
Para el tratamiento de los pacientes con melanoma localmente avanzado (MLA) disponemos de diferentes opciones terapéuticas. La ablación con láser de dióxido de carbono se utiliza para lesiones pequeñas y numerosas. Se puede realizar en forma ambulatoria con anestesia local y puede repetirse el procedimiento. Las heridas curan en 6 semanas aproximadamente. Se puede combinar con otras terapias regionales21.
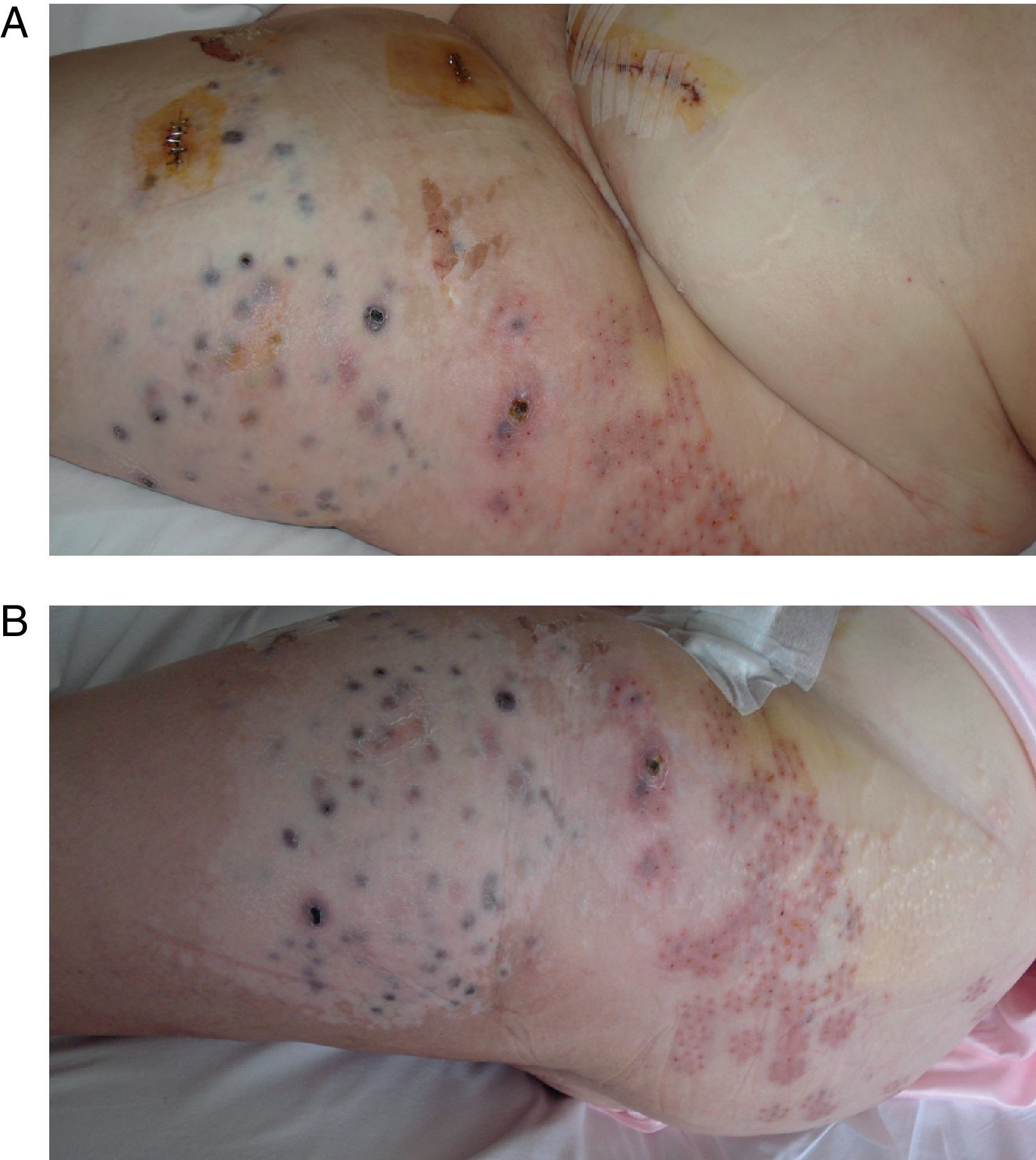
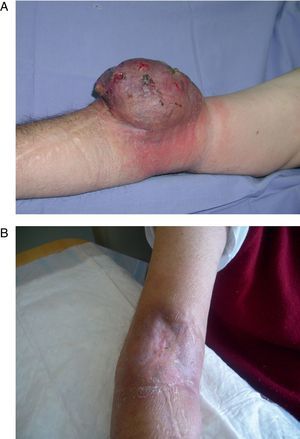
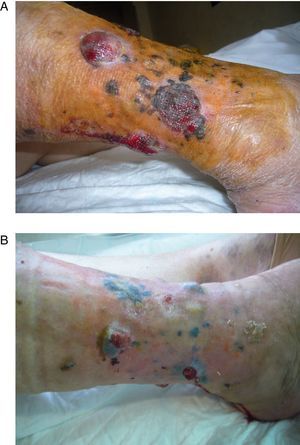
La electroquimioterapia se utiliza como terapia intralesional en los pacientes con MLA y consiste en la aplicación de impulsos eléctricos de alta intensidad que generan poros en la membrana celular y permiten que puedan entrar selectivamente citostáticos previamente administrados. Produce vasoconstricción local (<24h) que permite que el fármaco permanezca mayor tiempo dentro del tejido. Puede ser usado en áreas previamente irradiadas o perfundidas (fig. 3) Permite mejorar la calidad de vida en pacientes con lesiones sangrantes y dolorosas. La molestia más común es irritación en el sitio de la inyección21.
Paciente con diagnóstico de melanoma estadio IIIB con múltiples lesiones en tránsito que abarcan el miembro inferior izquierdo y glúteo del mismo lado A) postoperatorio inmediato donde se aprecia que las lesiones que quedaron fuera del área perfundida han sido tratadas mediante electroquimioterapia. B) la misma paciente 2 meses después. Se observa el pigmento residual tras la necrosis de todas las lesiones tratadas, junto a una gran área de vitíligo en la región perfundida.
En el MLA, la interleukina 2 y el interferón han inducido respuestas, de intensidad y duración variables22. El TNF-erade es un gen de TNFα insertado en un adenovirus mitigado por radiación y quimioterapia. Se utiliza por vía intralesional para disminuir su toxicidad. Tiene sinergismo con la radiación aumentando sus efectos, sin aumentar el daño tisular23,24.
La radioterapia se ha usado como tratamiento adyuvante después de la resección de la lesión primaria o nódulos metastásicos regionales en el MLA para el control de la enfermedad y prolongación de la supervivencia a pacientes que no son candidatos a cirugía o quimioterapia regional. Utilizada en forma paliativa se ha demostrado un porcentaje de respuesta de entre el 60 y el 79% en estadio III. Los esquemas de hipofraccionamiento con altas dosis presentan mejores resultados, con supervivencias entre 2 y 8 meses21.
La quimioterapia sistémica en el MLA presenta bajos porcentajes de respuesta (entre el 11 y el 17% para metástasis a distancia). Es una opción a considerar en pacientes con enfermedad metastásica en concomitancia o secuencialmente con las terapias locales, incluida la PAE4.
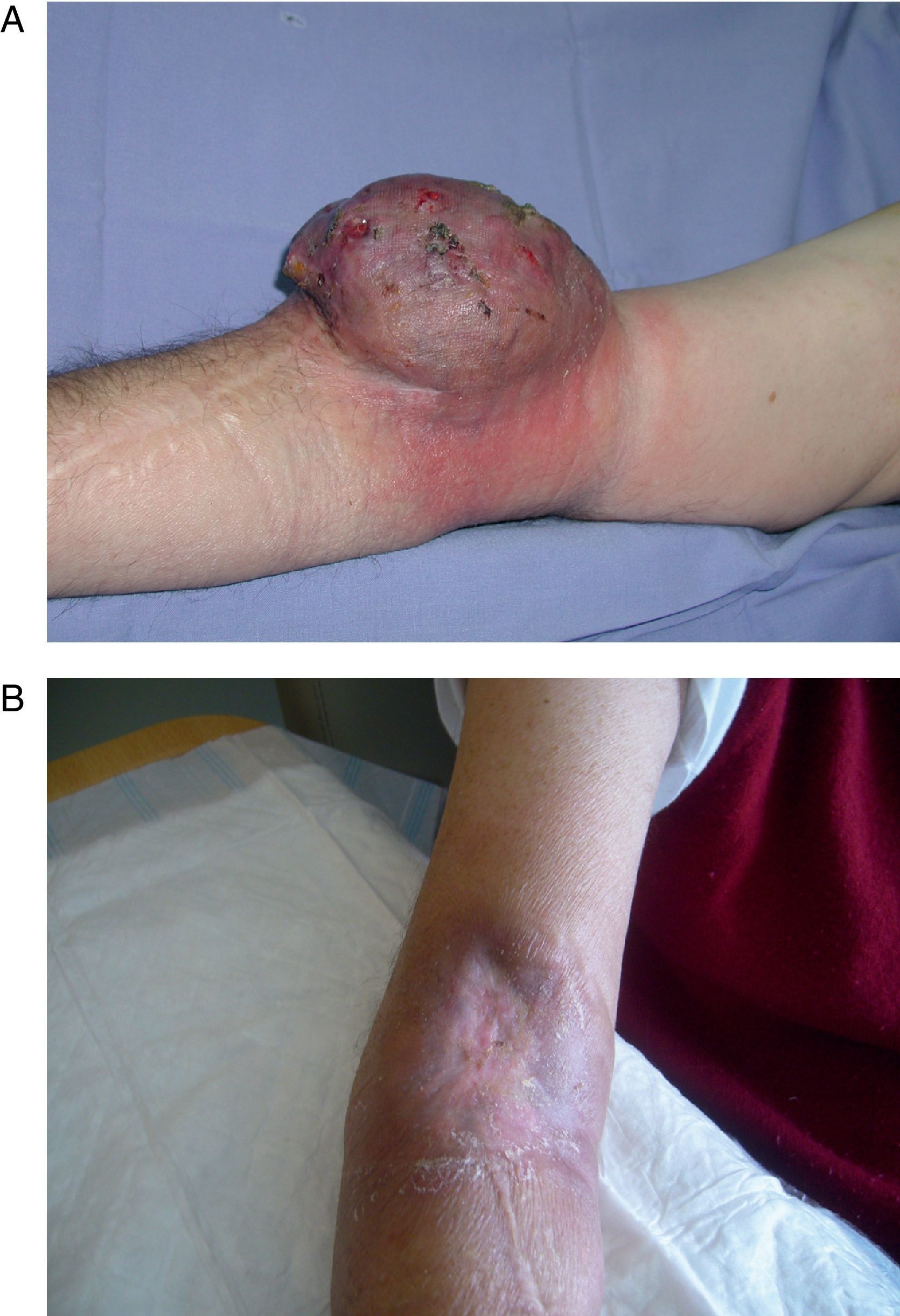
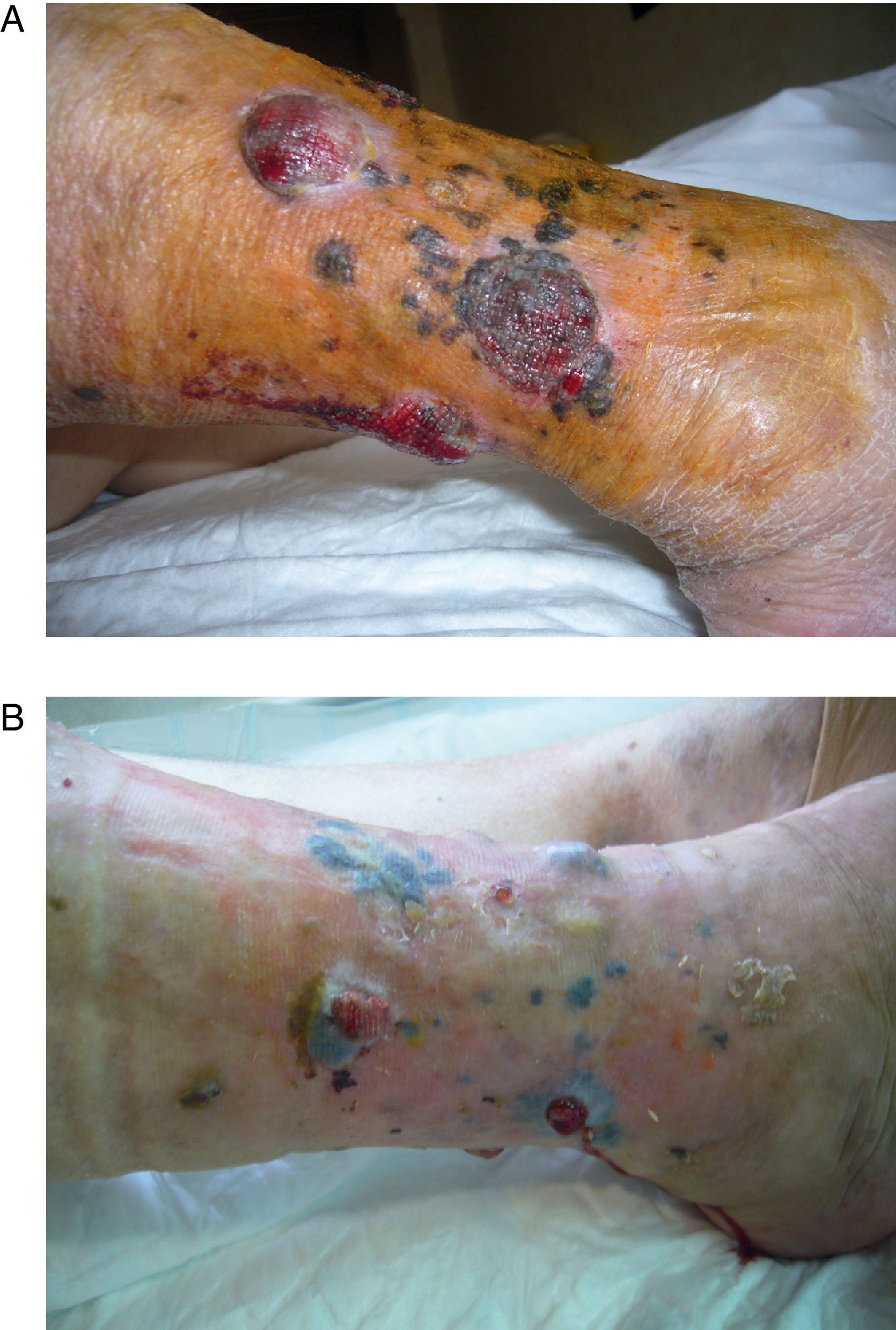
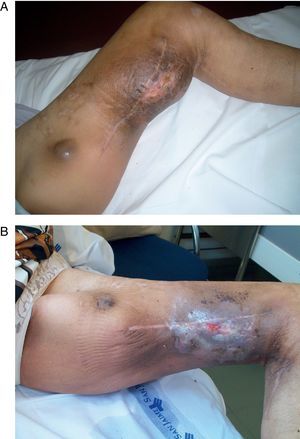
La PAE permite el tratamiento selectivo de la extremidad afecta con altas dosis de citostáticos y/o agentes biológicos, favoreciendo la respuesta y evitando la aparición de efectos sistémicos2,3. La hipertermia es citotóxica per se y produce una dilatación capilar en tejido tumoral que aumenta hasta 6 veces el flujo. La utilización del TNF en combinación con melfalán ha sido extensamente estudiada en melanoma y sarcoma de las extremidades localmente avanzados o irresecables25. Su uso fue aprobado en Europa en el año 1998 gracias a un estudio multicéntrico8,26. El TNF actúa sinérgicamente con el melfalán produciendo una mayor respuesta inflamatoria peritumoral, incrementando la permeabilidad vascular tumoral y prolongando los efectos del quimioterápico4,27. El control de la enfermedad locorregional puede convertir un tumor irresecable en resecable y reduce el porcentaje de recidiva local; permite la conservación de la extremidad en programas curativos o paliativos (fig. 4); disminuye significativamente las complicaciones locales de la enfermedad no controlada, como el sangrado o la sobreinfección, con un marcado impacto en la calidad de vida28,29.
Paciente con melanoma avanzado: A) se aprecian múltiples lesiones tumorales en pierna derecha, dolorosas y con tendencia al sangrado (imagen preoperatoria). B) en los dos meses posteriores a la perfusión aislada de la extremidad se aprecia que las lesiones han disminuido de tamaño y áreas de vitíligo (buen pronóstico).
En aquellos pacientes en los que ha fallado la primera perfusión, es factible repetir el procedimiento con un alto porcentaje de respuestas y prolongación del intervalo libre de enfermedad, con una toxicidad moderada4,25,30,31.
Al tratarse de una terapia local no se observa un impacto en la supervivencia global del paciente, que depende de los factores pronósticos de su enfermedad.
La morbilidad está relacionada con los efectos locales de la quimioterapia y la hipertermia que va desde el eritema leve a la epidermiolisis o la amputación. Una toxicidad mayor que el grado II no está relacionada con una mayor respuesta32.
La PAE con TNF y melfalán consigue respuestas favorables alrededor del 80%, por lo que se evita la amputación en hasta el 87% de los miembros perfundidos. Los porcentajes descritos son relativamente homogéneos en los distintos centros de referencia que realizan ésta técnica.
Los resultados aquí referidos (93,4% de respuestas globales, 86,7% de amputaciones evitadas) son equiparables a los de otros grupos ya expuestos en la literatura. Al tratarse de un centro de referencia muchos de los pacientes son remitidos exclusivamente para la realización del procedimiento, no pudiendo intervenir en las decisiones terapéuticas a tomar según las incidencias detectadas en el seguimiento.
El posicionamiento de las cánulas y la propia limitación del territorio perfundido restringen el efecto de los fármacos en los tejidos a tratar, observándose recaídas marginales al campo tratado, sobre todo en el caso del melanoma. En la actualidad hay varios estudios en marcha para intentar mejorar los resultados globales, que abarcan desde la utilización de otros fármacos en conjunción con el TNF, como la adriamicina, hasta la aplicación conjunta, simultánea o diferida, de otras modalidades terapéuticas como la electroquimioterapia.
ConclusionesLa PAE con TNF, melfalán e hipertermia en melanoma y sarcomas en extremidades analizada en el presente estudio, se muestra como una opción de tratamiento de probada eficacia (respuestas en el 93,4% de los pacientes tratados), es una técnica segura (toxicidades mínimas resueltas con medidas de soporte habitual) y puede prevenir la amputación del miembro comprometido (se evitaron el 87% de ellas).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al personal de quirófanos, anestesistas, perfusionistas y servicio de farmacia para el apoyo prestado para la realización de ésta técnica.