Sr. Director:
El trasplante hepático se ha convertido en la mejor alternativa terapéutica para los pacientes con enfermedad hepática en estadio terminal. Esto es debido a los avances logrados en las técnicas anestésicas, quirúrgicas, de inmunodepresión y de cuidados postoperatorios, que han posibilitado vencer una serie de agresiones a las que es sometido el injerto durante todo el proceso, desde su extracción hasta el implante, lográndose así una correcta funcionalidad del órgano trasplantado.
Sin embargo, un detalle tan aparentemente simple como es la discordancia de tamaños entre el donante y el receptor, o lo que es lo mismo, entre el injerto y la cavidad en la que se va a alojar, puede dar lugar a trastornos en la posición de las estructuras vasculares y, por ende, de la funcionalidad del órgano.
Presentamos el caso de un paciente sometido a trasplante ortotópico de hígado en nuestra unidad en el que se manifestó el citado problema, ofreciendo nuestra aportación para solucionar el problema.
Se trataba de un varón de 60 años con antecedentes personales de gastrectomía con reconstrucción Billroth I por ulcus duodenal en 1986 y una exposición antigua a virus de la hepatitis B.
Fue diagnosticado de cirrosis hepática de etiología mixta viral y alcohólica, en estadio funcional B7 de Child-Pugh, con hipertensión portal y varices esofágicas III/III. Fue incluido en la lista activa de trasplante hepático, siendo la indicación fundamental ascitis y deterioro de la función hepatocelular.
Como datos más significativos de la exploración física destacaban un buen estado nutricional, estabilidad hemodinámica y del nivel de conciencia, ictericia escleral, esplenomegalia y una cicatriz de laparotomía media supraumbilical. Entre sus datos antropométricos presentaba una talla de 176 cm, peso 88 kg, perímetro abdominal 109 cm y torácico 102 cm.
Entre sus datos analíticos encontramos positividad a anti-HBs, anti-HBc y IgG CMV, así como una plaquetopenia (58.000/µl), actividad de protrombina del 52% y una bilirrubina total de 3,81 mg/dl (bilirrubina directa 0,76 mg/dl). En la ecografía se observaba una vena porta permeable de 16 mm de calibre, con flujo de 25 cm/s de dirección hepatópeta, recanalización de la vena umbilical y esplenomegalia.
El paciente fue sometido a trasplante ortotópico de hígado, encontrándose un gran síndrome adherencial por cirugía abdominal previa, lo que obligó a la disección laboriosa del pedículo hepático con pinzado del mismo (maniobra de Pringle). Se realizó la hepatectomía con preservación de vena cava retrohepática (piggy-back). El injerto hepático era de pequeño tamaño, al proceder de donante femenina de 51 kg.
Una vez realizadas las anastomosis vasculares, se objetivó una mala reperfusión del injerto a pesar de repetidas comprobaciones de las mismas, lo que originó una hemorragia prolongada por alteraciones de la coagulación y por fibrinólisis. Esto ocasionó unos aportes totales de 10 l de sangre procedente del banco, 14 l del recuperador, 5,5 l de plasma fresco y 33 unidades de plaquetas. Tras evidenciarse un acodamiento del pedículo hepático como consecuencia de la incongruencia de tama ño entre el injerto y la cavidad receptora (relación peso receptor/peso donante de 1,7 [88:51]), se decidió colocar una prótesis de mama de suero salino de 160 ml de volumen por detrás del injerto, con el objeto de rectificar la angulación del hilio. Con ello se obtuvo una rápida y óptima reperfusión del injerto y una mejora apreciable de su funcionalidad, con lo que concluyó sin más incidencias la intervención.
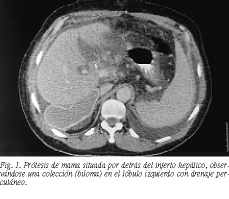
Durante el postoperatorio se realizó colangiografía de control trans-Kehr que evidenció extravasación de contraste en lóbulo hepático izquierdo, secundaria a una pequeña lesión traumática del hígado donante. En la TC de control se apreció la correcta posición del injerto apoyado en la prótesis. Asimismo, se observó un biloma en lóbulo hepático izquierdo que se puncionó para su evacuación, sin incidencias (fig. 1).
Se retiró el drenaje al día 27, siendo alta al día 34.
En la actualidad, con un seguimiento superior a un año, no hemos detectado complicaciones de ningún tipo debidas a la prótesis.
El trasplante de un hígado de pequeño tamaño en un receptor voluminoso puede crear problemas para la correcta reperfusión del injerto, por acodamiento o torsión de los elementos vasculares, ya sea del pedículo hepático o de las venas suprahepáticas. Esto origina una disfunción o no función inmediata del injerto.
Se trata de un problema ya conocido, y que incluso está presente en la cirugía hepática reglada, sobre todo tras resecciones mayores derechas (hepatectomía derecha o trisegmentectomía derecha), en las que se deja un hígado izquierdo fijado a la cavidad únicamente por los elementos vasculares, dando lugar a torsiones del pedículo hepático y de la vena suprahepática media e izquierda, causando un síndrome de Budd Chiari1,2.
En lo que a cirugía de trasplantes se refiere, donde primero nos encontramos con esta eventualidad es en los trasplantes pediátricos3,5 en los que, debido a las listas de espera prolongadas por falta de donantes6-7, se utilizan frecuentemente hígados reducidos (split, donante vivo). Esto da lugar en algunas ocasiones a trasplantes con lóbulo izquierdo o hígado izquierdo en un receptor de mayor relación corporal que su donante8.
De estos trabajos se empieza a deducir la necesidad de encontrar un tamaño ideal del injerto en relación al receptor, estableciéndose dos criterios fundamentales: la relación corporal donante-receptor (muy variable, siendo según las series de entre 1,5-6, determinando así la transección necesaria de hígado donante) y el diámetro transverso del abdomen del receptor4. En cualquier caso, esta incongruencia de tamaños es un problema que puede dar lugar a la anulación funcional del injerto, independientemente de los procesos anestésicos y quirúrgicos que se hayan llevado a cabo con anterioridad. Por ello, es interesante incidir en las alternativas terapéuticas válidas para solucionar este problema.
Existen dos tipos de soluciones, de fijación y de soporte. Entre las primeras, clásicamente se han empleado las pexias del injerto, bien a pared abdominal a través del ligamento redondo, o bien a diafragma1. Es un método no del todo eficaz, pues no se anclan el órgano a estructuras siempre firmes. Incluso se aporta una excesiva tensión y rigidez, lo que podría dar lugar a desgarros y roturas del mismo.
Por otra parte, podemos usar elementos de soporte. En ese sentido, se ha descrito el empleo de una sonda de Sengstaken-Blakemore9 colocada en la fosa hepática, con los balones gástrico y esofágico hinchados. El uso de esta sonda tiene la ventaja de poder modificar la posición del injerto en el postoperatorio, mediante la manipulación externa de los balones y posterior retirada de los mismos. Como inconveniente, su rotura puede dar lugar a una obstrucción aguda del flujo sanguíneo al injerto. También puede ser fuente de contaminación externa por las sucesivas manipulaciones. Por último, no olvidemos que es un elemento de soporte que será retirado, lo que no garantiza la estabilidad del injerto.
Finalmente, aportamos nuestra experiencia con el empleo de una prótesis mamaria como elemento de soporte permanente. Durante el acto quirúrgico evidenciamos una falta de reperfusión del injerto a pesar de comprobar repetidamente las anastomosis y valorar otro tipo de contingencias. En el momento de apreciar un acodamiento del hilio hepático hacia atrás debido a la incongruencia de tamaños, decidimos paliar este problema con la colocación tras el injerto de la citada prótesis, con lo que se rectificó el pedículo hepático y se resolvió el problema.
El uso de una prótesis de mama como elemento de soporte de estructuras vitales en el interior de la cavidad abdominal no es una práctica muy habitual (de hecho, no hemos encontrado referencias o trabajos al respecto), y mucho menos en la cirugía de trasplante hepático. Disponemos en la actualidad de dos tipos fundamentales de prótesis, las rellenas de gel de silicona y las rellenas de suero salino. Las primeras han ocasionado diversos problemas de rechazo, parece ser que asociados a una "hemorragia" de gel en el interior del cuerpo, aunque esto no está del todo claro. Por ello, se tiende a usar las prótesis rellenas de suero salino, como en nuestro caso10. Dichas prótesis suelen ser bien toleradas, originando en ocasiones infecciones por gérmenes grampositivos (Staphylococcus aureus o epidermidis) en relación con la cirugía mamaria. En nuestro caso, tras un seguimiento superior a un año no hemos detectado complicaciones infecciosas ni de otro tipo.
Por ello, y salvando el riesgo de la infección que puede minimizarse con las adecuadas medidas de antisepsia, creemos que es un método útil, estable y no modificable con manipulación externa, lo que confiere integridad al eje portal. Logramos así la correcta posición del injerto hepático, su adecuada reperfusión y, por tanto, se permite la normal funcionalidad del órgano trasplantado.