El único tratamiento curativo para las metástasis hepáticas de cáncer colorrectal es la cirugía. La identificación de factores pronósticos nos permite individualizar el tratamiento de estos pacientes, mejorando sus resultados oncológicos a largo plazo. El objetivo de nuestro estudio es identificar la supervivencia y los factores pronósticos de pacientes sometidos a tratamiento quirúrgico de metástasis hepáticas de cáncer colorrectal.
MétodosSe trata de un estudio retrospectivo de todos los casos de hepatectomías por metástasis hepáticas de cáncer colorrectal, operadas en un hospital de tercer nivel en España, entre los años 2010 y 2018. Se realizó análisis de supervivencia univariante con las curvas de supervivencia Kaplan-Meier. Mediante el modelo multivariante regresión de Cox se determinaron los factores pronósticos asociados a la supervivencia global.
ResultadosLa supervivencia global y supervivencia libre de enfermedad de nuestra serie, a los 5 años fue del 43% y del 33%, respectivamente. En el análisis de supervivencia, las características de las metástasis hepáticas (números, tamaño mayor, distribución bilobar y enfermedad extrahepática) y postoperatorias (transfusión sanguínea, complicaciones graves y margen afecto), así como el KRAS no mutado resultaron estadísticamente significativos. No obstante, después de aplicar la regresión de Cox, solo se identificaron 5 factores de riesgo independientes: mutación del KRAS, metástasis hepáticas >4cm, transfusión intraoperatoria, complicaciones graves y margen afecto.
ConclusionesEn nuestro grupo de pacientes hemos observado que el tamaño>4cm de la metástasis hepáticas, la transfusión intraoperatoria, las complicaciones posquirúrgicas graves y el margen afecto se mantienen como factores pronósticos tradicionales vigentes. Mientras que el biomarcador KRAS cobra un valor predictivo importante como factor pronóstico de supervivencia.
Liver resection is the only curative treatment for colorectal liver metastasis. The identification of predictive factors leads to personalize patient management to enhance their long-term outcomes. This population-based study aimed to characterize factors associated with, and survival impact of patients who received hepatectomy for colorectal liver metastasis.
MethodsA retrospective cohort study of all the hepatectomies for colorectal liver metastasis performed at third-level hospital of Spain (2010–2018) was conducted. The Kaplan–Meier method was used for survival analyses. Multivariable Cox and regression models were used to determine prognostic factors associated with overall survival.
ResultsThe 5-year overall survival and disease-free survival were 42 and 33%, respectively. Survival analysis showed that metastasis features (number, largest size, distribution, and extrahepatic disease) and postsurgical factors (transfusion, major complications, and positive margin resection), as well as non-mutated KRAS, showed a significant association with survival. Otherwise, on multivariate analysis, only 5 independent risk factors were identified: major size metastasis>4cm, RAS mutation, positive margin resection, intraoperative transfusion, and major complications.
ConclusionsAccording to our findings, major size metastasis>4cm, intraoperative transfusion, and major postoperative complications continue to be traditional prognostic factors. Meanwhile, the KRAS biomarker has a powerful impact as a survival prognostic factor.
El cáncer colorrectal (CCR) es una enfermedad con marcada incidencia y mortalidad alrededor del mundo. En el 2020, fue la patología maligna más frecuentemente diagnosticada en España con una tasa estimada de mortalidad del 14,6%1. Para finales del 2021 se espera diagnosticar 43.581 nuevos casos1. El hígado es la localización más común de metástasis en el CCR, entre el 40-50% de los pacientes diagnosticados de CCR desarrollarán alguna metástasis hepática durante los primeros 3 años2, mientras que cerca del 20-25% de pacientes tienen metástasis hepáticas en el momento del diagnóstico3.
El único tratamiento curativo para las metástasis hepáticas hoy en día es la cirugía, con una tasa de supervivencia del 36-58%4 a los 5 años. No obstante, solo un 15% de pacientes diagnosticados de metástasis hepáticas (MH) de cáncer colorrectal (MHCCR) son subsidiarios de tratamiento quirúrgico curativo, mientras que el 35% son potencialmente resecables y el 50% irresecables. Sin tratamiento, estos pacientes tienen una esperanza de vida de 5-6 meses5.
Está demostrado que el tratamiento quirúrgico agresivo de MHCCR puede mejorar la supervivencia en pacientes debidamente seleccionados6, los factores pronósticos desempeñan un rol importante en este proceso de selección. Los primeros factores pronósticos publicados sobre la supervivencia en pacientes operados de MHCCR datan de 1996 por Nordlinger et al.7, desde entonces y hasta ahora muchos aspectos en cuanto al tratamiento y manejo de la MHCCR han cambiado radicalmente.
El objetivo principal de nuestro estudio es identificar qué factores pronósticos influyen en la supervivencia de los pacientes con MHCCR tratados quirúrgicamente. Además, discutiremos si los factores pronósticos obtenidos con este estudio son similares a los tradicionalmente conocidos.
MétodosSe trata de un estudio observacional retrospectivo, que incluyen todas las hepatectomías por MHCCR realizadas en un hospital de tercer nivel de España, desde enero de 2010 hasta agosto de 2018.
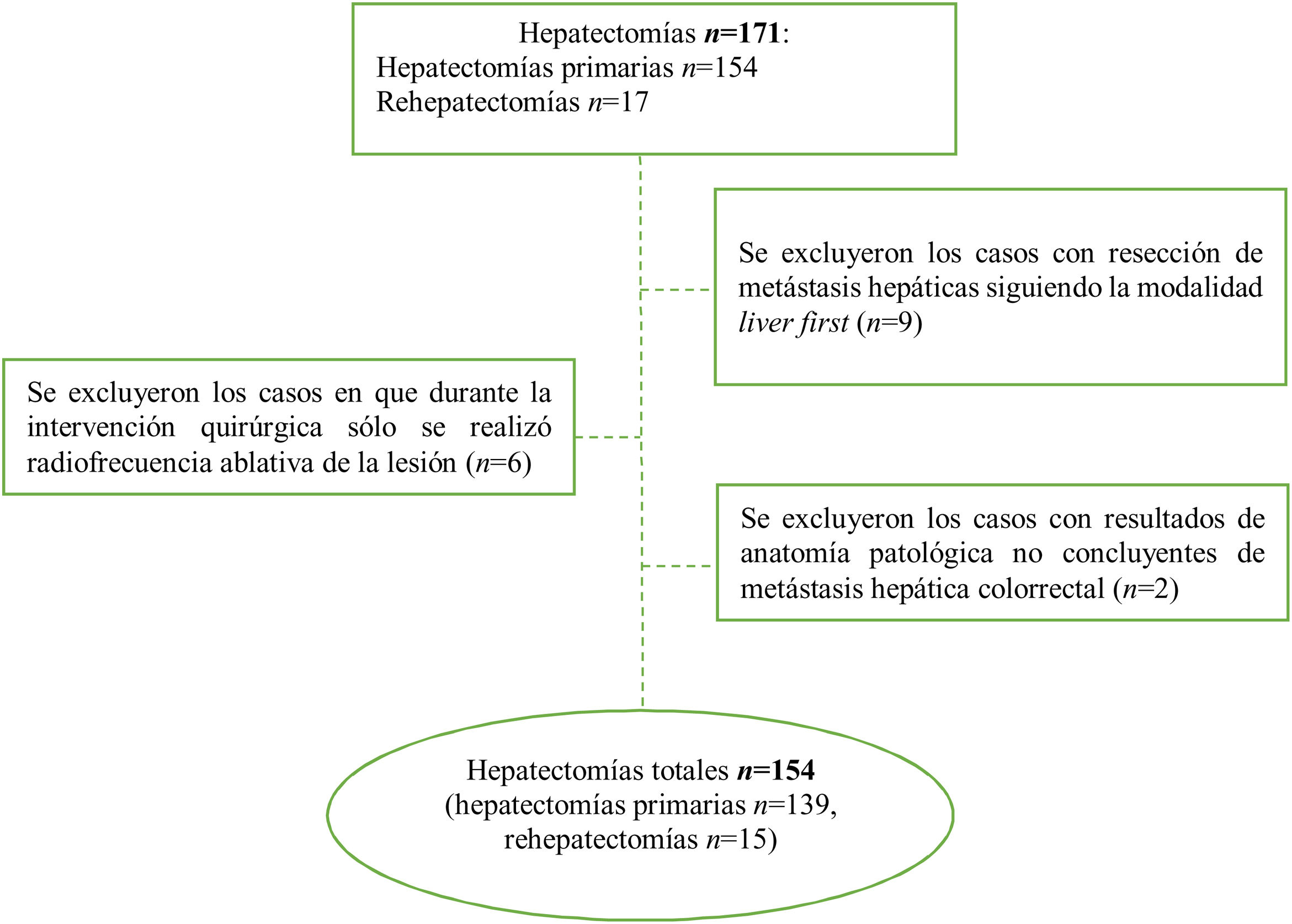
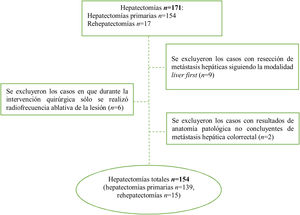
Los criterios de inclusión fueron: casos de resección hepática curativa por MHCCR, que se haya confirmado con el estudio anatomopatológico de la pieza. Se excluyeron los casos con imposibilidad de llevar a cabo una cirugía curativa (incluidos aquellos que recibieron tratamiento de termoablación exclusivo), cuando el estudio histológico de la pieza quirúrgica no confirmaba el diagnóstico de MHCCR y los casos en que se practicó la modalidad quirúrgica de cirugía hepática primero (liver first), debido a que en varios de ellos no se llegó a completar la resección cólica por progresión de la enfermedad, así como por la minoría de casos. Las rehepatectomías registradas se han considerado como casos nuevos.
En todos los casos se realizó un estudio de extensión con tomografía computarizada toracoabdominal, con el que se descartaba enfermedad metastásica diferente a la hepática. Posteriormente se indicó la resonancia magnética hepática, para el estudio detallado de la MH. En casos de dudas diagnóstica de presencia de metástasis extrahepática que no se pudiese confirmar ni con la tomografía computarizada ni con la resonancia magnética, se solicitó estudio de tomografía por emisión de positrones. La enfermedad extrahepática irresecable fue considerada contraindicación de cirugía resectiva de MHCCR.
Se consideraron MH sincrónicas aquellas MH presentes al momento del diagnóstico del tumor primario, y la cirugía simultánea solo se indicó en casos en donde factores como la edad, características del tumor primario, el número y tamaño de la metástasis y el remanente hepático futuro fueran óptimos.
Consideramos metástasis borderline a aquellas potencialmente modificables para su resección curativa, y son: las metástasis>5cm, presencia de 4 metástasis o más, o los casos en donde se preveía que el remanente hepático futuro sea inferior al 30%, en estos casos se indicó quimioterapia (QT) neoadyuvante (QTN) de doble terapia (fluorouracilo con oxaliplatino y/o irinotecan) asociado a anticuerpos monoclonales: cetuximab y/o panitumumab para los casos KRAS no mutado o bevacizumab si eran KRAS mutados. En nuestro centro no se realiza QTN en pacientes con metástasis quirúrgicas resecables desde el inicio. Todos los casos fueron evaluados por un equipo multidisciplinar para definir el manejo adecuado e individualizado que cada caso ameritaba.
Las variables a estudio fueron: edad, sexo, grado de ASA, tipo de tumor primario, estadio del tumor primario, tipo de MH, QTN, tipo de KRAS, antígeno carcinoembrionario preoperatorio, tipo de hepatectomía, transfusión intraoperatoria, márgenes de resección, morbimortalidad postoperatoria y seguimiento postoperatorio a largo plazo.
Se consideró la morbimortalidad ocurrida en los siguientes 30 días tras la cirugía. Los tipos iii, iv y v de la clasificación de Clavien-Dindo8 se han catalogado como complicaciones mayores.
El margen de resección fue clasificado como libre si no había células tumorales en 1mm, un margen inferior a 1mm se consideró margen afecto. La distribución anatómica de las lesiones hepáticas fue definida según la nomenclatura de Couinaud9. Se usó la terminología de Brisbane 200010 para las resecciones hepáticas.
Este estudio fue debidamente aprobado por el Comité de Ética de la Investigación con medicamentos (CEIm) de nuestra institución.
Mediante laparotomía antes de proceder a la resección hepática, en todos los casos, se practicó una revisión cuidadosa de toda la cavidad abdominal y tras la movilización hepática se procedió a la palpación y a la realización de la ecografía intraoperatoria del hígado. Aunque no de forma sistemática, pero según las necesidades de cada procedimiento, se realizaron maniobras de exclusión vascular hepática. Cuando así se requirió, se usó la maniobra de Pringle intermitente de 10min de duración seguida de 5min de reperfusión.
De igual forma, la transección hepática fue realizada usando el Cavi-Pulse Ultrasonic Surgical Aspirator (CUSA) junto a métodos de electrocoagulación convencional. Se consideró hepatectomía menor a las resecciones menores de 2 segmentos hepáticos y hepatectomía mayor a las que incluían 3 o más segmentos.
Los pacientes fueron revisados cada 3-6 meses después de la cirugía, durante los primeros 3 años, y posteriormente cada 6 meses, con tomografía computarizada toracoabdominal y marcadores tumorales. El seguimiento de los pacientes se prolongó hasta noviembre de 2020, para tener el máximo número posible de pacientes con seguimiento a largo plazo. Ante la presencia de recurrencia, se trataba al paciente siguiendo el mismo esquema inicial, si la MH era resecable cirugía directa, siempre que se descartase enfermedad extrahepática irresecable, en caso de irresecabilidad se optaba por QT de conversión o paliativa según el caso.
Análisis estadísticoLas características basales de la población fueron descritas mediante frecuencias absolutas y relativas (porcentajes) de sus categorías. Se calcularon los intervalos de confianza al 95% (IC 95%) de los parámetros. Se comprobó la normalidad de las variables cuantitativas para su expresión en media aritmética con su desviación típica o en mediana y el rango intercuartílitico (RIC).
Se calcularon las tasas de supervivencia mediante el método de estimación de Kaplan-Meier y las curvas de supervivencia obtenidas se compararon con el test log-rank. Las variables que mostraron una p<0,10 fueron seleccionadas para el análisis multivariante.
En el análisis multivariante se usó el modelo de regresión de Cox para la identificación de factores de riesgo independientes asociados a la supervivencia global (SG) y la supervivencia libre de enfermedad (SLE). Se consideraron significativas las variables que tuvieron una p<0,05.
El análisis estadístico se realizó con el paquete estadístico SPSS® versión 25 (IBM Corportation®, Armonk, New York, EE. UU.).
ResultadosDurante el período de estudio, se efectuaron 171 hepatectomías por MHCCR (154 primarias y 17 rehepatectomías), 17 casos fueron excluidos por no cumplir los criterios de inclusión (fig. 1). Se analizaron finalmente 154 casos, de los cuales 61 fueron mujeres y 93 hombres, la mediana de edad fue de 65,5 años (RIC: 57-72,3). En 132 (85,7%) casos se realizó cirugía secuencial colon-hígado y en 22 (14,3%), cirugía simultánea. En 53 casos se trató de metástasis bilobulares. En 35 casos (22,7%) el tamaño de la metástasis fue>4cm. Todas las características clínicas y patológicas de nuestra serie se describen en la tabla 1.
Características demográficas y clinicopatológicas de los pacientes sometidos a resección hepática por MHCCR (n=154)
| Características | Valor | % |
|---|---|---|
| Edad, mediana (RIC) | 65,50 (57-72) | |
| <70 años | 102 | 66,2 |
| Hombres | 93 | 60,4 |
| ASA riesgo alto (iii) | 60 | 38,9 |
| Tumor primario | ||
| Colon derecho | 35 | 22,7 |
| Colon izquierdo | 73 | 47,4 |
| Recto | 46 | 29,9 |
| Tipo de T: | ||
| T1 | 3 | 1,9 |
| T2 | 17 | 11,0 |
| T3 | 101 | 65,6 |
| T4 | 32 | 20,8 |
| Metástasis ganglionares del tumor primario | 96 | 62,3 |
| Tumor primario con invasión linfovascular | 67/144 | 43,5 |
| Tumor primario con invasión perineural | 27/144 | 17,5 |
| Metástasis hepáticas | ||
| MH sincrónicas | 72 | 46,8 |
| MH metacrónicas | 82 | 53,2 |
| Cirugía colon-hígado | 132 | 85,7 |
| Cirugía simultánea | 22 | 14,3 |
| Tamaño de metástasis más grande (>4cm) | 35 | 22,7 |
| Metástasis únicas | 77 | 50,0 |
| Metástasis unilobares | 101 | 65,6 |
| Metástasis multilobares | 53 | 34,4 |
| KRAS mutado | 51/109 | 46,8 |
| CEA>5ng/ml | 85/144 | 59,0 |
| Quimioterapia neoadyuvante MH | 78 | 50,6 |
| Tiempo quirúrgico (min), mediana (RIC) | 230 (180-270) | |
| Transfusión intraoperatoria | 33 | 21,4 |
| Hepatectomía mayor | 66 | 42,9 |
| Enfermedad extrahepática | 10 | 6,5 |
| Margen libre | 127 | 82,5 |
| Complicaciones leves (Clavien-Dindo I y II) | 16 | 39,6 |
| Complicaciones graves (Clavien-Dindo≥III) | 23 | 14,9 |
| Mortalidad | 2 | 1,3 |
| Estancia postoperatoria (días, RIC) | 7 (5,75 – 9) | |
| Tiempo postoperatorio prolongado (>7días) | 63 | 40,9 |
| Adyuvancia poshepatectomía | 107 | 69,9 |
| Recidiva al final del seguimiento: | 103 | 66,9 |
| Recidiva específica | 23 | 14,94 |
| Recidiva hepática y extrahepática | 58 | 37,67 |
| Recidiva extrahepática exclusiva | 22 | 14,29 |
CEA: antígeno carcinoembrionario; MH: metástasis hepáticas; MHCCR: metástasis hepáticas de cáncer colorrectal; RIC: rango intercuartílico.
Recibieron QTN el 50,6% de los casos; se detallan sus características en la tabla 2.
Características clínicas de los pacientes que han recibido quimioterapia neoadyuvante y de los que no
| Características | QTN (n=78)n (%) | sQTN (n=76)n (%) |
|---|---|---|
| Adyuvancia tumor primario | 73 (93) | 41 (53,9) |
| Metástasis ganglionares del tumor primario | 38 (53,5) | 29 (39,7) |
| MH sincrónicas | 51 (65,4) | 21 (27,6) |
| Metástasis única | 31 (39,7) | 46 (60,5) |
| Tamaño de metástasis más grande (>4cm) | 22 (28,2) | 13 (17,1) |
| Metástasis multilobares | 35 (44,9) | 18 (23,7) |
| Adyuvancia poshepatectomía | 59 (75,6) | 48 (64) |
MH: metástasis hepáticas; QTN: quimioterapia neoadyuvante; sQTN: sin quimioterapia neoadyuvante.
La mediana del tiempo de intervención quirúrgica fue de 230min (RIC: 180-270). La estancia hospitalaria tuvo como mediana 7 días (RIC: 5,8-9), en el 40,9% de los casos existió estancia prolongada (≥8 días). La tasa de transfusión intraoperatoria fue del 21,4%. La tasa de morbilidad fue del 14,9%. La tasa de mortalidad posquirúrgica fue del 1,3%. El tiempo de seguimiento máximo fue de 155 meses, con una mediana de 38 meses (RIC: 21- 65).
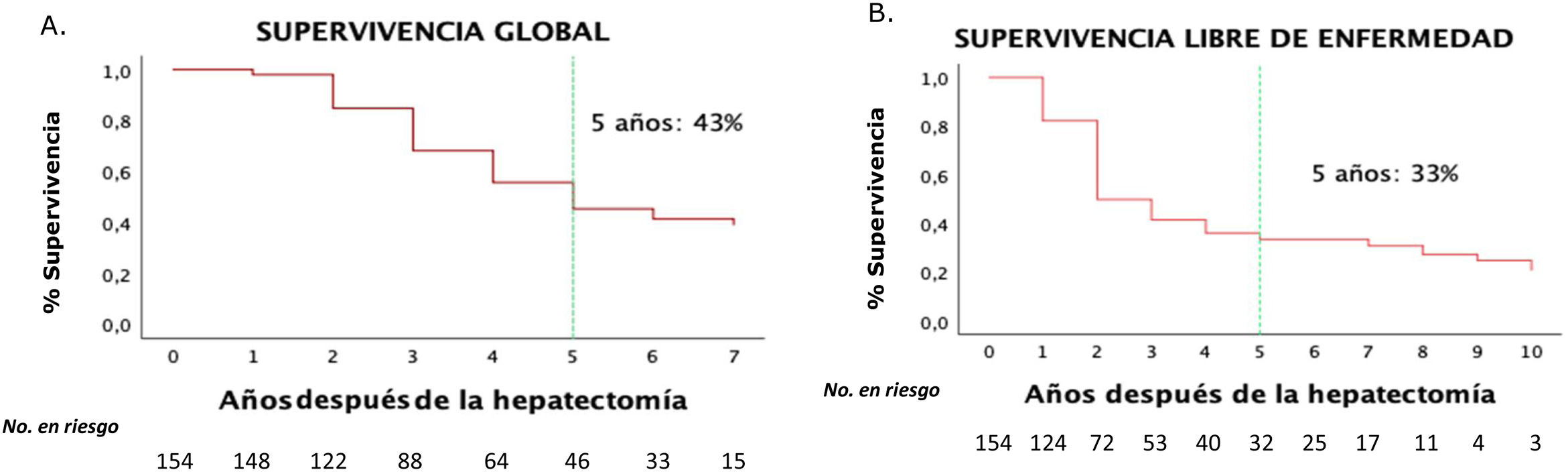
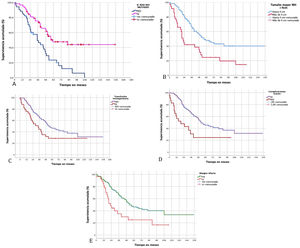
La SG para nuestra serie fue del 90% al primer año, del 62% a los 3 años y del 43% a los 5 años, mientras que la SLE fue del 58% al primer año, del 40% a los 3 años y del 33% a los 5 años (fig. 2).
Ni la edad, sexo o comorbilidad preoperatoria (tipo de ASA) se asociaron con peores resultados de SG o SLE.
Análisis univariante de la supervivencia global y la supervivencia libre de enfermedad a los 5 años
| N.o. pctes | SG 5 años (%) | Valor p | SLE 5 años (%) | Valor p | |
|---|---|---|---|---|---|
| Factores clinicopatológicos | |||||
| Edad | |||||
| <70 | 102 | 46,0 | 35,2 | ||
| >70 | 50 | 34,5 | NS | 24,9 | NS |
| Sexo | |||||
| Femenino | 61 | 43,3 | 34,8 | ||
| Masculino | 91 | 43,0 | NS | 30,9 | NS |
| ASA | |||||
| ASA I-II | 93 | 43,2 | 31,6 | ||
| ASA III | 59 | 40,2 | NS | 33,8 | NS |
| Factores dependientes del tumor primario | |||||
| Localización tumor primario | |||||
| Colon | 108 | 45,2 | 35,8 | ||
| Recto | 44 | 37,6 | NS | 25,2 | NS |
| Tumor primario origen embriológico | |||||
| Colon derecho | 35 | 44,1 | 25,1 | ||
| Colon izquierdo | 117 | 41,6 | NS | 34,6 | NS |
| Estado T | |||||
| T1-T2 | 20 | 37,1 | 27,4 | ||
| T3-T4 | 132 | 44,0 | NS | 33,4 | NS |
| Estado N | |||||
| N0 | 57 | 52,7 | 40,8 | ||
| N+ | 95 | 37,2 | 0,011 | 25,4 | 0,008 |
| Invasión linfovascular | |||||
| Sí | 67 | 40 | 22,4 | ||
| No | 76 | 42,3 | NS | 38,4 | NS |
| Invasión perineural | |||||
| Sí | 27 | 31,5 | 20 | ||
| No | 116 | 44 | NS | 35,2 | NS |
| Factores dependientes de las metástasis | |||||
| Tipo de metástasis | |||||
| Metacrónicas | 81 | 46,8 | 34 | ||
| Sincrónicas | 71 | 36,7 | NS | 27,9 | 0,040 |
| Número de metástasis | |||||
| Una metástasis | 77 | 48,7 | 39,2 | ||
| Más de una metástasis | 75 | 34,7 | 0,040 | 25,8 | 0,011 |
| Mayor tamaño de MH más grande | |||||
| >4cm | 34 | 25,2 | 22,7 | ||
| <4cm | 118 | 48,2 | 0,001 | 35,3 | 0,017 |
| Distribución de las metástasis | |||||
| Unilobar | 100 | 48,9 | 38,5 | ||
| Bilobular | 52 | 32,4 | 0,019 | 20,8 | 0,001 |
| QT neoadyuvante | |||||
| Sí | 77 | 32,9 | 21,6 | ||
| No | 75 | 51,8 | 0,011 | 41,3 | 0,001 |
| Metástasis extrahepáticas | |||||
| Sí | 10 | 15,6 | 15 | ||
| No | 142 | 44,9 | 0,039 | 34,4 | 0,046 |
| KRAS tipo salvaje | |||||
| Sí | 57 | 48,5 | 36,5 | ||
| No | 51 | 20,0 | 0,000 | 7,8 | 0,001 |
| CEA prehepatectomía | |||||
| CEA<5 | 59 | 52,0 | 43,7 | ||
| CEA>5 | 84 | 38,7 | 0,008 | 28,4 | 0,007 |
| Variables quirúrgicas | |||||
| Transfusión intraoperatoria | |||||
| Sí | 32 | 29,5 | 20,8 | ||
| No | 120 | 46,8 | 0,038 | 36 | 0,033 |
| Tipo de hepatectomía | |||||
| Hepatectomía menor | 88 | 47,3 | 34,6 | ||
| Hepatectomía mayor | 64 | 36,7 | NS | 27 | NS |
| Variables posquirúrgicas | |||||
| Estancia posquirúrgica larga | |||||
| Sí | 61 | 30,8 | 26,4 | ||
| No | 91 | 50,4 | 0,045 | 34,7 | 0,036 |
| Complicaciones globales | |||||
| Sí | 82 | 34,4 | 28,3 | ||
| No | 70 | 51 | 0,025 | 37,6 | NS |
| Clavien grave≥iii | |||||
| Sí | 21 | 45,4 | 28,6 | ||
| No | 131 | 26,9 | 0,011 | 33,3 | NS |
| Margen afecto | |||||
| Sí | 26 | 26 | 13,2 | ||
| No | 126 | 46,6 | 0,003 | 36,7 | 0,004 |
SG: supervivencia global; SLE: la supervivencia libre de enfermedad.
Solo el estadio ganglionar se relacionó de forma significativa con la SG y SLE, los tumores tipo N0 tuvieron una SG del 52,7% a los 5 años comparado con los N+ que alcanzaron una SG de 37,2% a los 5 años (p=0,011). El tipo de T no influyó de forma significativa sobre la supervivencia.
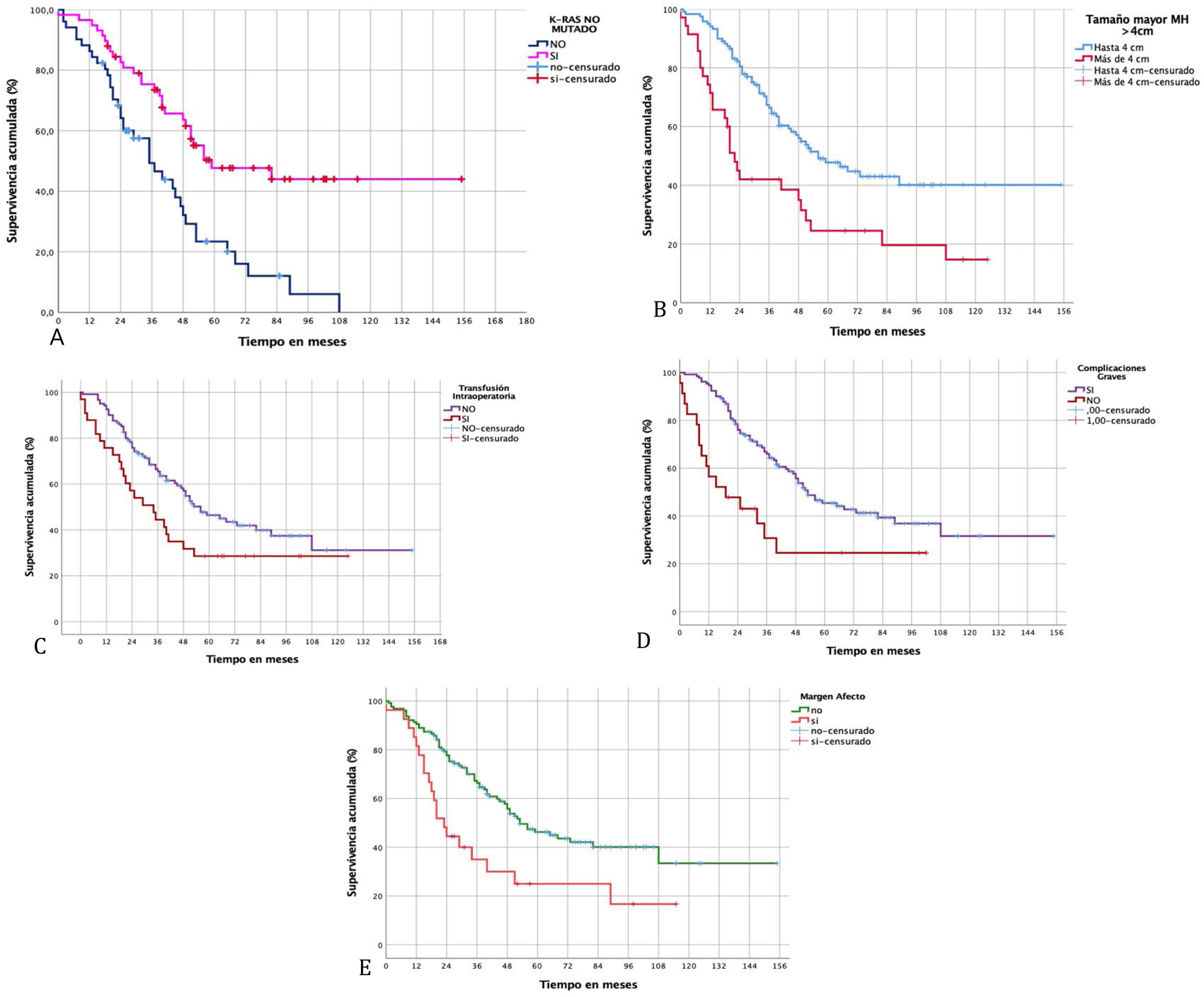
Características de las metástasis hepáticasUn número>1 de MH demostró disminuir la SG (p=0,04) y la SLE (p=0,011). El tamaño mayor de la MH>4cm también afectó de forma significativa la SG (p=0,001) y la SLE (p=0,017). De la misma forma, la distribución bilobular de las MH y la presencia de enfermedad metastásica extrahepática en el momento de la resección hepática se relacionaron con peor SG y SLE (tabla 3).
La QTN resultó ser un determinante negativo en la SG (p=0,011) y SLE (P=0,001) de nuestra serie.
Características biomoleculares y quirúrgicasLa presencia de KRAS no mutado junto con el antígeno carcinoembrionario ≤5mg/ml se relacionó con un aumento importante de la SG y SLE.
La transfusión de concentrados de hematíes se relacionó con una disminución significativa de la SG (p=0,038) y de la SLE (p=0,033).
Los pacientes con complicaciones graves tuvieron peor SG (p=0,011) y peor SLE (p=0,104) aunque esta última no fue significativa. La estancia posquirúrgica prolongada también se asoció a peor SG (p=0,045).
Finalmente, de las variables relativas al estudio histopatológico de la MH, la presencia de un margen afecto (<1mm) también mostró una peor SG (p=0,003) y SLE (p=0,004) (fig. 3).
Análisis multivariante de los predictores de supervivenciaAl aplicar la regresión de Cox, encontramos 5 factores de riesgo asociados con la SG. El KRAS no mutado resultó ser un factor de buen pronóstico independiente, mientras que las MH>4cm, la transfusión intraoperatoria, las complicaciones Clavien-Dindo graves y la presencia de margen afecto resultaron ser factores independientes de mal pronóstico (tabla 4).
Resultados de la regresión de Cox, con la identificación de factores predictores independientes de supervivencia
| Factores de riesgo | Hazard ratio | IC 95% | Valor p |
|---|---|---|---|
| KRAS no mutado | 0,26 | 0,14-0,48 | 0,000 |
| Tamaño de MH>4cm | 2,02 | 1,11-3,68 | 0,021 |
| Transfusión intraoperatoria | 4,05 | 2,07-7,92 | 0,000 |
| Clavien-Dindo grave≥iii | 2,72 | 1,19-6,24 | 0,018 |
| Margen afecto | 2,13 | 1,11-4,08 | 0,023 |
IC 95%: intervalo de confianza del 95%; MH: metástasis hepáticas.
En la literatura podemos encontrar distintas publicaciones con múltiples factores pronósticos, a partir de los cuales se han elaborado diversas escalas pronósticas con el objetivo de hacer una mejor selección de pacientes subsidiarios de cirugía hepática. Los criterios de Fong11 es una de las escalas más usadas, sin embargo, también existen muchos datos discordantes y, sobre todo, que se han modificado con el paso de los años12. En la actualidad es muy difícil contraindicar la cirugía en pacientes donde haya las mínimas posibilidades de obtener una resección R0 o que presenten enfermedad extrahepática resecable13.
En nuestra serie, los factores basales tales como sexo, edad o comorbilidades preoperatorias no tuvieron ninguna relación estadística con la supervivencia de los pacientes. Por lo que, apoyando los resultados obtenidos en otros estudios y el nuestro, ni la edad ni el sexo deberían ser factores que contraindiquen rotundamente la cirugía de las MH14–16.
Muchos estudios han encontrado una correlación importante entre las características del tumor primario y el pronóstico de las MH7,11,17; en nuestra serie no se ha logrado alcanzar esta premisa. Engstrand et al.18 asociaron una peor supervivencia para las MH con origen en colon derecho comparadas con las de colon izquierdo. A pesar de que nuestro estudio no mostró diferencias según la localización del tumor primario, observamos que al igual que en el estudio de Engstrand, tenemos un mayor número de pacientes con MH de colon izquierdo que de colon derecho (73 vs, 35), lo que podría indicar que los pacientes con MH de colon derecho tienen menos opciones de llegar a la cirugía hepática.
El status TN del tumor primario también ha sido relacionado con un peor resultado en la supervivencia para los pacientes con MH; en nuestro caso, los distintos tipos de T no influyeron sobre la supervivencia de nuestra serie. La N es un fuerte predictor de supervivencia en el CCR, y algunos estudios postulan su importancia también en el pronóstico de las MH19,20; en nuestro caso se relacionó con menor supervivencia en el análisis univariante, pero no así en el multivariante.
El KRAS mutado resultó ser en nuestra serie un factor determinante constante, de peor supervivencia. Varios estudios en la última década postulan la mutación del KRAS como un biomarcador predictivo importante en la enfermedad metastásica hepática del CCR21–23, es conocido que su presencia es indicativa de peor biología tumoral con un comportamiento más agresivo de las MH24,25. Passiglia et al.22 encontraron que el KRAS mutado era un biomarcador de pronóstico negativo en pacientes sometidos a resección quirúrgica de MHCCR, recomendando la evaluación de este biomarcador junto a factores clinicopatológicos, para determinar de forma más precisa el riesgo y la supervivencia de los pacientes candidatos a cirugía hepática, mejorando de esta forma su selección.
El objetivo de la QTN en las MHCCR es aumentar la supervivencia, favoreciendo la resección quirúrgica completa, sin embargo, el rol de la QTN es diferente dependiendo de si hablamos de enfermedad resecable o irresecable26. En las MH resecables de entrada, la QTN permitiría conocer la respuesta patológica al tratamiento y determinar la biología del tumor, permitiendo hacer un plan terapéutico individualizado para cada paciente, sin embargo, no existe, todavía, suficiente evidencia científica al respecto27,28. Para las MH no resecables o borderline, el objetivo es convertir la enfermedad en resecable (terapia de conversión)29; los estudios publicados muestran un aumento importante de la supervivencia, con tasas de SG a 5 años entre el 25% y el 58%. En nuestro caso, la QTN fue indicada en casos borderline, resultando ser un factor negativo para la supervivencia en el análisis univariante, sin significación en el multivariante. Este dato es importante para comparar nuestros resultados con los que existen en la literatura, ya que la SG sí que mejora cuando se compara pacientes inicialmente irresecables que tras quimioterapia se consigue resecar frente a pacientes irresecables con tratamiento de QT exclusivo, pero empeora si se compara pacientes con terapia de conversión frente a pacientes resecables de entrada, como muestran nuestros resultados30–32.
Tanto el tamaño como el número de metástasis son indicadores significativos de supervivencia según varias escalas pronósticas publicadas7,11,33. En la actualidad, debido a la introducción de nuevos agentes biológicos, el valor predictivo de las características morfológicas de la MH (número y tamaño) se ha visto modificado, llegando a ser inconcluyentes en otros estudios34,35. En nuestro caso solo el tamaño máximo>4cm resultó ser un factor predictivo negativo independiente.
Como en la mayoría de los estudios, el margen afecto demostró ser un factor predictivo negativo independiente. Mucho se ha discutido para establecer el tamaño ideal del margen afecto y los estudios han sugerido que un margen>1cm es óptimo y un factor independiente predictor de supervivencia, sin embargo, los márgenes subcentimétricos también se asocian a resultados favorables y, por lo tanto, no deberían contraindicar la cirugía36. En 2015, el grupo de Expertos en Manejo Onco-Quirúrgico de Metástasis Hepáticas (EGOSLIM) sugirió que un margen libre de 1mm es suficiente en la cirugía de las MHCCR37.
De nuestros resultados se extrae también que la transfusión sanguínea intraoperatoria es un predictor independiente de supervivencia. Se ha visto una interacción inmunológica relacionada con las transfusiones, que a su vez influye de forma negativa en los resultados oncológicos. Se podría considerar que a mayor enfermedad mayor dificultad quirúrgica con alto riesgo de sangrado y por lo tanto mayor necesidad de transfusión, con el consecuente e inherente riesgo de recurrencia. Sin embargo, estudios han demostrado, que eliminando todos los factores de confusión como carga tumoral, extensión de la cirugía, anemia preoperatoria, entre otros; la transfusión, por sí misma, conduce a una menor supervivencia específica de cáncer, y que, incluso, este riesgo aumenta a medida que aumenten las unidades transfundidas38.
Las complicaciones quirúrgicas graves también fueron un factor independiente de peor supervivencia en nuestro estudio. Se sabe que las complicaciones posquirúrgicas producen un período prolongado de inmunosupresión, lo que conlleva que células tumorales residuales proliferen y sobrevivan, asociándose a mayor proliferación neoplásica y peor supervivencia39,40.
La selección de pacientes candidatos para la cirugía de la MHCCR se ha basado tradicionalmente en factores pronósticos clinicopatológicos, sin embargo, el hecho de que la mayoría de los pacientes sometidos a cirugía posteriormente experimenten recidiva refuerza la necesidad de seguir buscando marcadores predictivos más efectivos al momento de decidir el tratamiento a seguir. Nuestro estudio ha demostrado el valor predictivo importante del KRAS, lo que respalda la evidencia emergente de que los marcadores biomoleculares pueden desempeñar un papel importante en una mejor selección de pacientes para el tratamiento quirúrgico41. Las limitaciones de nuestro estudio son una muestra unicéntrica sin validación externa y por lo tanto no generalizable. Al ser un estudio retrospectivo hay posibilidades de error de selección, especialmente en los pacientes sometidos a QTN que contaban con peor biología tumoral y no fueron aleatorizados.
En conclusión, nuestro estudio identifica 5 factores pronósticos de supervivencia: tamaño mayor de MH>4cm, transfusiones intraoperatorias, complicaciones posquirúrgicas graves, margen afecto y KRAS mutado. De estos, 4 factores están bien identificados en la literatura y por lo visto siguen teniendo un valor predictivo importante. La mutación del KRAS ha demostrado ser un predictor negativo constante en el pronóstico de los pacientes con MHCCR. No obstante, son necesarios más estudios multicéntricos para afianzar el peso pronóstico de nuestros resultados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.