Dada la escasez de donantes en el trasplante de páncreas1, es necesario el uso de criterios expandidos para incrementar el pool de injertos, siendo la donación en asistolia controlada (DAC) (Mastrich III) una fuente adicional efectiva de órganos ampliamente reconocida en trasplante renal y hepático, pero con menor experiencia en el trasplante de páncreas2,3.
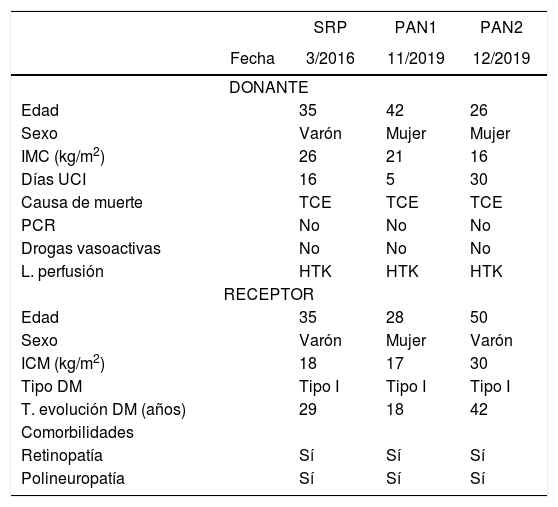
Presentamos tres casos de trasplante de riñón-páncreas realizados en nuestro centro en DAC, uno mediante extracción súper-rápida (SRP) y perfusión abdominal normotérmica (PAN) en dos casos. Las características demográficas de los donantes y receptores, así como los tiempos de isquemia se exponen en la tabla 1.
Características donante, receptor y tiempos de isquemia
| SRP | PAN1 | PAN2 | ||
|---|---|---|---|---|
| Fecha | 3/2016 | 11/2019 | 12/2019 | |
| DONANTE | ||||
| Edad | 35 | 42 | 26 | |
| Sexo | Varón | Mujer | Mujer | |
| IMC (kg/m2) | 26 | 21 | 16 | |
| Días UCI | 16 | 5 | 30 | |
| Causa de muerte | TCE | TCE | TCE | |
| PCR | No | No | No | |
| Drogas vasoactivas | No | No | No | |
| L. perfusión | HTK | HTK | HTK | |
| RECEPTOR | ||||
| Edad | 35 | 28 | 50 | |
| Sexo | Varón | Mujer | Varón | |
| ICM (kg/m2) | 18 | 17 | 30 | |
| Tipo DM | Tipo I | Tipo I | Tipo I | |
| T. evolución DM (años) | 29 | 18 | 42 | |
| Comorbilidades | ||||
| Retinopatía | Sí | Sí | Sí | |
| Polineuropatía | Sí | Sí | Sí | |
| TIEMPOS DE ISQUEMIA EN EXTRACCIÓN | |||
|---|---|---|---|
| T. isq. caliente funcional (min) | 21 | 7 | 14 |
| T. isq. caliente total (min) | 27 | 17 | 24 |
| T. bomba (min) | 110 | 100 | |
| TIEMPOS DE ISQUEMIA EN IMPLANTE | |||
|---|---|---|---|
| T. isq. fría (min) | 462 | 330 | 365 |
| T. isq. caliente (min) | 50 | 57 | 70 |
| T. isq. total (min) | 512 | 387 | 435 |
| T. isq. total renal (min) | 740 | 485 | 610 |
SRP: Técnica de extracción súper-rápida; PAN: Perfusión abdominal normotérmica; PCR: parada cardiorrespiratoria; L. perfusión: líquido de perfusión; T. evolución DM: tiempo de evolución de diabetes mellitus.
Donante. T. isq. caliente funcional: desde la primera hipotensión significativa (TAS < 60 mmHg) hasta la preservación o entrada en bomba. T. isq. caliente total: desde la limitación de tratamiento de soporte vital (LTSV) hasta la preservación o entrada en bomba. T. bomba: duración de PAN. Receptor. T. isq. fría: desde la preservación del injerto hasta que se introduce en el campo quirúrgico. T. isq. caliente: desde que el injerto entra en el campo quirúrgico hasta la perfusión del mismo. T. isq. total: desde la preservación del injerto en el donante hasta la perfusión en el recetor. T. isq. total: desde la preservación del injerto en el donante hasta la perfusión en el receptor.
Canulación premortem (se implantaron cánulas a través de vasos femorales derechos y un catéter con balón en aorta supracelíaca a nivel femoral izquierdo) vía percutánea en UCI por el intensivista y la administración de 1.000 U/kg de heparina sódica, en el momento de la misma. Los parámetros intraoperatorios de la PAN cumplieron las recomendaciones de la ONT4.
Extracción súper-rápidaMediante laparotomía xifopubiana se canula la aorta infrarrenal, posteriormente se clampa la aorta supracelíaca iniciando inmediatamente la perfusión fría. A continuación, se canula la vena cava infrarrenal para drenaje venoso y después se realiza la canulación y perfusión portal.
Técnica quirúrgica en receptorInjerto pancreático: anastomosis arterial entre ilíaca del donante e ilíaca común derecha del receptor. Anastomosis venosa entre porta del donante y cava-ilíaca común derecha del receptor. Anastomosis entre duodeno del donante y asa yeyunal del receptor. Se completa con apendicetomía reglada.
Injerto renal: anastomosis arterial entre arteria ilíaca externa izquierda y parche de aorta de arterial renal. Anastomosis venosa entre vena ilíaca externa izquierda y renal de riñón. Ureterostomía dejando catéter doble J.
Protocolo de anticoagulaciónEnoxaparina 40 mg dentro de 6 h previas al trasplante, heparina sódica 2.500 unidades por vía intravenosa (IV) intraoperatoriamente en casos de alto riesgo (receptores añosos, ateroesclerosis severa o hemodiálisis de larga evolución) y enoxaparina 60 mg/24 h tras 12 horas del trasplante.
Protocolo de inmunosupresiónInducción: metil-prednisolona (MP) 500 mg IV, tacrolimus 0,1 mg/kg y micofenolato de mofetilo (MMF) 1 g vía oral (VO). Intraoperatorio: timoglobulina (Tg) 1.5 mg/kg IV.
Mantenimiento: 1°-2° DPO (día postoperatorio): MP desde 125 mg/8 h IV pauta descendente, 3° DPO: prednisona 30 mg/día VO. Tacrolimus: 0,1 mg/kg/24 h VO (niveles 8-12 ng/mL). Tg: 1.5 mg/kg/día durante cinco días. MMF 500 mg/12 h vo hasta 5° DPO, después 1 g/12 h durante el primer mes.
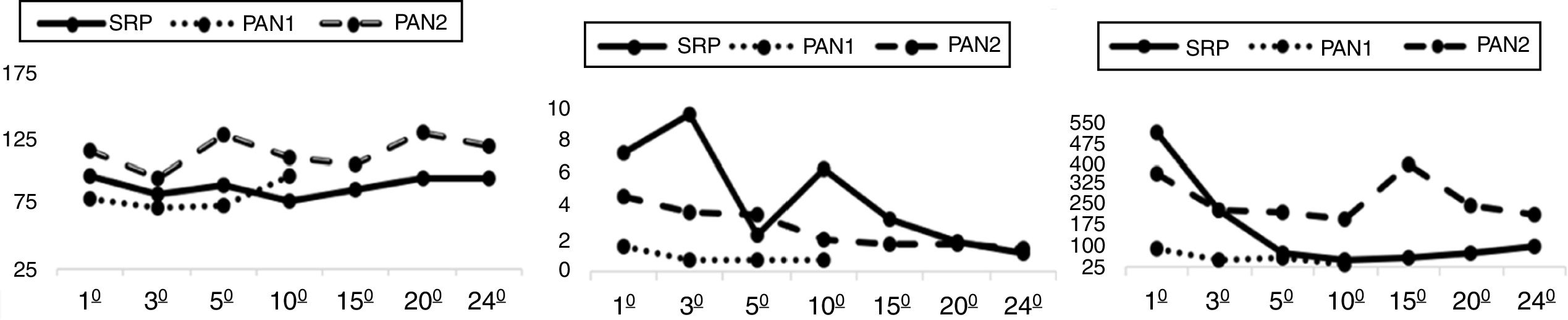
Evolución1° receptor: Desde la reperfusión del injerto, el enfermo no precisó insulina. Las cifras de amilasa se normalizaron en 48 h y los controles por ecografía doppler siempre fueron adecuados. A las 60 h, el paciente presentó hemoperitoneo siendo reintervenido sin encontrar claro foco de hemorragia. El injerto renal mostró función retrasada necesitando hemofiltración (HF) hasta el décimo día. Al 24̊ DPO, el paciente se da de alta con glucemias normales sin necesidad de insulina y cifras de creatinina dentro de la normalidad (fig. 1).
2° receptor: Evolucionó con buena función de ambos injertos. Inicialmente requirió perfusión de insulina en las tres primeras horas en UCI (2 u/mL), tras lo cual se retiró por glucemias dentro de la normalidad. Mejoría progresiva de la función renal sin retraso de la misma ni necesidad de HF. Alta al 10° PO con normalidad de parámetros (fig. 1) y sin necesidad de insulina.
Actualmente, los dos receptores presentan función correcta de ambos injertos.
3° receptor: Presentó inestabilidad hemodinámica 2° a shock cardiogénico por síndrome de denervación autonómica, con necesidad continua de drogas vasoactivas. Ventilación mecánica (VM) prolongada 2° a neumonía y posterior síndrome de distrés respiratorio agudo. El injerto renal sufrió disfunción secundaria con necrosis tubular aguda (NTA) por la situación hemodinámica necesitando HF todo el ingreso. Las glucemias fueron inicialmente adecuadas, aunque desde el 15° DPO el paciente precisó perfusión de insulina hasta el fin de su estancia. Al 25° DPO desarrolló shock séptico 2° a colección peripancreática tratada con drenaje percutáneo y antibióticos, constatándose fistula pancreática. Empeoró precisando intervención, realizándose drenaje del mismo y confirmándose viabilidad del injerto. Persistió situación hemodinámicamente lábil falleciendo a los 90 DPO por fracaso multiorgánico.
La mala evolución de este caso, pensamos que se relaciona a una inadecuada selección de receptor (50 años, fumador activo, BMI 30 kg/m2, arterioesclerosis severa) más que con el donante en asistolia o el método de extracción.
La escasez de injertos pancreáticos procedentes de donantes cadavéricos hace de la DAC una nueva fuente de órganos para el trasplante pancreático. La serie de Kopp et al.5 con técnica súper-rápida manifiesta resultados similares a los de donantes cadavéricos siguiendo una estricta selección de donantes (edad< 50 años, BMI < 30 kg/m2, tiempo de isquemia caliente < 30 minutos), al igual que nuestro primer caso. En la literatura destacan los trabajos de Oniscu et al.7 (tres páncreas obtenidos mediante PAN con canulación post mortem, aunque solo uno se usó para trasplante riñón-páncreas) y Miñambres et al.8 (un caso de trasplante riñón-páncreas) con resultados similares a los obtenidos con donación tras muerte encefálica.
La DAC parece mostrarse como una fuente fiable de órganos con resultados esperanzadores en el trasplante pancreático. Tanto la extracción mediante técnica súper-rápida5,7,9 como el uso de PAN6-8 han mostrado resultados alentadores y comparables a los donantes cadavéricos. Habrá que esperar a estudios de mayor volumen para indicarnos que técnica puede ofrecernos mejores resultados.